INTRODUCCION
Las pancreatitis agudas (PA) graves son entidades hipercatabólicas que inducen el desarrollo rápido de una malnutrición caloricoproteica con las implicaciones en la morbi-mortalidad que ello motiva. Es habitual que se compliquen, además de con distrés respiratorio del adulto y sepsis, con disfunción gastrointestinal, lo que conlleva una alteración de la correcta función a lo que se suele asociar la presencia de íleo paralítico, fístulas, hemorragia digestiva, abscesos, etc. Todo ello, unido al dolor que el mismo proceso provoca, impide la correcta alimentación a través del tracto digestivo del paciente, agravando aún más la referida malnutrición1.
Se ha sugerido que el reposo de la glándula pancreática con la disminución de la secreción pancreática y de su contenido en enzimas, podría tener efectos beneficiosos en el curso evolutivo de la enfermedad. El reposo pancreático podría conseguirse a partir de diversas maniobras terapéuticas, y sin ninguna duda, el ayuno sería el mecanismo que conseguiría de una manera más eficaz suprimir los distintos estímulos que pueden incidir en las fases pancreáticas de la digestión; el vaciamiento gástrico completo inhibiría la secreción pancreática y en voluntarios sanos se ha demostrado que el ayuno comporta disminución marcada de los valores de amilasa y lipasa. La administración de soluciones hipertónicas de glucosa así como diversos polipéptidos intestinales como la somatostatina inhiben de forma experimental y en humanos la secreción pancreática2. Harper et al3 en un modelo animal y Owyang et al4 en humanos demostraron que la instilación de ácido oleico en el intestino delgado distal o en el colon tendría efectos inhibitorios sobre dicha secreción. En el curso evolutivo de la enfermedad desempeñaría un papel importante el soporte nutricional5, ya que no se debe olvidar que las pancreatitis agudas, al igual que la sepsis y otras lesiones, cursan con un grado importante de estrés que motiva una serie de efectos metabólicos que llevarán rápidamente, junto con la imposibilidad de comer debido al dolor abdominal, náuseas, vómitos e íleo, casi siempre presente secundario a la inflamación del páncreas, a una malnutrición grave. Pero este planteamiento básico se cuestiona en la revisión del soporte nutricional en las pancreatitis agudas, lo que constituye la primera de las controversias con las que nos encontramos cuando tratamos los aspectos terapéuticos de la pancreatitis aguda6.
Existen diversas opiniones, incluso en los últimos años, sobre la utilidad o no del empleo de la nutrición artificial (NA) por lo que respecta a su influencia sobre la mortalidad y sobre las complicaciones.
¿HAY QUE APORTAR NUTRICION ARTIFICIAL A LAS PANCREATITIS AGUDAS?
Sobre si hay que nutrir o no en las PA existe un vivo debate, y los autores se alinean en los dos bandos; así Koretz7 se opone mientras que Marulendra8 y McClave et al9 entre otros10 apoyan la NA en el subgrupo de pacientes con PA grave, así como ante la aparición de disfunción orgánica y/o presencia de necrosis pancreática, e incluso en el caso de las PA leves este último autor considera que el empleo de nutrición enteral (NE) es apropiado11. Por tanto, ¿está indicada o no la NA en las PA? Los hechos establecidos son que:
La mayoría de las PA leves inician dieta oral en 5-7 días.
Es altamente improbable que las PA graves (definidas como Ranson al inicio ≥ 3 o APACHE II ≥ 10, especialmente si aumenta en las primeras 48 h, lo que conllevaría un riesgo elevado de desarrollar síndrome de disfunción multiorgánica [SDMO] o sepsis) puedan nutrirse oralmente en dicho período.
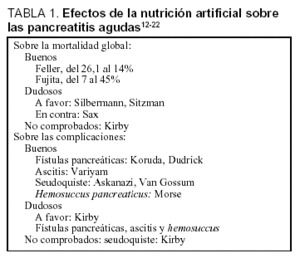
Los efectos de la NA en el transcurso de una PA grave recogidos en la bibliografía se detallan en la tabla 112-22.
En este debate, la opinión mayoritaria actual es que ante una pancreatitis aguda grave hay que proceder a la NA aun cuando no existe un nivel de evidencia I que indique un grado de recomendación A; los argumentos favorables se exponen en la tabla 2.
SITUACIONES METABOLICA Y CLINICA QUE CONDICIONAN LA NUTRICION ARTIFICIAL EN LAS PANCREATITIS AGUDAS GRAVES
Estos pacientes sometidos a una gran agresión y con fiebre practicamente desde su inicio presentan una respuesta metabólica similar a la que encontramos en la sepsis23 junto con una afección en mayor o menor medida de la función y de la estructura del tracto gastrointestinal (TGI), lo que se traduce por náuseas, vómitos y distensión abdominal frecuentes, cuando no existe un compromiso de compresión extrínseca del mismo por la glándula inflamada. Esta disfunción induce alteración y disminución de la asimilación de los sustratos que, eventualmente, alcanzarán el intestino, mientras que en el líquido peri toneal que se aprecia en la tomografía axial computarizada (TAC) de estos pacientes se acumulan importantes pérdidas proteicas. Todo ello configurará un marco que se expone en la figura 1 y que estará definido por un balance nitrogenado negativo junto con requerimientos de energía elevados, y secundariamente a un deterioro rápido metabólico y nutricional.
Figura 1. Situación metabólica y clínica en la PA grave.
NUTRICION PARENTERAL TOTAL EN PANCREATITIS AGUDAS GRAVES
Históricamente los autores se alinearon en un primer momento con la nutrición parenteral total (NPT) y de hecho, en trabajos retrospectivos no controlados, se han publicado una menor mortalidad y un menor número de complicaciones frente a la ausencia de nutrición21,24-47.
Sin embargo, posteriormente han surgido trabajos que han cuestionado la idoneidad de la NPT en este tipo de procesos a partir del de Sax et al28, que realizaron un estudio prospectivo sobre 54 pacientes a los que administraba NPT frente a fluidoterapia, sin hallar ventajas en la NPT y sí un incremento de la sepsis por catéter en un 10,4% de los casos. No obstante, hay que hacer notar que en todos los casos se trataba de PA leves, por lo que quizá ni siquiera estaría indicada la NA.
Ventajas
Permite alcanzar rápidamente el soporte requerido.
Se produce una falta de estimulación pancreática.
Evita el empleo del tracto gastrointestinal proximal.
En algunas ocasiones es la única vía de acceso posible.
Inconvenientes
Parece incrementar la respuesta al estrés11.
Se asocia con un mayor riesgo de hiperglucemia11.
Se asocia con un mayor riesgo de infección por catéter.
Tiene mayor coste; en este punto conviene llevar a cabo la siguiente reflexión, que habitualmente no se hace: ¿son baratas las sondas de doble luz y/o las yeyunales que requieren procedimientos endoscópicos?
No obstante, la NP constituye un recurso que permite la nutrición eficaz en pacientes con PA con un tracto gastrointestinal disfuncionante y en los que no es posible la NE.
NUTRICION ENTERAL TEMPRANA EN PANCREATITIS AGUDAS GRAVES
El empleo de NE temprana en la PA se basa en el efecto de prevenir la disfunción de la barrera que se originaria en nutriciones tardías y por tanto consitituir un posible origen de traslocación bacteriana, lo que llevaría a una segunda onda de infección. En un estudio prospectivo sobre 21 pacientes con pancreatitis aguda grave de distintas etiologías, aunque mayoritariamente biliar29, y con Ranson medio de 3,57, el empleo de NE temprana por sonda nasogastroyeyunal dentro de las primeras 60 h tras la admisión se realizó sin complicaciones significativas en todos excepto en un paciente, por lo que los autores concluyeron que la NE temprana yeyunal puede usarse sin complicaciones en la PA. En otro estudio30 se administró NE a 18 pacientes por sonda nasoentérica frente a 20 sometidos a NP, y se encontró una menor cantidad de complicaciones sépticas y totales en el primer grupo; la NE fue bien tolerada y tuvo menor coste. No obstante, existe el riesgo de exacerbación de la PA en el caso de descolocación de la sonda, como han descrito McClave et al11. Aun cuando queda por demostrar si el empleo de este acceso y vía es superior o no a la NP, tal como postulan algunos autores10,31,32.
El camino para un empleo generalizado de la NE en las PA aún no está libre de preguntas, y ejemplo de ello es el trabajo en fase II publicado muy recientemente de Powell et al33 sobre 13 PA graves sometidas a NE frente a 14 sin aporte nutricional. Los autores no encontraron ninguna mejoría en la escala de disfunción de órganos ni en los marcadores inflamatorios estudiados (interleucina [IL]-6, receptor 1 soluble de factor de necrosis tumoral [TNF], anticuerpo IgG antiendotoxina core y proteína C reactiva [PCR]) en el grupo nutrido. Además presentaban una peor función intestinal medida como permeabilidad intestinal en el cuarto día de forma significativa.
Los factores que limitan al empleo de la NE en las PA son los siguientes:
Requiere implantación nasoyeyunal y con frecuencia por endoscopia.
Tiene el riesgo de desplazamiento y empeoramiento de la pancreatitis.
Se tarda en alcanzar el soporte requerido.
NUTRICION FLEXIBLE
En el debate NE frente a NPT se ha acuñado otro criterio alternativo: la flexibilidad en el aporte de la nutrición34, lo que equivaldría a no adoptar una vía de acceso rígida e inamovible en la NA de las PA, sino que dependiendo de la funcionalidad o no del aparato digestivo y del estado clínico del paciente podría combinarse el empleo de ambas rutas. Este abordaje estaría indicado en los pacientes en los que se presume una larga estancia en la UCI, bien por su afección multiorgánica, bien por la necesidad de reintervenciones sucesivas, bien por la aparición de nuevas complicaciones. Y la administración de NPT estaría indicada siempre que se produjeran cualquiera de estos criterios objetivos: intolerancia a la NE, aumento del dolor y/o reascenso de la amilasemia.
SUSTRATOS SISTEMA-ESPECIFICOS Y PANCREATITIS AGUDA
El empleo de algunos sustratos con conocidas acciones inmunomoduladoras y aminoácidos condicionalmente indispensables en otras situaciones de hipercatabolismo, como es el caso de la sepsis35 o del trasplante de médula ósea, se ha considerado en las PA, y concretamente el empleo de glutamina. En un estudio realizado por de Beaux et al36 sobre 14 pacientes aleatorizados para ser sometidos a NP sin y con adición de glutamina durante 7 días para determinar el efecto de este aminoácido sobre la proliferación linfocítica y sobre la producción de citocinas proinflamatorias no se llegó a resultados concluyentes, probablemente debido al escaso número de pacientes, pero sí existía una tendencia en el grupo suplementado a la mejoría de dicha proliferación, medida como síntesis de ADN, así como una reducción en la liberación de IL-8 aunque no en el TNF ni en la IL-6.
Quizá en ello influya también la vía de acceso, tal como se establece en el trabajo de Windsor et al37, quienes diseñaron un estudio para determinar si mediante la NE se podía modular la respuesta inflamatoria y la gravedad del curso clínico al compararla con la NP. Sobre un grupo de 34 pacientes con PA estratificado según su APACHE II en el ingreso se aleatorizó el empleo de NP o bien de NE durante 7 días, y se apreció en el grupo enteral una mejoría de la respuesta inflamatoria aguda, pedida por valores de PCR y escala APACHE II, aunque sin cambio en la escala de la TAC y un incremento en la capacidad antioxidante del plasma sin cambios en los anticuerpos IgM antiendotoxina, séricos, mientras que en el grupo de NP se apreció un incremento de estos últimos con descenso de la capacidad antioxidante; los parámetros de inflamación o la escala de TAC no se modificaron. Los autores concluyeron que esta NE modulaba la respuesta sérica e inflamatoria y que era clínicamente beneficiosa en la PA.
DIRECTRICES PARA LA PRESCRIPCION DE NUTRICION ARTIFICIAL EN LA PANCREATITIS AGUDA
Existen tras peculiaridades que es necesario considerar antes del inicio del soporte nutricional:
Hasta el 40-90% de los pacientes desarrolla intolerancia hidrocarbonada.
Hasta el 81% requiere insulina.
Hasta un 15% desarrolla hipertrigliceridemia.
Ello condicionará el empleo de hidratos de carbono, evitando en las formulaciones enterales aquellas que se basan en sacarosa y buscando aquellas cuya fuente son dextrinomaltosas. Pero, asimismo, plantearse un aporte energético con mayor participación de grasas para disminuir el aporte hidrocarbonado, pasando desde un 25-35% hasta un 40-60% puede entrar en conflicto si el paciente tiene previamente o desarrolla a posteriori una hipertrigliceridemia superior a 400 mg/dl, cuyas causas son múltiples y se identifican las siguientes: aumento de la síntesis por hiperglucemia e insulina endógena y disminución de la oxidación grasa y efecto bloqueador de enzimas por TNF. En esta situación hay que reducir al mínimo la relación de calorias no proteicas/g de N hasta 80/1. En el caso que no exista hipertrigliceridemia, el empleo de lípidos, incluso por vía parenteral, es seguro14,38.
En el caso específico de la NE hay que tener en cuenta que es deseable emplear formulaciones pobres en grasas para evitar la estimulación pancreática incluso en el yeyuno y con presencia de triglicéridos de cadena media, ya que éstos se absorben en ausencia de la lipasa, la colipasa y las sales biliares.
Por lo que respecta a una alternativa con polioles sólo se recoge en un trabajo de Pérez Campos39, donde en una serie de enfermos afectados de pancreatitis aguda grave, aquellos que recibieron los hidratos de carbono de la nutrición parenteral con una mezcla de fructosa, glucosa y xilitol, en la relación 2:1:1, obtuvieron valores significativamente inferiores de glucemia e insulinemia frente al grupo control que recibió solamente glucosa.
No quedan, pues, definidas las necesidades energéticas (tabla 3) pero se suele aplicar el mismo patrón que en las sepsis40. El gasto energético evaluado por la fórmula de Harris-Benedict tiene poco valor, y la calorimetría indirecta está sujeta a múltiples variaciones, según el grado de fiebre, se haya procedido a ventilación mecánica o no, se haya administrado sedación o no, haya habido revisión quirúrgica o no, etc. Por tanto, se suele aplicar una proporción teórica bastante ajustada ya que el incremento del gasto energético sobre el valor teórico no parece ser tan marcado como en otros procesos críticos y parece estar mediado fundamentalmente por si existe asociación de sepsis41. Al igual que en otras situaciones hipercatabólicas, parece que la relación kcal no proteicas/g de nitrógeno más adecuada es la cercana a 120/1 aun cuando pueda disminuir hasta valores menores como en la consideración anterior, por la hiperlipemia asociada con hiperglucemia.
Tampoco quedan definidas las necesidades cualicuantitativas del aporte proteico. Por lo que respecta a qué formulación emplear en la NPT y basándose en su paralelismo con la sepsis, donde se han empleado de forma satisfactoria formulaciones enriquecidas con aminoácidos de cadena ramificada (AACR)35,44,45 se ha postulado su empleo en la PA; a este respecto existen trabajos sobre su tolerancia y mejoría de la supervivencia en un modelo experimental de pancreatitis experimental46. Si dichas acciones de los AACR se consiguen de forma directa o a través de su conversión en glutamina es algo aún no dilucidado.
En el caso concreto de la NE hay que formular la siguiente consideración: por lo que respecta al empleo de dietas con proteínas intactas, éstas ligan tripsina y reducen las concentraciones, lo que desencadena liberación de colecistocinina, mientras que las dietas con aminoácidos ligan menos tripsina y, por tanto, disminuirían el riesgo de exacerbaciones. Las necesidades proteicas en cuanto a cantidad y calidad no han quedado definidas tal como se expone en la tabla 4.
La corriente actual pasa por un aporte más conservador en el que priman mejorías cualitativas de sustratos en detrimento de reducciones cuantitativas energeticoproteicas para mantener la función de los órganos en lugar de la masa tisular51.
CONCLUSIONES
1. Se recomienda la NA siempre que se estime que no hay ingestión oral eficaz en 7 días o en menos si el paciente se encuentra previamente malnutrido o séptico.
2. Sólo se indica en PA graves (en riesgo de SDMO o sepsis).
3. La NE es de elección si se consigue o está indicado un acceso yeyunal. Con formulación pobre en grasas (rica en triglicéridos de cadena media) y preferentemente con buen porcentaje de aminoácidos.
4. Si hay intolerancia o mala evolución clínica, o bien imposibilidad o no indicación de acceso yeyunal, pasar a NPT, controlando la hiperglucemia e hipertrigliceridemia.
5. La NPT incluyendo lípidos se tolera bien, no estimula la secreción pancreática y puede minimizar la malnutrición ante una disfunción gastrointestinal52.
6. El aporte de aminoácidos no debe ser superior a 1,5 g/kg/día. Existe tendencia a preferir AACR y quizá glutamina pero no existe aún una nutrición organoespecífica en la pancreatitis.
7. No existen suficientes estudios controlados con polioles.