Conocer el perfil clínico, así como el significado pronóstico, de la presencia de niveles elevados de hormona paratiroidea (PTH) en pacientes ingresados por síndrome coronario agudo (SCA).
Diseño y ámbitoEstudio observacional y prospectivo de pacientes ingresados por SCA en un único centro español durante un periodo de 6meses.
Intervención y variables de interésSe determinaron las concentraciones de PTH, calcidiol, calcitriol, NT-proBNP, proteínaC reactiva, cistatinaC y fibrinógeno circulantes en las primeras 48h del ingreso y se realizaron modelos ajustados para predecir muerte o reingreso por SCA tras el alta.
ResultadosSe reclutaron 161 pacientes (edad 67±14años; 75,2% varones) de los cuales 41 (25,5%) presentaron valores elevados de PTH. Se registraron 50 eventos adversos durante un seguimiento de 275 personas-año. Los pacientes con niveles elevados de PTH fueron en mayor proporción mujeres (21,2 vs. 39,0%) y de mayor edad (63,3 vs. 77,8años, ambos p<0,05). Asimismo, presentaron mayor riesgo cardiovascular y una peor evolución en el seguimiento (razón de tasas de incidencia: 2,64; IC 95%: 1,5-4,6). Sin embargo, en un modelo ajustado por la escala GRACE, los niveles de PTH no se mostraron como un factor de riesgo independiente (hazard ratio=1,1; IC 95%: 0,6-2,2); tampoco el resto de componentes del panel.
ConclusionesLa proporción de pacientes con niveles elevados de PTH ingresados por SCA es elevada. Su presencia se asoció con un perfil clínico más adverso y peor evolución durante el seguimiento, aunque no resultó ser un predictor independiente de mal pronóstico.
To know the clinical profile as well as the prognostic significance of elevated levels of parathyroid hormone (PTH) in patients admitted for acute coronary syndrome (ACS).
Design and settingObservational and prospective study of patients admitted for ACS in a single Spanish center during a period of six months.
Intervention and variables of interestThe circulating concentrations of PTH, calcidiol, calcitriol, NT-proBNP, C-reactive protein, cystatinC and fibrinogen were determined within the first 48h at admission. We performed adjusted models to predict death or re-entry for ACS after hospital discharge.
ResultsA total of 161 patients were recruited (age 67±14 years, 75.2% were men). Forty-one (25.5%) patients had elevated PTH values. During follow-up for a period of 275 person-years, 50 adverse events were recorded. Patients with elevated PTH levels were proportionally more women (21.2 vs. 39.0%) and older (63.3 vs. 77.8 years, both P<.05). Likewise, they presented significantly more cardiovascular risk and a worse prognosis during follow-up (incidence rate ratio 2.64 CI 95%: 1.5-4.6). However, in an adjusted model by the GRACE score, PTH levels were not shown to be an independent risk factor (hazard ratio=1.1; 95% CI: 0.6-2.2), neither other components of the panel.
ConclusionsThe proportion of patients with elevated levels of PTH admitted for ACS was high. The presence of high PTH levels was associated with an unfavorable clinical profile and a worse outcome during the follow-up, although it was not an independent predictor of poor prognosis.
Los pacientes que presentan un síndrome coronario agudo (SCA) constituyen una población muy heterogénea, con una amplia variabilidad tanto en su manera de presentación como en el riesgo de muerte o recurrencia isquémica a largo plazo1. Por ello, resulta fundamental la búsqueda continua de nuevas herramientas que apoyen al clínico a la hora de realizar una evaluación pronóstica. Además de variables puramente clínicas tales como los antecedentes cardiovasculares, la comorbilidad, el electrocardiograma o la presencia de insuficiencia cardiaca al ingreso, los biomarcadores se han erigido como un elemento esencial a la hora del diagnóstico, la estratificación y así en la toma de decisiones en lo que concierne al manejo médico2. El score de GRACE (Global Registry of Acute Coronary Events) se emplea rutinariamente para la estratificación de riesgo de los pacientes con SCA y se ha mostrado como una herramienta potente en este contexto. Sin embargo, su capacidad de diferenciar o discriminar los pacientes que presentan un devenir adverso es importante pero no es perfecta como sugiere su estadístico C en torno a 0,83. Esta observación es de particular importancia dado que cualquier mejoría al respecto de su discriminación sería de gran valor en la práctica clínica.
Tanto la vitaminaD, en su forma de calcidiol y calcitriol, como la hormona paratiroidea (PTH) tienen un papel crucial en la homeostasis ósea y el mantenimiento del equilibrio calcio-fósforo. Estudios previos han demostrado la existencia de una relación entre un mayor riesgo cardiovascular y la presencia de hiperparatiroidismo, bien sea este primario4 o secundario5. Dicha relación parece atribuible, en gran medida, a un aumento de la prevalencia de los factores de riesgo cardiovascular entre aquellos pacientes con hiperparatiroidismo primario asintomático6,7. Por otro lado, autores han relacionado la presencia de niveles elevados de PTH con una enfermedad coronaria más compleja8, una respuesta subóptima a la antiagregación plaquetaria9 e incluso con la presencia de mayor número de eventos adversos durante el seguimiento10 en pacientes diagnosticados de enfermedad coronaria estable. Sin embargo, las evidencias acerca de un potencial impacto pronóstico de PTH en pacientes con SCA son prácticamente inexistentes, solo un pequeño estudio piloto previo de 22 pacientes11. Por lo tanto, y hasta el momento presente, no se ha realizado un estudio específico destinado a explorar esta hipótesis ad hoc.
Nuestro objetivo fue, por tanto, investigar si la determinación de niveles circulantes de PTH aporta información pronóstica tras el alta en pacientes ingresados con diagnóstico de SCA. Investigamos, además, si los niveles circulantes de calcidiol y calcitriol son útiles en la diferenciación de los pacientes en riesgo de eventos adversos y si potencialmente dicha asociación permanece tras el ajuste por otros biomarcadores más establecidos, tales como la fracción amino-terminal del péptido natriurético cerebral (NT-proBNP), la proteínaC reactiva (PCR) y la cistatinaC.
Pacientes y métodoEstudio observacional, analítico y de cohortes, prospectivo, en el que se reclutaron todos los pacientes con diagnóstico principal de SCA ingresados desde el 1 de noviembre de 2011 hasta el 31 de abril de 2012 en un Hospital General Universitario en Cartagena (Murcia; latitud 37°N). Los criterios de exclusión establecidos fueron la imposibilidad de seguimiento por no ser residentes en España o negativa a firmar el consentimiento informado. Entre los datos recogidos se incluyeron: datos demográficos, factores de riesgo cardiovascular, antecedentes de enfermedad cardiovascular y enfermedad renal crónica (ERC), datos clínicos y analíticos (albúmina, hemoglobina, creatinina, cistatinaC, PCR, NT-proBNP, 25-hidroxivitaminaD o calcidiol [25(OH)-D], 1,25(OH)vitaminaD o calcitriol [1,25(OH)-D], PTH, fibrinógeno, calcio y calcio corregido por albúmina) relativos al ingreso y eventos durante el seguimiento. El estudio fue aprobado por el Comité de Ética de Investigación Clínica (CEIC) de nuestro centro y cumple con la última versión de la Declaración de Helsinki.
DefinicionesSe definió el antecedente de enfermedad cardiovascular como la presencia de cardiopatía isquémica crónica, ictus o enfermedad arterial periférica en la historia clínica previa. La escala pronóstica empleada fue el score de GRACE en la versión 1.0, la cual integra 9 variables: la edad, la frecuencia cardiaca y presión arterial sistólica al ingreso, los niveles de creatinina al ingreso, la presencia de marcadores de daño miocárdico elevados o depresión del segmento ST al ingreso, el antecedente de infarto de miocardio previo, la presencia de insuficiencia cardiaca al ingreso y la práctica intrahospitalaria de una intervención coronaria percutánea durante el ingreso12.
Métodos de laboratorioPara las determinaciones analíticas se extrajo una muestra de sangre venosa a las 8:00am durante las primeras 48h del ingreso.
La medida de PTH se realizó mediante un ensayo de quimioluminiscencia directa en el analizador AdviaCentaurXP (Siemens Healthcare Diagnostic). Se consideró un valor de 79,5pg/ml de PTH, considerado como límite superior de referencia de acuerdo con las recomendaciones del fabricante, como punto de corte para clasificar a los pacientes en los grupos «PTH normal» y «PTH elevada». Se analizaron, además, cistatinaC mediante inmunonefelometría en el analizador BN ProSpec (Siemens Healthcare Diagnostic); NT-proBNP mediante un inmunoanálisis quimioluminiscente basado en la tecnología LOCI en el analizador Dimension Vista (Siemens Healthcare Diagnostic), PCR, albúmina y calcio mediante inmunoturbidimetría, método de fijación del colorante verde de bromocresol (BCG) y método del arsenazo, respectivamente, en el analizador Advia 2400 (Siemens Healthcare Diagnostic).
Para la medida de 25(OH)-D se extrajo una muestra de sangre utilizando como contenedor un tubo con heparina de litio, gel separador y glutatión reducido (antioxidante). Tras la extracción, la muestra fue enviada en hielo y protegida de la luz al laboratorio, donde se procedió a su centrifugación y separación del plasma, que se mantuvo congelado a –80°C hasta su procesamiento. La 25(OH)-D se determinó mediante cromatografía líquida de alta resolución con detección ultravioleta en el analizador Agilent 1200, realizándose previamente una breve etapa manual de precipitación y extracción. La 1,25(OH)-D se determinó en suero mediante radioinmunoanálisis (RIA). La tasa de filtrado glomerular (TFG) se estimó mediante la fórmula derivada del estudio Modification of Diet in Renal Disease, usándose para la medida de creatinina el método de Jaffé cinético compensado y estandarizado respecto al método de referencia de dilución isotópica-espectrometría de masas (IDMS) [MDRD-4 IDMS] en el analizador Advia 2400 (Siemens Healthcare).
Análisis estadísticoLas variables continuas se expresaron mediante media y desviación típica, o mediana y rango intercuartílico, según lo apropiado y las variables categóricas como número absoluto y porcentaje. Para comparar variables continuas entre dos grupos se empleó el test t de Student o la U de Mann-Whitney, según lo apropiado, y para las categóricas se empleó la Chi-cuadrado o el test exacto de Fisher.
Realizamos un análisis de supervivencia mediante un método gráfico de Kaplan-Meier y la prueba de log-rank (Cox-Mantel). Presentamos la tasa de incidencia (TI) de eventos adversos por cada 100 pacientes-año en función de los niveles de PTH, así como la razón de TI, con su respectivo intervalo de confianza (IC). Además, llevamos a cabo un modelo de regresión de Cox ajustado, con finalidad explicativa, por la puntuación obtenida en la escala de GRACE —considerada como gold standard en la estratificación de riesgo por las guías de práctica clínica13—, obteniéndose el hazard ratio (HR) y el IC al 95% para cada covariable del modelo. La variable temporal es el tiempo trascurrido entre el alta hospitalaria y la aparición del evento o bien el último contacto con el investigador. Se empleó el método introducir y se calcularon los IC así como los valores de «p» mediante el estadístico de Wald. Adicionalmente, se estimaron los valores de «p» por un método de pasos hacia atrás y estadístico de razón de verosimilitud. Se comprobó la hipótesis de proporcionalidad de riesgos con un método gráfico y adicionalmente con el test de residuos de Schöenfeld. La variable principal (dependiente) del estudio fue la de muerte por cualquier causa o reingreso por SCA (reinfarto o angina inestable que requiriera ingreso) tras ser dado de alta. La discriminación del modelo de Cox se calculó con el estadístico C de Harrell. El análisis fue completado con la evaluación del valor de la PTH en los diferentes subgrupos mediante el estudio de las interacciones de primer grado en el modelo jerárquico con un método de pasos hacia atrás y razón de verosimilitud (Chunk test). Adicionalmente investigamos el rendimiento diagnóstico de la PTH para la predicción del evento combinado mediante el cálculo del área bajo la curva en una curva receiver operating characteristic (ROC) y la macro !DT (Doménech JM, UAB, Barcelona). Para el test de contraste de hipótesis se ha considerado un umbral α de 0,05 para rechazar/aceptar la hipótesis nula. El análisis estadístico se llevó a cabo con el software SPSS® v. 23.0. (SPPS Inc., Chicago, IL, EE.UU.).
SeguimientoTras el alta hospitalaria, los pacientes fueron seguidos mediante revisión en las consultas de cardiología y/o seguimiento telefónico en el 100% de los pacientes durante una mediana de 22meses (Q1-Q3: 8-33) para el evento combinado de muerte o SCA.
ResultadosCaracterísticas basales de la muestraEn el estudio se reclutaron 161 pacientes con una edad de 67±14años. El 75,2% eran varones. Destacamos que un 65,8% presentaban antecedentes de hipertensión arterial, el 55,9% de dislipidemia, un 35,4% de diabetes mellitus, el 36,6% referían hábito tabáquico activo, así como un 35,4% eran obesos. El 47,8% presentaban antecedentes de enfermedad cardiovascular, siendo la cardiopatía isquémica el más prevalente de ellos (estando presente hasta en el 39,8% de la muestra). En lo relativo al ingreso, el diagnóstico en el 62,7% fue de síndrome coronario agudo sin elevación del segmento ST (SCASEST), mientras que el 36,0% se catalogaron como SCA con elevación persistente del segmento ST (SCACEST). La puntuación de GRACE score media fue de 140±47 (Q1-Q3: 58-259) y el manejo fue conservador —sin coronariografía— hasta en un 16,8% de los pacientes. Hasta un 39,1% presentaban una clase Killip superior a I, mientras que el 96,9% presentaban una elevación analítica de la troponinaI y el 75,2% presentaban un electrocardiograma anormal al ingreso. En lo que respecta a la función renal, el 11,2% presentaban antecedentes de ERC, siendo la TFG media del total de la muestra de 75,0±30,8ml/min/1,72 m2 (Q1-Q3: 18,8-164,1).
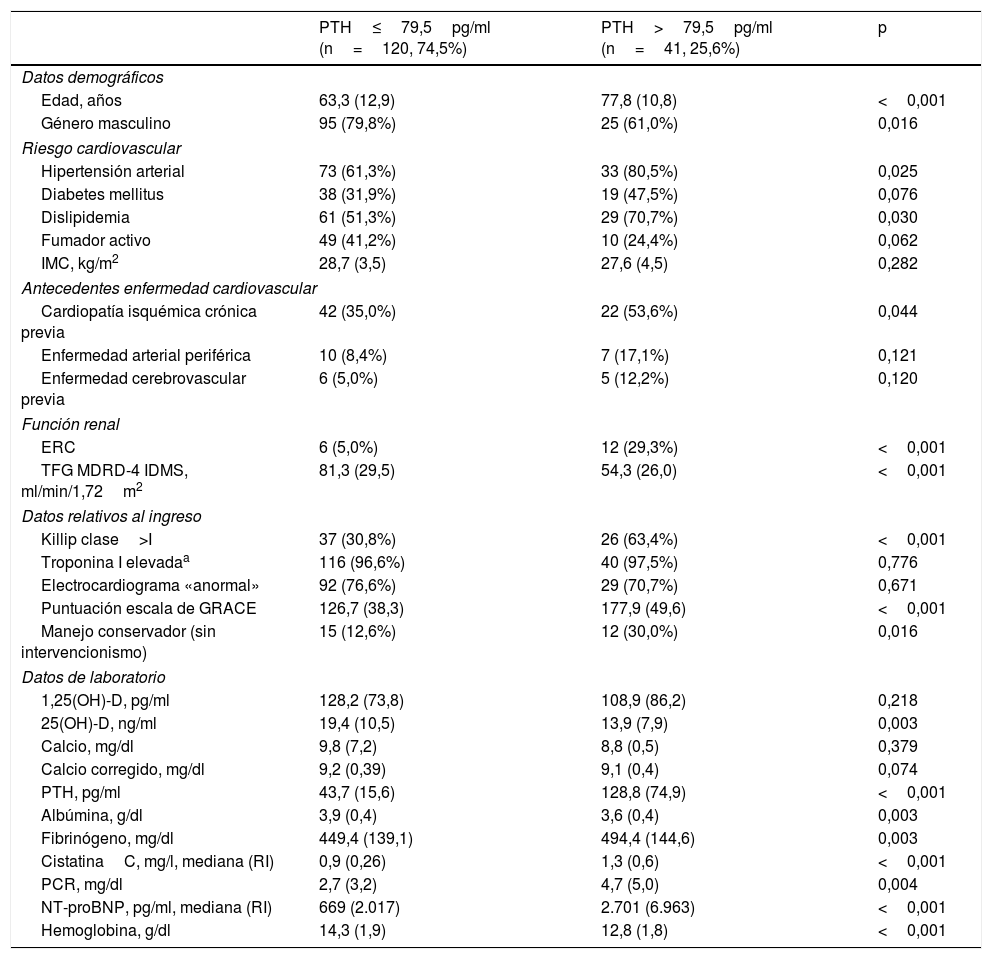
Niveles de hormona paratiroidea y características clínicasDe los pacientes incluidos en el estudio, 41 (25,5%; IC: 18,7-32,3%) presentaban valores de PTH elevados al ingreso (128,8±74,9 frente a 43,7±15,6pg/ml; p<0,001). Aquellos con niveles más elevados de PTH presentaban (tabla 1) una mayor edad y mayor proporción de mujeres, más factores de riesgo cardiovascular tales como hipertensión (80 frente a 61%; p=0,025) o dislipidemia (70 frente a 51%; p=0,030) y, a su vez, más antecedentes de cardiopatía isquémica crónica (53 frente a 35%; p=0,044). Los pacientes con niveles elevados de PTH ingresaron en peor clase funcional Killip (63 frente a 30% en clase Killip>I; p<0,001) y presentaron mayor score en la escala GRACE (177 frente a 126; p<0,001). Al mismo tiempo se manejaron durante su ingreso de manera más conservadora sin intervencionismo (30 frente a 12%; p<0,016). En lo referente a la función renal, los pacientes con niveles elevados de PTH presentaban más antecedentes de ERC (29 frente a 5%; p<0,001) y peor TFG estimada (54,3 frente a 81,3ml/min/1,72m2; p<0,001). Desde el punto de vista analítico, los pacientes con niveles elevados de PTH presentaban concentraciones menores de 25(OH)-D (13,9 frente a 19,4ng/ml; p=0,003), más anemia (hemoglobina 12,8 frente a 14,3g/dl; p<0,001), mayores concentraciones de NT-proBNP (2.701 frente a 669pg/ml; p<0,001), mayores niveles de reactantes de fase aguda como PCR (4,7 frente a 2,7mg/dl; p=0,004) y fibrinógeno (494 frente a 449mg/dl; p=0,003) así como significativamente mayores niveles de cistatinaC (1,3 frente a 0,9ng/l; p<0,001).
Características basales de la muestra en función de los niveles de hormona paratiroidea
| PTH≤79,5pg/ml (n=120, 74,5%) | PTH>79,5pg/ml (n=41, 25,6%) | p | |
|---|---|---|---|
| Datos demográficos | |||
| Edad, años | 63,3 (12,9) | 77,8 (10,8) | <0,001 |
| Género masculino | 95 (79,8%) | 25 (61,0%) | 0,016 |
| Riesgo cardiovascular | |||
| Hipertensión arterial | 73 (61,3%) | 33 (80,5%) | 0,025 |
| Diabetes mellitus | 38 (31,9%) | 19 (47,5%) | 0,076 |
| Dislipidemia | 61 (51,3%) | 29 (70,7%) | 0,030 |
| Fumador activo | 49 (41,2%) | 10 (24,4%) | 0,062 |
| IMC, kg/m2 | 28,7 (3,5) | 27,6 (4,5) | 0,282 |
| Antecedentes enfermedad cardiovascular | |||
| Cardiopatía isquémica crónica previa | 42 (35,0%) | 22 (53,6%) | 0,044 |
| Enfermedad arterial periférica | 10 (8,4%) | 7 (17,1%) | 0,121 |
| Enfermedad cerebrovascular previa | 6 (5,0%) | 5 (12,2%) | 0,120 |
| Función renal | |||
| ERC | 6 (5,0%) | 12 (29,3%) | <0,001 |
| TFG MDRD-4 IDMS, ml/min/1,72m2 | 81,3 (29,5) | 54,3 (26,0) | <0,001 |
| Datos relativos al ingreso | |||
| Killip clase>I | 37 (30,8%) | 26 (63,4%) | <0,001 |
| Troponina I elevadaa | 116 (96,6%) | 40 (97,5%) | 0,776 |
| Electrocardiograma «anormal» | 92 (76,6%) | 29 (70,7%) | 0,671 |
| Puntuación escala de GRACE | 126,7 (38,3) | 177,9 (49,6) | <0,001 |
| Manejo conservador (sin intervencionismo) | 15 (12,6%) | 12 (30,0%) | 0,016 |
| Datos de laboratorio | |||
| 1,25(OH)-D, pg/ml | 128,2 (73,8) | 108,9 (86,2) | 0,218 |
| 25(OH)-D, ng/ml | 19,4 (10,5) | 13,9 (7,9) | 0,003 |
| Calcio, mg/dl | 9,8 (7,2) | 8,8 (0,5) | 0,379 |
| Calcio corregido, mg/dl | 9,2 (0,39) | 9,1 (0,4) | 0,074 |
| PTH, pg/ml | 43,7 (15,6) | 128,8 (74,9) | <0,001 |
| Albúmina, g/dl | 3,9 (0,4) | 3,6 (0,4) | 0,003 |
| Fibrinógeno, mg/dl | 449,4 (139,1) | 494,4 (144,6) | 0,003 |
| CistatinaC, mg/l, mediana (RI) | 0,9 (0,26) | 1,3 (0,6) | <0,001 |
| PCR, mg/dl | 2,7 (3,2) | 4,7 (5,0) | 0,004 |
| NT-proBNP, pg/ml, mediana (RI) | 669 (2.017) | 2.701 (6.963) | <0,001 |
| Hemoglobina, g/dl | 14,3 (1,9) | 12,8 (1,8) | <0,001 |
25(OH)-D: 25-hidroxivitaminaD; 1,25(OH)-D: 1,25(OH)vitaminaD; ERC: enfermedad renal crónica; GRACE: Global Registry of Acute Coronary Events; IMC: índice de masa corporal; NT-proBNP: fracción amino-terminal del péptido natriurético cerebral; PCR: proteínaC reactiva; PTH: hormona paratiroidea; RI: rango intercuartílico; TFG MDRD: tasa de filtrado glomerular.
Los pacientes con déficit de calcidiol (<10pg/ml) presentaban más comorbilidad, siendo pacientes más ancianos (71,9 frente a 65,6años; p=0,013), con mayor proporción de cardiopatía isquémica crónica (56,8 frente a 35,0%; p=0,022) y enfermedad pulmonar obstructiva crónica (18,9 frente a 4,1%; p=0,007), y una tendencia hacia una mayor proporción de enfermedad arterial periférica (18,9 frente a 8,1%; p=0,073). A su vez, los pacientes con niveles bajos de calcitriol (<48pg/ml) también eran pacientes más ancianos (74,6 frente a 66,3años; p=0,025).
Hormona paratiroidea y otros biomarcadores en los pacientes con eventosLos pacientes con eventos presentaban, comparativamente con aquellos con una evolución favorable, mayores niveles de PTH (86,5 frente a 56,2pg/ml; p=0,010) y de NT-proBNP (5.262,4 frente a 1.790,6pg/ml; p<0,001). No se observaron diferencias en cuanto a los niveles de PCR (4,2 frente a 2,8mg/dl; p=0,061), fibrinógeno (464,3 frente a 461,3mg/dl; p=0,901), calcidiol (17,4 frente a 18,1ng/ml; p=0,688) y calcitriol (119,1 frente a 125,1pg/ml; p=0,691).
Implicaciones pronósticasDurante el seguimiento ocurrieron un total de 50 eventos (26 fallecimientos y 24 reingresos por SCA de los cuales 14 fueron por nuevo episodio de infarto de miocardio y 10 por angina inestable) durante un periodo de seguimiento de 275pacientes-año.
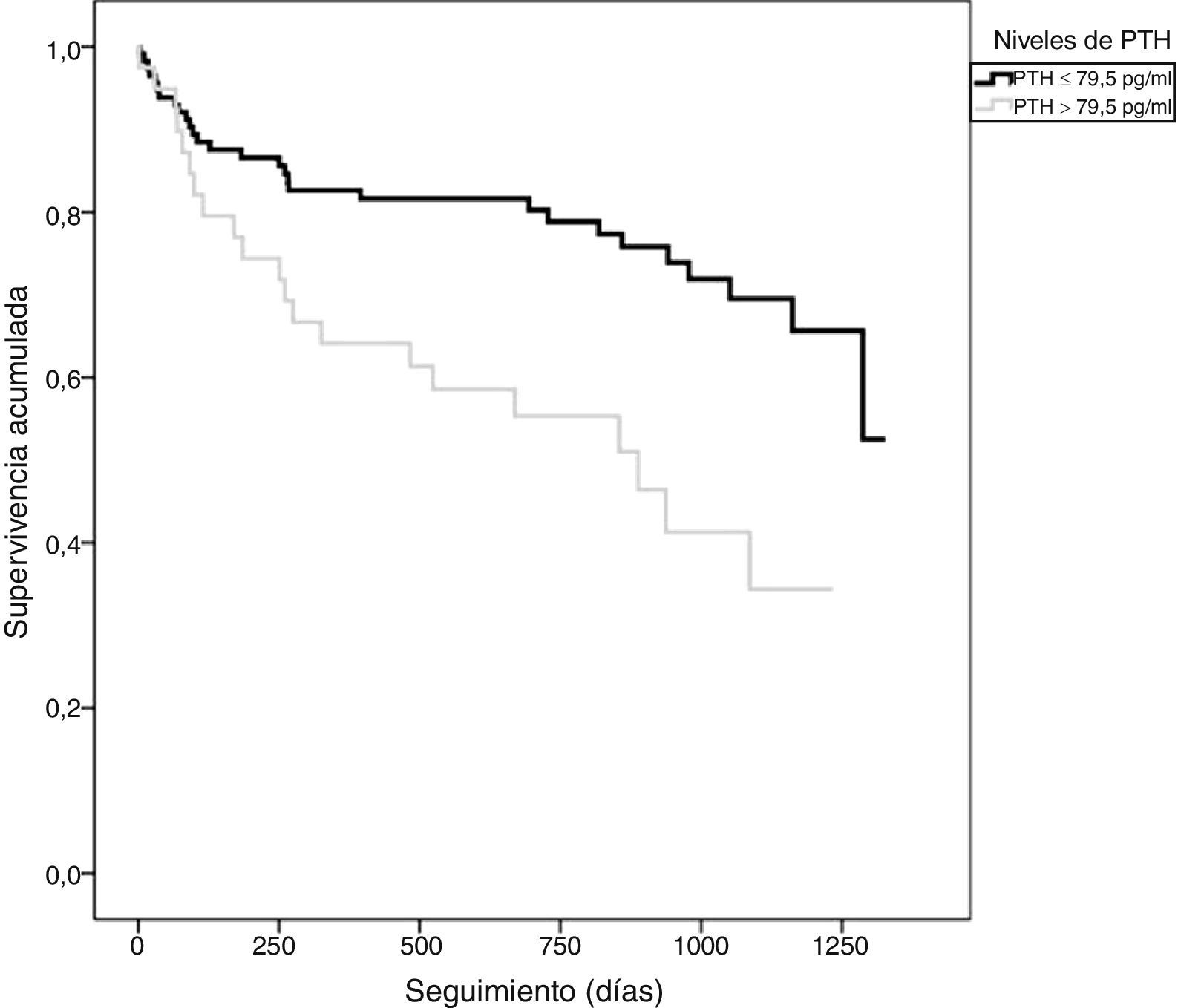
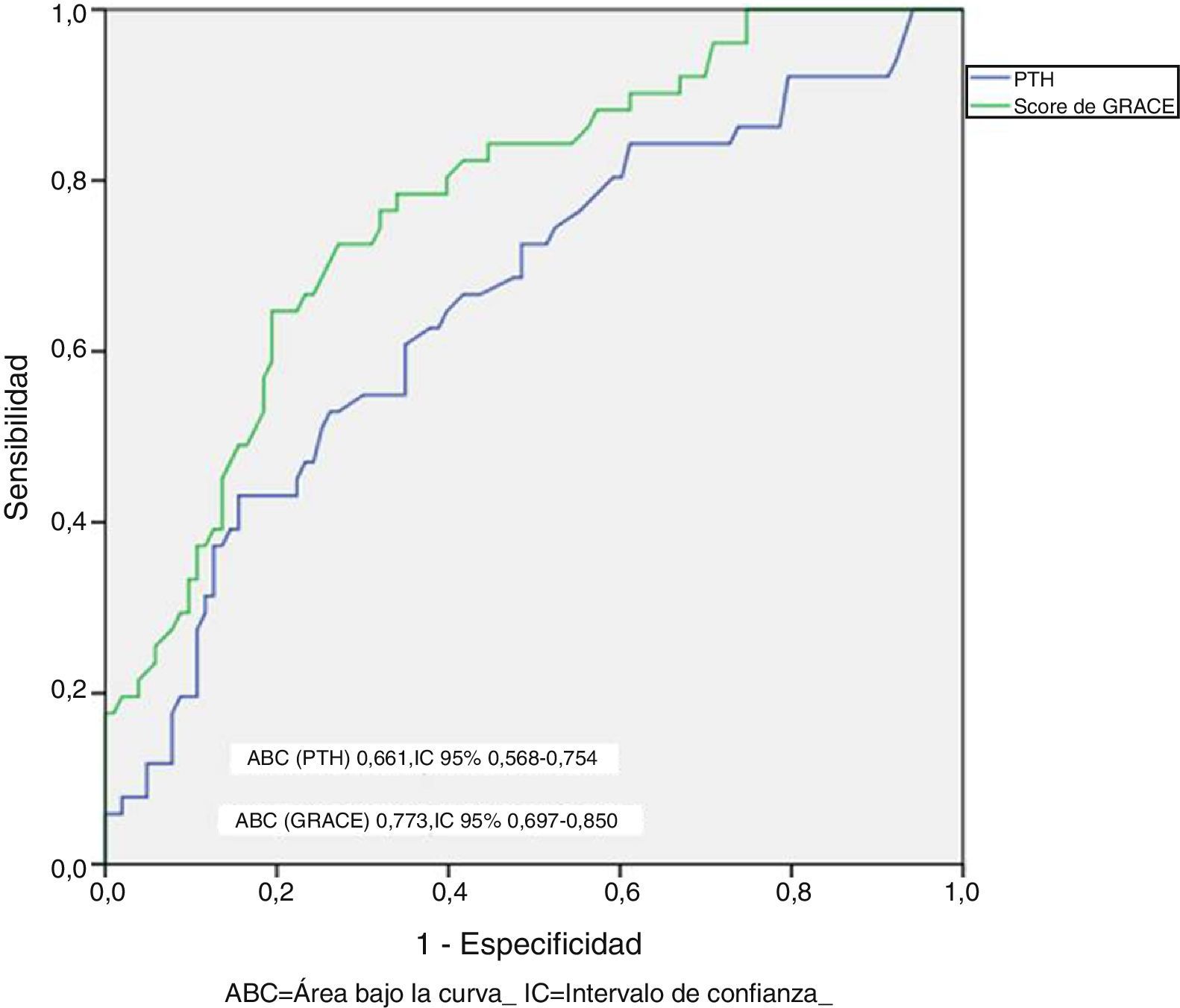
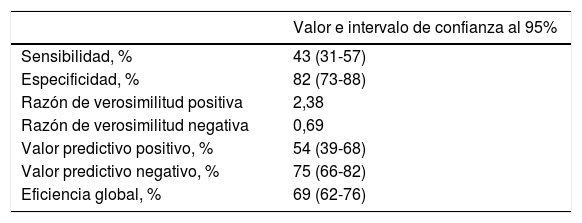
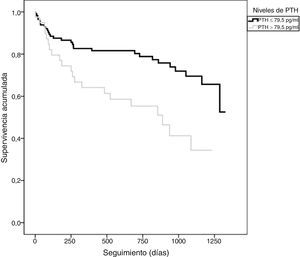
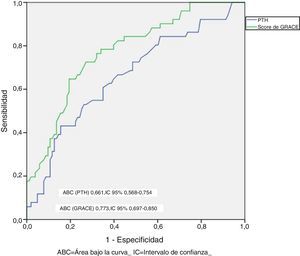
Los pacientes que presentaron un evento adverso mostraron niveles circulantes de PTH superiores (86,5±78,2 vs. 56,2±35,9pg/ml; p=0,010), mayores niveles de NT-proBNP (5.262±6.545 vs. 1.790±3.737pg/ml; p<0,001) y PCR (4,2±4,9 vs. 2,8±3,1mg/dl; p=0,061). A su vez, los pacientes con PTH elevada presentaron una TI de eventos superior a aquellos con PTH normal (TI: 34,9 vs. 13,2 por 100 pacientes-año; razón de TI: 2,64; IC 95%: 1,5-4,6). En el análisis mediante Kaplan-Meier (fig. 1) durante el seguimiento, la tasa de eventos adversos totales resultó superior en el grupo de pacientes con PTH elevada (Chi2=10,098; log-rank p<0,001). El score de GRACE presentó un mejor rendimiento diagnóstico (mayor área bajo la curva) que la PTH en la identificación de los pacientes en riesgo (Chi2=8,0; p para la comparación de áreas=0,044) (fig. 2). Los detalles del rendimiento diagnóstico de la PTH se presentan en la tabla 2. Destacamos la especificidad y el valor predictivo negativo, aún con una eficiencia global moderada.
Rendimiento diagnóstico de la determinación de hormona paratiroidea en la identificación de los pacientes en riesgo del evento combinado
| Valor e intervalo de confianza al 95% | |
|---|---|
| Sensibilidad, % | 43 (31-57) |
| Especificidad, % | 82 (73-88) |
| Razón de verosimilitud positiva | 2,38 |
| Razón de verosimilitud negativa | 0,69 |
| Valor predictivo positivo, % | 54 (39-68) |
| Valor predictivo negativo, % | 75 (66-82) |
| Eficiencia global, % | 69 (62-76) |
Se ha considerado el punto de corte recomendado por el fabricante para las estimaciones. Los intervalos de confianza se han calculado mediante el método de Wilson.
En un modelo de Cox ajustado por el score de GRACE, los niveles de PTH considerados tanto de forma continua (HR=1,0; IC 95%: 0,9-1,0; estadístico C de Harrell 0,726) como dicotomizada (HR=1,1; IC 95%: 0,6-2,2) no se asociaron con un pronóstico adverso. De la misma manera, ni calcidiol independiente (HR=0,9; IC 95%: 0,6-1,5; estadístico C de Harrell 0,717) ni calcitriol (HR=1,0; IC 95%: 0,4-2.2; estadístico C de Harrell 0,699) se asociaron con un peor pronóstico de manera independiente. En un análisis similar ajustado por score de GRACE para el resto de biomarcadores del panel analizados, ninguno de ellos mostró una asociación significativa con el pronóstico. Análisis adicionales ajustados por las principales comorbilidades, además del score de GRACE, no supusieron cambios significativos en los hallazgos (resultados no mostrados).
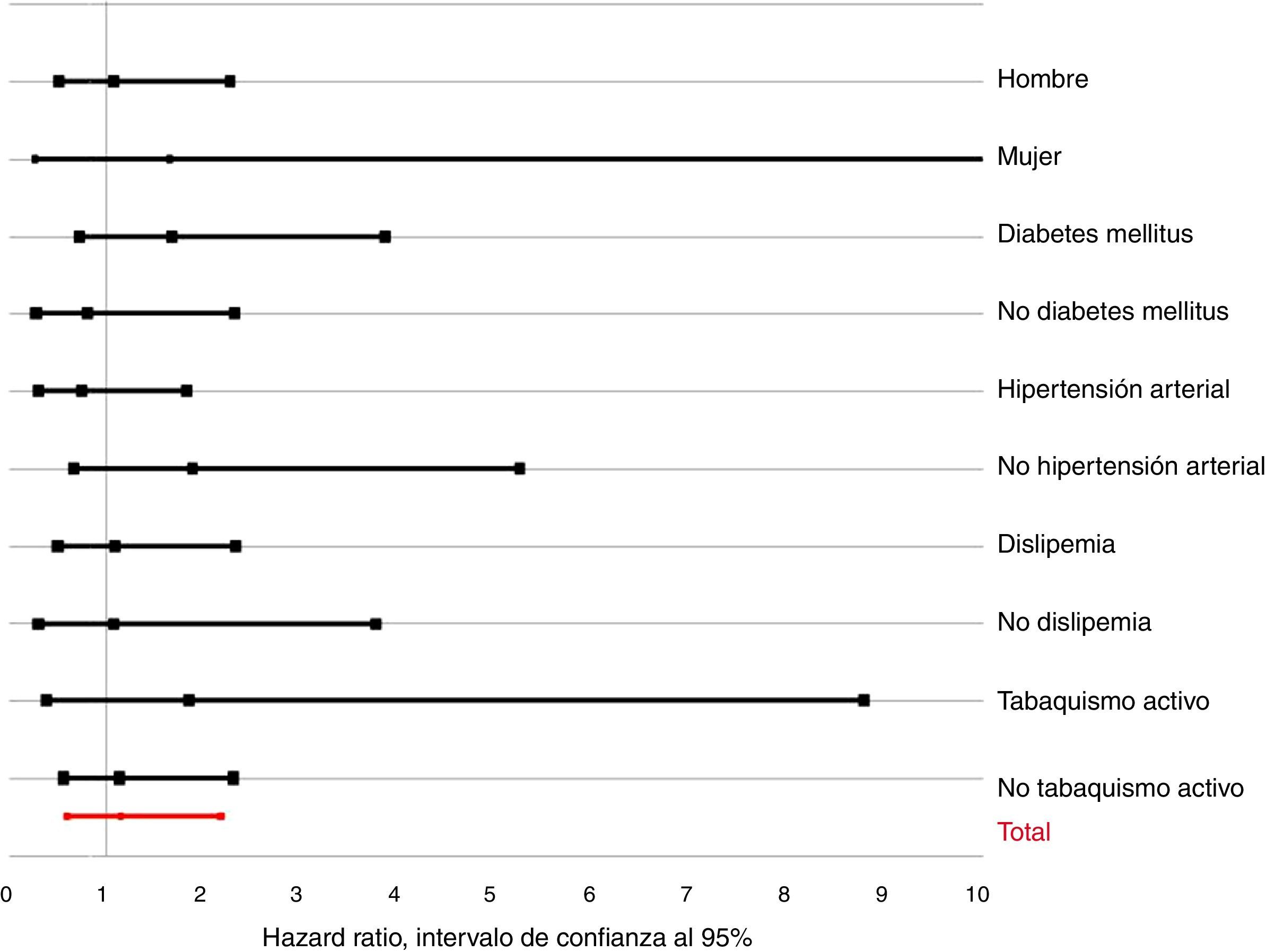
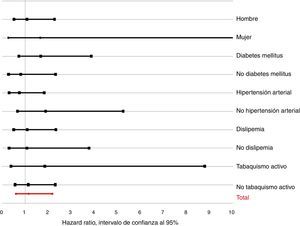
Análisis de subgruposLa figura 3 muestra el valor del HR ajustado para la PTH dicotomizada según los principales subgrupos. No se observaron interacciones con el género (p para la interacción=0,234), la condición de diabetes mellitus (p=0,263), hipertensión (p=0,605), dislipidemia (p=0,909) o el tabaquismo activo (p=0,512). Tampoco se observaron para la obesidad (p=0,680), cardiopatía isquémica previa (p=0,987), ERC (p=0,426), ictus previo (p=0,530), arteriopatía periférica (p=0,226), enfermedad pulmonar obstructiva crónica (p=0,664), disfunción sistólica ventricular izquierda (p=0,400) o los niveles de 25(OH)-D (p=0,611).
DiscusiónNuestro estudio aporta los siguientes hallazgos novedosos: 1) los niveles elevados de PTH en los pacientes ingresados por SCA en un hospital son frecuentes y se observan en aproximadamente uno de cada 4 pacientes; 2) los pacientes con niveles elevados de PTH asocian más factores de riesgo cardiovascular, presentan infartos más extensos, de mayor riesgo, con más insuficiencia cardiaca, son manejados en mayor proporción de forma conservadora y asociados a mayor inflamación, y así presentan una peor evolución tras el alta; 3) sin embargo, la PTH no fue un predictor independiente de mal pronóstico una vez ajustado por la escala de GRACE, sugiriendo que la mayor parte de la información que aporta ya está incluida en una escala de estratificación de uso común en práctica clínica; 4) finalmente, tampoco el calcidiol o el calcitriol se mostraron como instrumentos útiles en la estratificación de riesgo del paciente con SCA.
En la actualidad son numerosos los estudios que apoyan la relación existente entre enfermedad cardiovascular e hiperparatiroidismo. La presencia de niveles elevados de PTH se ha asociado a un aumento del riesgo cardiovascular siendo esta asociación atribuible, en gran medida, a un aumento de la prevalencia de los factores de riesgo cardiovascular clásicos, entre los que destacan fundamentalmente la hipertensión14 y la intolerancia a la glucosa15. Los mecanismos de hipertensión propuestos en los pacientes con hiperparatiroidismo incluyen una mayor rigidez arterial en la enfermedad de larga duración o grave, la estimulación directa del sistema renina-aldosterona a través de la PTH y la disfunción endotelial, con aumento de la actividad simpática. Del mismo modo, niveles elevados de PTH se han asociado a una disminución de la sensibilidad a la insulina con hiperinsulinemia asociada15. En este sentido, estudios observacionales recientemente publicados en nuestro medio, como el de García-Martín et al. (2014)6, han analizado de manera retrospectiva pacientes con hiperparatiroidismo primario asintomático objetivando una elevada prevalencia de obesidad (59,9%), diabetes mellitus (25%), hipertensión (47,2%) y dislipidemia (44,4%). El impacto pronóstico del hiperparatiroidismo en lo referente al desarrollo de enfermedad cardiovascular quedó patente en el estudio de Vestergaard y Mosekilde (2003)16, que reportó un descenso próximo al 40% del riesgo relativo de infarto de miocardio, ictus y muerte en los pacientes con hiperparatiroidismo primario corregido quirúrgicamente comparado con los que habían seguido una estrategia conservadora.
Pese a todo lo anteriormente expuesto, todavía es muy pobre la evidencia en lo que respecta a la relación existente entre los niveles de PTH y el pronóstico una vez la enfermedad coronaria está establecida. Estudios recientes han analizado la presencia de condicionantes asociados a un perfil clínico más adverso en aquellos pacientes con angina crónica estable y niveles elevados de PTH. Por ejemplo, se ha objetivado como la presencia de niveles elevados de PTH se ha correlacionado con la presencia de enfermedad coronaria más compleja, con mayor puntuación en el score Syntax y más calcificada (Martín-Reyes et al., 2016)8 o con una respuesta subóptima a la antiagregación, secundaria a un mayor grado de reactividad plaquetaria (Verdoia et al., 2016)9. En lo que respecta a las implicaciones pronósticas en pacientes estables, los niveles elevados de PTH también se han relacionado con mayores eventos cardiovasculares adversos durante el seguimiento. En el estudio de Tuñón et al. (2016)10 en el que se analizaron pacientes a los 6meses tras ser ingresados por un SCA se observó cómo aquellos pacientes diabéticos tipo2 que posteriormente desarrollaban más eventos durante el seguimiento presentaban —comparativamente con los pacientes diabéticos que no desarrollaron eventos adversos— mayores niveles de PTH [71,3 (47,3-106,6) vs. 51,9 (40,8-66,2)pg/ml; p=0,004)], factor de crecimiento de fibroblastos-23 [112,0 (59,9-167,6) vs. 68,9 (54,2-93,0)RU/ml; p=0,002] y fósforo [(3,53±0,71 vs. 3,25±0,50mg/dl; p=0,017)], no apreciándose diferencias significativas en pacientes no diabéticos. En la misma línea, en un pequeño estudio de 22 pacientes mayores de 60 años que ingresaron por SCASEST se concluyó que la presencia de niveles bajos de 25(OH)-D y elevados de PTH identificaban a aquellos pacientes con una mayor probabilidad de tener un evento cardiovascular adverso (3 pacientes) durante el seguimiento, siendo los niveles de PTH significativamente mayores en los pacientes que presentaron dichos eventos11.
En este sentido, nuestro estudio muestra de forma consistente que los niveles elevados de PTH en los pacientes con SCA asocian un peor pronóstico en términos de muerte y reingreso por infarto de miocardio o angina pero que, sin embargo, esta asociación virtualmente desaparece tras ajustar por el score de GRACE, sugiriendo la ausencia de un efecto independiente sobre el pronóstico en este grupo de pacientes. El hallazgo de una mayor TI de eventos en los pacientes con PTH elevada durante el seguimiento resultó razonable teniendo en cuenta que se trataba de una población de mayor riesgo cardiovascular y con mayores factores predictores asociados de mal pronóstico comparada con aquellos con valores normales de PTH al ingreso. Los pacientes con niveles elevados de PTH presentaban más factores de riesgo cardiovascular tales como hipertensión o dislipidemia y, a su vez, más antecedentes de cardiopatía isquémica crónica. Nuestro estudio coincide con trabajos previos que han analizado la mayor prevalencia de dichos factores de riesgo en este grupo poblacional6,7 aunque con prevalencias notablemente distintas, por ejemplo, en hipertensión (80,0% en población con PTH elevada en nuestro estudio vs. 47,2% en registros previos), diabetes (47,5% en población con PTH elevada en nuestro estudio vs. 25% en registros previos) o dislipidemia (71% en población con PTH elevada en nuestro estudio vs. 44% en registros previos). Probablemente estos hallazgos guarden relación con el hecho de que la población analizada en nuestro estudio sea de mayor riesgo cardiovascular, siendo población de mayor edad y que ya ha presentado un evento isquémico, mientras que la población de los estudios mencionados6,7 se limitaba a pacientes con diagnóstico de hiperparatiroidismo primario asintomático. Desde el punto de vista de la función renal, los pacientes con niveles elevados de PTH tenían más antecedentes de ERC, presentaban peores TFG y niveles más elevados de cistatinaC. Dicho deterioro de la función renal se ha demostrado como un importante marcador pronóstico independiente en la cardiopatía isquémica, presentándose de manera consistente como un factor de riesgo de eventos cardiovasculares y de mortalidad total en poblaciones de alto riesgo17,18. Resulta reseñable también el hecho de que entre los pacientes con niveles elevados de PTH sobresalgan otros datos analíticos directamente relacionados con un pronóstico cardiovascular adverso en el contexto de un SCA, como son la presencia de más anemia, de niveles más elevados de NT-proBNP o la presencia de mayores niveles de reactantes de fase aguda, consistente con estudios previos19-21.
Por otra parte, en nuestro estudio se objetivó que los pacientes con mayores niveles de PTH presentaban niveles más bajos de 25(OH)-D [rho=–0,274; p=0,001]. Este hallazgo resulta de interés dado que trabajos previos han puesto de manifiesto la relación existente entre la presencia de niveles reducidos de 25(OH)-D con el perfil clínico de los pacientes y una evolución adversa en el SCA21-24, suponiendo por tanto un factor de mal pronóstico adicional en este grupo de pacientes. Además, la deficiencia de vitaminaD se asocia con un aumento de la prevalencia de comorbilidad en la población general24 y se ha propuesto que los niveles de vitaminaD podrían ser un reflejo del «estado global de salud» de un paciente25. Esta observación está en línea con los resultados de nuestro estudio.
LimitacionesNuestro estudio presenta algunas limitaciones. En primer lugar, se trata de un estudio observacional y por ello está sujeto potencialmente a sesgo de confusión. En segundo lugar, está concebido como de naturaleza exploratoria y por ello no podemos descartar que estudios con una mayor potencia puedan encontrar un valor pronóstico.
ConclusionesLa prevalencia de los niveles elevados de PTH entre los pacientes ingresados por SCA fue elevada y su presencia se asoció con un perfil clínico más adverso y una peor evolución. Sin embargo, no resultó un predictor independiente de mal pronóstico al ajustar por una escala de uso clínico común, como es la escala de GRACE. Los niveles bajos de calcidiol y calcitriol, aun asociándose a un perfil de mayor riesgo y más comórbido, no se mostraron útiles en la estratificación de riesgo.
AutoríaTodos los autores han participado en el trabajo de investigación y en la preparación del artículo, confirmando a su vez que aprueban la versión final del artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Expresamos nuestro agradecimiento al Servicio de Análisis Clínicos, y en particular a Carmen Nieto por las tareas relacionadas con la determinación de hormona paratiroidea.