Se analiza el impacto de un Código Sepsis intrahospitalario sobre el uso y consumo de antibióticos, la estancia hospitalaria y la mortalidad.
DiseñoEstudio retrospectivo cuasiexperimental observacional.
ÁmbitosUCI polivalente de 11 camas en un hospital de tercer nivel.
PacientesPacientes ingresados en UCI con diagnóstico de sepsis grave o shock séptico.
IntervencionesUn grupo postintervención (POST-CS) (septiembre 2012-agosto 2013) se comparó con un grupo histórico (PRE-CS) control (enero-diciembre 2010).
VariablesTipo de tratamiento antibiótico, estrategia terapéutica antibiótica y resultados clínicos. El consumo de antibióticos fue expresado en dosis diarias definidas/100 estancias.
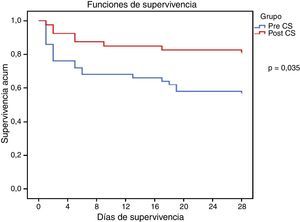
ResultadosSe incluyeron 42 pacientes con sepsis grave/shock séptico en el grupo POST-CS y 50 en el grupo PRE-CS. El consumo total de antibióticos (dosis diarias definidas) fue similar en ambos grupos. En el grupo POST-CS la tasa de desescalamiento fue significativamente mayor (75 vs. 30,8%, p<0,005), mientras que la prescripción de antibióticos de uso restringido fue significativamente menor (74 vs. 52%, p=0,031). Finalmente, el grupo de pacientes POST-CS presentó una mortalidad intrahospitalaria y a 28 días significativamente menor (23 vs. 44% [p=0,035] y 31 vs. 56% [p=0,01]), así como una disminución de la estancia en UCI en el límite de la significación estadística (5 vs. 10,5 días, p=0,05).
ConclusiónLa implantación de un programa de Código Sepsis intrahospitalario se asoció a una mejor utilización del tratamiento antibiótico, incrementándose significativamente el desescalamiento terapéutico y disminuyendo el uso de antibióticos de uso restringido, así como a una significativa disminución de la mortalidad y una tendencia hacia una menor estancia en UCI.
A study was performed to analyze the impact of an in-hospital Sepsis Code (SC) program on use of antibiotic and clinical outcomes.
DesignQuasi-experimental observational retrospective study.
SettingPolyvalent 11 beds ICU belonging to a tertiary Universitary hospital.
PatientsPatients admitted consecutively to the ICU with diagnosis of severe sepsis or septic shock.
InterventionsA post intervention group (POST-SC) (September 2012–August 2013) was compared with a historical group (PRE-SC) used as control (January–December 2010).
VariablesAntibiotic treatment, therapeutic antibiotic strategy, mortality and length of stay. Antibiotic consumption was expressed as defined daily doses (DDD)/ 100 stays.
Results42 patients with SS/SS in POST-SC group and 50 patients in PRE-SC group were consecutively recluted and further analyzed. Total antibiotic consumption (DDD) was similar in both groups. Rate of de-escalation therapy was significantly higher in POST-SC group (75% vs 30,8%, p<0,005) while prescription of restricted antibiotics was significantly lower (74% vs 52%, p=0,031). Finally POST-SC patients showed a significantly decrease in hospital and 28 days mortality rates [23% vs 44%, (p=0,035) and 31% vs 56% (p=0,014) respectively] as well as a reduction in ICU length of stay compared to PRE-SC cohort (5 days vs 10,5 days, p=0,05).
ConclusionThe implementation of a Sepsis Code-hospital protocol is associated to an improvement in the management of antibiotic therapy with a significant increase in de-escalation therapy and lesser utilization of restricted use antibiotics, as well as a significant reduction in mortality, and a tendency towards shorter ICU length stay.
La sepsis grave (SG) constituye una de las enfermedades más frecuentes en los hospitales y especialmente en las unidades de cuidados intensivos (UCI)1. Estudios epidemiológicos recientes demuestran que su incidencia aumenta2, superando a otras enfermedades como el ictus, el cáncer o el infarto de miocardio. Además de generar un importante consumo de recursos, esta enfermedad presenta una elevada mortalidad, que en el caso del shock séptico (SS) puede alcanzar cifras cercanas al 50%3,4. Si bien hasta hace unos años la piedra angular en el tratamiento de la sepsis eran los antibióticos, y sin olvidar su gran importancia, se ha visto que la probabilidad de sobrevivir a esta agresión depende en gran medida de la precocidad en el diagnóstico y de la instauración de un abordaje terapéutico temprano y adecuado, ya que se trata de una enfermedad dependiente del tiempo5,6. Desde la publicación en 2001 del trabajo de Rivers et al.7, que demostró cómo una intervención precoz y «agresiva» en las 6 primeras horas consistente en la aplicación de un protocolo de actuación guiado por determinados objetivos clínicos disminuía la mortalidad un 16%, se han publicado sucesivas guías y recomendaciones para el manejo clínico y el tratamiento de los pacientes con SG o SS, promovidas por sociedades científicas de ámbito mundial cuyo principal exponente final ha sido el proyecto conocido como Surviving Sepsis Campaign8, con el objetivo de disminuir la mortalidad de la sepsis un 25%.
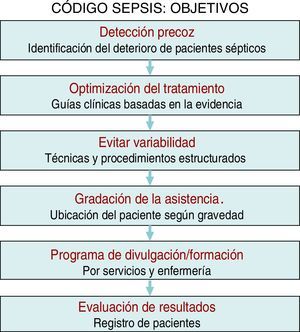
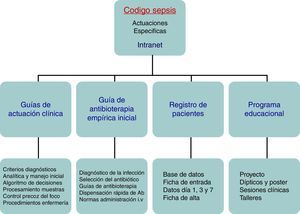
Existe suficiente evidencia científica para afirmar que la aplicación precoz y dirigida de estas medidas diagnóstico-terapéuticas (bundles o paquetes de medidas) incrementan de manera significativa la supervivencia y disminuyen tanto la estancia hospitalaria como los costes sanitarios9. Sin embargo, a pesar de campañas de difusión y educacionales, el grado de cumplimiento de estas medidas sigue siendo escaso en la mayoría de los entornos hospitalarios. En un reciente trabajo de Ferrer et al.10 se demuestra cómo las medidas de manejo y tratamiento recomendadas en las primeras 6 y 24h por las guías únicamente se cumplían en un 10 y un 15,7% de los casos, respectivamente. Este hecho se tradujo en un muy discreto descenso de las cifras de mortalidad y del consumo de recursos, bastante alejado de las expectativas marcadas por la Surviving Sepsis Campaign. Dado que un retraso en el diagnóstico, en la reanimación inicial, en la administración de antibioterapia adecuada y en el control del foco infeccioso eleva la incidencia de fracaso de órganos, de la mortalidad, la estancia hospitalaria y el consumo de recursos11,12, y sabiendo además que el grado de cumplimiento de las medidas recomendadas para el manejo inicial de la sepsis es escaso, en los últimos años comienzan a organizarse en diferentes centros hospitalarios grupos multidisciplinares de trabajo para el manejo integral de la SG. En nuestro centro, en el año 2011 se creó el Grupo de Trabajo en Código Sepsis (GT-CS), un grupo de trabajo multidisciplinar que se marca como objetivo el reconocimiento y tratamiento precoz de la SG y el SS mediante la puesta en marcha de una serie de intervenciones: sesiones de difusión y formación, elaboración de protocolos de actuación y de herramientas de ayuda informáticas, así como elaboración de registros en una base de datos (fig. 1).
En este trabajo se analizan los efectos que la implantación de un Código Sepsis intrahospitalario (CSI) ha supuesto para los pacientes críticos que ingresan en la UCI con diagnóstico de SG o SS. El objetivo principal es analizar los cambios en el perfil y la adecuación del tratamiento antibiótico empleado y, de forma secundaria, analizar las diferencias en los resultados clínicos entre los 2 grupos estudiados.
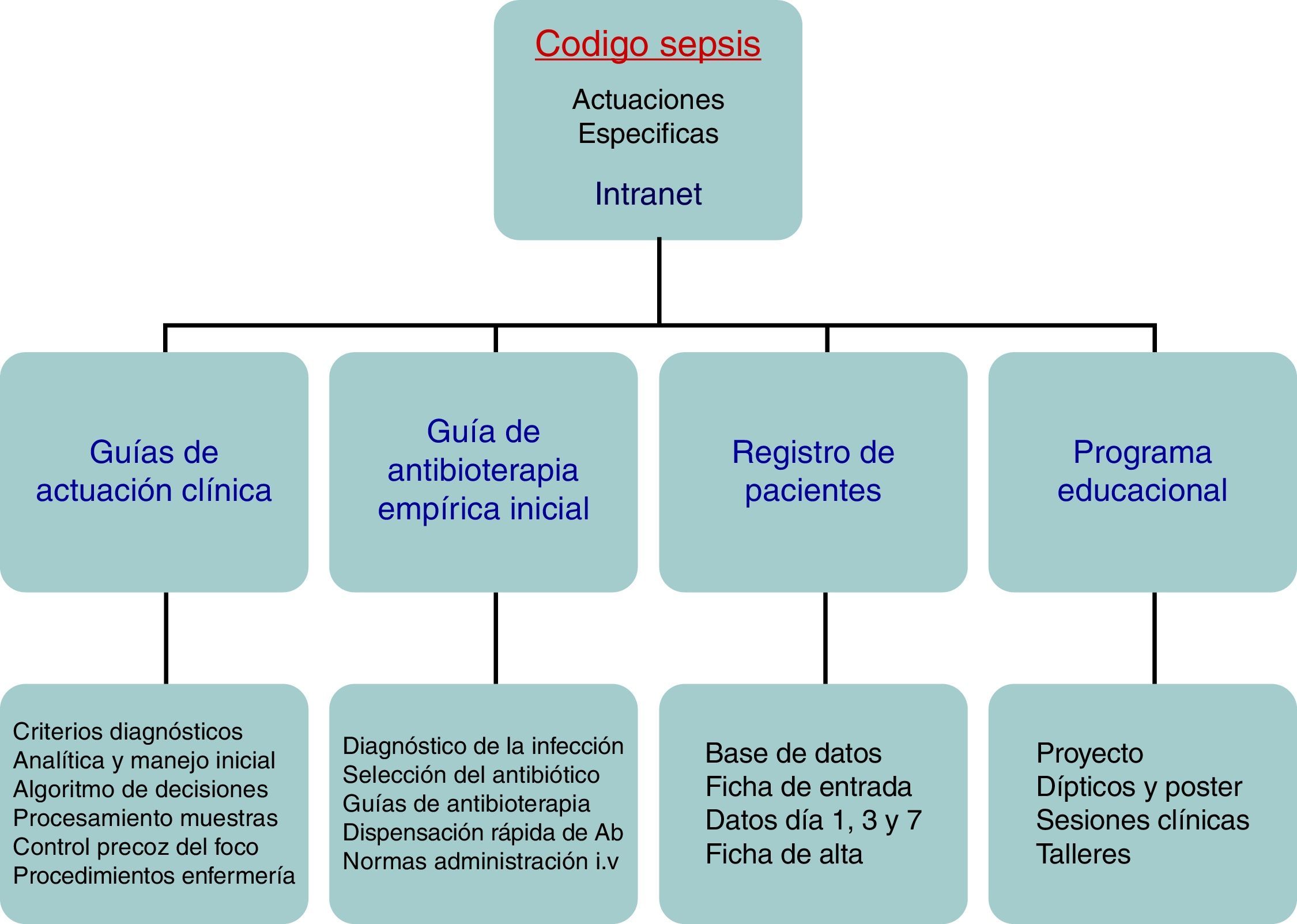
Pacientes y métodosEl GT-CS del Hospital Clínico Universitario de Valladolid se constituye en mayo de 2011 con el objetivo de elaborar, difundir e implantar un plan de mejora hospitalario en la prestación de la asistencia integral al paciente con SG y/o SS (fig. 1). El GT-CS está compuesto por un grupo seleccionado de médicos de diferentes especialidades y personal de enfermería. Las actuaciones que se llevaron a cabo incluyeron la implementación de un programa educacional y de difusión con diversas sesiones formativas a servicios médicos y a enfermería, la elaboración tanto en papel como en formato electrónico de guías de actuación clínica en el paciente séptico (algoritmos de diagnóstico, de gradación de gravedad, árboles de decisión y tratamiento en forma de dípticos y pósters, etc.), guías de antibioterapia empírica inicial en SG y SS, guías de control del foco infeccioso, guías de extracción, procesamiento y transporte de muestras biológicas para cultivo, guías de preparación y administración de fármacos, así como un sistema de dispensación rápida de antibióticos. Además, se diseñó una aplicación informática integrada en la intranet hospitalaria y un registro informatizado para la inclusión y el seguimiento de los pacientes incluidos en el CSI (fig. 2).
Diseño del estudio y variablesEl estudio fue realizado en la UCI médico-quirúrgica de 11 camas del Hospital Clínico Universitario de Valladolid. Se trata de un estudio restrospectivo cuasiexperimental y observacional en el que se incluyeron pacientes diagnosticados de SG/SS a su ingreso en UCI, según las definiciones propuestas por la Conferencia de Consenso SCCM/ESICM/ACCP/ATS/SIS13.
Se comparó una población consecutiva de pacientes sépticos atendidos tras la implantación del CSI durante 12 meses (septiembre 2012-agosto 2013) (POST-CS) con una cohorte histórica de pacientes sépticos, recogida también de forma consecutiva durante el año 2010 en el mismo centro, previamente a la implantación del citado CS (PRE-CS).
La gravedad de los pacientes se estimó mediante la utilización del Acute Physiology and Chronic Health Evaluation II (APACHE II) score en el momento del ingreso en UCI.
Se excluyeron del estudio los pacientes con una edad menor de 18 años y los que hubieran desarrollado la SG/SS durante su estancia en la UCI, siendo otro el motivo de ingreso en la unidad. Los pacientes que estuvieron ingresados en la UCI menos de 24h no se tuvieron en cuenta en el consumo de antibióticos debido a que en esa situación no es posible calcular las dosis diarias definidas (DDD) al no haber generado estancias hospitalarias. Así mismo, tampoco se incluyeron en el estudio los pacientes en los que se decidió llevar a cabo una limitación del esfuerzo terapéutico. En el grupo de los pacientes PRE-CS, la prescripción se hizo en función del criterio de los médicos responsables. En el grupo de pacientes POST-CS, la elección de la antibioterapia empírica se realizó siguiendo las recomendaciones de la Guía para el Tratamiento Antibiótico Empírico Inicial en el paciente con SG o SS elaborada para tal efecto por el GT-CS.
Finalmente se revisaron sistemáticamente los resultados microbiológicos y la prescripción antibiótica en los días 3 y 7, reevaluando el tratamiento antibiótico en cada caso, así como la evolución y el desenlace clínico final.
El estudió fue evaluado y aprobado por la Comisión de Ética e Investigación del Hospital Clínico Universitario de Valladolid. Todos los datos clínicos y demográficos fueron recogidos y analizados de forma anonimizada de acuerdo con la Ley de Protección de Datos mediante el uso del Sistema de Gestión de Datos de Investigación de nuestro centro.
Registro de variablesSe registraron variables epidemiológicas, demográficas y clínicas de los pacientes incluidos en el estudio: edad, sexo, APACHE II, tipo de infección (comunitaria o nosocomial), foco infeccioso, tipo de microorganismo causante de la infección, nivel de gravedad de la sepsis (SG o SS), estancia y mortalidad en UCI y hospitalaria en ambas cohortes.
En relación con la antibioterapia, se revisaron los resultados microbiológicos de los cultivos y se evaluó la adecuación del tratamiento empírico iniciado en la UCI, registrándose el grupo de antibióticos que se prescribieron empíricamente, con especial mención a la prescripción de antibióticos de uso restringido y al tipo de estrategia terapéutica que se siguió. Fueron considerados de uso restringido los siguientes antibióticos: carbapenemes, linezolid, tigeciclina y daptomicina. Estos antibióticos se consideraron restringidos en los 2 periodos igualmente mediante control por el Servicio de Farmacia.
Se determinó la adecuación del tratamiento antibiótico según la sensibilidad in vitro de los microorganismos aislados (causantes de la infección). Se consideró tratamiento empírico adecuado cuando al menos un fármaco era eficaz de acuerdo con los resultados in vitro14. Se analizó la tasa de desescalamiento antibiótico, entendiendo como tal la reevaluación del tratamiento antibiótico una vez que los resultados microbiológicos estuvieron disponibles, sustituyendo el antibiótico empírico seleccionado inicialmente por otro/s de menor espectro15. Con base en esto la estrategia terapéutica se clasificó en 3 grupos:
- a)
Tratamiento “desescalado”: interrupción de un antibiótico o cambio a un antibiótico con un espectro más estrecho, basado en resultados microbiológicos, antibiograma y foco de infección.
- b)
Tratamiento no “desescalado”: pese a la disponibilidad de resultados microbiológicos y pertinencia de sustitución por otro antimicrobiano de menor espectro más adecuado, este no se realiza. No se consideró tratamiento no “desescalado” aquellos casos en que pese a disponer de cultivos microbiológicos no se consideró pertinente el cambio a un antibiótico de menor espectro (por ejemplo en situaciones tales como alergias medicamentosas, no indicación de un antibiótico para determinados focos infecciosos, etc.).
- c)
Modificación de tratamiento: adición de un nuevo antibiótico o cambio a otro con un espectro más amplio.
Se analizó el tiempo (días) que se tardó en modificar el tratamiento en los grupos a y c, así como los días de tratamiento antibiótico en la UCI y los días de tratamiento antibiótico total de su estancia hospitalaria. Así mismo, se midió el consumo de antibióticos por grupo terapéutico y/o indicación principal.
El consumo de antibióticos en el ámbito hospitalario fue expresado como el número de DDD por 100 estancias. Se trata de una estimación del número de DDD por cada 100 estancias de pacientes, y refleja la presión o el uso de un determinado antibiótico sobre los pacientes atendidos. Se ha tenido en cuenta el consumo de antibióticos durante los días que duró el proceso infeccioso por el que ingresaron en la UCI, y siempre que la prescripción fuera consecuencia del abordaje inicial de la SG/SS. Los antibióticos que se prescribieron por reinfecciones y/o colonizaciones en su estancia en UCI no se han analizado, puesto que no eran el objeto del estudio. No se analizó el consumo de fármacos antifúngicos dada la escasa incidencia de infección por hongos en ambas cohortes: 3 pacientes en el grupo PRE-CS y 5 en el grupo POST-CS.
Finalmente, también se registró la mortalidad bruta intra-UCI, la mortalidad a los 28 días, la mortalidad hospitalaria y los días de estancia hospitalaria y en UCI.
Análisis estadísticoLas variables continuas se expresaron como mediana y rango intercuartílico al no presentar una distribución normal. Las variables cualitativas se expresaron como su valor absoluto acompañado de su porcentaje. La comparación de las medianas de las variables continuas de ambos grupos se efectuó mediante el test U de Mann-Whitney. La comparación de proporciones se realizó mediante la prueba de la chi cuadrado. Para analizar la diferencia de mortalidad entre ambos periodos se empleó la regresión logística binaria uni y multivariante, creando la variable dicotómica código sepsis (CS): sí=post-CS/no=pre-CS. El riesgo de mortalidad hospitalaria se expresó como odds ratio (OR) e intervalo de confianza al 95% (IC 95%). Para el análisis multivariante se incluyeron aquellas variables que en el univariante mostraron diferencias con una p<0,1. Así mismo, se llevó a cabo un análisis de supervivencia mediante curvas de Kaplan-Meier. Se tomó un riesgo alfa con una p<0,05 para considerar una relación como estadísticamente significativa. Se empleó el programa SPSS 20.0 (SPSS, Inc., Chicago, IL, EE. UU.) para el análisis estadístico.
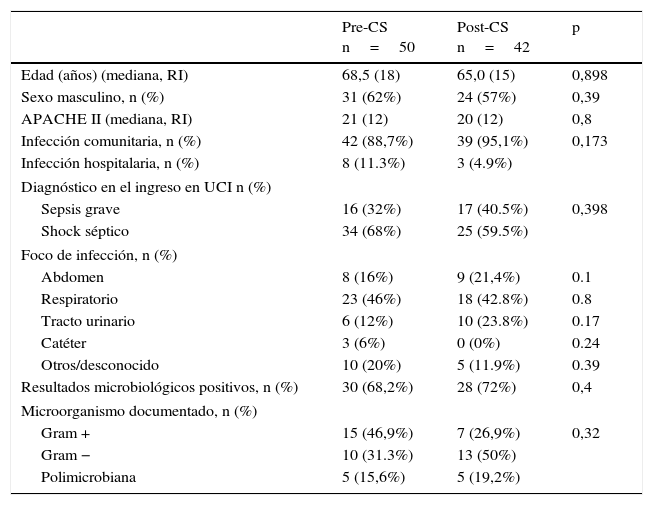
ResultadosCaracterísticas de los pacientesEn el periodo de estudio PRE-CS se incluyeron 50 pacientes consecutivos diagnosticados de SG/SS. En el grupo POST-CS se incluyeron 42 pacientes con SG/SS. Las características demográficas y clínicas de los 2 grupos de pacientes se resumen en la tabla 1. No hay diferencias entre los 2 grupos en edad y sexo. Igualmente, la puntuación APACHE II el día del ingreso en la UCI no presentó diferencias significativas. Aunque se observó una tendencia a mayor presencia al ingreso de SS en el periodo pre-CS, esta no fue estadísticamente significativa. Seis pacientes del grupo PRE-CS y 4 del grupo POST-CS fallecieron en las primeras 24h de ingreso en la UCI. Estos pacientes solo fueron excluidos para el cálculo del consumo de antibióticos, pero sí se tuvieron en cuenta para el análisis del resto de las variables.
Características descriptivas de los pacientes en los 2 grupos
| Pre-CS n=50 | Post-CS n=42 | p | |
|---|---|---|---|
| Edad (años) (mediana, RI) | 68,5 (18) | 65,0 (15) | 0,898 |
| Sexo masculino, n (%) | 31 (62%) | 24 (57%) | 0,39 |
| APACHE II (mediana, RI) | 21 (12) | 20 (12) | 0,8 |
| Infección comunitaria, n (%) | 42 (88,7%) | 39 (95,1%) | 0,173 |
| Infección hospitalaria, n (%) | 8 (11.3%) | 3 (4.9%) | |
| Diagnóstico en el ingreso en UCI n (%) | |||
| Sepsis grave | 16 (32%) | 17 (40.5%) | 0,398 |
| Shock séptico | 34 (68%) | 25 (59.5%) | |
| Foco de infección, n (%) | |||
| Abdomen | 8 (16%) | 9 (21,4%) | 0.1 |
| Respiratorio | 23 (46%) | 18 (42.8%) | 0.8 |
| Tracto urinario | 6 (12%) | 10 (23.8%) | 0.17 |
| Catéter | 3 (6%) | 0 (0%) | 0.24 |
| Otros/desconocido | 10 (20%) | 5 (11.9%) | 0.39 |
| Resultados microbiológicos positivos, n (%) | 30 (68,2%) | 28 (72%) | 0,4 |
| Microorganismo documentado, n (%) | |||
| Gram + | 15 (46,9%) | 7 (26,9%) | 0,32 |
| Gram − | 10 (31.3%) | 13 (50%) | |
| Polimicrobiana | 5 (15,6%) | 5 (19,2%) | |
APACHE II: Acute Physiology and Chronic Health Evaluation II; Post-CS: periodo posterior al Código Sepsis; Pre-CS: periodo anterior al Código Sepsis; RI: rango intercuartílico; UCI: Unidad de Cuidados Intensivos.
En ambos periodos la mayor parte de los pacientes presentaba infecciones adquiridas en la comunidad. Tampoco hubo diferencias estadísticamente significativas en cuanto al foco de origen de la sepsis. En el periodo post-CS también se observó una tendencia a una mayor tasa de aislamientos de gramnegativos como agentes causantes del cuadro infeccioso, que no llega a alcanzar la significación estadística. Es de destacar que la tasa de aislamiento de patógenos fue elevada y muy similar entre ambos grupos (68 vs. 72%).
Prescripción de antibióticosLos resultados sobre el tratamiento antibiótico se muestran en la tabla 2. El porcentaje de pacientes que recibieron tratamiento empírico adecuado fue muy elevado, y aunque no alcanzaron diferencias significativas entre ambos grupos, fue mayor en el POST-CS (86,7 vs. 96,2%, p=0,45). Respecto al tratamiento empírico, la combinación de antibióticos más prescrita fue la de carbapenem+linezolid, siendo esta más empleada en el periodo pre-CS que en el post-CS, aunque sin llegar a alcanzar significación estadística (56,0 vs. 39,3%, p=0,37).
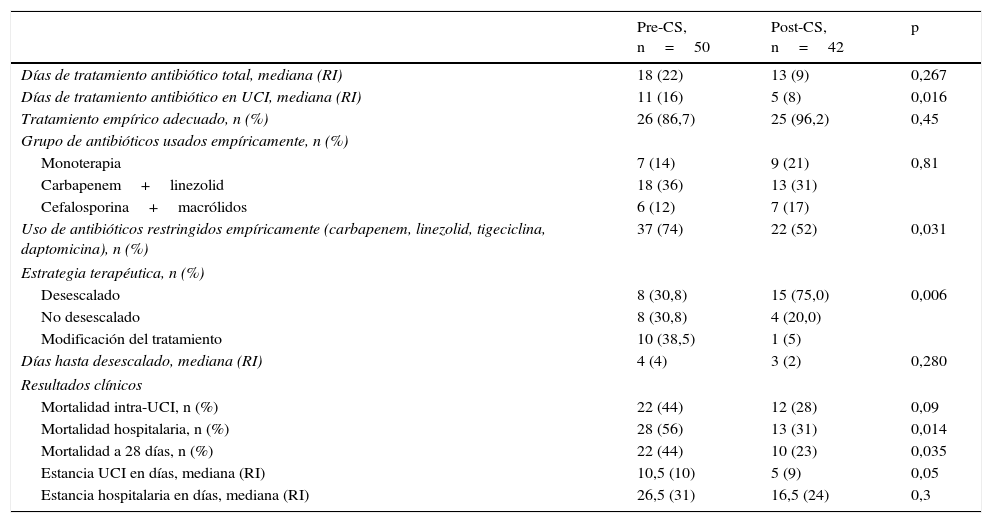
Influencia de la implantación del Código Sepsis intrahospitalario en el tratamiento antibiótico empleado, en la estrategia terapéutica y en los resultados clínicos
| Pre-CS, n=50 | Post-CS, n=42 | p | |
|---|---|---|---|
| Días de tratamiento antibiótico total, mediana (RI) | 18 (22) | 13 (9) | 0,267 |
| Días de tratamiento antibiótico en UCI, mediana (RI) | 11 (16) | 5 (8) | 0,016 |
| Tratamiento empírico adecuado, n (%) | 26 (86,7) | 25 (96,2) | 0,45 |
| Grupo de antibióticos usados empíricamente, n (%) | |||
| Monoterapia | 7 (14) | 9 (21) | 0,81 |
| Carbapenem+linezolid | 18 (36) | 13 (31) | |
| Cefalosporina+macrólidos | 6 (12) | 7 (17) | |
| Uso de antibióticos restringidos empíricamente (carbapenem, linezolid, tigeciclina, daptomicina), n (%) | 37 (74) | 22 (52) | 0,031 |
| Estrategia terapéutica, n (%) | |||
| Desescalado | 8 (30,8) | 15 (75,0) | 0,006 |
| No desescalado | 8 (30,8) | 4 (20,0) | |
| Modificación del tratamiento | 10 (38,5) | 1 (5) | |
| Días hasta desescalado, mediana (RI) | 4 (4) | 3 (2) | 0,280 |
| Resultados clínicos | |||
| Mortalidad intra-UCI, n (%) | 22 (44) | 12 (28) | 0,09 |
| Mortalidad hospitalaria, n (%) | 28 (56) | 13 (31) | 0,014 |
| Mortalidad a 28 días, n (%) | 22 (44) | 10 (23) | 0,035 |
| Estancia UCI en días, mediana (RI) | 10,5 (10) | 5 (9) | 0,05 |
| Estancia hospitalaria en días, mediana (RI) | 26,5 (31) | 16,5 (24) | 0,3 |
Post-CS: periodo posterior al Código Sepsis; Pre-CS: periodo anterior al Código Sepsis; RI: rango intercuartílico; UCI: Unidad de Cuidados Intensivos,.
Se objetivaron menos días totales de tratamiento antibiótico en el grupo POST-CS, siendo significativamente menor la duración de la antibioterapia durante la estancia en UCI: [11(16) vs 5(8); p=0,016]. Por otra parte, cabe destacar que en el grupo POST-CS el empleo de antibióticos de uso restringido como tratamiento empírico fue significativamente inferior en comparación con el grupo PRE-CS (74 vs. 52%, p=0,031).
Respecto al desescalamiento antibiótico, una vez que se dispuso de los resultados microbiológicos este se llevó a cabo de una forma significativamente mayor en el grupo POST-CS que en el PRE-CS (75 vs. 30,8%, p=0,006). Hay que reseñar que en el grupo PRE-CS hubo 4 pacientes que pese a disponer de resultados microbiológicos no pudieron ser clasificados en ningún grupo de estrategia terapéutica: en uno de ellos no procedía “desescalar”, por lo que no se clasificó en ningún grupo. Los otros 3 pacientes fallecieron antes de la emisión de los resultados microbiológicos definitivos.
De igual forma, en el grupo POST-CS existían 8 pacientes con aislamiento microbiológico que tampoco pudieron ser clasificados en ninguna estrategia terapéutica: en 4 pacientes no procedía “desescalar” y los restantes fallecieron antes de la emisión de los resultados microbiológicos.
Consumo de antibióticosLos resultados en consumo de antibióticos se expresan en número de DDD/100 estancias comparando los 2 periodos: pre y post-CS. Se excluyeron 6 y 4 pacientes en los grupos PRE-CS y POST-CS, respectivamente, por haber ingresado en la UCI menos de 24h y no haber generado estancia hospitalaria.
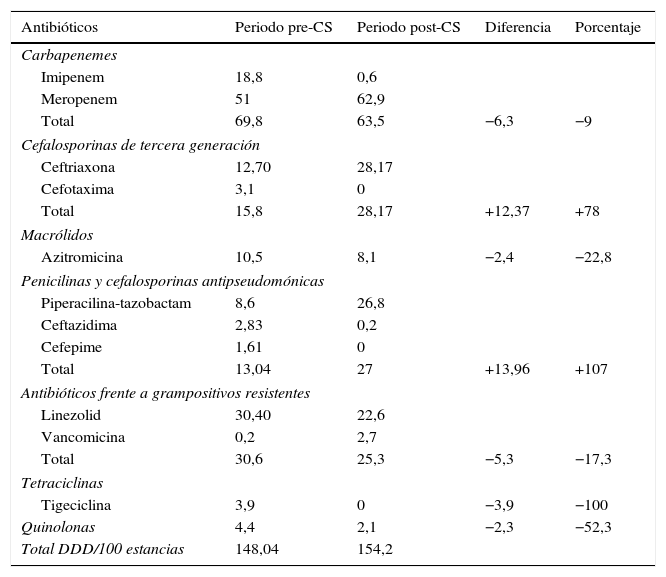
El consumo promedio de antimicrobianos en el PRE-CS fue de 148,04DDD/100 estancias y 154,2 en el grupo POST-CS. El consumo de los antibióticos de uso restringido (carbapenem, linezolid, tigeciclina) fue mayor en el grupo PRE-CS (104,1 vs. 86,1 DDD/100 estancias), siendo linezolid en el que se observó una mayor diferencia (30,4 vs. 22,6 DDD/100 estancias). En cambio, el consumo de cefalosporinas de tercera generación y piperacilina-tazobactam fue mayor en el grupo POST-CS (tabla 3).
Diferencia entre el número de dosis diarias definidas de antibióticos por 100 estancias de pacientes con sepsis grave/shock séptico ingresados en la Unidad de Cuidados Intensivos entre ambos periodos
| Antibióticos | Periodo pre-CS | Periodo post-CS | Diferencia | Porcentaje |
|---|---|---|---|---|
| Carbapenemes | ||||
| Imipenem | 18,8 | 0,6 | ||
| Meropenem | 51 | 62,9 | ||
| Total | 69,8 | 63,5 | −6,3 | −9 |
| Cefalosporinas de tercera generación | ||||
| Ceftriaxona | 12,70 | 28,17 | ||
| Cefotaxima | 3,1 | 0 | ||
| Total | 15,8 | 28,17 | +12,37 | +78 |
| Macrólidos | ||||
| Azitromicina | 10,5 | 8,1 | −2,4 | −22,8 |
| Penicilinas y cefalosporinas antipseudomónicas | ||||
| Piperacilina-tazobactam | 8,6 | 26,8 | ||
| Ceftazidima | 2,83 | 0,2 | ||
| Cefepime | 1,61 | 0 | ||
| Total | 13,04 | 27 | +13,96 | +107 |
| Antibióticos frente a grampositivos resistentes | ||||
| Linezolid | 30,40 | 22,6 | ||
| Vancomicina | 0,2 | 2,7 | ||
| Total | 30,6 | 25,3 | −5,3 | −17,3 |
| Tetraciclinas | ||||
| Tigeciclina | 3,9 | 0 | −3,9 | −100 |
| Quinolonas | 4,4 | 2,1 | −2,3 | −52,3 |
| Total DDD/100 estancias | 148,04 | 154,2 | ||
DDD: dosis diarias definidas; Post-CS: periodo posterior al Código Sepsis; Pre-CS: periodo anterior al Código Sepsis.
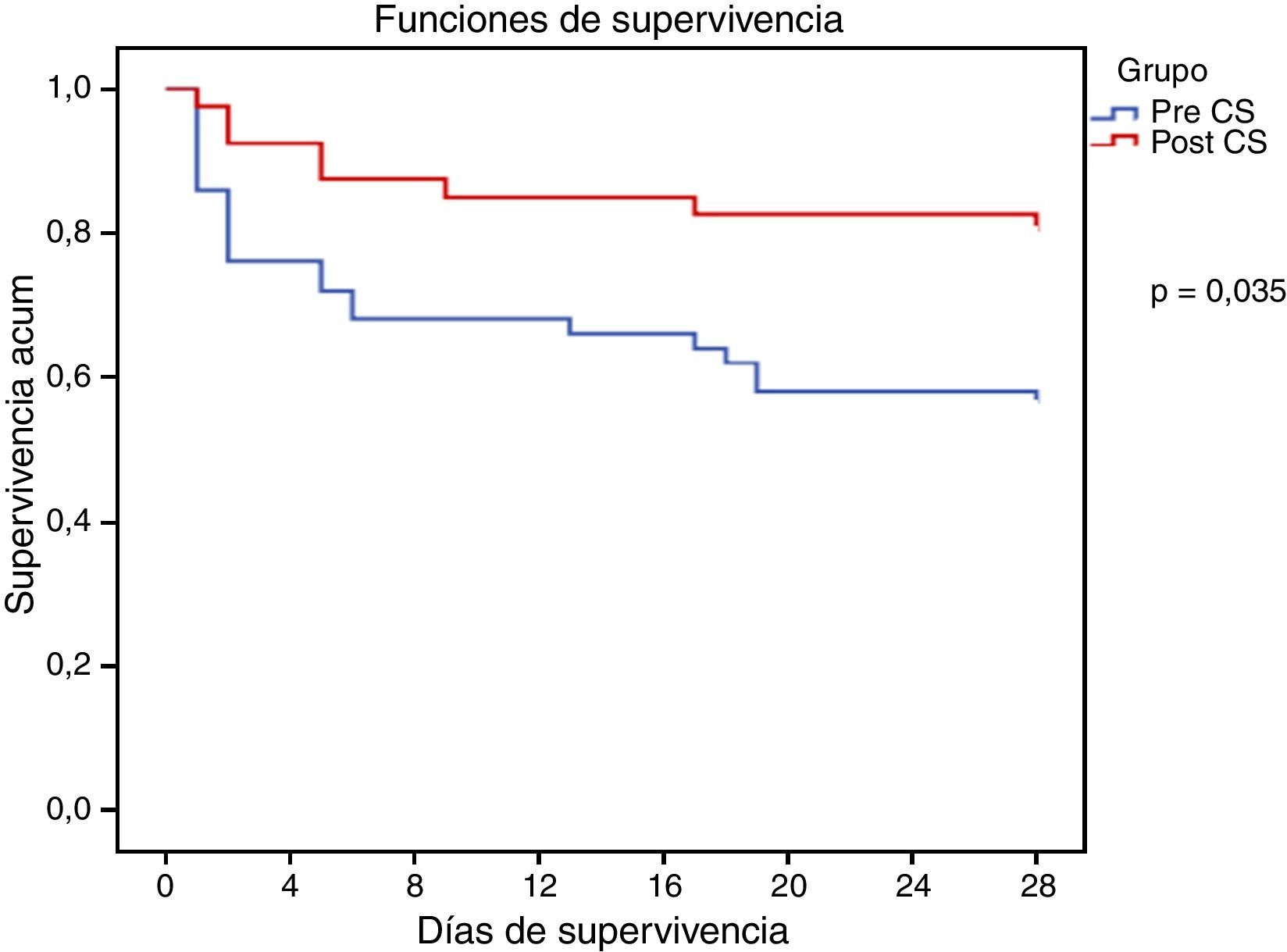
Los resultados clínicos se muestran en la tabla 2. La mortalidad hospitalaria, intra-UCI y a los 28 días del ingreso fue mayor en el grupo PRE-CS. Se hallaron diferencias estadísticamente significativas en la mortalidad hospitalaria (56 vs. 31% [IC 95% 3,2-46,9], p=0,014) y en la mortalidad a los 28 días (44 vs. 23% [IC 95% −0,8 a 41,2], p=0,035). La estancia intra-UCI fue mayor en el grupo PRE-CS que en el POST-CS, en el límite de la significación estadística (10,5 vs. 5 días, p=0,05).
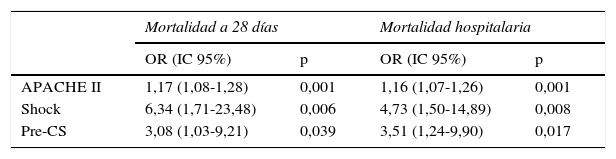
Todas las variables recogidas se incluyeron en un modelo de regresión logística binaria (RLB) para el análisis de mortalidad. En el análisis univariante solo las variables CSI, shock séptico y APACHE II mostraron diferencias estadísticamente significativas tanto para mortalidad hospitalaria como para mortalidad a 28 días. Al incluirlas a todas en el modelo de RLB multivariante, todas ellas continuaban presentando una asociación independiente tanto con la mortalidad hospitalaria como con la mortalidad a 28 días. Así, la variable pre-CS presentó una OR de 3,08 (IC 95% 1,03-9,21, p=0,03) para la mortalidad a 28 días y de 3,51 (IC 95% 1,24-9,90, p=0,01) para la mortalidad hospitalaria (tabla 4). Finalmente, el análisis de supervivencia mediante curva de Kaplan-Meier evidenció una mayor mortalidad a 28 días, estadísticamente significativa, en el grupo de pacientes PRE-CS (fig. 3).
Regresión logística binaria multivariante para la mortalidad a 28 días y hospitalaria
| Mortalidad a 28 días | Mortalidad hospitalaria | |||
|---|---|---|---|---|
| OR (IC 95%) | p | OR (IC 95%) | p | |
| APACHE II | 1,17 (1,08-1,28) | 0,001 | 1,16 (1,07-1,26) | 0,001 |
| Shock | 6,34 (1,71-23,48) | 0,006 | 4,73 (1,50-14,89) | 0,008 |
| Pre-CS | 3,08 (1,03-9,21) | 0,039 | 3,51 (1,24-9,90) | 0,017 |
APACHE II: Acute Physiology and Chronic Health Evaluation II; IC 95%: intervalo de confianza al 95%; OR: odds ratio; Pre-CS: periodo anterior al Código Sepsis.
El presente trabajo demuestra cómo una intervención relativamente económica, aunque con un importante esfuerzo humano, como es la puesta en marcha de acciones y herramientas encaminadas a un mejor diagnóstico y tratamiento de la SG y el SS mediante la creación del GT-CS favoreció no solo un descenso directo de las cifras de mortalidad, sino también una mejor optimización en la prescripción de antibióticos, y de forma interesante una tendencia hacia un menor tiempo de estancia en la UCI.
El carácter multidisciplinar de un proyecto de estas características plantea importantes retos en relación con el trabajo en un equipo eficiente, la dinámica y las relaciones de grupo, la cooperación, la comunicación y el intercambio de información, y conlleva una importante labor de formación y divulgación intrahospitalaria. El objetivo prioritario inicial de la creación de equipos multidisciplinares en CSI no es solo la aplicación de los mejores tratamientos basados en la evidencia (fluidoterapia, extracción de cultivos, antibioterapia y control del foco precoces, etc.), sino también optimizar los recursos, evitar la variabilidad interprocedimiento, favorecer la difusión de buenas prácticas, la mejora de los cuidados y la seguridad del paciente, así como realizar una adecuada gradación de la asistencia (ubicando al paciente en cada momento en el lugar más adecuado en función de su gravedad) para, finalmente, realizar un registro de los resultados analizando la eficiencia del programa (fig. 1). Con todo ello, la finalidad principal es disminuir la elevada tasa de mortalidad asociada a esta enfermedad, mientras que otros objetivos como una mejor optimización en el consumo de los recursos derivados de esta enfermedad es también alcanzable, como se ha demostrado en el presente trabajo.
Existen ciertos estudios en la literatura médica que ya han demostrado la posibilidad de alcanzar el objetivo de una disminución de la mortalidad mediante la implementación del cumplimiento de paquetes de medidas16,17. Sin embargo, la repercusión de la implantación de los programas de CSI sobre la optimización del tratamiento antibiótico no ha sido hasta ahora analizada. Dicha optimización consistiría en mejorar y racionalizar el consumo y la prescripción de antibióticos mediante medidas como el establecimiento de una cobertura antibiótica empírica más adecuada y racional, un desescalamiento antibiótico precoz, la selección adecuada del fármaco y un ajuste individualizado del tratamiento.
En este sentido, el presente trabajo resulta novedoso, ya que analiza esta relación mostrando resultados satisfactorios. Así, por un lado, se demuestra una disminución en el uso del binomio linezolid/carbapenem como tratamiento empírico en el periodo postintervención, mientras que, por otro, se observa durante el periodo post-CS un aumento muy significativo en la tasa de desescalamiento antibiótico. Los primeros estudios sobre “desescalada” antibiótica se realizaron en pacientes críticos con neumonía nosocomial. Uno de estos trabajos, realizado en 24 UCI españolas, analizó prospectivamente a 244 pacientes con neumonía tratados empíricamente con imipenem más aminoglucósido o vancomicina, y no observó influencia del desescalamiento en la mortalidad18. Sin embargo, en un reciente estudio realizado por Garnacho-Montero et al., el desescalamiento de la terapia antibiótica en una población de 628 pacientes con SG o SS sí se relacionó de forma independiente con una menor tasa de mortalidad intrahospitalaria a los 28 días19. En nuestro caso, el análisis de RLB no evidenció que el desescalamiento fuera una variable que se relacionara con la mortalidad. El limitado tamaño de la muestra podría modular este hallazgo.
En cuanto al consumo de antibióticos, se objetivó un descenso estadísticamente significativo en el número de días bajo tratamiento antibiótico en la UCI tras la implantación del CS, probablemente en relación con una menor estancia intra-UCI. Sin embargo, no se observaron diferencias en el número total de DDD/100 estancias de los pacientes con SG/SS en la UCI entre ambos periodos. Esto significa que el número de pacientes que se encontraban expuestos a tratamiento antimicrobiano por cada 100 estancias fue similar tras la implantación del CS. Este valor es similar al que presentan otros centros en este tipo de pacientes20. En cambio, sí se observaron diferencias en el consumo de determinados grupos de antibióticos tras la implantación del CS. Se produjo una reducción en el empleo de antibióticos con actividad frente a grampositivos resistentes: disminución en el 17,3% de las DDD/100 estancias; y de macrólidos: disminución en el 22% de las DDD/100 estancias. También es destacable el aumento de más del doble del consumo de piperacilina-tazobactam respecto al grupo PRE-CS. Estos datos reflejan una reducción en el espectro antibiótico empleado tras la implantación del CS. Cabe reseñar que la DDD es una unidad de medida que no refleja necesariamente la dosis diaria recomendada o prescrita, ya que estas deben basarse en características individuales (edad, peso) y en consideraciones farmacocinéticas, especialmente en pacientes críticos. Los datos de consumo expresados en DDD proporcionan una estimación aproximada y no una fotografía exacta de su utilización real.
Respecto a los resultados clínicos de los pacientes estudiados tras la implantación del CSI, cabe destacar que si bien las cifras de mortalidad intra-UCI y hospitalarias en el periodo post-CS son similares a las de otras series recientes2,21–23, estas son significativamente inferiores a las que existían en nuestro centro previamente a la implantación del programa. De hecho, el modelo de RLB multivariante demuestra cómo la implantación del CSI fue, junto con el APACHE II y la presencia de SS al ingreso, la única variable asociada independientemente con la mortalidad hospitalaria y a día 28, de tal forma que el riesgo de fallecer de un paciente séptico era más de 3 veces superior en el periodo pre-CS que en el post-CS. Este dato es lógico, dado que la aplicación de un CS promueve la educación para un diagnóstico más temprano de la enfermedad, así como una mayor precocidad en la instauración de medidas como la administración de antibioterapia, la fluidoterapia vigorosa, el control del foco, la extracción de cultivos, la mejor gradación del riesgo, etc., en las primeras horas de la enfermedad, medidas que por sí solas han demostrado mejorar el pronóstico de esta patología si se llevan a cabo óptimamente. Es lógico que la implementación de todas estas medidas también se traduzca en un descenso de la estancia intra-UCI y/u hospitalaria, como dejan entrever los resultados del presente trabajo. Hay que destacar que durante ambos periodos no se realizó ninguna otra intervención sobre este grupo de pacientes que pudiera justificar estos hallazgos.
El presente trabajo tiene algunas limitaciones que deben ser señaladas: la principal de ellas es que no se trata de un ensayo prospectivo, sino que se comparó de forma retrospectiva el efecto de la implantación del CS con una cohorte histórica anterior a su puesta en marcha en un número limitado de pacientes. No se han recogido datos analíticos, ni tampoco referentes a otros tratamientos distintos de los antibióticos (dosis de aminas, corticoides, necesidad de terapia de soporte renal, etc.). Por otra parte, el incremento de las infecciones por gramnegativos que se ha producido en el segundo periodo del estudio puede haber influido en parte en los resultados relativos al descenso en el consumo de linezolid, si bien es cierto que el uso de este fue principalmente como fármaco empírico, cuando aún no se disponía de resultados microbiológicos que dirigieran la terapia.
En resumen, la puesta en marcha por parte del GT-CS de acciones y herramientas encaminadas a un mejor diagnóstico y tratamiento de la SG y SS favoreció no solo una optimización en la prescripción de antibióticos, sino además una disminución en las cifras de mortalidad hospitalaria y a los 28 días, así como una tendencia hacia un acortamiento de la estancia intra-UCI.
Aunque son necesarios estudios más amplios de tipo multicéntrico con un mayor número de pacientes para confirmar estos hallazgos, sin duda los resultados expuestos deben animar a difundir e implementar la creación de grupos de trabajo multidisciplinares para favorecer la implantación de programas de CSI en todos nuestros centros sanitarios.
FinanciaciónEste trabajo ha sido realizado dentro del programa de concesión de ayudas para la intensificación de la actividad investigadora convocado por la Gerencia Regional de Salud de la Junta de Castilla y León para el año 2016 (GRS 1112/A/15).
AutoríaLGL, SGC y DAO coordinaron el diseño del estudio. LGL, FBD, RCG, FDG y DAO participaron en la recogida y el análisis de datos clínicos. LGL revisó las historias clínicas de los pacientes. LGL, SGC, AFS y TSS realizaron el análisis farmacoeconómico. MFM y DAO realizaron el análisis estadístico de variables clínicas y de supervivencia. Finalmente, LGL, SGC, DAO y FGM participaron en la redacción y la elaboración del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a todo el Grupo de Trabajo Multidisciplinar en Código Sepsis del Hospital Clínico Universitario de Valladolid su trabajo y dedicación, sin los cuales este estudio no se hubiera podido llevar a cabo.