El objetivo primario de este estudio fue evaluar el impacto de la oxigenoterapia con cánula nasal de alto flujo (HFNC) sobre la fracción de engrosamiento del diafragma.
DiseñoEstudio de cohorte, prospectivo y descriptivo.
ÁmbitoEl estudio se llevó a cabo en el Laboratorio de Fisiología y Cuidados Respiratorios, Unidad de Terapia Intensiva, Hospital Británico de Buenos Aires.
ParticipantesTrece sujetos sanos >18 años.
IntervencionesOxigenoterapia con cánula nasal de alto flujo.
Variables de interés principalesDatos demográficos (edad y sexo), datos antropométricos (peso, talla e índice de masa corporal), variables clínicas y respiratorias (fracción de engrosamiento del diafragma [DTf], presión esofágica, frecuencia respiratoria [FR], producto presión-tiempo esofágico por minuto [PTPes/min]).
ResultadosLa mediana de DTf disminuyó significativamente a medida que aumentaba el flujo programado (p<0,05). La medición basal de la DTf fue del 21,4%, del 18,3% con 20l/m y del 16,4% con 40l/m. También observamos una disminución significativa de la FR a medida que aumentaba el flujo en HFNC (p<0,05). En los 8 sujetos con registros, la PTPes/min fue de 81,3 cmH2O/s/min (±30,8) y 64,4 cmH2O/s/min (±25,3) al inicio y 40l/m, respectivamente (p=0,044).
ConclusionesEl uso de oxigenoterapia a alto flujo a través de cánula nasal en sujetos sanos disminuye la DTf y la FR conforme aumenta el flujo programado. Además, el uso de un flujo de 40l/m puede reducir el trabajo muscular asociado a la respiración.
The primary objective of this study was to evaluate the impact of high-flow nasal cannula oxygen therapy [HFNC] on the diaphragm thickening fraction.
DesignProspective, descriptive, cohort study
SettingThe study was conducted in the Physiology and Respiratory Care Laboratory, Intensive Care Unit, Hospital Británico de Buenos Aires.
ParticipantsThirteen healthy subjects >18 years old
InterventionsHigh-flow nasal cannula oxygen therapy
Main variables of interestDemographic data (age and gender), anthropometric data (weight, height, and body mass index), and clinical and respiratory variables (Diaphragm thickening fraction [DTf], esophageal pressure swing, respiratory rate [RR], esophageal pressure-time product per minute [PTPes/min]).
ResultsMedian DTf decreased significantly as flow increased (P<.05). The baseline DTf measurement was 21.4%, 18.3% with 20 l/m, and 16.4% with 40 l/m. We also observed a significant decrease in RR as flow increased in HFNC (P<.05). In the 8 subjects with recordings, the PTPes/min was 81.3 cmH2O/sec/min (±30.8) and 64.4 cmH2O/sec/min (±25.3) at baseline and 40 l/m respectively (P=.044).
ConclusionsThe use of high-flow oxygen therapy through nasal cannula of HFNC in healthy subjects decreases the DTf and RR in association with increased flow. In addition, the use of 40 l/m flow may reduce the muscular work associated with respiration.
La terapia de oxígeno a alto flujo a través de cánula nasal (HFNC, por sus siglas en inglés high flow nasal cannula) implica la administración de gas humidificado y calentado a un flujo elevado, con una fracción inspirada oxígeno (FiO2)1 variable. El uso de HFNC en la unidad de cuidados intensivos (UCI) ha experimentado un incremento debido a las ventajas que ofrece en el tratamiento de ciertas enfermedades1–3, así como a los beneficios que proporciona en comparación con la terapia de oxígeno convencional4–6. La HFNC ofrece soporte respiratorio al eliminar el espacio muerto de las vías respiratorias superiores entre respiraciones, lo que permite optimizar la composición del gas inspirado para el paciente. La insuflación nasal de alta velocidad (HVNI, por sus siglas en inglés high velocity nasal insufflation) constituye una variante de la HFNC que emplea una cánula de diámetro reducido, lo que posibilita la entrega de un flujo elevado a una velocidad superior7.
El trabajo respiratorio (WOB, por sus siglas en inglés work of breathing) se refiere al esfuerzo mecánico asociado con la respiración y se cuantifica como el gradiente de presión necesario para lograr una variación en el volumen pulmonar, determinado principalmente por la resistencia y la elasticidad ofrecida por el sistema respiratorio8.
Los cambios en el swing de presión esofágica (Pes) son representativos de la presión pleural y ayudan a establecer el gradiente de presión generado principalmente por la acción del diafragma9. La ecografía diafragmática es una herramienta que, como complemento no invasivo a la medición de Pes, permite la evaluación de la función del diafragma y podría reflejar, a través de la fracción de engrosamiento del músculo, la magnitud de reclutamiento de fibras diafragmáticas10.
Nosotros hipotetizamos que la implementación de HFNC tendrá un impacto significativo en la fracción de engrosamiento del diafragma en sujetos sanos. Específicamente, consideramos que la HFNC conducirá a una disminución en la fracción de engrosamiento diafragmático, indicativa de un menor reclutamiento de fibras diafragmáticas. Además, esperamos que la frecuencia respiratoria presente una respuesta favorable al uso de HFNC, con una reducción en sus valores, lo que sugiere una mejora en la eficiencia respiratoria. Por lo tanto, el objetivo principal de este estudio fue evaluar el impacto de la terapia de oxígeno con cánula nasal de alto flujo sobre la fracción de engrosamiento del diafragma en sujetos sanos. Secundariamente, este estudio tuvo como objetivo evaluar el comportamiento de la frecuencia respiratoria y el WOB en estos sujetos.
Pacientes y métodoEstudio de cohorte, descriptivo y prospectivo conducido en el Laboratorio de Fisiología y Cuidados Respiratorios, Unidad de Cuidados Intensivos, Hospital Británico de Buenos Aires entre el 1 de marzo al 30 de junio de 2022. Se incluyeron 13 sujetos sanos mayores de 18 años. Todos los sujetos proporcionaron consentimiento informado por escrito. Se registraron datos demográficos (edad y género), datos antropométricos (peso, altura e índice de masa corporal [IMC]), y variables clínicas y respiratorias.
Datos clínicos y respiratoriosSe registraron las siguientes variables para cada sujeto:
- -
- -
Swing de presión esofágica. Diferencia entre la Pes basal y la deflexión máxima de la Pes inspiratoria.
- -
Frecuencia respiratoria (FR). Número de respiraciones por minuto registradas en 60s.
- -
Producto presión/tiempo esofágico por minuto (PTPes/min). Se calculó como el área determinada por la deflexión máxima de la Pes esofágica inspiratoria multiplicada por la FR12. Se utilizó un softwaread hoc desarrollado en Matlab R2018b (The MathWorks, Inc., Natick, Massachusetts, EE. UU.) para este propósito.
Para el estudio, utilizamos: un monitor de mecánica pulmonar FluxMed® con un catéter con balón de látex distal de 7cm de longitud (MBMed, Buenos Aires, Argentina) para la medición de la presión esofágica; un equipo de ultrasonido Esaote MyLab® 40 (Génova, Italia) para las mediciones del diafragma, y un dispositivo de oxigenoterapia de alto flujo Precision Flow® con tecnología HVNI (Vapotherm Inc., Exeter, NH) y sus productos descartables.
Procedimientos realizadosA todos los sujetos se les colocó un balón esofágico introducido a través de la nariz (después de anestesia tópica), hasta el tercio medio del esófago, aproximadamente a 30cm de la nariz. El mismo fue inflado con 1ml de aire y conectado al monitor de mecánica pulmonar. Se realizó una prueba de oclusión para evaluar la colocación adecuada del balón esofágico. Para esto se realizó una pausa teleespiratoria y se registró la presión en la vía aérea durante un esfuerzo inspiratorio según lo detallado en la prueba de Baydur. Se definió una posición aceptable del catéter cuando la relación entre los cambios de la presión esofágica y los de la vía aérea (ΔPes/ΔPaw) fueron cercanos a la unidad (entre 0,8 y 1,2)13,14. La Pes fue digitalizada y registrada en un ordenador portátil después de un período de estabilización de 5min. Los datos se registraron con cada sujeto acostado en posición semisentada a 45°, respirando en reposo con la boca cerrada en 3 condiciones diferentes: sin HFNC, con HFNC a 20l/min y con HFNC a 40l/min. En todos los casos, la fracción de oxígeno inspirado fue del 21% después de una secuencia de flujo aleatoria generada en línea en la página web (https://www.randomizer.org/).
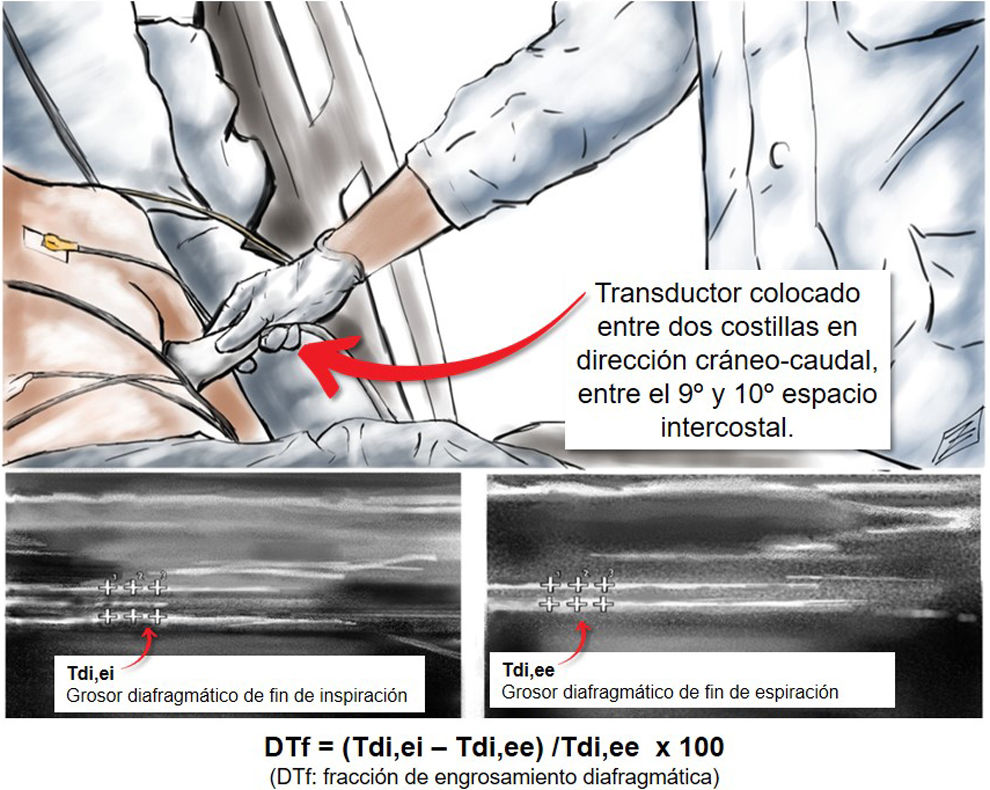
Cada condición de prueba se mantuvo 5min, durante los cuales la Pes fue registrada continuamente. Durante el último minuto de cada uno de estos períodos de 5min, se registró la FR, y luego se realizaron las mediciones de ultrasonido correspondientes por un operador experto (el mismo en todos los casos). La medición ecográfica se realizó utilizando un transductor lineal de alta frecuencia de 7-13MHz en tiempo real en modo B. El transductor se colocó entre 2 costillas en dirección craneocaudal, buscando el área con la mejor resolución de imagen, entre el 9° y el 10° espacio intercostal derecho, medial a la línea axilar anterior, localizando el diafragma entre dos capas paralelas de tejido hiperecoico (pleura y peritoneo) que tienen una capa de tejido hipoecoico (diafragma) entre ellas. Una vez localizada la zona de apoyo, se midió el grosor diafragmático al final de la espiración en 3 ciclos respiratorios, utilizando el caliper electrónico del equipo.
En esta posición, se midió el grosor del diafragma al final de la espiración y al final de la inspiración del mismo ciclo respiratorio (fig. 1), y se registró el valor promedio de 3 ciclos respiratorios. Se permitió un período de lavado de 2min, con el sujeto respirando en reposo tan cómodamente como fuera posible, entre cada condición de prueba para evitar la suma de efectos. La DTf11 y PTPes/min12 fueron calculadas para cada sujeto en cada condición disponible.
Análisis estadísticoPara la estadística descriptiva se utilizó la media y el desvío estándar o la mediana y el rango intercuartílico para variables cuantitativas, y las frecuencias absolutas y relativas para variables cualitativas. Utilizamos la prueba de Shapiro-Wilk y gráficos de cuantiles-cuantiles de las diferencias para validar la normalidad de los datos. Para el análisis de la variación en la frecuencia respiratoria y DTf en diferentes flujos, decidimos utilizar un modelo de regresión perteneciente al modelo lineal generalizado (ecuación de estimación generalizada). Esta elección se fundamenta en la falta de independencia de los datos y la imposibilidad de asegurar homocedasticidad entre los mismos. El tamaño de la muestra fue determinado por el número máximo de voluntarios que pudimos incorporar al estudio y basado en estudios previos15. Se consideró como significación estadística una p<0,05. Se utilizó el software Stata® 13 para el análisis de datos (StataCorp. 2011. Stata Statistical Software: Release 13. College Station, TX: StataCorp LP).
Este estudio se realizó de acuerdo con la Declaración de Helsinki, fue aprobado por el Comité de Ética en Investigación del Hospital Británico de Buenos Aires, aprobación: CRIHB #1220 PRIISABA No. 6256 y fue registrado en https://clinicaltrials.gov/ #NCT06086769. Todos los participantes proporcionaron consentimiento informado por escrito para participar. Los datos que respaldan los hallazgos de este estudio están disponibles a través del autor de la correspondencia previa solicitud razonable. El equipo Precision Flow® y sus descartables fueron proporcionados por JAEJ S.A. (Buenos Aires, Argentina). Este estudio no recibió financiamiento.
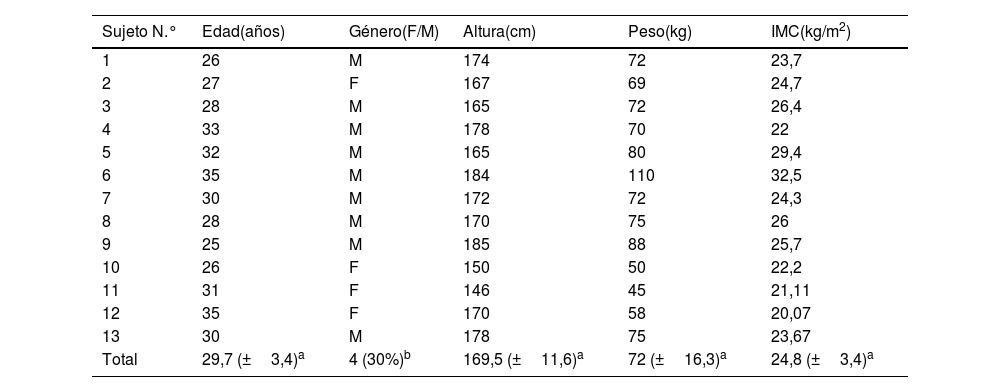
ResultadosSe analizaron los datos de 13 sujetos sanos, el 31% de los cuales eran mujeres, con una edad media de 29,7 años (±3,4) (tabla 1).
Características demográficas y antropométricas de los 13 participantes del estudio
| Sujeto N.° | Edad(años) | Género(F/M) | Altura(cm) | Peso(kg) | IMC(kg/m2) |
|---|---|---|---|---|---|
| 1 | 26 | M | 174 | 72 | 23,7 |
| 2 | 27 | F | 167 | 69 | 24,7 |
| 3 | 28 | M | 165 | 72 | 26,4 |
| 4 | 33 | M | 178 | 70 | 22 |
| 5 | 32 | M | 165 | 80 | 29,4 |
| 6 | 35 | M | 184 | 110 | 32,5 |
| 7 | 30 | M | 172 | 72 | 24,3 |
| 8 | 28 | M | 170 | 75 | 26 |
| 9 | 25 | M | 185 | 88 | 25,7 |
| 10 | 26 | F | 150 | 50 | 22,2 |
| 11 | 31 | F | 146 | 45 | 21,11 |
| 12 | 35 | F | 170 | 58 | 20,07 |
| 13 | 30 | M | 178 | 75 | 23,67 |
| Total | 29,7 (±3,4)a | 4 (30%)b | 169,5 (±11,6)a | 72 (±16,3)a | 24,8 (±3,4)a |
F: femenino; IMC: índice de masa corporal; M: masculino.
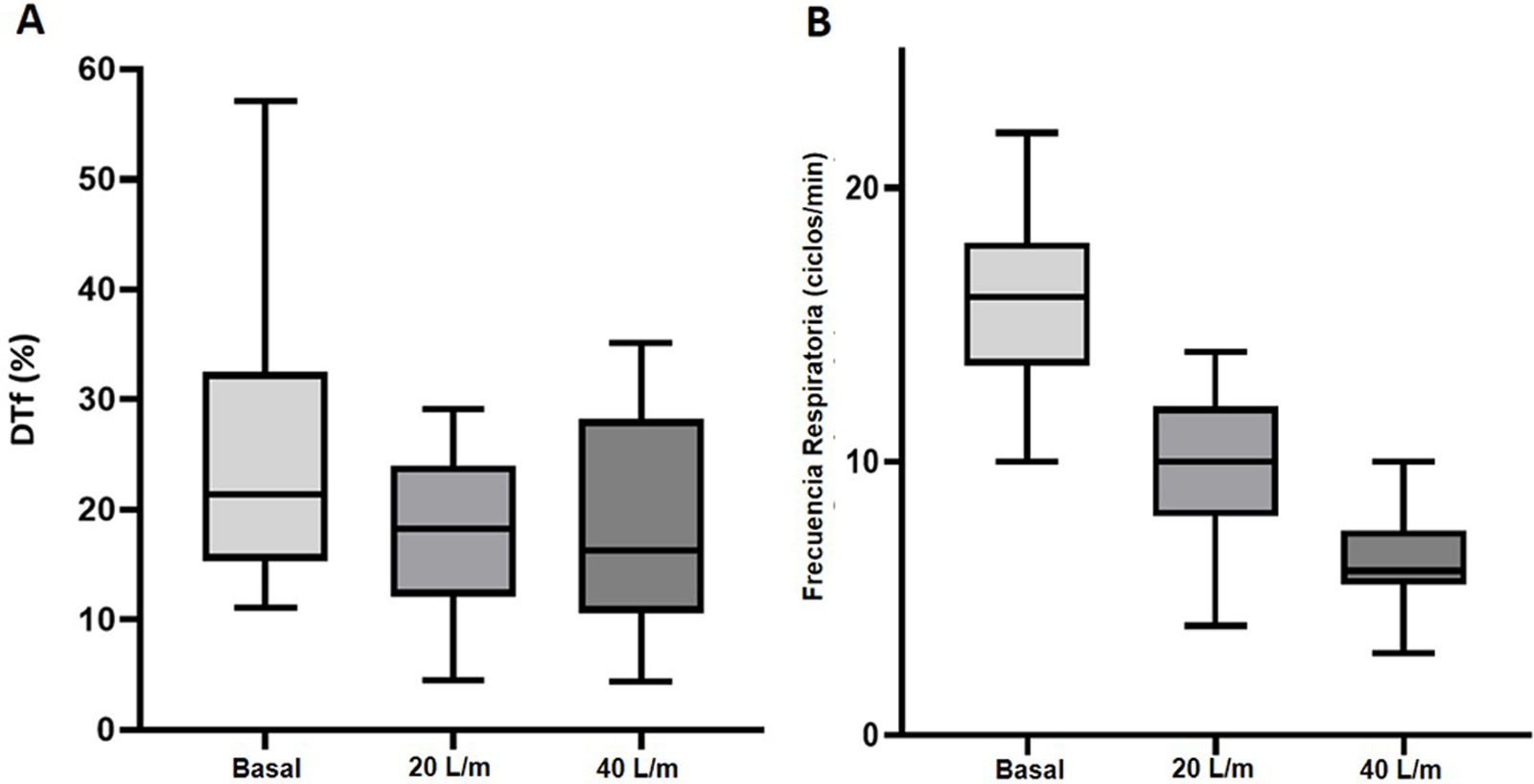
La mediana de DTf disminuyó significativamente a medida que aumentaba el flujo (p<0,05). La DTf basal fue del 21,4% (RIQ: 17,4-30), 18,3% (RIQ: 13-23,1) con 20l/m, y 16,4% (RIQ: 11,7-27,5) con 40l/m (por cada litro de flujo aplicado, la DTf disminuyó 0,16%±0,06; IC del 95%: 0,28-0,036; p=0,011) (fig. 2A). También observamos una disminución significativa en la FR a medida que aumentaba el flujo en HFNC (p<0,05). La mediana de la FR basal fue de 16 respiraciones por minuto (RIQ: 14-18), 10 respiraciones por minuto (RIQ: 8-12) a 20l/m, y 6 respiraciones por minuto (RIQ: 6-7) a 40l/m; una reducción de 0,25 respiraciones por minuto ±0,02 (IC del 95%: 0,3-0,22; p<0,0001) por litro de flujo utilizado (fig. 2B).
Comportamiento de la fracción de engrosamiento diafragmática (A) y frecuencia respiratoria (B): basal, con HFNC a 20l/min, y con HFNC a 40l/min. A) Modelo lineal generalizado considerando la dependencia de los datos (ecuación de estimación generalizada; EEG) (p<0,011). DTf (%): fracción de engrosamiento del diafragma. B) Modelo lineal generalizado considerando la dependencia de los datos (ecuación de estimación generalizada; GEE) (p<0,0001). Frecuencia respiratoria expresada en respiraciones/minuto.
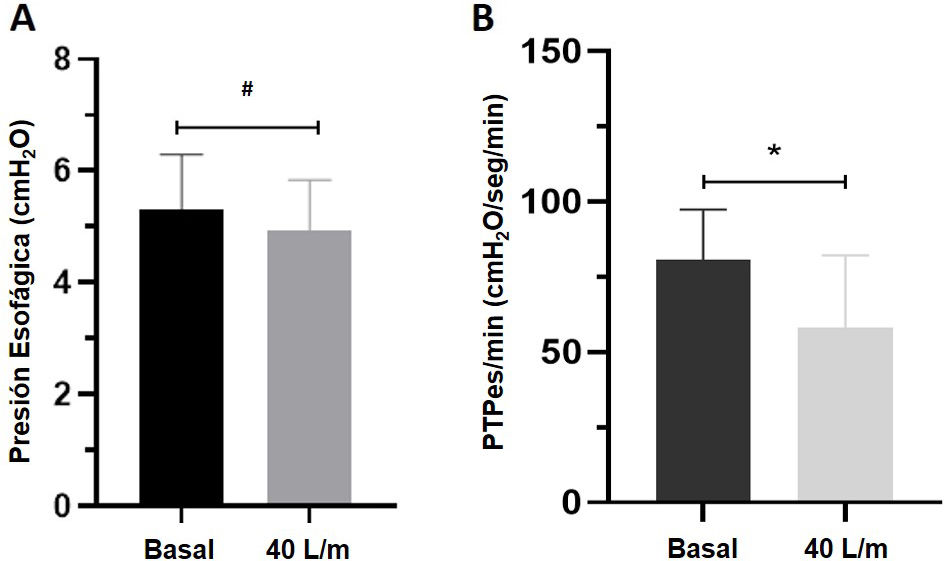
Debido a problemas técnicos, no pudimos procesar todas las señales (5 registros fueron eliminados involuntariamente); sin embargo, en los 8 sujetos en los que los registros se conservaron, se obtuvo una media de Pes de 5,31cmH2O (±1,39) y 4,92cmH2O (±1,30); basal y a 40l/m, respectivamente (p=0,75) (fig. 3A). Además, se calcularon el PTPes/min basal y el resultante de la aplicación de HFNC a 40l/m, en los cuales se evidenció una disminución significativa en el WOB, siendo de 81,3cmH2O/s/min (±30,8) y 64,4cmH2O/s/min (±25,3); basal y a 40l/m, respectivamente (p=0.044) (fig. 3B).
DiscusiónEste estudio describe el efecto de la HFNC sobre la DTf, la FR y el WOB en sujetos sanos. Como principales hallazgos, podemos destacar que: 1) la aplicación de HFNC a 40l/m disminuyó la DTf en un 23%; 2) el uso de HFNC impactó en la FR, disminuyéndola significativamente con el aumento del flujo programado; 3) finalmente, se evidenció una disminución del 20% en el WOB a través de la disminución del PTPes/min con HFNC a 40l/m.
La ganancia de volumen pulmonar viene determinada principalmente por la variación de la presión pleural generada por la acción de los músculos respiratorios. Como principal músculo inspiratorio, el diafragma ejerce su efecto aumentando los 3 diámetros del tórax16. Cuanto mayor es el engrosamiento del diafragma, mayor es el reclutamiento muscular. Nuestros hallazgos revelan una reducción en la DTf, lo que posiblemente indica una disminución en el reclutamiento muscular. Llamativamente, casi el 70% de esta reducción se logra con un flujo programado de 20l/m, mientras que el 30% restante se alcanza a 40l/m. Esta diferencia podría atribuirse al efecto de aceleración del flujo generado por la tecnología HVNI y su impacto en la presión, especialmente en el lavado de CO2. Según los análisis de fluidos realizados con diferentes diámetros de cánulas (2,7 vs. 5,4mm), y la experiencia clínica, la insuflación nasal a alta velocidad a demostrado requerir en adultos de un flujo menor para purgar por completo la CO2 del reservorio anatómico extratorácico entre respiraciones7,17. En consecuencia, lograr efectos significativos en la DTf con un flujo programado relativamente bajo. Esto podría llevar a considerar este efecto para aquellos pacientes con mala adherencia al uso de HFNC asociada a intolerancia a la programación de un flujo elevado17,18.
En nuestro estudio, también se evidenció una marcada disminución de la FR la cual podría estar determinada por la suma de las ventajas fisiológicas de la HFNC con tecnología HVNI ya que con esta se utilizan cánulas nasales de pequeño calibre (normalmente de 2,7mm de diámetro interno en pacientes adultos) que producen una aceleración del flujo superior al de las cánulas de mayor calibre utilizadas en estudios anteriores17. Una de las ventajas de administrar un flujo elevado en la nasofaringe es el efecto de lavado de dióxido de carbono (CO2), lo que reduce la reinhalación6. Con una FR más baja, la HFNC puede aumentar el lavado del espacio muerto y reducir aún más la reinhalación y, por lo tanto, disminuir el WOB mediante la optimización de la relación ventilación minuto y la ventilación alveolar. A medida que la respiración se ralentiza, los flujos más bajos consiguen un lavado más eficaz, especialmente con la administración de flujos más elevados19. Esto sugiere que el FR podría ser un indicador importante no solo de la función respiratoria, sino también de la eficacia de la terapia al flujo utilizado. Algunos estudios no informan cambios en la FR con la implementación de la HFNC, o si lo hacen, el cambio no es clínicamente relevante 3,20. Sin embargo en estos estudios, en los que se evalúa la respuesta en pacientes con falla respiratoria, sabemos que la causa del aumento del volumen minuto es multifactorial21.
Cabe señalar que una FR más baja no justifica por sí sola una disminución del WOB. Sin embargo, una disminución de la DTf refleja sin duda una reducción del reclutamiento muscular asociado a un menor gradiente de presión para el volumen inspirado20. En definitiva, posiblemente una menor carga de trabajo para generar ese cambio de volumen en un sistema con una aireación pulmonar más homogénea, con un mayor volumen pulmonar de fin de espiración5 y, por tanto, una menor elastancia. En este sentido, la combinación de estos efectos fisiológicos evidenciados con el uso de HFNC en sujetos sanos podría determinar una menor carga ventilatoria extrapolable a los pacientes ingresados en la UCI. En este contexto, la evidencia sugiere que cuando se utiliza ventilación mecánica no invasiva, tanto la DTf como el comportamiento de la FR y su relación con la DTf, emergen como herramientas útiles para anticipar el pronóstico en pacientes con insuficiencia respiratoria hipoxémica22. Del mismo modo, aunque son necesarios más estudios en esta línea, estas variables podrían servir como herramientas válidas, factibles y no invasivas para predecir el resultado de la terapia de HFNC en pacientes hospitalizados en la UCI.
Para un mismo gradiente de presión muscular, dos relaciones diferentes de elastancia total del sistema respiratorio provocan cambios diferentes en la Pes23. La variabilidad de esta relación podría explicar la disociación entre los resultados de DTf y Pes encontrados en nuestro estudio, siendo estadísticamente significativa en el primer caso y no en el segundo. Además, la resistencia espiratoria generada por un flujo elevado en sujetos sanos podría, al igual que la PEEP, provocar la activación de los músculos espiratorios, y esto tener un impacto en los cambios de volumen inicial y, por tanto, afectar los valores de Pes4,24. Por último, nuestros sujetos sanos eran mayoritariamente varones (70%), lo que podría dar lugar a una menor presión generada por la HFNC e influir en los resultados relacionados con la Pes25.
Vivier et al.26 han documentado previamente una correlación notable entre el PTP diafragmático y la DTf en pacientes ventilados de forma no invasiva (ρ=0,74; p<0,001). Nuestro estudio proporciona una validación parcial de estos hallazgos, observando una reducción en el PTPes/min acompañado de una reducción del DTf en la misma dirección. Notablemente, a pesar de estas tendencias, no identificamos diferencias significativas en el subrogado de presión pleural (Pes) a través de los escenarios evaluados. Aunque nuestros resultados no permiten extraer conclusiones definitivas sobre la correlación entre estas variables, el comportamiento tanto de la PTPes/min como de la DTf sugiere claramente la posibilidad de que esta exista. La disminución observada en el WOB dentro de nuestros sujetos bajo diferentes escenarios, con ausencia de variación en Pes, podría explicarse por la reducción en FR. Es esencial reconocer que la PTPes/min depende del tiempo, lo que subraya que la relación con la DTf puede no depender únicamente de los cambios de presión, sino también estar influida por los cambios en la FR con la utilización de HFNC y, además, el impacto de estos sobre el tiempo inspiratorio.
Por último, cabe señalar que al haber sido realizado en voluntarios sanos nuestro estudio se llevó a cabo con una FiO2 del 21%. El uso de concentraciones más elevadas de O2 podría influir en la respuesta de la FR a través de la disminución del volumen minuto respiratorio mediada por quimiorreceptores. Sin embargo, este mecanismo en seres humanos con normoxemia podría ser poco relevante27.
Nuestro estudio tiene algunas limitaciones. En primer lugar, se trata de un estudio realizado en sujetos sanos, por lo que los datos pueden no ser generalizables a pacientes con diferentes patologías. Sin embargo, el fundamento fisiológico de la HFNC sugiere que los beneficios explicados anteriormente pueden reproducirse en otras poblaciones. En segundo lugar, este estudio no fue ciego, lo que podría añadir un sesgo. Sin embargo, debido al diseño del estudio, fue imposible evitarlo. Por último, la disponibilidad de variables relacionadas con el Pes afectó al número de registros posibles de evaluar. A pesar de esta pérdida involuntaria de registros, se encontró una diferencia estadísticamente significativa con el número de registros evaluados.
ConclusionesEl uso de oxigenoterapia a alto flujo a través de cánula nasal en sujetos sanos disminuye la fracción de engrosamiento diafragmática y la frecuencia respiratoria en relación con el aumento del flujo. Además, el uso de un flujo de 40l/m podría reducir significativamente el trabajo muscular asociado a la respiración.
Autorías- 1.
Gustavo A. Plotnikow: Diseño del estudio, recolección y análisis de datos, búsqueda de literatura, preparación del manuscrito.
- 2.
Facundo JF Bianchini: Recolección de datos, búsqueda de literatura, revisión del manuscrito.
- 3.
Roque S. Moracci: Análisis de datos, búsqueda de literatura, revisión del manuscrito.
- 4.
Malena P. Loustau y Valeria S. Acevedo: Búsqueda de literatura, preparación del manuscrito.
- 5.
Jaime A. Mackinlay, Emanuel Di Salvo y Federico Melgarejo: Recolección de datos, búsqueda de literatura.
- 6.
Facundo J. Gutierrez, Javier Mariani y Matias Madorno: Diseño del estudio, análisis de datos.
Los autores declaran no haber recibido financiación para la realización de este trabajo.
Conflicto de interesesGAP ha recibido financiación para programas de enseñanza de Medtronic LATAM y Vapotherm Inc. EE. UU. Los demás autores no tienen conflictos de intereses.
Los autores agradecen la colaboración y el apoyo del Dr. Gaston Murias, jefe de la Unidad de Cuidados Intensivos, y a todos los miembros del personal de Terapia Física y Cuidado Respiratorio del Servicio de Rehabilitación de la Unidad de Cuidados Intensivos del Hospital Británico de Buenos Aires de Argentina. También agradecemos a Juan Ignacio Mithieux de JAEJ S.A. y a Amy Bergeski, Gerente Senior de Investigación Clínica de Vapotherm Inc., por su apoyo desinteresado durante el estudio.
Este estudio fue presentado en el 32° Congreso Argentino e Internacional de Terapia Intensiva celebrado del 9 al 11 de noviembre de 2022 en la ciudad de Mar del Plata, Buenos Aires, Argentina.