La reología describe la relación entre el esfuerzo o tensión (stress) soportado por el material y la deformación (strain) inducida en él por la fuerza aplicada. En base a la evidencia experimental en animales de laboratorio y la reciente investigación en humanos, los conceptos básicos de la reología parecen explicar de forma más verosímil la lesión pulmonar inducida por la ventilación mecánica (ventilator induced lung injury o VILI)).
El objetivo de este artículo es analizar las implicaciones clínicas de la teoría reológica y la relación de la potencia mecánica (mechanical power, MP) en el desarrollo del VILI.
El VILI es un fenómeno dependiente del tiempo: dinámica de desarrolloDinámica del desarrollo del VILIEn 2013, de nuevo los investigadores del equipo de Gattinoni et al.1, repitieron el experimento de 2011, pero esta vez con un diseño prospectivo de cohortes. Ventilaron cerdos sanos durante 60h (fracción inspirada de oxigeno=0,5, frecuencia respiratoria [Fr]=15rpm) de manera que en todos ellos el volumen teleinspiratorio fuera igual a la capacidad pulmonar total. Pero, utilizando diferentes combinaciones de volumen corriente (Vc) y de presión positiva al final de la espiración (PEEP), crearon 4 cohortes de cerdos, cada una ventilada con un valor diferente de strain: 2,5; 1,154; 0,556 y 0,217. Tal y como ocurría en el primero de sus experimentos, los animales ventilados con mayores cifras de strain presentaban mayor grado histológico de VILI y mayores niveles de marcadores inflamatorios locales y sistémicos.
En este caso, el diseño prospectivo posibilitaba el seguimiento temporal de las cohortes. Y descubrieron que existía una interacción estadísticamente significativa entre el nivel de strain y el tiempo de aplicación del patrón ventilatorio:
- •
En la cohorte strain 2,5, la aparición de VILI se detecta ya a las 6h de ventilación y todos los cerdos han muerto a las 48h.
- •
En las cohortes strain 1,154 y strain 0,556, todos los cerdos sobreviven y la aparición del VILI se retrasa hasta las 24 y 36h, respectivamente.
- •
Pero, de manera sorprendente, en la cohorte strain 0,217, a pesar de haber sido ventilada durante 60h hasta volúmenes teleinspiratorios iguales a la capacidad pulmonar total (con valores iniciales de presión meseta [Pplat] inspiratoria de 36 ±3cmH2O), no solo no aparece VILI, sino que los valores de Pplat al final del experimento eran los más bajos de entre las 4 cohortes.
Por tanto, se puede concluir que el desarrollo del VILI es un fenómeno tiempo-dependiente. Es importante destacar que en ninguna de las teorías que, hasta la fecha, se han propuesto para explicar el mecanismo etiopatogénico del VILI (barotrauma, volutrauma, atelectrauma, biotrauma) se ha considerado explícitamente un mecanismo que incluyera al tiempo de aplicación de la ventilación como un factor responsable de importancia.
En busca de una nueva teoría que permita incluir el tiempo entre los factores productores de VILI, Gattinoni y su grupo de investigación estudiaron experimentalmente la dinámica de desarrollo temporal del VILI2. Así, en animales sanos ventilados sin PEEP y sometidos a un strain de 2,5, observaron que el desarrollo del VILI se producía de manera exponencial. Midiendo con tomografía axial computarizada la aparición de densidades nuevas en el parénquima pulmonar, descubrieron que:
- •
La aparición de nuevas densidades se inicia hacia las 6h de ventilación.
- •
Aparece en las zonas de interfase de las estructuras naturalmente no homogéneas (sobre todo en microatelectasias subpleurales de la base, aunque también peribronquiales e intraparenquimtosas).
- •
Se va generalizando bilateralmente en todo el parénquima siguiendo una función exponencial.
A esas zonas inhomogéneas en las que se inicia el VILI, se les ha llamado multiplicadores de stress (stress raisers) y actúan como una especie de «núcleos de cristalización» en la generalización exponencial del VILI. El desarrollo de VILI mediante un mecanismo que implica la existencia de stress raisers fue deducido matemáticamente ya en 1970 por Mead3. El concepto de stress raisers está tomado de la ingeniería de materiales. Es exactamente por un mecanismo de multiplicadores de stress como esta ciencia explica la generación de la llamada «fatiga de los materiales»: la propagación por su interior de las fracturas iniciadas originalmente en zonas microscópicas de impureza (stress raisers), que acaban haciendo inservible un material.
Un importante descubrimiento con implicaciones prácticas fue que dichas densidades de VILI inicial (los multiplicadores de stress) aparecen solo en los cortes de tomografía axial computarizada realizados en espiración. Esto significa que los stress raisers son zonas altamente reclutables, por lo que usando presiones elevadas de PEEP se impide su aparición y se consigue mantener un parénquima más homogéneo. Esta sería, por tanto, una forma de prevenir la aparición de las lesiones pulmonares precursoras del VILI.
El aumento de la frecuencia respiratoria incrementa el VILILa investigación sobre la influencia de las variables dinámicas (tiempo) en la producción del VILI ha proseguido con paso firme, y ha aportado nuevas pruebas sólidas de la implicación de factores temporales. Ya en el año 2000 el equipo de John Marini 4 describió por primera vez en un modelo animal (pulmones de conejo aislados del tórax y perfundidos «ex vivo»), que la Fr alta empeoraba el VILI. Pero las pruebas más sólidas de la implicación de factores temporales (la Fr) han sido proporcionadas por el equipo de investigadores del instituto Karolinska5, en el que participa el español Suarez-Sipmann.
Es un experimento realizado sobre un modelo animal de VILI denominado «two-hit injury model» (se genera VILI en un modelo experimental en cerdo mediante lavados alveolares con suero fisiológico seguidos de una ventilación muy agresiva durante 2h). Los animales con VILI se ventilaron en modo volumen control con la estrategia del ARDSnet (Vc=6mL/kg, PEEP=10cmH2O, fracción inspirada de oxigeno=0,5) y fueron aleatorizados a ser ventilados unos con una Fr de 20rpm y otros con una Fr de 40rpm. A las 4-6h de ventilación, la P/F había empeorado significativamente y los marcadores bioquímicos y anatomopatológicos detectaban mayor lesión pulmonar en el grupo de Fr alta.
Por tanto, la Fr baja protege del VILI a los pulmones con SDRA. Claramente, estos hallazgos suscitan una pregunta clínica muy relevante: ¿Es realmente protectora la ventilación de «alta frecuencia»? Por ahora ningún metaanálisis de ensayos clínicos lo ha confirmado ni en pacientes adultos ni en pacientes pediátricos o neonatales.
El flujo alto aumenta la producción de VILIEn relación también con los factores dinámicos que influyen en el VILI, Gattinoni y su equipo 6, han comunicado los resultados encontrados en el modelo experimental de cerdos sanos ventilados en volumen controlado con la misma Fr y el mismo strain (15rpm y 2,1±0,9, respectivamente) pero diferente strain rate. Se dividieron aleatoriamente en 2 grupos. En uno de ellos, se utilizaron flujos bajos (469±156mL/s) y relaciones I:E de 1:3 a 1:5, para someter a los animales una baja strain rate. En el otro grupo experimental, el de alta strain rate, se utilizaron flujos altos (1.322±246mL/s) y relaciones I:E de 1:5 a 1:9. Al final del experimento, el grupo sometido a alta strain rate tuvo:
- •
Peor complianza y P/F.
- •
Más marcadores inflamatorios en el lavado broncoalveolar.
- •
Más signos anatomopatológicos de edema pulmonar.
- •
Mayor prevalencia de VILI (73 vs. 20%; p=0,01).
- •
Mayor mortalidad a las 54h de ventilación (47 vs. 13%).
Es decir, en la producción del VILI no solo importa la deformación (strain) inducida por el respirador mecánico en los pulmones ventilados, sino también la velocidad a la cual el respirador produce esta deformación (strain rate). A mayor velocidad en la deformación inducida por el aire, mayor VILI.
Otro hallazgo fundamental de este experimento fue que los animales que habían presentado VILI habían tenido, durante su ventilación:
- 1.
Un mayor índice de histéresis pulmonar dinámica (Julios).
- 2.
Un mayor índice de stress relaxation (P1–P2; cmH2O).
Estas 2 mediciones que pueden realizarse de forma sencilla con el respirador mecánico están describiendo el comportamiento viscoso del parénquima pulmonar.
Protti et al.6 detectaron además que strain y strain rate interaccionan entre sí e incrementan tanto la histéresis dinámica como el P1 – P2. Este hecho indica que el patrón respiratorio que se ha aplicado está forzando a los pulmones (como hemos visto, cuerpos viscoelásticos) a comportarse más como líquidos viscosos que como sólidos elásticos. Y ello incrementa la producción de VILI. Monitorizando estas 2 medidas, podríamos detectar si el patrón respiratorio con el que estamos ventilando a nuestros pacientes está forzando a sus pulmones a comportarse como líquidos viscosos. Es decir, podría ayudarnos a programar el respirador para disminuir el VILI.
Este hallazgo es sorprendente, pero viene a dar verosimilitud a una hipótesis que se había sugerido como explicación a unos hechos evidenciados hace ya algunos años. En una serie de experimentos7–9 diseñados para intentar comparar la ventilación en modo controlado por presión con esquema de control adaptativo (PC-CMVa; modo controlado por presión con volumen objetivo) con la ventilación controlada por volumen (VC-CMV), tanto en modelo animal de pulmón sano como en el de SDRA los autores encontraron una clara superioridad del modo VC-CMV, no solo en los parámetros de oxigenación sino también en las mediciones anatomopatológicas de la necropsia. El modo de PC-CMVa producía mucho más VILI, y los autores proponían el mayor pico de flujo como el responsable. Por tanto, es posible que un mayor flujo pico induzca una mayor strain rate y, tal como acaba de demostrar el equipo de Gattinoni, esto produce más VILI.
¿Qué efecto tiene la presión positiva al final de la espiración?Por ahora, el efecto de la PEEP sobre la producción de VILI no ha sido aún establecido experimentalmente en el marco de la nueva teoría basada en el efecto del stress y el strain.
Teóricamente, al aumentar la PEEP se está incrementando la CRF. Dado que la CRF está en el denominador tanto del strain como del strain rate, al aumentar el reclutamiento pulmonar mediante el incremento de la PEEP debería disminuir la producción de VILI, aunque existen resultados contradictorios al respecto.
Los datos de 2 análisis basados en modelos empíricos10 y simulaciones de ordenador11 apuntan en esa dirección. Sin embargo, se sabe que en la clínica real es difícil prever el efecto que va a tener la PEEP sobre el reclutamiento pulmonar12, así que no siempre que se aumenta la PEEP se incrementa la CRF en los pacientes con SDRA. Por lo que estos análisis teóricos podrían estar basados en premisas erróneas y, por tanto, sesgados.
Los resultados de los ensayos clínicos arrojan datos interesantes. En el reanálisis a posteriori de Kassis et al.13 de los datos de su anterior ensayo clínico publicado originalmente en NEJM, los pacientes con SDRA ventilados con una estrategia dirigida por la presión esofágica recibieron durante el primer día una PEEP significativamente mucho más elevada. En ellos la elastancia mejoró (p<0,01) y el stress (ΔPTP) disminuyó (p<0,05). Pero juntando todos los pacientes de ambos grupos (intervención y control), realizaron un análisis tipo caso-control y descubrieron que los supervivientes (28 días) habían sido ventilados durante el primer día con un gradiente de presión (presión de conducción o “driving pressure”, DP) inferior a 13cmH2O, un valor estadísticamente menor a la DP que habían recibido los fallecidos (entorno a 15cmH2O).
Hasta el momento, la prueba científica más consistente del efecto beneficioso de la PEEP sobre el desarrollo del VILI ha sido proporcionada por el equipo sueco del instituto Karolinska. Los autores repitieron el experimento5 realizado con el modelo animal de VILI «two-hit injury model» aplicando una maniobra de reclutamiento y pautando la PEEP óptima (definida como 2cmH2O por encima de la PEEP que maximiza la complianza dinámica en una maniobra decremental)14. Es decir, se modificó el modelo de VILI para aplicar una estrategia de open lung approach. El principal hallazgo de este experimento fue que la estrategia open lung approach compensó el efecto lesivo de la Fr (20 vs. 40rpm). A las 4-6h de ventilación los marcadores bioquímicos y anatomopatológicos de VILI eran indistinguibles entre ambas cohortes (Fr alta y Fr baja). De hecho, los datos de inflamación eran superponibles a los encontrados en la cohorte Fr baja del experimento anterior (ARDSnet). Por tanto, en el SDRA la PEEP protege del VILI inducido por la Fr alta.
En la misma dirección apuntan otros datos del experimento anteriormente citado de Protti et al.6. Tanto en la cohorte de baja strain rate como en la de alta strain rate, respecto de los animales ventilados con PEEP=0cmH2O (ZEEP) los ventilados con PEEP=10cmH2O presentaban menor stress relaxation (diferencia P1-P2). No parece existir interacción (p=0,994) entre el efecto de la PEEP y del strain rate. Así que la PEEP parece ser un factor independiente que disminuye el comportamiento viscoso del parénquima pulmonar al ser ventilado. Es una relación estadística que podría no ser causal, pero como los pulmones con VILI habían sido ventilados con menor stress relaxation, de nuevo la evidencia circunstancial parece indicar que la PEEP evita la formación de VILI.
Integración global de los conceptos: la potencia mecánicaEl paso definitivo en el desarrollo de una teoría completa, basada en la reología y en la ingeniería de materiales, que explique científicamente la producción de VILI lo ha constituido la introducción del concepto de MP por el equipo de Gattinoni en 2016. Permite la integración global de todos los diferentes parámetros del respirador que se han descrito como cofactores susceptibles de producir VILI (Vc, presiones, Fr y flujo) en una única cantidad física. Se trata de medir la energía mecánica que se transmite al aparato respiratorio del enfermo (vías aéreas+parénquima pulmonar) desde el respirador artificial. Toda esta carga energética (Julios), expresada por unidad de tiempo (Julios/min), es la MP.
Para los físicos energía y trabajo son conceptos intercambiables. La energía es una medida de la «capacidad para realizar un trabajo», y el trabajo es la «energía transferida por una fuerza».
Para la fisiología clásica, el trabajo respiratorio (WOB) durante la inspiración en ventilación mecánica con flujo constante15 se mide como:
(Ecuación 1)
Es decir, el trabajo que hace el ventilador cada inspiración para introducir el aire en el sistema respiratorio coincide con el área bajo la curva del asa inspiratoria del bucle dinámico presión-volumen, medida sobre el eje de volúmenes. Ese trabajo es exactamente la energía que el respirador suministra al sistema respiratorio del paciente para poder ventilarlo.
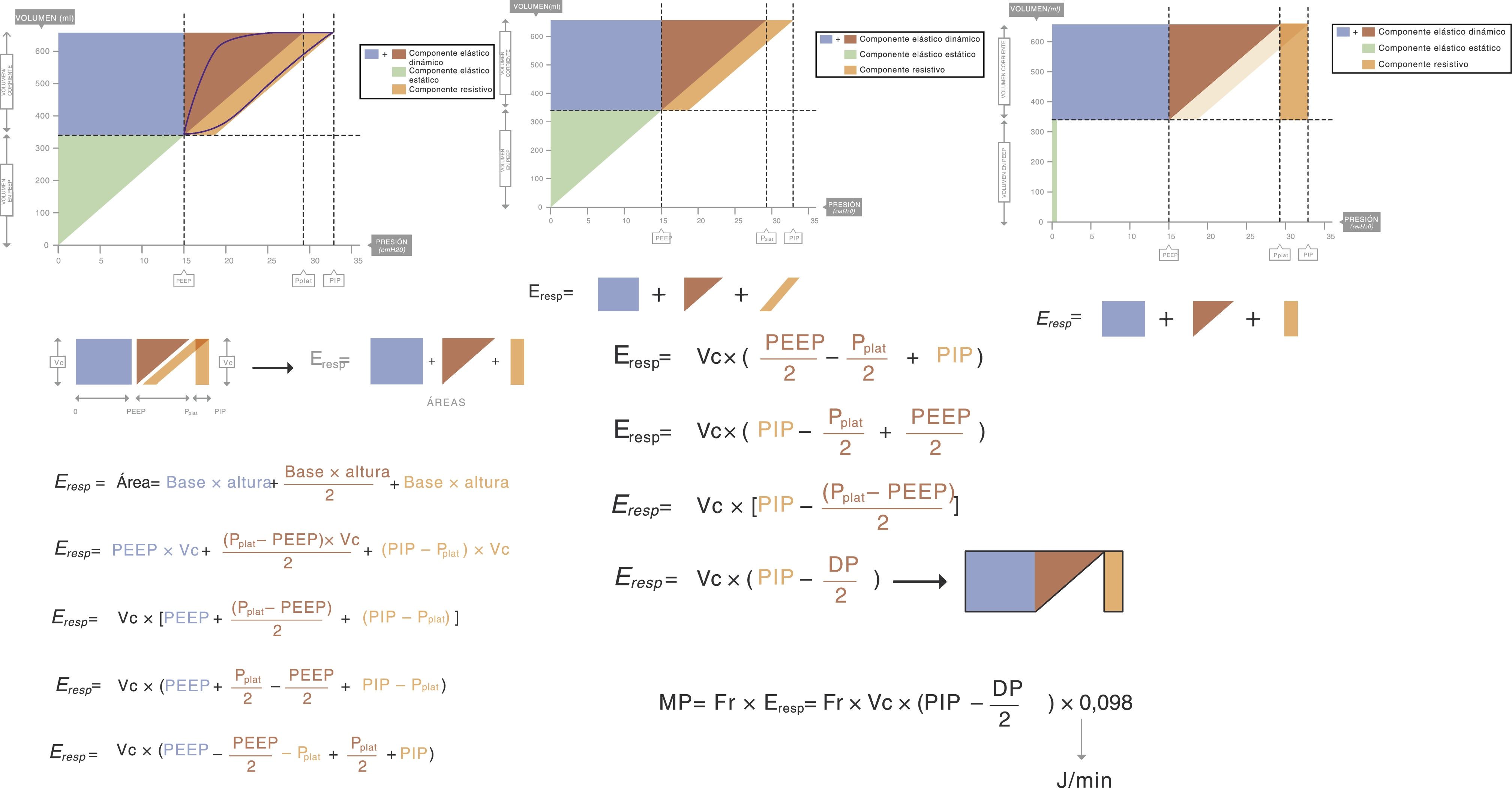
Basándose en esto, Gattinoni et al. 16 han obtenido 2 fórmulas equivalentes capaces de estimar la MP en volumen control. Las fórmulas se pueden deducir, partiendo de la ecuación de movimiento de la fisiología respiratoria clásica, mediante un elegante razonamiento geométrico sobre el bucle dinámico presión-volumen (una información de la que ya se dispone prácticamente en todos los respiradores artificiales a pie de cama) (fig. 1)17. La energía suministrada (J) cada ciclo por un respirador de flujo constante es:
Cálculo de la potencia mecánica. A efectos prácticos el componente elástico estático (triángulo inferior) no se incluye en el cálculo de la energía ya que dicha energía solo se utiliza en la primera inspiración. El punto clave es la energía que se envía el resto de los ciclos respiratorios. Reproducido con permiso de Modesto-Alapont V, et al.17.
DP: presión de conducción o driving pressure; Eresp: energía invertida en la respiración; PEEP: presión positiva al final de la espiración; PIP: presión pico; Pplat: presión meseta; Vc: volumen corriente.
Eresp: energía; Vc: volumen corriente; E: elastancia; R: resistencia; Ti: tiempo inspiratorio; PEEP: presión positiva al final de la espiración.
(Ecuación 2)
Esta ecuación está expresada en función de las 2 constantes, elastancia (E=1/C) y resistencia (R). Pero puede simplificarse muchísimo, conociendo las siguientes equivalencias:
Flujo=Vc/Ti.
DP=Pplat-PEEP.
R=(PIP-Pplat)/Flujo.
E=DP/Vc.
En esta otra:
Eresp: energía; Vc: volumen corriente; PIP: pico de presión; DP: driving pressure.(Ecuación 3)
Multiplicando la energía suministrada ciclo a ciclo por la Fr se puede calcular la MP:
MP: mechanical power; Fr: frecuencia respiratoria; Vc: volumen corriente; E: elastancia; R: resistencia; Ti: tiempo inspiratorio; PEEP: presión positiva al final de la espiración.(Ecuación 4)
O su equivalente
MP: mechanical power; Fr: frecuencia respiratoria; Vc: volumen corriente; PIP: pico de presión; DP: driving pressure.(Ecuación 5)
Donde 0,098 es el factor de conversión de L×cmH2O a Julios.
Gattinoni ha demostrado que el cálculo resultante de estas fórmulas es equivalente, tanto en pulmones normales como en pacientes con SDRA, al resultado de integrar el área bajo la curva del bucle dinámico presión-volumen, sobre el eje de los volúmenes (la definición física del trabajo respiratorio). Y, además, mediante simulaciones de ordenador, basándose en esta fórmula ha demostrado que:
- •
La MP se incrementa exponencialmente:
- ∘
Exponente=2: con el Vc, la DP y el flujo.
- ∘
Exponente=1.4: con la Fr.
- •
La MP se incrementa linealmente: con la PEEP, la E y la R.
Los mismos investigadores han publicado un estudio que constituye lo que en metodología de la investigación se denomina una prueba de concepto18: la evidencia experimental incontrovertible de que el responsable del VILI es la MP. El estudio consistió en 2 experimentos:
- •
En el primero se demostró que existe un umbral de MP a partir del cual se induce VILI. La muestra son cerdos ventilados durante 54h en volumen control con una strain≥2 (un valor de strain que ya habían descrito previamente que con una Fr de 15rpm producía VILI e incluso era letal). Los animales son divididos aleatoriamente en 5 cohortes, cada una de ellas ventilada con diferentes Fr (3, 6, 9, 12 y 15rpm) y por tanto diferentes MP (2±0,2J; 7±3J; 10±3J; 14±2J y 22±2J, respectivamente). La aparición de VILI se midió con una tomografía computarizada y con la histología de la necropsia. Y demostraron que solo en los cerdos ventilados con una MP mayor de 12J/min se produce VILI. Por debajo de ese umbral no aparece patología. Debido a la muerte de los animales ventilados con mayor MP, el experimento solo pudo durar 34±13h
- •
El segundo experimento fue el de confirmación. Para demostrar que no es la Fr la responsable, esta vez todos los animales fueron ventilados a 35rpm durante 54h. Pero, en función del Vc que se les administró, se dividieron en 2 cohortes: una formada por cerdos a los que se suministró una MP menor y mayor de 12J/min (8±2J/min) y otra con cerdos ventilados desde el principio a más de 12J/min (22±5J/min). Los resultados confirman los hallazgos del primer experimento: solo se indujo VILI en la cohorte de alta MP, en la que los índices de stress, strain, Ebreath e histéresis dinámica se incrementaron durante el tiempo que duró la ventilación mecánica. Es decir, la ventilación empeoró el VILI.
Además, analizando los datos de todos los animales de ambos experimentos, se comprobó que la MP suministrada fue:
- •
Inversamente proporcional a la caída en la oxigenación (P/F)
- •
Directamente proporcional al aumento de la E, los índices de comportamiento viscoso (diferencia P1 -- P2, histéresis dinámica) y a las medidas anatomopatológicas de presencia de edema pulmonar.
La existencia de este umbral de MP es un hallazgo determinante, y es compatible con lo que conocemos científicamente en la ingeniería de materiales19–21. Según esta ciencia, en el interior de cualquier material existen siempre impurezas (a veces microscópicas). Estas funcionan como stress raisers en el inicio de la formación de las fracturas internas, cuya propagación acaba produciendo la fatiga del material. Desde estos puntos iniciales, el crecimiento de las fracturas tiene lugar con una dinámica de propagación muy característica que ha sido demostrada experimentalmente desde los años 1920. Según el llamado criterio energético de fractura de Griffith: se producirá el crecimiento y propagación de la fractura por el espesor del material solo cuando la tasa de energía que se le aporte al sistema supere un valor umbral crítico (Crit Griffit, Gc). La analogía con la MP y el VILI es evidente.
Las pruebas clínicas de la importancia del MP en el desarrollo del VILI son aún poco consistentes (series prospectivas grandes), pero apuntan firmemente en esa dirección. En los datos de la cohorte LUNG SAFE22, los parámetros ventilatorios independientemente asociados con mortalidad en pacientes ventilados por SDRA fueron:
- •
El uso de PEEP disminuye la mortalidad.
- •
La Fr, la PIP y la DP aumentan la mortalidad. Es destacable que estos 3 parámetros estén presentes en la fórmula abreviada de la MP.
En otra cohorte diferente, también de tamaño muestral grande, Fuller et al.23 encontraron que en pacientes con pulmones sanos en los que se aplica una estrategia de ventilación protectora para intentar prevenir la aparición de SDRA, tanto la DP como la MP se asociaron a mayor incidencia de SDRA.
La identificación de un umbral razonable de MP a partir del cual se genere VILI parece, por tanto, un hallazgo de importancia capital por su aplicación en la clínica diaria.
Un ejemplo cotidiano paradigmático es la indicación de sustituir la ventilación convencional por la ventilación de alta frecuencia oscilatoria. En base a las teorías de volu/barotrauma parecería que la ventilación de alta frecuencia oscilatoria debiera ser el soporte respiratorio más seguro y poco lesivo, al administrar Vc inferiores al espacio muerto con una presión de distensión continua (MAP) moderada. Contraintuitivamente, ningún ensayo clínico realizado hasta la fecha ha demostrado esta superioridad e incluso hay evidencias consistentes que indican que podría ser más lesiva que la ventilación convencional. Esta paradoja podría resolverse fácilmente si tenemos en cuenta que se trata de una modalidad ventilatoria basada en la utilización de un movimiento oscilatorio armónico simple. La energía transmitida por una onda hacia el sistema respiratorio podría exceder claramente el umbral de MP capaz de generar VILI. Lo mismo podría aplicarse a la indicación de ECMO respiratoria en el paciente con SDRA con el objetivo de disminuir la MP (al mantener al pulmón con parámetros de reposo) para disminuir la probabilidad de VILI.
Versión termodinámica: lesión pulmonar como producto de la entropía generadaDe manera independiente, Oliveira et al. han publicado un versión diferente de la misma teoría24. Está basada en un estudio del problema desde el punto de vista de la termodinámica, que es la parte de la física que estudia los cuerpos macroscópicos que están constituidos internamente por múltiples partes. Por complejo que resulte, el comportamiento del pulmón al ser hinchado por el respirador artificial debe obedecer las 3 leyes de la termodinámica, que marcan los límites mediante los cuales los cuerpos físicos evolucionan de un estado (espiración) a otro (inspiración) y viceversa.
Para entender este razonamiento, solo es necesario conocer las 2 primeras leyes de la termodinámica:
- •
La primera ley de la termodinámica, que es la ley de conservación de la energía pero aplicada a la energía interna (se excluye la energía del sistema como un todo, debida a su posición o su movimiento) de un sistema termodinámico. Según esta ley solo hay 2 formas de cambiar la energía interna de un sistema termodinámico:
- 1.
Calentándolo (o enfriándolo) una cantidad de energía calorífica (Q).
- 2.
Realizando un trabajo (W).
Q: energía calorífica; W: trabajo
- (Ecuación 6)
- •
La segunda ley de la termodinámica, que describe la entropía (S) como una variable de estado de un sistema termodinámico. Obliga a que cuando se produzca un cambio de estado, la entropía de un sistema nunca pueda decrecer. Poniendo ese cambio de entropía en función de la temperatura absoluta (T, grados Kelvin), se enuncia:
S: entropía; Q: energía calorífica; T: temperatura
(Ecuación 7)
Combinando ambas leyes, se obtiene la ecuación de estado de un sistema termodinámico:
S: entropía; T: temperatura; W: trabajo
(Ecuación 8)
Esta ecuación describe la relación existente entre la energía interna, la temperatura, la entropía y el trabajo realizado por (o sobre) un sistema termodinámico.
La esencia de un ser vivo es una continua actividad interna de un naturaleza sumamente ordenada (gradientes eléctricos, químicos y de temperatura). En el libro de 1944 ¿Qué es la vida? Erwing Schrödinger estableció que, desde el punto de vista termodinámico, los seres vivos son capaces de mantener durante toda su vida el orden en una aparente violación de la segunda ley de la termodinámica. Y que para ello, deben ser capaces de exportar al ambiente que les rodea la entropía que están generando. Pero, ¿qué ocurre si no toda la entropía puede ser exportada? La entropía remanente queda retenida en el interior del sistema, y su consecuencia inevitable es la progresión gradual del sistema hacia la disfunción (es decir la enfermedad) y eventual muerte. Ello hace surgir 2 preguntas esenciales para la vida y muerte de un organismo: ¿a qué ritmo se produce la entropía en el interior de un organismo?, y ¿con qué eficacia está ese organismo exportando la entropía generada? Esta explicación filosófica ha sido concretada por Oliveira et al. a nivel del pulmón.
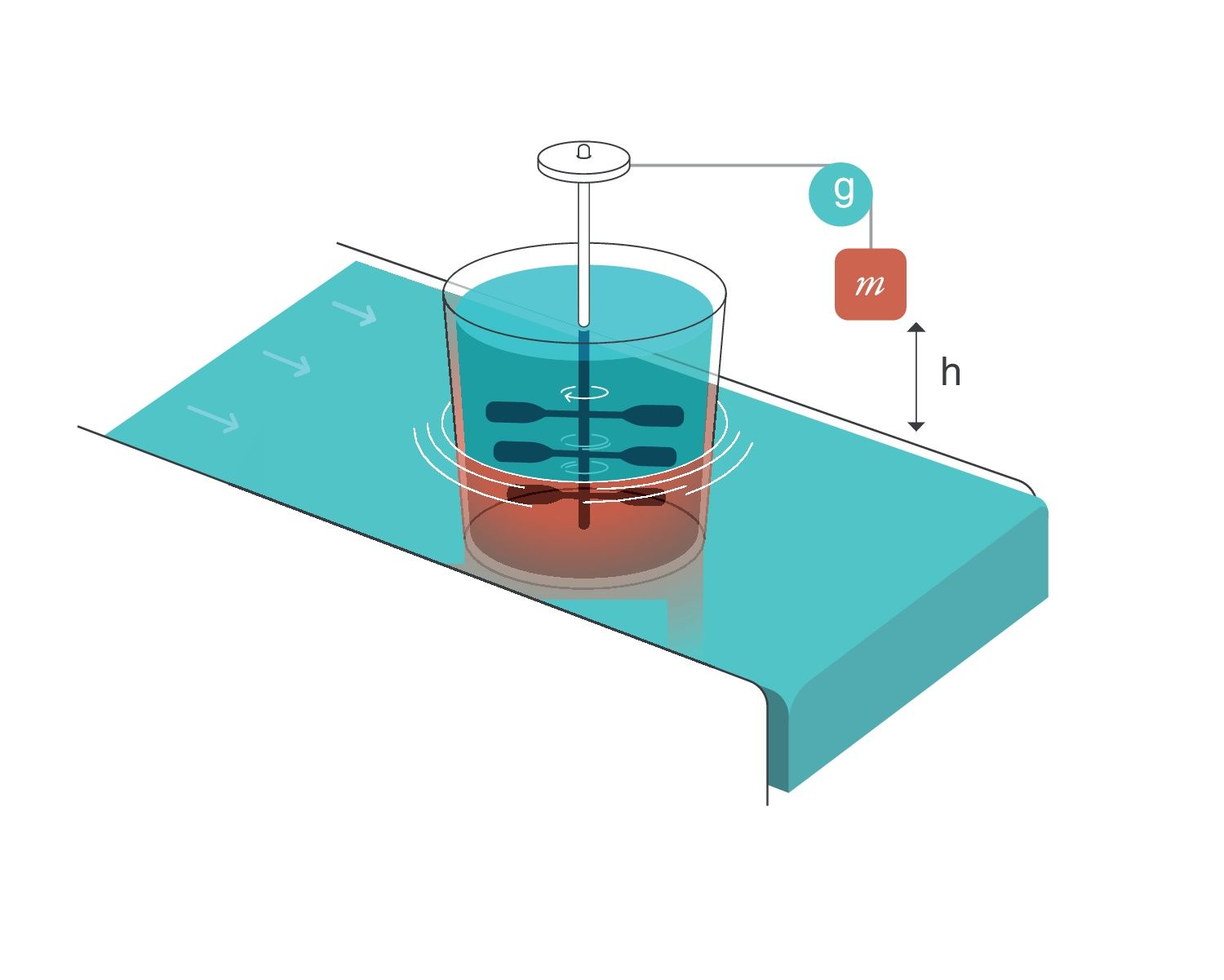
Para la termodinámica25, un generador de entropía es un sistema compuesto por 2 partes en contacto (fig. 2):
- 1.
La primera parte del sistema consiste en un peso de masa m que, durante su caída, hace girar un conjunto de remos/palas sumergidos en el interior de un líquido viscoso.
- 2.
Esta parte está en contacto térmico con la segunda parte del sistema, que consiste en un reservorio de calor, que mantiene una temperatura constante T. Para la termodinámica, un «reservorio de calor» es capaz, por definición, de mantener constante la temperatura independientemente de cuanto lo calentemos o enfriemos. Tiene una capacidad calorífica infinita.
Generador de entropía. Reproducido con permiso de Modesto-Alapont V, et al. 17.
g: gravedad; h: distancia; m: masa.
Cuando el peso de masa m cae una distancia h, se realiza un trabajo sobre el interior del líquido viscoso:
W: trabajo; m: masa; h: distancia; g: gravedad(Ecuación 9)
Esto produce un incremento en la energía térmica del líquido, que conllevaría, a su vez, un aumento de su temperatura si este no estuviera en equilibrio térmico con el reservorio de calor. Pero dado que el líquido y el reservorio se encuentran en contacto térmico, y el reservorio mantiene su temperatura constante, cuando el peso cae el líquido transfiere esa energía en forma de calor al reservorio, haciendo que la entropía del reservorio aumente una cantidad
W: trabajo; T: temperatura; m: masa; h: distancia; g: gravedad
(Ecuación 10)
Si el líquido es capaz de «exportar» esa entropía al reservorio, su entropía permanecerá constante. El «generador de entropía» demuestra físicamente que cuando un trabajo W es disipado completamente en un reservorio calorífico de temperatura T, la entropía del sistema completo (líquido+reservorio) aumenta en una cantidad W/T.
Podemos describir al sistema formado por el pulmón y el sistema circulatorio como un «generador de entropía»:
- 1.
Aparato respiratorio. El líquido movido por los remos sumergidos representaría al pulmón sometido al trabajo respiratorio (WOB=Eresp) que realiza el ventilador mecánico cada inspiración. Es importante recordar que la MP es esa energía multiplicada por los ciclos respiratorios que se hacen cada minuto.
- 2.
Aparato circulatorio. El reservorio calorífico representaría el sistema circulatorio que está en contacto térmico con los pulmones y que es capaz de mantener la temperatura corporal constante (condiciones isotérmicas; 36,5°C=273,15±36,5°C=309,65°K).
Mientras el pulmón sea capaz de exportar esa entropía al sistema circulatorio, disipando completamente el trabajo que se hace sobre él, la entropía pulmonar permanecerá constante: no se producirá VILI. Pero si la MP es demasiado elevada, y supera la capacidad que tiene el sistema circulatorio de retirar la entropía que se está produciendo en el interior del pulmón, parte de la entropía generada (MP/T) se dirigirá a producir VILI. Así pues, la capacidad del sistema circulatorio de eliminar la entropía generada en el interior del pulmón explica que exista un umbral de MP a partir del cual se genera VILI.
Oliveira et al. justifican que si el pulmón se mueve en el límite elástico, es decir a strain pequeño, la distribución tridimensional de las fibras microscópicas de elastina y colágeno del interior del tejido pulmonar hacen que el stress recaiga casi exclusivamente sobre las fibras de elastina. Y las fibras de elastina tienen una propiedad termodinámica muy característica: se comportan como las cintas de goma elástica, que tienen un módulo de Young proporcional a su temperatura absoluta T.
- •
Cuando se estiran durante la respiración normal (inspiración) son capaces de liberar calor al medio que les circunda (sistema circulatorio), lo cual tiene como respuesta una disminución en su entropía26.
- •
Ello les da la capacidad de que, cuando se contraen durante la espiración, pueden convertir la energía térmica (aportada por el sistema circulatorio) en trabajo. Es decir, absorber calor para volver al estado de equilibrio.
Si cuando se aporta externamente energía (MP), la ventilación mecánica hace comportarse al pulmón como un sólido elástico, esta propiedad termodinámica hace que no se genere entropía y toda la energía aportada durante la inspiración se recupere al final de la espiración sin pérdidas. El proceso es reversible y no se producirá VILI.
Por el contrario, si cuando se aporta energía, la ventilación mecánica hace comportarse al pulmón como un líquido viscoso, se pondrá en marcha el mecanismo termodinámico del «generador de entropía». En este caso el stress recaerá además sobre las fibras de colágeno (100 veces más rígidas que las de elastina) y ácido hialurónico (una de las estructuras más débiles de la matriz extracelular del pulmón).
Mientras el sistema circulatorio sea capaz de retirar la entropía (MP/T) que se está generando en el interior del pulmón no se producirá VILI. Pero si la MP que suministramos es demasiado elevada y saturamos la capacidad del sistema circulatorio de retirarla, esa entropía deformará irreversiblemente el parénquima y producirá lesión pulmonar.
Sabiendo que:
- •
El peso molecular del ácido hialurónico es de 2.500Da.
- •
El pulmón humano posee 0,1×10 − 6g de ácido hialurónico por cada gramo de tejido pulmonar.
- •
La fuerza que se necesita para romper la unión entre el ácido hialurónico y sus proteínas circundantes es de (40±11)×10-12Newtons.
Gattinoni et al. 27 han conjeturado que para desplazar la unión hialurónico-proteínas unos 2,8×10 − 6m, se necesitan 1,12×10−16J.
Cuando la MP es de 12J/min, la entropía generada a 36,5°C es de 12/309,65°K=0,038J/min. En ese orden de magnitud, la cantidad de entropía/molécula hialurónico se aproxima a la necesaria para romper esa unión, con lo que es probable que en cada ciclo respiratorio puedan romperse una cantidad de moléculas superior a las que se puedan ir reparando fisiológicamente. Si la MP aumenta, y con ello la entropía/molécula, muy probablemente el ritmo al que se generan las fracturas exceda esa capacidad fisiológica de reparación. Y, por tanto, con el tiempo, se desarrollará VILI.
ConclusiónEn los últimos años se ha desarrollado una nueva teoría para explicar el desarrollo del VILI. Se basa en los conocimientos físicos generados por la reología, la ingeniería de materiales y la termodinámica. Está siendo confirmada experimentalmente con animales de laboratorio, pero, además, los datos clínicos más recientes evidencian que sus predicciones explican mejor los hechos y fenómenos que se describen en los pacientes mecánicamente ventilados, que las antiguas teorías (barotrauma, volutrauma, atelectrauma, biotrauma).
Su principal hallazgo, la existencia de un umbral de energía (MP) a partir del cual se originaría el VILI, es susceptible de revolucionar en un futuro próximo las indicaciones y la aplicación de las diferentes modalidades de ventilación mecánica y soporte respiratorio extracorpóreo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.