El traumatismo craneoencefálico (TCE) es una de las patologías más importantes en la actualidad, ya que afecta a un alto porcentaje de individuos de todas las edades. A pesar de los avances en el campo del diagnóstico, la monitorización y el tratamiento del TCE, quedan importantes cuestiones sin resolver alrededor de la fisiopatología de este tipo de traumatismo. Con el fin de profundizar en dicho conocimiento y poder evaluar y aplicar un posible tratamiento que resulte eficaz para estos pacientes, se han desarrollado diferentes modelos experimentales que simulan los mecanismos de acción y el cuadro clínico del TCE. A su vez, cada modelo representa un determinado tipo de traumatismo y evalúa un aspecto concreto de la cascada fisiopatológica desencadenada tras el TCE.
El objetivo de este trabajo es detallar los principales modelos experimentales que abordan la lesión cerebral tras un TCE, así como su potencial traslación a la práctica clínica diaria.
Traumatic brain Injury (TBI) is a major public healthcare concern, affecting people of all ages. Despite advances in the diagnosis, monitoring and clinical management of TBI, many unresolved questions remain regarding its physiopathology. In an attempt to understand the pathological features of TBI and to evaluate single potential therapeutic strategies, various animal models have been developed to simulate the mechanisms of action and the clinical manifestations of TBI patients. In turn, each model represents a specific type of trauma and evaluates a specific physiopathological aspect of the cascade triggered as a result of TBI.
This review describes the main experimental models currently available referred to TBI and their possible application to the clinical setting.
El traumatismo craneoencefálico (TCE) es una de las principales causas de muerte y discapacidad a nivel mundial1,2. En la Unión Europea se producen más de un millón de ingresos hospitalarios/año como consecuencia de un TCE3. Según la información obtenida por el RETRAUCI (Registro de Trauma en UCI de la SEMICYUC), en España la cifra de pacientes hospitalizados anualmente por TCE supera la suma de los pacientes diagnosticados de esclerosis múltiple, cáncer de mama y daño medular traumático4.
El TCE es una patología compleja debido a diferentes factores. En primer lugar, los mecanismos lesionales son variables según el tipo e intensidad del intercambio de energía. Segundo, las lesiones cerebrales desencadenadas, tanto primarias como secundarias, no son homogéneas en todos los individuos (según edad y comorbilidades, entre otras). Estos motivos ocasionan una gran heterogeneidad en los fenómenos fisiopatológicos desencadenados tras el TCE. A su vez, estos hechos explicarían la falta de éxito de los ensayos clínicos farmacológicos desarrollados hasta la fecha. Indudablemente, para alcanzar el éxito de cualquier terapia, previamente deben conocerse pormenorizadamente las cascadas fisiopatológicas que se desencadenan, así como su curso temporal. Concretamente, en el caso del daño cerebral traumático, este conocimiento se ve dificultado por la propia naturaleza de la enfermedad. Por ello, el diseño de modelos experimentales traumáticos homogéneos a este nivel nos brinda la oportunidad de descifrar las alteraciones moleculares y celulares producidas tras el intercambio de energía sobre el encéfalo.
En definitiva, el objetivo de este trabajo es detallar los principales modelos experimentales que abordan la lesión cerebral tras un TCE para conocer sus ventajas y posibles aplicaciones en el campo de la investigación, así como su potencial traslación a la práctica clínica diaria.
Fisiopatología del traumatismo craneoencefálicoLa lesión mecánica directa sobre el cerebro, conocida como lesión primaria, daña la estructura del citoesqueleto axonal y altera la permeabilidad de la membrana celular, generándose un déficit en el aporte de oxígeno, una acumulación de productos patológicos y una alteración global de la homeostasis cerebral5,6. Posteriormente, estos hechos desembocan en la activación de diferentes cascadas bioquímicas, deletéreas para la evolución del paciente, denominadas lesión cerebral secundaria. Desde un punto de vista terapéutico, el control de estas últimas rutas de señalización redundaría en un beneficio directo sobre el paciente, dado que sobre la lesión primaria solo podemos organizar estrategias de prevención primaria para evitarla (uso de casco, sistemas de retención en los vehículos, entre otros).
A su vez, las lesiones cerebrales pueden ser focales, consecuencia del impacto o de las fuerzas de inercia, o bien difusas, secundarias al proceso de aceleración/deceleración. Estas últimas, conocidas también como lesión axonal difusa (LAD), se caracterizan por ser extensas y multifocales7. Cabe resaltar que la LAD es una de las manifestaciones patológicas más comunes dentro del TCE, teniendo una incidencia del 40 al 50% en las hospitalizaciones por TCE8. La LAD puede asociar déficit cognitivo, así como alteraciones motoras y sensoriales debido al daño en la conectividad y funcionalidad neuronal5.
De forma paralela a la deformación del parénquima, y a la respuesta inflamatoria desencadenada, debemos tener en consideración la disrupción de la barrera hematoencefálica (BHE) tras el intercambio de energía sobre el encéfalo. Esta falta de integridad en la BHE, desencadenada por la apertura de uniones estrechas (tight junctions), genera edema cerebral vasogénico por la salida de agua y componentes plasmáticos hacia el compartimento extracelular9-11. En una fase más tardía se produce edema celular (o citotóxico), como consecuencia de una acumulación de agua en el espacio intracelular en compensación al cambio de osmolaridad producido por la liberación de sustancias neurotóxicas tras el traumatismo11,12.
Modelos animales en el estudio del traumatismo craneoencefálicoPara el correcto diseño y realización de un modelo experimental que simule un TCE es necesario que se cumplan una serie de criterios: 1) poder controlar la energía que se emplee; 2) que sea fácilmente reproducible; 3) el daño realizado debe ser cuantificable y extrapolable a los casos clínicos en humanos; 4) el daño producido debe ser consecuencia del intercambio de energía aplicado; 5) que exista la posibilidad de predicción de la gravedad del daño cerebral inducido13.
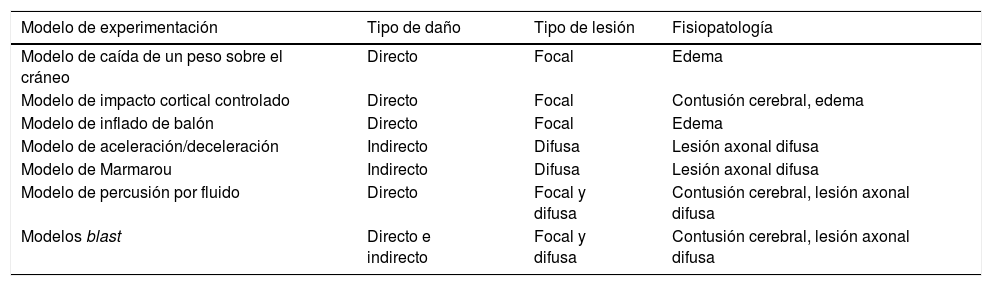
En la literatura encontramos diferentes modelos animales que emulan un TCE. Cada uno de ellos ha sido diseñado con el fin de reproducir y simular un tipo concreto de lesión cerebral traumática. En este sentido, los distintos modelos pueden ser clasificados en dos tipos, bien atendiendo al tipo de intercambio de energía producido, según sea mediante daño indirecto (aceleración/deceleración) o directo (impacto), o bien en función del tipo de lesión cerebral traumática generada (lesión focal o difusa)14 (tabla 1).
Clasificación de los modelos de experimentación animal según el impacto directo o indirecto, el tipo de lesión y la fisiopatología
| Modelo de experimentación | Tipo de daño | Tipo de lesión | Fisiopatología |
|---|---|---|---|
| Modelo de caída de un peso sobre el cráneo | Directo | Focal | Edema |
| Modelo de impacto cortical controlado | Directo | Focal | Contusión cerebral, edema |
| Modelo de inflado de balón | Directo | Focal | Edema |
| Modelo de aceleración/deceleración | Indirecto | Difusa | Lesión axonal difusa |
| Modelo de Marmarou | Indirecto | Difusa | Lesión axonal difusa |
| Modelo de percusión por fluido | Directo | Focal y difusa | Contusión cerebral, lesión axonal difusa |
| Modelos blast | Directo e indirecto | Focal y difusa | Contusión cerebral, lesión axonal difusa |
Por último, para simplificar esta revisión, nos centraremos principalmente en aquellos modelos que usen roedores como animales de experimentación, dada su facilidad en la estabulación y su bajo coste, hechos que simplifican y hacen más asequible su uso.
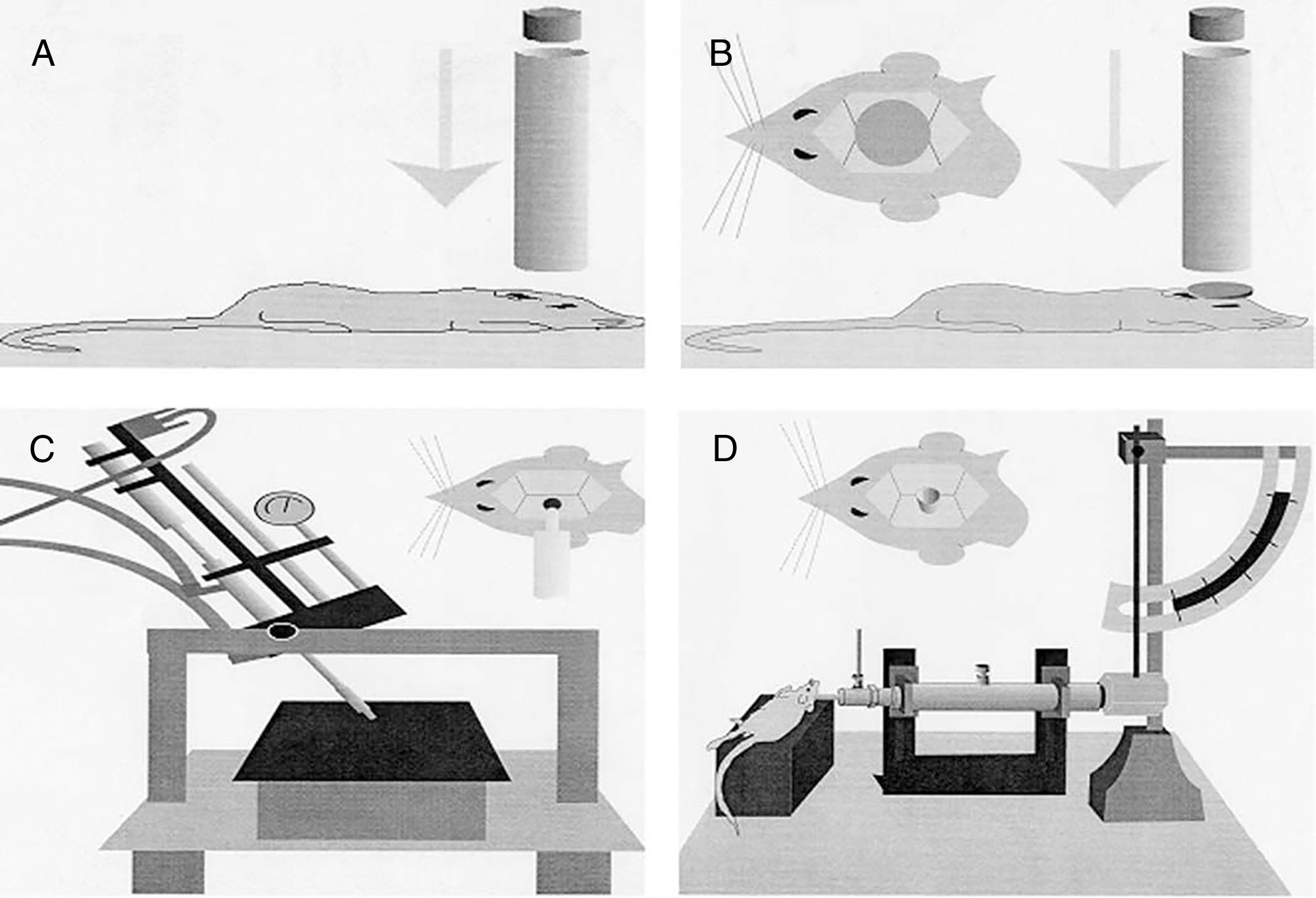
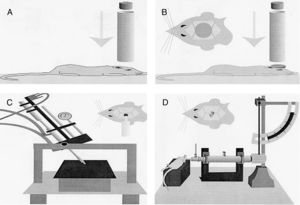
Modelos de lesión focalModelo de caída de un peso sobre el cráneoPara la realización de este modelo, de manera clásica, se emplea la fuerza gravitatoria y la caída de un peso de masa conocida sobre el cráneo del animal de experimentación (fig. 1A). Para ello, tras anestesiar al roedor se coloca en una superficie horizontal, fijado para evitar el movimiento de la cabeza tras la caída de la pesa. La magnitud de la lesión dependerá de la masa de la pesa y de la altura15.
Modelos de traumatismo craneoencefálico en roedores. (A) Modelo de caída de peso sobre el cráneo. (B) Modelo de impacto-aceleración por caída libre de un peso: modelo de Marmarou. (C) Modelo de impacto cortical controlado. (D) Modelo de percusión por fluido.
Fuente: Morales DM, Marklund N, Lebold D, Thompson HJ, Pitkanen A, Maxwell WL, et al. Experimental models of traumatic brain injury: do we really need to build a better mousetrap? Neuroscience. 2005;136:971-89. doi:10.1016/j.neuroscience.2005.08.030.
Aunque es un modelo fácil de realizar, rápido y económico, su uso no se encuentra muy extendido al presentar una alta variabilidad, ya que se produce la rotura del cráneo en fragmentos óseos de diferente tamaño dependiendo del intercambio de energía al que se realiza el experimento. Otra desventaja es la posibilidad de rebote de la pesa una vez impacta por primera vez sobre el cráneo del animal.
Con objeto de optimizar este modelo, varios grupos de investigación están desarrollando una serie de modificaciones con el fin de aumentar la reproducibilidad y conseguir un daño cerebral específico, alcanzándose la posibilidad de modificar la gravedad del TCE que se desarrolla16.
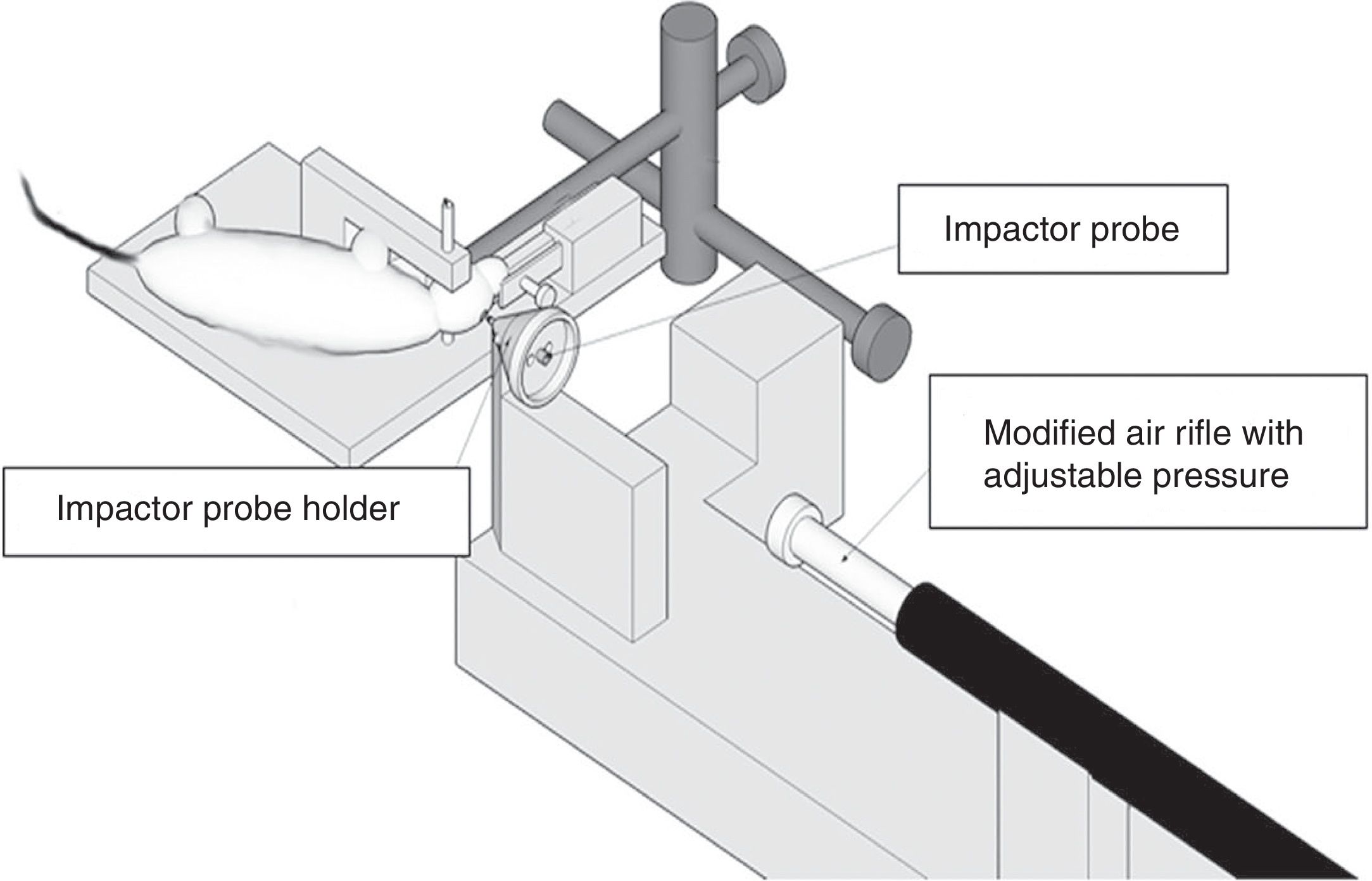
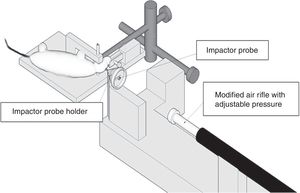
Modelo de impacto cortical controladoEste modelo genera una lesión cerebral traumática experimental de tipo focal. Ha sido probado únicamente en roedores. Para su desarrollo es necesario realizar una craneotomía, de manera que un pistón proyecta aire comprimido sobre el encéfalo13.
El dispositivo consiste en un cilindro neumático conectado generalmente con un sistema de rosca a un impactador de 4-5cm de longitud y 1cm de diámetro (fig. 1C). La intensidad del daño cerebral traumático dependerá principalmente de la velocidad del impactador y de la profundidad de la deformación generada. En la mayoría de los trabajos la velocidad utilizada oscila entre 0,5-1,0m/s y la profundidad de la deformación cortical es modulada mediante una barra que sujeta el sistema de impactación. La duración del impacto suele ajustarse entre 25 y 250ms13.
Las lesiones histológicas originadas principalmente en este modelo tras el impacto mecánico son de tipo focal y afectan a la presión intracraneal comprometiendo la presión de perfusión cerebral17,18. En general, el daño cerebral alcanzado con este modelo se caracteriza por una zona de necrosis focal en la corteza, rodeada de un área de edema cerebral, similar a las contusiones en los pacientes con TCE19. Por otro lado, diferentes estudios han demostrado que tras el impacto cortical controlado se puede provocar en menor medida LAD, a nivel subcortical, cerebelo y mesencéfalo, entre otras20,21.
Existen varias ventajas de este modelo. En primer lugar, es posible controlar de una manera eficiente las diferentes variables de tipo mecánico que se desarrollan, de modo que permite una cuantificación más precisa del daño producido sobre el encéfalo.
En segundo lugar, este modelo permite evaluar los efectos producidos por el edema cerebral postraumático, así como el papel de la BHE. Concretamente, mediante este modelo, el grupo de Kiening et al. describieron el papel de la acuaporina-4 (AQP4) en el desarrollo del edema cerebral22. En tercer lugar, su capacidad para estudiar la integridad de la BHE tras el TCE permite explorar diferentes tratamientos farmacológicos que puedan atravesar la BHE. De esta manera se garantiza alcanzar de manera segura las rutas de señalización activadas tras el TCE, tal y como sucede con la melatonina o un mimético de la ApoE23-25. En cuarto lugar, la menor mortalidad de este modelo, al no lesionarse el tronco cerebral, permite conocer a medio plazo los cambios celulares que se producen en el TCE a nivel molecular y genético26-28. La utilización de técnicas de microarray permite analizar alteraciones en un gran número de genes tras aplicar el modelo de impacto cortical controlado. Concretamente se han descrito secuencias de genes relacionados con procesos inflamatorios (IL1α, IL1β y COX2, entre otros), con funciones en el citoesqueleto (sinaptotagmina 4, MAP2, GFAP, nestina y vimentina, entre otros), transducción de señales (ERK y MAPK, entre otros), de regulación del ciclo celular (como las ciclinas)26, así como genes que regulan las rutas de señalización por calcio (proteína kinasa C beta y proteína kinasa 1β calcio/calmodulina dependiente)28. Este modelo también ha sido utilizado para el estudio de cambios fisiopatológicos en relación con el receptor GABAA en cultivos de células granulosas dentadas27. Por último, desde un punto de vista clínico, se ha evaluado el papel de las contusiones cerebrales de repetición, frecuentemente asociadas a determinados deportes de contacto (boxeo, rugby, etc.), permitiendo estudiar a nivel experimental la ansiedad y los problemas motores derivados, así como caracterizar a la corticosterona como posible biomarcador de estas lesiones29.
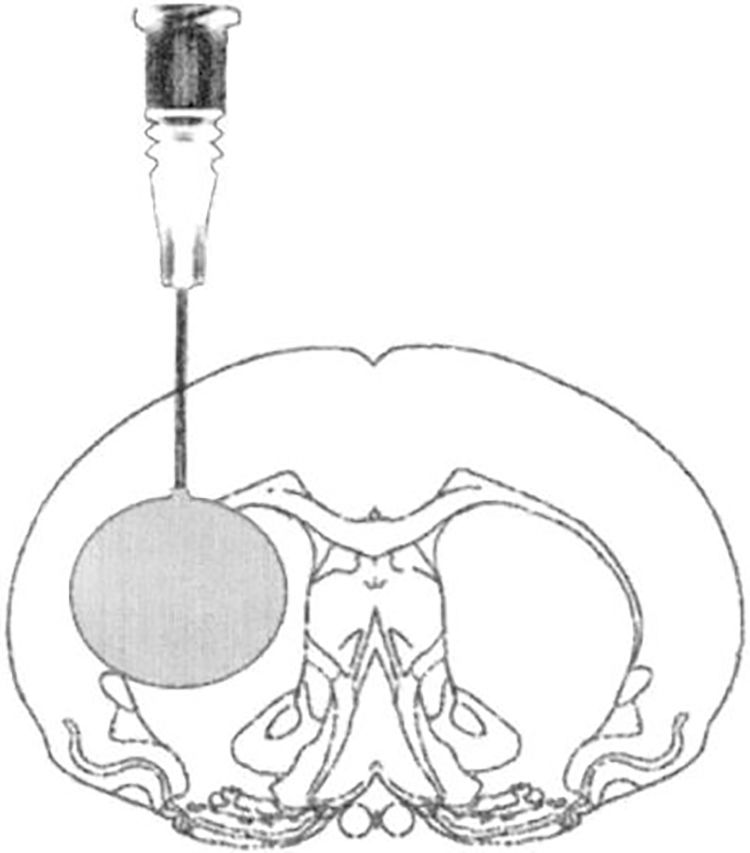
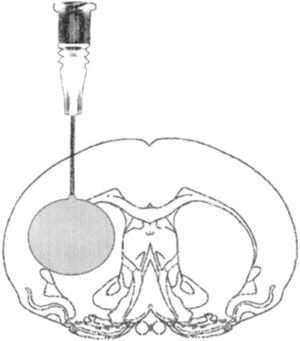
Modelo de lesión focal por inflado de balónEste modelo genera hipertensión intracraneal transitoria, reproduciendo el efecto de compresión generado por una lesión focal ocupante de espacio (LOE) en el encéfalo y el desarrollo posterior de edema tras la evacuación quirúrgica del mismo. En este modelo se realiza un pequeño trépano a través del cual se aloja una sonda elástica en el espacio epidural, y una vez dentro se infla dicha sonda a modo de globo, produciendo el efecto de una LOE30-33 (fig. 2).
Modelo de hipertensión intracraneal mediante lesión ocupante de espacio en rata tras craneotomía.
Fuente: Lopez-Valdes et al.33.
Las LOE traumáticas son responsables de la hipertensión intracraneal en un 30-50% de los TCE30. Dicho incremento sostenido de la presión intracraneal se reconoce como uno de los principales mecanismos que ensombrecen el pronóstico de los pacientes con TCE y, al igual que sucede en el modelo de impacto cortical controlado, existe una pérdida en la integridad de la BHE que conlleva la formación de edema cerebral.
Este modelo es altamente reproducible, económico y de fácil metodología, ya que las variables de volumen y de tiempo de llenado/evacuación del balón son fácilmente controlables. Sin embargo, es conocido que la lesión cerebral traumática grave no suele ser única, máxime ante la presencia de una LOE de alto volumen, hecho que dificulta la extrapolación de estos resultados a la clínica30-33.
Modelos de lesión difusaModelo de aceleración-desaceleraciónEn muchas ocasiones las lesiones producidas por un TCE vienen determinadas por una aceleración rápida de la región craneoencefálica, sin que exista un impacto directo por un objeto. La oscilación y rotación del cerebro dentro del cráneo genera una deformación del mismo, hecho que se traduce en LAD. El movimiento empleado es de tipo rotacional, creándose primero una aceleración prolongada seguida de una deceleración brusca en un corto periodo de tiempo, por lo que se habla de «aceleración-desaceleración» a nivel cerebral.
Este tipo de intercambio indirecto de energía ha sido recreado en distintos modelos animales de TCE, tales como cerdos, ovejas y primates7,34. Varios estudios en cerdos de estatura pequeña de la raza Hanford han demostrado que una aceleración rotacional de la cabeza produce una LAD, pudiéndose ver afectado el tallo troncoencefálico, e incluso se ha constatado la inducción del coma al afectarse el sistema reticular ascendente35,36.
En general estos modelos han demostrado reproducir con efectividad los mecanismos fisiopatológicos que suceden en los pacientes que presentan una LAD tras el TCE. Sin embargo, tienen como principal desventaja su elevado coste, dado que al utilizar animales grandes los requerimientos técnicos y las instalaciones son muy sofisticadas. Por último, es preciso subrayar que, debido a la diferente masa cerebral interespecies, la extrapolación de los resultados obtenidos en cada trabajo depende del tipo de animal utilizado, así como también se hace patente la dificultad de traslación de estos hallazgos a la práctica clínica diaria.
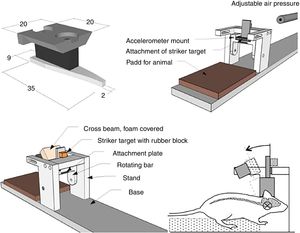
Modelo MarmarouEl modelo desarrollado por Marmarou et al. es uno de los más utilizados en roedores, debido a su bajo coste y a su alta reproducibilidad37. Es un modelo de impacto-aceleración por caída libre de un peso sobre el cráneo. Tal y como se muestra en la figura 1B, el animal se coloca sobre una superficie de gomaespuma, se expone el cráneo del roedor y se fija un disco metálico al mismo, el cual permitirá que la energía del impacto se distribuya de manera homogénea, disminuyendo así la posibilidad de fractura craneal y la génesis de lesiones focales. El grado de lesión cerebral se encuentra íntimamente relacionado con el tamaño de la pesa seleccionado y la altura desde la que se deja caer.
Una de las grandes ventajas de este modelo es que consigue simular la LAD traumática y el desarrollo posterior de edema cerebral13,38. El proceso de swelling está asociado con una rotura de la BHE que conlleva una respuesta neuroinflamatoria dentro del compartimento intracraneal39. Por ello, este modelo sirve para estudiar la integridad y la funcionalidad de la BHE, así como para valorar posibles moléculas o tratamientos dirigidos a mejorar los resultados funcionales tras el TCE40. En definitiva, el modelo del grupo de Marmarou simula de una manera apropiada el TCE resultante en los accidentes de tráfico, y además ha demostrado su utilidad para estudiar el TCE por repetición38,41.
Las desventajas de este modelo están relacionadas principalmente con la limitación del investigador para controlar las fuerzas biomecánicas del impacto, pudiéndose producir un efecto de rebote de la pesa sobre el cráneo, generando lesiones no controladas tras el primer intercambio de energía.
Modelos de lesión mixtaModelo de percusión por fluidoEste modelo se diseñó inicialmente para mimetizar la lesión cerebral focal. Pero a pesar de que la mecánica teórica del mismo se orienta a la génesis de un daño focal, en algunos casos, la energía liberada en el impacto puede producir LAD, por lo que se considera un modelo de daño cerebral traumático mixto42-44.
Para la realización de este modelo, previamente debe llevarse a cabo una craneotomía, de manera que el intercambio de energía viene dado por la aplicación de presión por medio de un fluido directamente sobre la duramadre del animal de experimentación. Para ejercer esta presión se emplea un péndulo unido a un pistón, el cual mueve una determinada masa de líquido, originando la presión prefijada en el experimento (fig. 1D). Este impacto produce desplazamiento y daño por deformación del tejido neuronal. A su vez, la magnitud del daño dependerá de la cantidad de líquido utilizado13,45.
En los primeros modelos el impacto se desarrollaba a nivel de la línea media del cerebro46. Posteriormente, otros grupos comenzaron a realizar la lesión en uno de los dos hemisferios cerebrales, denominándose «modelo de percusión lateral por fluido». Se ha demostrado que la lateralización del daño permite investigar y comparar la extensión de la lesión en ambos hemisferios por separado. Además, pequeñas variaciones en la posición de la craneotomía pueden causar diferencias significativas en la gravedad del daño cerebral47. El modelo de percusión lateral por fluido produce una contusión cortical focal y un daño subcortical difuso. Hicks et al. demostraron con este modelo la persistencia de una serie de cascadas degenerativas tras el TCE en zonas vulnerables del cerebro, tales como el tálamo, el hipocampo ipsilateral, el septum medio, estriado y la amígdala48.
Las manifestaciones histológicas obtenidas con el modelo de percusión por fluido son múltiples, siendo capaz de reproducir la generación de hemorragia intracerebral, swelling, y daño progresivo de la sustancia gris, afecciones propias del daño cerebral traumático en humanos49. Además, en este modelo se ha detectado un aumento de la presión arterial y un aumento de la presión intracraneal. Aunque en principio este modelo pretende simular una lesión de tipo focal, como se ha comentado con anterioridad, es conocido que produce una lesión de tipo mixta, pues desencadena procesos como LAD, neuroinflamación y edema en el parénquima cerebral50,51. Este modelo ha sido empleado en estudios de memoria, déficits cognitivos y de aprendizaje y déficit de comportamiento a nivel experimental50-54.
El modelo de percusión por fluido posee una serie de ventajas, como son su bajo coste, la recreación de una contusión cerebral similar a la que sucede en seres humanos, así como una alta reproducibilidad. Pero a pesar de ser un modelo que se emplea con relativa frecuencia, la principal desventaja es la dificultad de mantener un adecuado control de la calibración y del mantenimiento del sistema de percusión, al poder generarse posibles burbujas de aire en el líquido. Este hecho puede conllevar una cierta variabilidad en el grado de la lesión alcanzada. Por otro lado, este modelo no excluye un daño múltiple, pudiendo afectar, entre otras áreas, al troncoencéfalo45,46.
Modelo tipo blast (modelo explosivo)En este modelo se simula un TCE secundario a la detonación de un explosivo. Los daños cerebrales ocasionados en este tipo de traumas son múltiples y variados. Las explosiones pueden asociar múltiples elementos inertes que son despedidos e impactan a modo de proyectiles en el cráneo, o bien el daño cerebral se produce por la propia onda expansiva tras la detonación. Por ello, a la hora de diseñar modelos experimentales tipo blast, es necesario que sean reproducibles y que contemplen dichos aspectos de manera independiente o simultánea. En los modelos experimentales tipo blast las lesiones en el TCE son tanto focales como difusas, presentándose un daño de tipo mixto55.
Dentro de los múltiples modelos tipo blast, uno de los más utilizados es el modelo de daño cerebral por penetración balística. Este modelo es diseñado con el fin de simular el daño producido por un proyectil u objeto en el cerebro55-57 (fig. 3). También existen otros modelos tipo blast en los que se combinan específicamente un daño de LAD y el desarrollo de contusiones cerebrales55,57 (fig. 4).
Modelo de simulación de impacto por un proyectil.
Fuente: Risling y Davidsson55.
Modelo blast tipo mixto.
Fuente: Risling y Davidsson55.
En otra versión del modelo tipo blast, el daño es producido por medio de las ondas liberadas a través de la detonación de un explosivo. Para ello, se emplea un cilindro metálico, el cual presenta uno de los extremos cerrados y está en contacto con la detonación. En el otro lado del tubo se coloca al roedor anestesiado introducido en un compartimento que impide cualquier tipo de movimiento una vez se produzca la detonación. Para la detonación se puede emplear un explosivo plástico o aire comprimido58,59. Se han reconocido distintos tipos de fenómenos histológicos tras este tipo de lesión, entre los que se incluyen la LAD, el daño en la sustancia blanca, la neurodegeneración y la activación de la glía60.
Los modelos de lesión cerebral tipo blast generalmente poseen una alta reproducibilidad y gracias a ellos se pueden estudiar múltiples respuestas tras el TCE, como son la respuesta inflamatoria secundaria, contusiones o lesiones axonales55,57,58. Dependiendo del modelo a utilizar, el mayor inconveniente es que suelen requerir un alto gasto económico y, según el caso, presentan una complejidad elevada por el tipo de materiales necesarios para su desarrollo.
Modelos animales combinadosEs frecuente que, en la patología y desarrollo del TCE, determinados fenómenos como la hipoxia, la isquemia, la hipotensión y la hipovolemia estén presentes de forma combinada y contribuyan al desarrollo de la lesión cerebral secundaria. La combinación de un TCE con una de estas situaciones supone un agravante que empeora la evolución del paciente y aumenta su morbimortalidad61. Para entender y valorar las consecuencias en este contexto se han desarrollado estos tipos de modelos animales, con el fin de evaluar situaciones más complejas y reales, de manera que se puedan ensayar terapias más efectivas que mejoren el pronóstico de los pacientes62.
Algunos de los modelos más empleados son los que evalúan la hipoxia y la hipotensión. Para ello, en el caso de la hipoxia, los animales se someten a unas condiciones de baja oxigenación (PO2 de 30-40mmHg). En los modelos de TCE realizados en condiciones de hipotensión, se induce una hemorragia o se administran fármacos para disminuir la presión arterial a valores de 30 y 50mmHg62. Otra metodología muy empleada consiste en la oclusión de la carótida, produciendo de esta forma isquemia cerebral simulando una hipotensión arterial grave. Este tipo de intervenciones han sido combinadas con modelos de TCE de impacto cortical controlado63.
Además de los modelos ya nombrados, existen otros modelos mixtos relacionados con procesos de hipertermia, hiperglucemia, hiponatremia e incluso modelos que simulan un politrauma62.
Modelos in vitro para el estudio del traumatismo craneoencefálicoEstos modelos constituyen una herramienta para intentar comprender los mecanismos implicados en el TCE a nivel tisular una vez se produce la lesión. El objetivo de los ensayos in vitro es simular, en la medida de lo posible, la fisiopatología del TCE a través de experimentos que nos permitan obtener un control de los parámetros físicos y ambientales, pudiendo de esta forma estudiar la respuesta de una región concreta del cerebro a un daño único o combinado. No solo se basa en las lesiones agudas acontecidas en un determinado momento, sino que se estudia la progresión de la lesión desde el momento del inicio hasta días después, para así poder obtener una mayor información cronopatológica y poder averiguar el momento idóneo para administrar un determinado tratamiento. Por ello, se estudian distintos mecanismos, como son las tasas apoptóticas, las cascadas de señalización celular, entre otras64,65.
Dentro de los modelos in vitro existe la posibilidad de trabajar con tejido cerebral completo o con células disociadas. Las ventajas del uso de tejido cerebral son numerosas, ya que se preserva una estructura anatómica formada por una población celular heterogénea. Los resultados son extrapolables a los TCE en humanos de una manera más directa. Sin embargo, existen limitaciones al carecer de sistema circulatorio y de una respuesta inflamatoria con señales de activación tales como las mediadas por citoquinas. Una limitación técnica es que en estos experimentos se debe tener en cuenta el daño producido al tejido a la hora de su extracción y durante su manipulación. Otra limitación incluye el corto periodo de tiempo en el que se deben realizar estos ensayos, siendo la viabilidad del tejido de unas 8h aproximadamente66. En los ensayos in vitro con células disociadas, en lugar de utilizar una sección de tejido cerebral de un animal se utilizan células obtenidas mediante disociación tras realizar procesos mecánicos y enzimáticos en tejidos extraídos del cerebro, proporcionando grupos celulares específicos como neuronas corticales67 o astrocitos y neuronas; de esta forma podemos evaluar la respuesta individual de cada subtipo celular68.
Modelo in vitro de traumatismo craneoencefálico por medio de un daño mecánico directoEn este modelo se estudia el daño traumático producido sobre el parénquima cerebral tras el impacto y la penetración de un objeto. Se puede realizar directamente sobre el tejido cerebral o en cultivos celulares aislados. El daño se genera mediante una aguja, cuchilla u otro objeto punzante, produciéndose una axotomía primaria y pérdida celular por daño directo. Una vez producida la lesión en un área concreta se produce la activación de una serie de rutas metabólicas, de las que destacan las rutas apoptóticas dependientes de caspasa-3 y las rutas de proliferación dependientes del factor de crecimiento epidérmico64,65. Se ha evaluado este modelo con fines terapéuticos probando diferentes péptidos con posible capacidad neuroprotectora69.
Una limitación de este modelo es que los parámetros mecánicos para su ejecución no se encuentran bien definidos, de modo que la gravedad del mismo es heterogénea, y se cuantifica por el número de células afectadas. Además, clínicamente este tipo de daño es relevante en tan solo un pequeño porcentaje de pacientes tras el traumatismo70.
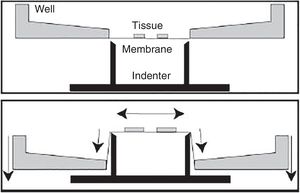
Modelo in vitro de traumatismo craneoencefálico por compresiónEste modelo representa el cuadro clínico del TCE producido en el modelo de experimentación animal de caída de peso sobre el cráneo15. Para ello, se aplican unas presiones determinadas a un cultivo celular o de tejido, generándose un daño en la zona impactada que se expande a regiones periféricas71. Una desventaja de este modelo es la dificultad de medir el grado de deformación del tejido.
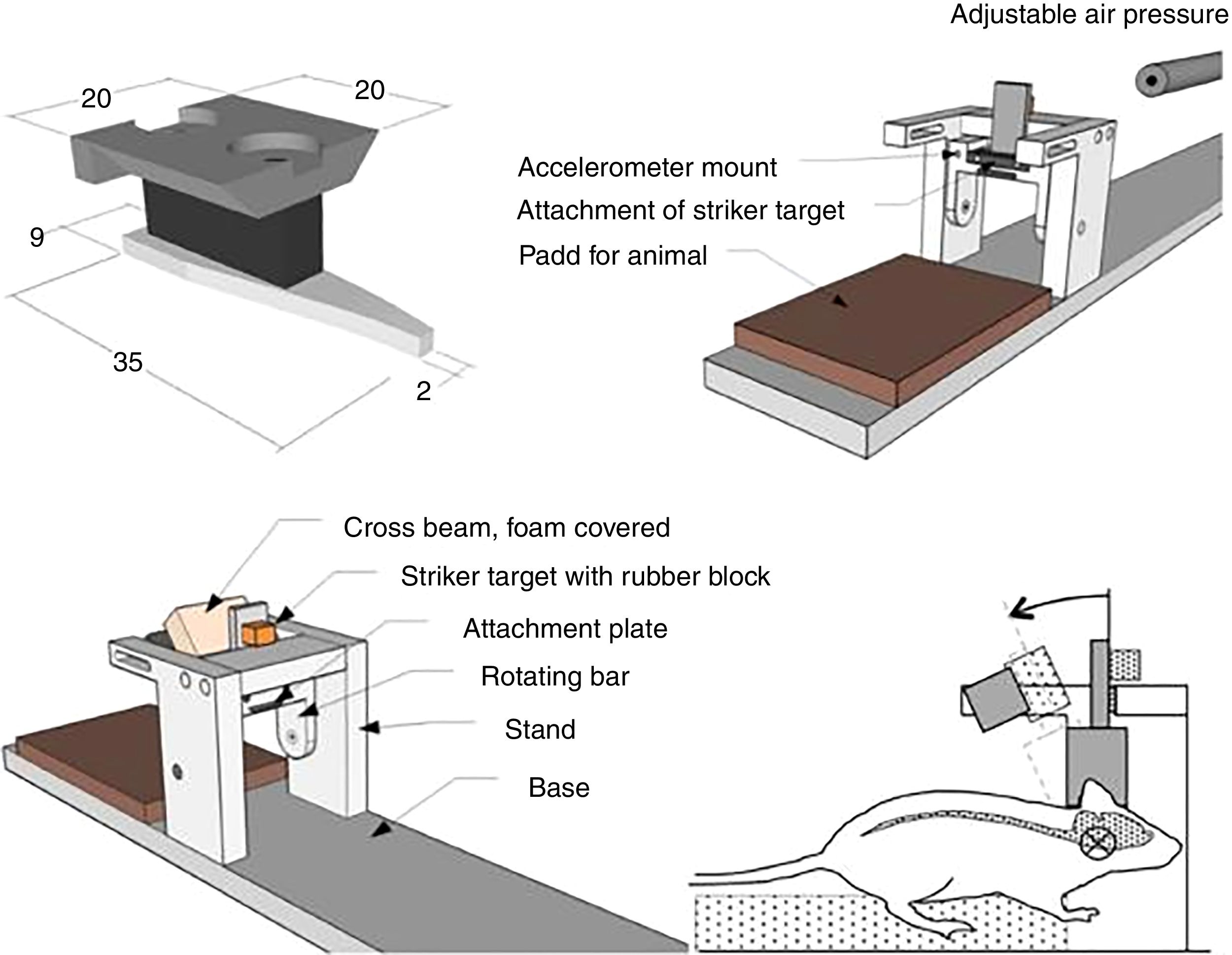
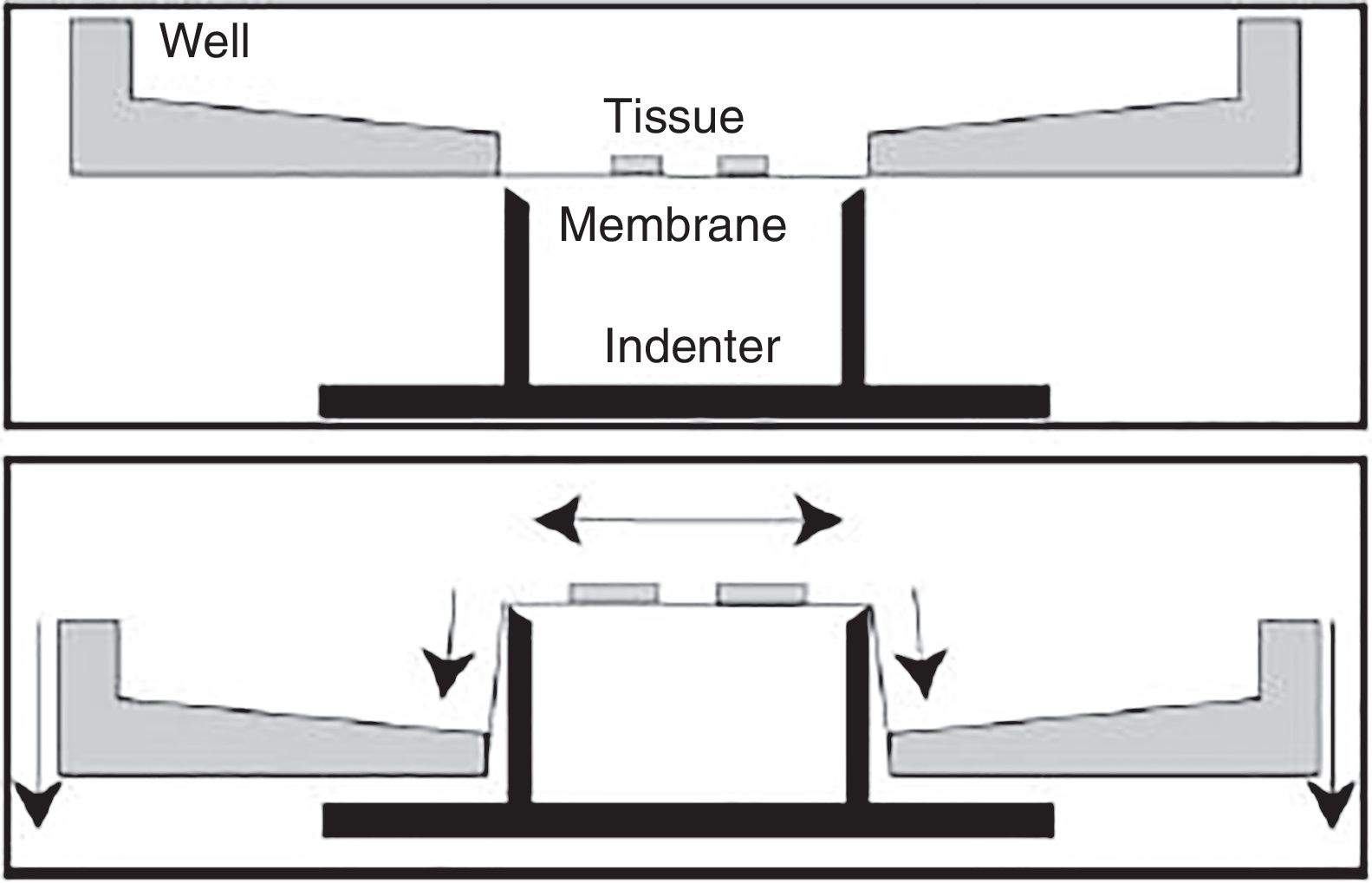
Modelo in vitro de traumatismo craneoencefálico por estiramientoDentro de los diferentes modelos in vitro, este es el más empleado para estudiar la lesión cerebral traumática. Fue diseñado con el fin de reproducir el proceso de deformación del parénquima cerebral, al ser esta una de las lesiones más frecuentes en el TCE.
Desde finales de la década de los noventa se han desarrollado diferentes modelos, utilizando aire comprimido o incluso procesos de aspiración72,73. No obstante, los inconvenientes que presentan son la alta variabilidad y la heterogeneidad de los resultados, así como la dificultad de medir la magnitud de la deformación en el experimento. Posteriormente, se han desarrollado otros modelos de estiramiento que son mucho más eficaces y poseen una gran reproducibilidad74. Estos últimos se realizan aplicando una fuerza opuesta desde diferentes puntos (fig. 5). En estos casos existe la posibilidad de controlar los parámetros mecánicos por medio de aplicaciones informáticas, al mismo tiempo que se emplean técnicas de microscopia, lo que resulta en un mayor control por parte del investigador de las diferentes variables y en una mayor adquisición de resultados74-76.
Modelo in vitro de traumatismo craneoencefálico por estiramiento.
Fuente: Morrison et al.74.
Este modelo posee una alta reproducibilidad, pudiéndose aplicar sobre secciones histológicas muy concretas, como por ejemplo en el hipocampo76-78. Por otra parte, permite ensayar diferentes extractos o fármacos76-78.
Modelo in vitro de traumatismo craneoencefálico por desplazamiento dinámico o por fluidoEn estos modelos in vitro se realizan la deformación de un cultivo celular o de un tejido mediante la presión ejercida por un fluido. Así, se puede deformar con una micropipeta, u orientar la deformación en una dirección mediante el desplazamiento dinámico generado por unos hidrogelificadores en cultivos celulares79,80. Con este modelo se puede estudiar la deformación celular de una manera muy detallada utilizando distintas técnicas de microscopia; entre ellas, la microscopia electrónica de barrido79. Una de las principales ventajas de este modelo es que permite estudiar la respuesta celular en tiempo real.
ConclusionesA pesar de haber sido desarrollados en la década de los setenta y ochenta, varios de los modelos expuestos siguen utilizándose en la actualidad con algunas modificaciones que hacen de ellos modelos más complejos a la vez que más fiables. Cabe señalar que, en la actualidad, debido a la problemática mundial y el auge del terrorismo y conflictos armados, los modelos tipo blast están siendo desarrollados y optimizados por numerosos grupos de investigación, pues aportan información relevante para una mejora en el tratamiento de pacientes que presentan este tipo de TCE.
Los modelos in vitro, por su parte, resultan útiles para estudios de TCE a nivel celular o tisular, pues permiten ahondar desde un enfoque molecular más fácilmente que los modelos in vivo. Los ensayos in vitro permiten también visualizar de manera clara y directa, gracias a técnicas de microscopia, los cambios morfológicos que se producen en el TCE. Con el tiempo, se están desarrollando modelos cada vez más complejos y reales que, incluso en algunos casos, requieren de sistemas de computación. En un futuro próximo, el desarrollo de los nuevos sistemas de edición génica simplificará la obtención de modelos animales transgénicos específicamente diseñados para estos estudios.
En definitiva, los modelos animales para la investigación del TCE son de gran utilidad, debido a que permiten profundizar en el conocimiento de los fenómenos que se suceden tras la lesión cerebral traumática a nivel experimental. Desentrañar las cascadas fisiopatológicas y la ventana temporal de la lesión cerebral secundaria permitiría identificar posibles dianas terapéuticas que mejoren el pronóstico de aquellos individuos que presentan un TCE. Es necesario subrayar que, de otra forma, durante la atención inicial al paciente con TCE, se hace muy complicado conocer en tiempo real este tipo de fenómenos a pie de cama, por la misma naturaleza y peculiaridades clínicas asociadas.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.