La cardioprotección es esencial en la revascularización coronaria quirúrgica. En este estudio exploramos la relación existente entre el tiempo que una masa miocárdica permanece en situación de isquemia y la dosis de cardioplejía utilizada para su preservación, reflejada a través del índice de cardioplejía infundida, con el desarrollo de bajo gasto cardiaco postoperatorio.
DiseñoSe incluyeron todos los pacientes sometidos a revascularización coronaria quirúrgica entre enero de 2013 y diciembre de 2015. El síndrome de bajo gasto cardiaco postoperatorio se definió siguiendo los criterios del documento de consenso de la SEMYCIUC. Se analizaron los factores perioperatorios asociados al síndrome de bajo gasto cardiaco y, mediante la curva ROC, se determinó el punto de corte del índice de cardioplejía infundida para predecir la ausencia del mismo.
ResultadosDe los 360 pacientes incluidos, 116 (32%) presentaron bajo gasto postoperatorio. Los factores de riesgo independientes fueron: clasificación funcional de la New York Heart Association (OR 1,8 [IC 95%=1,18-2,55]), la fracción de eyección del ventrículo izquierdo (OR 0,95 [IC 95%=0,93-0,98]), el empleo de cardioplejía retrógrada (OR 1,2 [IC 95%=1,03-1,50]) y el índice de cardioplejía infundida (OR 0,99 [IC 95%=0,991-0,996]), que mostró un área bajo la curva ROC de 0,77 (0,70-0,83; p<0,001) para la ausencia de síndrome de bajo gasto cardiaco postoperatorio, usando como punto de corte óptimo 23,6ml·min-1(100g/m2 de VI)-1.
ConclusionesEl índice de cardioplejía infundido es inversamente proporcional a los requerimientos postoperatorios de inotropos, pudiendo constituir una estrategia para optimizar la cardioprotección. El volumen total de cardioplejía intermitente debería calcularse, de forma individualizada, en base al índice de masa del ventrículo izquierdo y el tiempo de isquemia.
Strategies for cardio-protection are essential in coronary artery bypass graft surgery. The authors explored the relationship between cardioplegia volume, left ventricular mass index and ischemia time by means of the infused cardioplegia index and its relationship with post-operative low cardiac output syndrome.
DesignAll patients undergoing coronary artery bypass graft surgery between January 2013 and December 2015 were included. Low cardiac output syndrome was defined according to criteria of the SEMICYUC's consensus document. The perioperative factors associated with low cardiac output syndrome were estimated, and using a ROC curve, the optimum cut-off point for the infused cardioplegia index to predict the absence of low cardiac output syndrome was calculated.
ResultsOf 360 patients included, 116 (32%) developed low cardiac output syndrome. The independent risk predictors were: New York Heart Association Functional Classification (OR 1.8 [95% CI=1.18-2.55]), left ventricle ejection fraction (OR 0.95 (95% CI=0.93-0.98]), ICI (OR 0.99 [95% CI=0.991-0.996]) and retrograde cardioplegia (OR 1.2 [95% CI=1.03-1.50]). The infused cardioplegia index showed an area under the ROC curve of 0.77 (0.70-0.83; P<.001) for the absence of postoperative low cardiac output syndrome using the optimum cut-off point of 23.6ml·min-1(100g/m2 of LV)-1.
ConclusionsThe infused cardioplegia index presents an inverse relationship with the development of post-operative low cardiac output syndrome. This index could form part of new strategies aimed at optimising cardio-protection. The total volume of intermittent cardioplegia, especially that of maintenance, should probably be individualised, adjusting for ischemia time and left ventricle mass index.
La disfunción sistólica del ventrículo izquierdo (VI) es un importante factor pronóstico en los pacientes sometidos a cirugía cardiaca1. El aturdimiento miocárdico, causa frecuente de disfunción sistólica postoperatoria, conlleva una disminución de la contractilidad secundaria al daño por isquemia/reperfusión sin llegar a provocar la muerte celular2 y podría contribuir a la aparición de síndrome de bajo gasto cardiaco (SBGC) postoperatorio. A mayor tiempo de isquemia, mayor será el daño molecular y las alteraciones celulares secundarias3. Se estima que entre un 10 y 15% de los pacientes sometidos a cirugía de revascularización coronaria desarrollan disfunción ventricular izquierda4,5.
Durante la cirugía cardiaca es imprescindible la instauración de estrategias de cardioprotección con el fin de minimizar el daño por isquemia/reperfusión. Entre estas estrategias, la cardioplejía constituye la principal medida para la miocardioprotección intraoperatoria. Se han desarrollado diversos métodos para optimizar la cardioplejía que abarcan desde variaciones en su contenido o temperatura hasta el uso de distintas vías y flujos de administración. Sin embargo, en nuestro conocimiento, existe escasa bibliografía sobre su ajuste con relación a otros factores relacionados con la susceptibilidad miocárdica al daño por isquemia/reperfusión, como el grado de afectación isquémica o el aumento de la masa del VI. Este último, asociado con un mayor trabajo miocárdico con el consiguiente aumento de consumo miocárdico de oxígeno, debería tenerse en cuenta a la hora de diseñar estrategias eficaces de cardioprotección.
En este estudio, por medio del índice de cardioplejía infundido (ICI), hemos explorado la relación entre el volumen de cardioplejía, el tiempo de isquemia y la masa ventricular izquierda, con la aparición de daño miocárdico en pacientes sometidos a cirugía de revascularización miocárdica.
Pacientes y métodosEl Comité de Ética del hospital aprobó el estudio.
Diseño del estudio y poblaciónEl estudio se desarrolló en la Unidad de Cuidados Intensivos (UCI) médico-quirúrgica de 24 camas del Hospital Universitario de Canarias. Es un estudio ambispectivo de cohortes en el que se incluyeron todos los pacientes sometidos a cirugía de revascularización coronaria entre enero de 2013 y diciembre de 2015.
Para la definición de SBGC postoperatorio se recurrió a la definición de consenso de la SEMICYUC6, incluyendo a aquellos paciente que, tras optimizar la precarga, presentaran: índice cardiaco (IC) medido<2,2l/min/m2; cuadro clínico compatible con SBGC, en pacientes no monitorizados, con oliguria (diuresis<0,5ml/kg/h), saturación venosa central<60% (con saturación arterial normal) y/o lactato>3mmol/l; aquellos que requirieron inotropos y/o balón de contrapulsación en el postoperatorio inmediato para garantizar una situación hemodinámica adecuada; y por último, aquellos pacientes con criterios de shock cardiogénico (IC<2l/min/m2), con presión arterial sistólica<90mmHg y oliguria.
Recogida de datosSe recogieron de forma prospectiva datos demográficos, comorbilidades, clase funcional, estudio de las principales arterias coronarias afectas, SYNTAX score, fracción de eyección del VI (FEVI), desplazamiento sistólico del anillo tricuspídeo, mediante ecocardiografía y situación crítica preoperatoria definida por la necesidad de ventilación mecánica, soporte inotrópico, asistencia ventricular y/o fracaso renal agudo con diuresis<10ml/h. El riesgo quirúrgico se calculó mediante EuroSCORE7.También se registraron variables quirúrgicas: tiempo de isquemia, tiempo de circulación extracorpórea (CEC), tipo y volumen de cardioplejía (único dato registrado retrospectivamente), revascularización completa o incompleta (en base a los vasos principales); y posquirúrgicas: parámetros hemodinámicos, dosis de aminas, disfunción ventricular derecha (definida como hipocontractilidad objetivada por el cirujano a la salida de bomba), duración de la ventilación mecánica, necesidad de técnicas de reemplazo renal, estancia en UCI, en el hospital y mortalidad a los 30 días.
Se analizaron muestras de sangre en el postoperatorio inmediato, a las 24h del ingreso y cada 24h en aquellos pacientes que lo requirieron. Como marcadores bioquímicos de daño miocárdico se midieron: troponina i, creatincinasa MB, N-terminal propéptido natriurético cerebral, y como marcador sistémico de hipoperfusión se utilizó el lactato. El estudio ecocardiográfico preoperatorio se realizó siguiendo las guías de la Sociedad Americana de Ecocardiografía8 en el laboratorio de ecocardiografía. La masa del VI se calculó mediante la fórmula modificada de Devereux et al.9, se indexó por el área de superficie corporal y la FEVI se estimó mediante el Simpson modificado.
VariablesLa principal variable independiente fue el ICI. Este índice relaciona el total de cardioplejía infundida durante el tiempo de isquemia con el índice de masa del VI (IMVI) (ΣCardioplejía/tiempo de isquemia/IMVI). La principal variable dependiente fue la ausencia de criterios de SBGC postoperatorio.
Protocolos anestésicos y quirúrgicosTodos los pacientes fueron preoxigenados y se realizó la inducción con dosis de propofol de entre 1,5 y1,8mg/kg, entre 0,1 y 0,3mcg/kg/min de remifentanilo y 1mg/kg de rocuronio. Para el mantenimiento anestésico se utilizó sevoflurano 1,5-2vol% y perfusión continua de remifentanilo. El circuito extracorpóreo estaba compuesto por un oxigenador de membrana (Optima XP, Cobe, Denver, Co, USA or Quantum Lifestream International, Inc. Woodlands, TX, EE. UU.), un circuito extracorpóreo Tygon (Dideco, Mirandola, Italia) y una bomba centrifuga Medtronic Biopump (Minneapolis, MN, EE. UU.). Bajo hipotermia de entre 30-32°C, el flujo de la bomba se ajustó para garantizar presiones arteriales medias>60mmHg e IC de 2,2l/min/m2. Todos los pacientes recibieron inicialmente cardioplejía anterógrada mientras que el mantenimiento se hizo mediante cardioplejía anterógrada o retrógrada a criterio del cirujano. Para la parada cardiaca se administraron entre 1.200 y 1.500mL de cardioplejía fría de cristaloides (500ml solución de Ringer, 40mEq KCl, 25mEq HCO3Na, 35mg lidocaína) mediante infusión intermitente con una relación 4:1 con cardioplejía sanguínea. Además, se administraron dosis adicionales de 500ml de suero con 20mEq de KCl cada 20-25min o cuando se estimó necesario.
Análisis estadísticoLas variables continuas se expresan como medias y desviaciones estándar, medianas y percentiles 25-75, usando el estadístico t de Student o el test U de Mann-Whitney de acuerdo a la naturaleza de las variables (determinada por el test de Kolmogorov-Smirnov). La homocedasticidad de las varianzas se testó mediante el test de Levene. Las variables categóricas se presentan como frecuencias y porcentajes, se usó la Chi cuadrado o el test exacto de Fisher para comparar diferencias entre grupos. Las variables asociadas significativamente al síndrome de bajo gasto con una p<0,10 en el análisis univariado (edad, dislipidemia, calcioantagonistas, FEVI, EuroSCORE, NYHA, situación crítica preoperatoria, carácter de la cirugía, grado de revascularización, ICI y cardioplejía retrógrada) se incluyeron en el análisis de regresión logístico con el objeto de identificar predictores independientes de SBGC. El tiempo de CEC, el IMVI indexada y el volumen de cardioplejía total fueron excluidos del análisis de regresión al estar incluidos en el cálculo del ICI con el objeto de evitar colinealidad. Exploramos la asociación entre el ICI y el SBGC estratificando por las 2 covariables de riesgo del modelo final: NYHA (grado i-ii vs. iii-iv) y FEVI (utilizando el punto de corte asociado a la aparición de SBGC: 56%). Las asociaciones entre el ICI, biomarcadores de daño miocárdico y dosis de inotropos se calcularon usando el estadístico Rho de Spearman. El ICI se agrupó en terciles y su asociación con las necesidades de dobutamina se estudió con el test de Kruskal-Wallis. La fiabilidad del ICI para predecir la ausencia de SBGC se verificó mediante el análisis del área bajo la curva ROC; se excluyeron los casos con disfunción severa del ventrículo derecho. Para el punto de corte óptimo se calcularon la precisión general, sensibilidad, especificidad, valores predictivos positivos/negativos y la razón de probabilidad positiva/negativa. El punto de corte óptimo para la ausencia de SBGC se seleccionó mediante el índice J de Youden. Finalmente, un análisis univariado del impacto clínico del SBGC fue llevado a cabo. Se consideró significación estadística una p<0,5 para 2 colas. El análisis estadístico se realizó con el programa IBM SPSS 20.0 (IBM SPSS, Inc., Armonk, NY, EE. UU.).
ResultadosSe incluyeron 362 pacientes con una media de edad de 68±9 años de los que 280 (77,3%) eran hombres. El EuroSCORE medio fue de 9,2±12,5. Variables médico-quirúrgicas: 348 (96,1%) fueron primointervenciones, 225 (62,2%) cirugía electiva, 127 (35,1%) urgente y 10 (2,8%) emergente con un tiempo medio de isquemia de 68±39min y un tiempo de CEC de 114±78 min. Nueve (2,5%) pacientes estaban en situación crítica preoperatoria. Dos (0,5%) de 12 (3%) murieron en quirófano por lo que no se incluyeron en el análisis.
Ciento dieciséis (32%) pacientes cumplieron criterios de SBGC postoperatorio. En la tabla 1 se describen las variables demográficas y preoperatorias en relación con la presencia de SBGC. Las variables que se asociaron de forma significativa al desarrollo de SBGC fueron: un menor uso de beta-bloqueo preoperatorio, edad avanzada, mayor IMVI, mayor EuroSCORE, peor clase funcional de la NYHA, situación crítica preoperatoria, intervención no electiva, mayores tiempos de isquemia o de CEC, menor ICI, mayor proporción de cardioplejía retrógada con respecto al total de la cardioplejía infundida, todas ellas con un valor p<0,01).
Características preoperatorias de pacientes con o sin SBGC
| No SBGC(n=244) | SBGC(n=116) | p | |
|---|---|---|---|
| Sexo, n (% de hombres) | 192 (78,7) | 87(75) | 0,43 |
| Edad (años)* | 67 (10) | 70 (9) | 0,02 |
| Betabloqueantes, n (%) | 189 (77,5) | 71 (61,2) | <0,01 |
| Dislipidemia (%) | 197 (80,7) | 83 (71,6) | 0,05 |
| Diabetes, n (%) | 133 (54,5) | 65 (56) | 0,78 |
| Hipertensión, n (%) | 185 (75,8) | 89 (76,7) | 0,85 |
| Insuficiencia renal, n (%) | 37 (15,2) | 24 (20,7) | 0,19 |
| IAM previo, n (%) | 47 (19,3) | 23 (19,8) | 0,19 |
| IECA, n (%) | 86 (35,2) | 32 (27,5) | 0,82 |
| ARA-II, n (%) | 41 (16,8) | 16 (13,8) | 0,75 |
| Calcioantagonistas, n (%) | 39 (15,9) | 8 (6,9) | 0,10 |
| Alteraciones segmentarias, n (%) | 126(51,6) | 70(60,3) | 0,11 |
| FEVI, %* | 62 (11) | 53 (16) | <0,01 |
| IMVI, g·m-2* | 128 (45) | 138 (44) | <0,01 |
| EuroSCORE, %* | 6,5 (8) | 15 (17,6) | <0,01 |
| NYHA, n (%) | <0,001 | ||
| I | 76 (31,1) | 20 (17,2) | |
| II | 93 (38,1) | 30 (25,8) | |
| III | 60 (24,6) | 41 (35,3) | |
| IV | 15 (6,1) | 25 (21,6) | |
| Estado crítico preoperatorio, n (%) | 0 (0) | 9 (7,8) | <0,01 |
| SYNTAX score, n (%) | 0,86 | ||
| Bajo:≤22 | 93 (38,1) | 44 (37,9) | |
| Intermedio: 23-32 | 108 (44,3) | 49 (42,2) | |
| Alto≥33 | 43 (17,6) | 23 (19,8) | |
| Carácter de la cirugía, n (%) | <0,01 | ||
| Electiva | 166 (68) | 58 (50) | |
| Urgente | 77 (31,6) | 49 (42,2) | |
| Emergente | 1 (0,4) | 9 (7,8) | |
| Pinzamiento aórtico, min* | 62 (32) | 80 (48) | <0,01 |
| Circulación extracorpórea, min* | 103 (78) | 132 (65) | <0,01 |
| Cardioplejía total, ml* | 2.106 (739) | 2.339 (1.157) | 0,05 |
| Cardioplejía inicial, ml* | 1.324 (286) | 1.248 (456) | 0,97 |
| ICI (ml·min-1·g-1·m-2)* | 0,327(0,16) | 0,216(0,11) | <0,01 |
| Cardioplejía anterógrada, n (%) | 178 (73) | 63 (54) | <0,001 |
| Cardioplejía mixtaan (%) | 58 (24) | 41 (35) | 0,023 |
| Cardioplejía retrógrada, ml* | 288 (588) | 514 (844) | <0,01 |
| Cardioplejía retrógrada (%) | 11 (21) | 18 (25) | <0,01 |
ARA-II: antagonistas receptores angiotensina tipo ii; FEVI: fracción de eyección ventrículo izquierdo; IAM: infarto agudo de miocardio; ICI: índice de cardioplejía infundido; IECA: inhibidores enzima convertidora de angiotensina; IMV: índice de masa del ventrículo izquierdo; NYHA: New York Heart Association; SBGC: síndrome de bajo gasto cardiaco.
a Cardioplejía mixta: anterógrada y retrógrada.
bValores expresados como medias y percentiles 25 y 75.
En el modelo final de regresión logística, la clase funcional de la NYHA y la cardioplejía retrógrada fueron identificadas como factores de riesgo independientes, mientras que la FEVI y el ICI aparecieron como factores protectores (tabla 2). No se encontraron interacciones de primer orden.
Modelo de regresión
| OR | IC 95% IC | p | |
|---|---|---|---|
| Clase de la NYHA | 1,8 | 1,18-2,55 | 0,005 |
| FEVI | 0,95 | 0,93-0,98 | <0,001 |
| ICI | 0,99 | 0,991-0,996 | <0,001 |
| Cardioplejía retrógrada | 1,2 | 1,03-1,50 | 0,021 |
FEVI: fracción de eyección del ventrículo izquierdo; IC: intervalo de confianza; ICI: índice de cardioplejía infundida; NYHA: New York Heart Association; OR: odds ratio.
Tras estratificar por NYHA observamos que en los pacientes con un NYHA I-II un menor ICI de 20,7 (18,4-28,8) vs. 32 (24-42,5)ml/min-1 (100g/m2 de VI)-1 se asoció con la aparición de SBGC (p<0,001). De modo similar, en los pacientes con clase funcional NYHA III-IV, un menor ICI de 20,4 (14,6-25,8) vs. 27,6 (21,9-33,3)ml/min-1 (100g/m2 de VI)-1 se asoció con SBGC (p<0,001). Por otro lado, en los pacientes con FEVI>56%, un menor ICI de 21,6 (18,3-26,4) vs. 31,5 (22,9-41,9)ml/min-1 (100g/m2 de VI)-1 se asoció con SBGC (p<0,001). En aquellos pacientes con una FEVI<56%, un menor ICI de 19,5 (13,9-28,1) vs. 29,4 (25,2-39,5)ml/min-1 (100g/m2 de VI)-1 se asoció con SBGC postoperatorio (p<0,001).
El ICI se asoció de forma directa con el IC a las 24h (p<0,01) y de forma inversa con las dosis de dobutamina al término de la cirugía (p<0,001), dosis acumulada total (p<0,001) y dosis máxima de dobutamina (p<0,001), a la dosis acumulada total de levosimendan (p<0,001) y a los niveles de lactato a las 24h (p0,02). También se asoció inversamente con los marcadores bioquímicos de daño miocárdico, tanto al ingreso en UCI, como sus picos máximos postoperatorios: troponina i (p<0,001 respectivamente) y creatincinasa MB (p<0,001 respectivamente); y con el Nt-ProBNP a las 24h (p<0,001) y su pico postoperatorio (p<0,01) (tabla 3).
Correlaciones entre el ICI con parámetros hemodinámicos y marcadores bioquímicos de lesión miocárdica
| Rho | p | |
|---|---|---|
| Índice cardiaco 24h | 0,207 | <0,01 |
| Dobutamina al final de la cirugía (mcg/kg/min) | −0,38 | <0,001 |
| Dosis acumulada total de dobutamina (mcg) | −0,43 | <0,01 |
| Dosis máxima de dobutamina (mcg/kg/min) | −0,40 | <0,001 |
| Dosis acumulada total de levosimendan (mcg) | −0,25 | <0,001 |
| Ácido láctico 24h (mmol/l) | −0,17 | 0,02 |
| Troponina I a la llegada de quirófano (ng/ml) | −0,28 | <0,001 |
| Troponina I pico máximo (ng/ml) | −0,28 | <0,001 |
| CK-MB a la llegada de quirófano (U/l) | −0,28 | <0,001 |
| CK-MB máxima (U/l) | −0,26 | <0,001 |
| Nt-ProBNP a las 24h (pg/ml) | −0,31 | <0,001 |
| Nt-ProBNP pico máximo (pg/ml) | −0,32 | <0,01 |
a ICI: índice de cardioplejía infundido; CK-MB: creatincinasa-MB; Nt-ProBNP: N-terminal péptido natriurético cerebral.
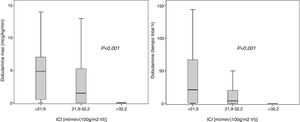
El tercil superior de ICI [ml min-1 (100g/m2 de VI)-1] se asoció con dosis más bajas de dobutamina (dosis máxima y tiempo de administración): dosis máxima de dobutamina (mcg/kg/min), ICI<21,9: 4,85 (0,5-7,1); ICI 21,9-32,2: 1,44 (0-5,3) e ICI>32: 0 (0-0); tiempo de dobutamina (horas): ICI<21,9: 21 (0,5-67); ICI 21,9-32,2: 4 (0-20) e ICI>32: 0 (0-0); p<0,001, respectivamente (fig. 1).
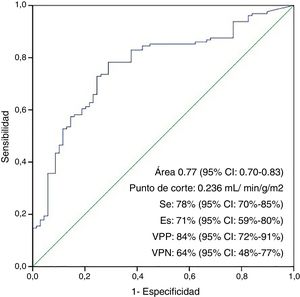
El área bajo la curva ROC para la no aparición de SBGC en función de la dosis de cardioplejía por unidad de masa y tiempo de isquemia (ICI) fue de 0,77 (IC 95%: 0,70-0,83; p<0,001), con un punto de corte óptimo de 23,6ml/min-1(100g/m2 de VI)-1, con una sensibilidad del 78%, una especificidad del 71%, un valor predictivo positivo del 84%, un valor predictivo negativo del 64%, una razón de probabilidad positiva de 2,7 y razón de probabilidad negativa de 3,27 (fig. 2).
Los pacientes con SBGC postoperatorio mantuvieron esta situación clínica una mediana de 27 (20-139)h, requiriendo una mediana de dosis máxima de dobutamina 9,5 (8-16)mcg/kg/min. Estos pacientes presentaron valores significativamente más altos de marcadores bioquímicos de daño miocárdico y de hipoperfusión, tanto en el período postoperatorio inmediato como después de 24h; así como niveles más altos de N-terminal propéptido natriurético cerebral después de 24h. Nueve pacientes desarrollaron disfunción ventricular derecha, falleciendo 2 de ellos. También requirieron más tiempo de ventilación mecánica, mostraron mayor incidencia de fracaso renal agudo con necesidad de técnicas de reemplazo renal, tuvieron estancias en UCI e intrahospitalarias más prolongadas y mayor mortalidad, siendo todas ellas diferencias estadísticamente significativas (p<0,001) (tabla 4).
Variables postoperatorias en pacientes con y sin SBGC
| No SBGC(n=244) | SBGC(n=116) | p | |
|---|---|---|---|
| PAm 0h (mmHg) (DE) | 87 (16) | 85 (16) | 0,60 |
| PAm 4h (mmHg) (DE) | 79 (12) | 72 (10) | 0,001 |
| PAm 24h (mmHg) (DE) | 78 (13) | 74 (12) | 0,09 |
| IC 0h (l/min/m2)b | 2,6 (2,4-3,4) | 2,3 (1,9-2,8) | <0,001 |
| IC 4h (l/min/m2)b | 2,5 (2,1-3,1) | 2,3 (2,3-2,4) | <0,001 |
| IC 24h (l/min/m2)b | 3 (2,5-3,4) | 2,7 (2,3-3) | 0,02 |
| TAPSE | 24±7 | 22±9 | 0,69 |
| Dobutamina (dosis máxima/mcg)b | 0 (0-0) | 9,5 (8-16) | <0,001 |
| Dobutamina (horas totales)b | 0 (0-0) | 27 (20-139) | <0,001 |
| Noradrenalina (dosis máxima/mcg)b | 0 (0-0) | 0,41 (0,07-0,98) | <0,001 |
| Noradrenalina (horas totales)b | 0 (0-0) | 45 (1-100) | <0,001 |
| Troponina I llegada UCI, ng/mlb | 1,5 (0,9-2,6) | 4,2 (3-10,6) | <0,001 |
| Troponina I 4ha, ng/mlb | 3,5 (2-4,5) | 6,4 (4-11,6) | <0,001 |
| Troponina I 24h, ng/mlb | 2 (1,2-3) | 8,5 (5,5-11) | <0,001 |
| Láctico llegada UCI, mmol/lb | 1,9 (1,5-2,4) | 2,1 (1,8-3,6) | 0,01 |
| Láctico 4h, mmol/lb | 1,5 (1,3-2,6) | 2,5 (1,8-3,8) | 0,005 |
| Láctico 24h, mmol/lb | 1,4 (1-2) | 1,8 (1,6-2) | <0,001 |
| CK-MB llegada UCI, IU/lb | 42 (32-49) | 80 (51-108) | <0,001 |
| CK-MB 4h, IU/lb | 37 (29-50) | 83 (55-136) | <0,001 |
| CK-MB 24h, IU/lb | 24 (21-43) | 63 (51-153) | <0,001 |
| NT-ProBNP 4h, pg/mLb | 686(368-1740) | 2475(115-11455) | <0,001 |
| NT-ProBNP 24h, pg/mlb | 1.960 (1.090-3.140) | 4.125(2.760-8.860) | <0,001 |
| Ventilación mecánica (horas)b | 3 (1,7-5) | 16 (5-87) | <0,001 |
| Terapias sustitución renal n (%) | 1 (0,4) | 20 (18) | <0,001 |
| Estancia UCI (días)b | 2 (1-3) | 5 (2-11) | <0,001 |
| Estancia hospital (días)b | 12 (8-21) | 20 (11-32) | <0,001 |
| Mortalidad (%) | 1 (0,4) | 9 (7,7) | <0,001 |
CK-MB: creatincinasa-MB; DE: desviación estándar; IC: índice cardiaco; NT-ProBNP: N-terminal péptido natriurético cerebral; PAm: presión arterial media; SBGC: síndrome de bajo gasto cardiaco; TAPSE: desplazamiento sistólico del anillo tricuspídeo; UCI: unidad de cuidados intensivos.
El objetivo de nuestro estudio fue identificar un parámetro que permita el ajuste de la dosis de cardioplejía según el IMVI, creando así una herramienta, el ICI, que podría ser útil para optimizar la preservación miocárdica durante la cirugía, reduciendo el daño miocárdico postisquémico y el desarrollo de SBGC postoperatorio.
El aturdimiento miocárdico se define como una disfunción ventricular postisquémica que persiste tras la reperfusión en ausencia de daño miocárdico irreversible10. Clínicamente, se caracteriza por la necesidad de fármacos inotrópicos postoperatorios a pesar de que se obtengan resultados quirúrgicos satisfactorios. En pacientes de alto riesgo con baja reserva cardiaca, el aturdimiento miocárdico conlleva un aumento de los días de ventilación mecánica, del riesgo de insuficiencia renal, de estancia en UCI y hospitalaria, y de la mortalidad, como se pudo observar en aquellos pacientes que desarrollaron SBGC.
El SBGC postoperatorio es una de las complicaciones más frecuentes tras la cirugía de revascularización coronaria. La incidencia en nuestro estudio, del 32%, es mayor que la encontrada en otros estudios que se suele situar entre el 16,1 y el 13,5%5,11,12. Varias circunstancias podrían explicar esta diferencia. En primer lugar, el número de cirugías urgentes y emergentes en nuestra población fue superior al registrado en otros estudios (Algarni et al.1 recogieron un 8-10% de cirugías urgentes, mientras Ding et al.5 un 8,3% de cirugías emergentes en el grupo que presentó SBGC); en segundo lugar, en nuestro estudio no se realizaron cirugías sin CEC; por último, la definición de SBGC utilizada por otros autores es más restrictiva, quedando excluidos los pacientes que, aun necesitando inotropos, no superaron un determinado umbral de dosis o tiempo de tratamiento5,11,12. Estos criterios de inclusión podrían limitar la sensibilidad para detectar formas menos graves de disfunción miocárdicas en el postoperatorio inmediato. Sin embargo, como recogen las guías de monitorización hemodinámica de la SEMICYUC13, «no se recomienda la monitorización rutinaria y sistemática del GC en los pacientes con inestabilidad hemodinámica». Por otra parte, los criterios clínicos son suficientes para una clasificación adecuada de los pacientes con SBGC postoperatorio, como se ha demostrado recientemente en el estudio ESBAGA en el que el grupo clasificado clínicamente presentaba una evolución postoperatoria con un claro aumento de los datos de morbimortalidad muy similar al grupo diagnosticado por parámetros de monitorización hemodinámica14.
Aunque no existe consenso sobre las causas de la elevación de los marcadores bioquímicos de daño miocárdico postoperatorio, 3 importantes ensayos clínicos han identificado la protección miocárdica subóptima como principal factor responsable del daño por isquemia/reperfusión15. En nuestro estudio observamos que los pacientes con menor ICI presentaron mayores concentraciones de estos marcadores (troponinas, creatincinasa MB y N-terminal propéptido natriurético cerebral) y de lactato (como indicador sustitutivo de hipoperfusión), precisando más soporte inotrópico en el postoperatorio inmediato. Además, se identificaron como factores de riesgo para desarrollar SBGC postoperatorio los siguientes: mayor edad, mayor IMVI, FEVI postoperatoria disminuida, peor clase funcional de la NYHA, mayor EuroSCORE, cirugía urgente, tiempo de CEC prolongado, y el volumen y vía de administración de la cardioplejía, todo ello acorde con estudios previos5,11,12,16.
Como ya se ha mencionado, en la etiopatogenia de la disfunción miocárdica postisquémica en cirugía cardiaca se han identificado distintos factores contribuyentes. De acuerdo con nuestros hallazgos, el aumento del IMVI implica un aumento de la morbimortalidad del paciente sometido a cirugía cardiaca17; esto se debe a que el aumento del IMVI conlleva un mayor riesgo de isquemia miocárdica perioperatoria secundario a desequilibrio entre la oferta y la demanda de oxígeno miocárdico. La hipertrofia ventricular izquierda se asocia con alteraciones estructurales vasculares coronarias con aumento de las resistencias, alteraciones del flujo y aumento de la presión telediastólica del VI con la consiguiente reducción de la perfusión subendocárdica. Asimismo, implica un aumento de demanda miocárdica de oxígeno y un mayor estrés de la pared. Durante la cirugía, los pacientes con hipertrofia ventricular severa tienen mayor riesgo de una preservación miocárdica subóptima. La combinación de estos factores implica un peor pronóstico18. Por otra parte, el IMVI también se ha relacionado con un incremento de las arritmias postoperatorias19, un aumento de la estancia media17 e incluso se ha identificado como un predictor independiente de la mortalidad a 30 días, con una relación prácticamente lineal18.
Dada la importancia de la preservación miocárdica, se han desarrollado diversas estrategias de cardioprotección durante la cirugía, identificándose la cardioplejía como un elemento clave. Entre las diversas formas de cardioplejía, el patrón oro en los últimos 30 años ha sido una solución hiperkaliémica despolarizante que induce una parada cardiaca rápida y fácilmente reversible; aunque no por ello exenta de inconvenientes. El aumento de las concentraciones de potasio puede estar relacionado con la aparición diferentes grados de vasoconstricción y vasoespasmo, dando lugar a una distribución irregular de la cardioplejía20 y, por tanto, una reducción de la protección miocárdica.
Además, las concentraciones extracelulares de potasio presentan un estrecho margen terapéutico de modo que pequeñas variaciones de las mismas pueden dar lugar a corrientes iónicas persistentes que conllevan un aumento intracelular de calcio y sodio21,22. En un intento de restaurar el equilibrio iónico, se activan bombas transmembrana con el consiguiente consumo de energía, que contribuye al aturdimiento miocárdico23. Esto exige mantener concentraciones extracelulares de potasio estables mediante su apropiado aporte ajustado a una masa miocárdica en presencia de enfermedad arterial coronaria.
A pesar de los numerosos estudios que exploran los tipos y modos de administración de la cardioplejía, en nuestro conocimiento, no se han desarrollado estrategias que permitan ajustar la dosis de cardioplejía al IMVI. En un estudio realizado a mediados de los años 80, Matsuda et al.24 evaluaron las dosis óptimas iniciales de cardioplejía en pacientes con hipertrofia ventricular severa sometidos a reemplazo valvular aórtico. Sin embargo, no hemos encontrado estudios posteriores que validen sus conclusiones o que desarrollen estrategias de cardioprotección en base de sus resultados. En nuestro estudio relacionamos, por medio del ICI, el IMVI y la cantidad de cardioplejía. La conclusión principal fue la existencia de una relación entre el tiempo de isquemia al que se somete una determinada masa miocárdica, la dosis de cardioplejía utilizada para su conservación y el desarrollo de SBGC postoperatorio. Para ser exactos, encontramos que un ICI>23,6ml/min/ (100g/m2 de VI) se asocia con una menor incidencia de SBGC, y también se asocia inversamente con los requerimientos de inotropos postoperatorios. Probablemente, debido a que estas dosis permiten lograr una mayor estabilidad en las concentraciones iónicas.
Por último, nuestros resultados indican que la cardioplejía retrógrada intermitente se asocia con una menor cardioprotección. En pacientes con enfermedad arterial coronaria, la administración retrógrada de cardioplejía abarca mejor el territorio de la arteria descendente anterior que la vía anterógrada25 debido a que el territorio ventricular puede recibir flujo retrógrado a través de los colaterales de Tebesio26. Sin embargo, la administración exclusiva de cardioplejía retrógrada puede proporcionar una protección miocárdica insuficiente debido a la escasa perfusión del ventrículo derecho, la pared posterior y el septo interventricular, salvo que se combine con administración anterógrada a través del ostium coronario27. No obstante, diversos estudios muestran que con cardioplejía retrógrada de alto flujo se pueden mejorar los resultados en la preservación del ventrículo derecho y del tabique interventricular25. Los hallazgos de nuestro estudio muestran que a mayor proporción de cardioplejía administrada por vía retrógrada, mayor incidencia de SBGC postoperatorio. Esto podría deberse a que el volumen de cardioplejía por vía retrógrada o la combinación con cardioplejía intermitente fue insuficiente.
El presente trabajo tiene ciertas limitaciones: es un estudio observacional unicéntrico realizado exclusivamente con cardioplejía hiperkaliémica intermitente, sin compararlo con otros métodos de administración y sin un método predefinido para la administración de la misma (ruta, volumen y dosis posteriores), quedando a criterio del cirujano. Sin embargo, cada mililitro de cardioplejía administrado por cada gramo de miocardio y minuto de isquemia redujo la probabilidad de desarrollar SBGC en algo menos del 1%.
En resumen, 2 factores han demostrado ser clave en el desarrollo de aturdimiento miocárdico postoperatorio: el tiempo de pinzamiento aórtico y una adecuada estrategia individualizada de preservación del miocárdica. Nuestro estudio muestra que el ajuste de la dosis de cardioplejía según el tiempo de isquemia y el IMVI puede constituir una herramienta útil para mejorar el grado de miocardioprotección durante la cirugía de revascularización coronaria, minimizando así los efectos deletéreos de una protección miocárdica subóptima.
Una posible aplicación de los hallazgos de este estudio, en el manejo de la cardioplejía hiperkaliémica, podría consistir en el ajuste de la dosis inicial de cardioplejía en base al IMVI. En pacientes con hipertrofia leve (IMVI<130g/m2), se administrarían 1,2l, mientras que en aquellos con hipertrofia de moderada a severa se administrarían al menos 1,5l. Con respecto a las dosis de mantenimiento, sería importante mantener unos intervalos de administración de entre 20 y 25min, dependiendo del procedimiento quirúrgico. Esta dosis de mantenimiento podría calcularse como el producto de 25ml por los minutos de isquemia (20 o 25 como máximo) multiplicado por un factor de corrección de masa miocárdica (IMVI/100).
Sería necesario desarrollar otros estudios para verificar la utilidad, en la práctica clínica, de este esquema. También sería interesante evaluar el ICI con otra solución de cardioplejía.
Contribución de los autoresJJJR, CLJ y JLIS diseñaron el proyecto y desarrollaron el análisis estadístico. JLA específicamente llevó a cabo los estudios ecocardiográficos, y GYB los estudios hemodinámicos y cálculo del SYNTAX score. RAP y RMS realizaron el proceso quirúrgico y junto con el resto de los autores implementaron el proceso investigador, discutieron los datos y contribuyeron en la redacción final del manuscrito.
Conflicto de interesesNo hay conflicto de intereses.