INTRODUCCION
En la actualidad, se realizan cada año un gran número de sustituciones valvulares cardíacas por prótesis debido a valvulopatías, para así incidir en la evolución natural de las mismas, mejorando el pronóstico y la calidad de vida. En España, en el año 2000, se realizaron 6.048 reemplazos valvulares (4.698 pacientes una sola válvula y 1.350 dos o más) y 1.024 sustituciones valvulares asociadas a revascularización miocárdica1. Las prótesis valvulares pueden ser mecánicas (metálicas o de aleaciones de carbono) o bioprótesis (heteroinjertos, compuestos por tejido pericárdico o valvular porcino o bovino, o bien homoinjertos de válvulas aórticas preservadas)2. A pesar de su indiscutible utilidad en los pacientes con valvulopatía, se sabe que pueden dar lugar a complicaciones graves e incluso mortales, entre las que destacan: trombosis de la prótesis, embolizaciones sistémicas, hemorragias por la necesidad de anticoagulación, alteraciones estructurales de la prótesis, con disfunción de las mismas e insuficiencia o estenosis valvular, hemólisis, leak paravalvulares y endocarditis. En el presente trabajo, nos centraremos en las complicaciones trombóticas y hemorrágicas, intentando destacar la dificultad de encontrar el equilibrio en algunos casos, así como recomendar unas pautas basadas en las guías actuales de manejo antitrombótico en pacientes con prótesis valvulares.
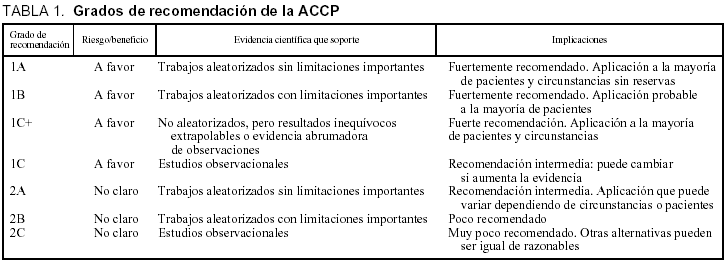
Para señalar los grados de las diferentes recomendaciones, se seguirá el esquema propuesto por el American College of Chest Physicians3, que se incluye en la tabla 1.
COMPLICACIONES TROMBÓTICAS
Trombosis valvular
En las últimas décadas, se han realizado importantes esfuerzos para conseguir prótesis valvulares que generen flujos similares a los fisiológicos y superficies biocompatibles que sean "comparables" al endocardio, para que sean lo menos trombogénicas posible. A pesar de ello, se ha descrito una incidencia global de trombosis en prótesis valvulares del 0,1-5,7% por paciente/año4.
Se define como trombosis valvular protésica cualquier obstrucción de la prótesis causada por material trombótico no infectado5; el atrapamiento de los discos, la obstrucción por pannus, por vegetaciones u otros motivos se consideran disfunciones no estructurales. La formación del trombo depende de la interacción de los elementos sanguíneos con las superficies artificiales, del flujo transprotésico y de los mecanismos facilitadores de la coagulación local y sistémica6. Entre estos últimos, destacan los defectos de la superficie protésica, la falta de endotelización, la anticoagulación inadecuada, la pérdida de contracción auricular (fibrilación), el consumo de fármacos (estrógenos, anticonceptivos), las enfermedades sistémicas y los tumores. En las series descritas, los factores que más se han asociado a la trombosis incluyen la anticoagulación inadecuada y la implantación en posición auriculoventricular de la prótesis, especialmente la tricúspide. La trombosis protésica mitral es aproximadamente el doble de la aórtica. Es más frecuente en la parte auricular de las prótesis. Con respecto al tipo de válvula, las antiguas válvulas de jaula son las más trombogénicas y los homoinjertos y las bidisco las menos2. El riesgo trombótico/tromboembólico más elevado tras la sustitución valvular lo encontramos durante los primeros meses postoperatorios7,8. Esto parece deberse a la gran activación del sistema intrínseco de la coagulación por la exposición a las superficies valvulares todavía no endotelizadas.
De los pacientes que sufren una trombosis valvular, el 15-33% puede sufrir un nuevo episodio. Esta observación de recurrencia del problema, unido a la mayor frecuencia de situaciones de hipercoagulabilidad en los pacientes con trombosis protésica, ha hecho plantearse la necesidad o no de realizar un estudio de hipercoagulabilidad en estos enfermos; e incluso la necesidad o no de utilizar bioprótesis en lugar de prótesis mecánicas en los pacientes de alto riesgo para trombosis9-11.
La trombosis valvular puede manifestarse clínicamente como una insuficiencia cardíaca con edema pulmonar, hipoperfusión, shock o embolización sistémica (se observa hasta en un 25% de los casos antes de establecerse el diagnóstico). Los síntomas y los hallazgos clínicos de la trombosis protésica dependen de la rapidez en que se desarrolle la obstrucción valvular. Lo más típico es que la evolución sea rápida y que los pacientes precisen intervención médica inmediata, pero a veces, el inicio de la clínica es más insidioso y los síntomas van apareciendo en un período de semanas-meses12.
El diagnóstico precoz y el tratamiento adecuado son la base del éxito en la evolución de estos pacientes. En función de una sospecha clínica (que incluye, además, la disminución o desaparición de los clics protésicos en la auscultación), el diagnóstico se realiza mediante ecocardiografía Doppler. Se observa una disminución en la amplitud de los movimientos de los discos valvulares, imágenes de trombos, un aumento del gradiente transvalvular y una disminución del área valvular. En la actualidad, aunque la ecocardiografía transtorácica es rápida y efectiva para diagnosticar la trombosis protésica en la mayor parte de los pacientes, el patrón de referencia sigue siendo la ecocardiografía transesofágica en casos seleccionados13,14. La obstrucción protésica debe sospecharse cuando se calculen gradientes de más de dos veces los considerados normales, dependiendo del tipo de prótesis y el tamaño de la misma. También es de gran utilidad, cuando se disponga de ella, la fluoroscopia, que permite observar la apertura inadecuada y/o la falta de cierre de los discos valvulares. El diagnóstico diferencial que se presenta con mayor frecuencia cuando evaluamos una obstrucción protésica es el desarrollo de pannus, que puede observarse hasta después de 10-15 años de la implantación de la prótesis y en muchas ocasiones no es posible hasta el acto quirúrgico y/o estudio anatomopatológico.
En la mayoría de los casos, el recambio de la prótesis obstruida es el tratamiento de elección. Dado que la intervención quirúrgica conlleva una alta mortalidad12,15, una alternativa es el tratamiento fibrinolítico; este tratamiento continúa siendo controvertido por sus resultados y posibles complicaciones. En una revisión realizada por Birdi et al16 en 158 pacientes con trombosis valvular de cavidades izquierdas que fueron tratados con fibrinólisis, se indican resultados aceptables en el 68,4% de los pacientes. La mortalidad global durante el procedimiento fue del 7%, y en las embolias cerebrales del 9,5%. La tasa de retrombosis fue del 17% y la mortalidad tardía del 6,3%. Los resultados fueron mejores en los pacientes con prótesis aórticas que en los mitrales, en las prótesis de disco oscilante que en las bidisco, las que mejor clase funcional presentaban, así como los que presentaban clínica aguda. Lo recomiendan como alternativa en los casos de contraindicación o alto riesgo para cirugía.
Los dos factores que más contribuyen al fracaso de la trombólisis son el pannus subyacente en gran cantidad de casos y el trombo evolucionado; ambos se asocian habitualmente a los procesos más cronificados. Una historia de síntomas prolongada durante 2 o más semanas suele predecir malos resultados con la trombólisis, por lo que la cirugía en estos casos es lo más recomendado. Cuando hay disfunción de la prótesis o la trombosis ocurre a pesar de anticoagulación en un rango adecuado para el tipo de prótesis también se recomienda el recambio valvular.
En general, si el paciente está estable y con pocos síntomas, que no progresan, y si el trombo no obstruye la válvula y es menor de 5 mm de diámetro, el paciente debe anticoagularse en los rangos adecuados. Si el trombo es mayor, se debe realizar trombólisis o sustitución valvular. Dado que el tratamiento fibrinolítico conlleva un riesgo de embolización elevado, se reserva sólo para los pacientes críticos con alto riesgo operatorio (especialmente los que presentan disfunción miocárdica grave). Este tratamiento es más adecuado cuando la trombosis es reciente y cuando está relacionada con una anticoagulación inadecuada o con la presencia de factores que aumentan temporalmente la coagulabilidad17.
En definitiva, la trombosis protésica es poco frecuente, encontrando escasas series publicadas, pero los casos en los que se presenta, la morbimortalidad es muy elevada (con posibles secuelas permanentes) y precisa un tratamiento de emergencia. En nuestro centro, en el período comprendido entre junio de 1990 y julio de 2002, se han intervenido para sustitución valvular por trombosis protésica 18 pacientes. En el estudio retrospectivo, encontramos una edad media de 59,8 años (rango, 43-75), 13 mujeres, con un Parsonnet medio elevado, 18,5 (rango, 9-31). Cabe destacar que 16 sustituciones fueron mitrales y sólo dos aórticas. Fallecieron 4 pacientes. El tiempo desde la sustitución valvular hasta la trombosis fue variable, con un rango entre horas y años. Aunque no se recogió de manera sistemática un estudio para descartar hipercoagulabilidad, en todos los casos analizados se sospechó el déficit transitorio de anticoagulación por diferentes motivos, confirmándose en el 50% de los casos. En un caso, la simple retirada durante 6 h de la heparina para realizar un procedimiento invasivo (coronariografía) fue suficiente para la formación de un trombo protésico.
Embolización
En los pacientes portadores de prótesis mecánicas, la incidencia de embolización grave (esto es, la que da lugar a déficit neurológico persistente o muerte) es de aproximadamente un 4% por paciente/año en aquellos que no tienen tratamiento antitrombótico, un 2% paciente/año en los tratamientos realizados con antiplaquetarios y un 1% en los pacientes que tienen cumarínicos18. En la mayoría de los casos se manifiestan por episodios cerebrovasculares. Son más elevados los riesgos de embolización en los pacientes con prótesis valvulares mitrales, más de una prótesis, válvulas de jaula, pacientes con fibrilación auricular, aumento del tamaño auricular, pacientes ancianos y aquellos con disfunción ventricular.
La posibilidad de desarrollar una de estas complicaciones es una de las justificaciones para la anticoagulación en los pacientes portadores de válvulas cardíacas protésicas. Esta anticoagulación, que se debe iniciar precozmente tras la implantación protésica, también puede acarrear problemas, fundamentalmente en forma de hemorragias, que pueden ser graves e incluso comprometer la vida. Por tanto, se debe buscar el equilibrio entre una buena anticoagulación que evite, en lo posible, los riesgos trombóticos y embólicos pero asumiendo el menor número y gravedad posible de episodios hemorrágicos. La eficacia y ajuste de las dosis anticoagulantes con los dicumarínicos se realiza mediante el INR (international normalized ratio).
Aunque la incidencia global de efectos adversos, tromboembólicos o hemorrágicos es más baja cuando utilizamos los dicumarínicos para mantener un INR de 2,5-3,5, algunos pacientes de alto riesgo de complicaciones tromboembólicas se benefician de una anticoagulación más intensa, mientras que aquellos cuyas necesidades antitrombóticas sean menores se beneficiarán de la mejor proximidad a las cifras más bajas de INR, y así disminuir la posibilidad de hemorragia.
Los pacientes con bioprótesis de tipo heteroinjertos tienen una mayor tendencia a embolizar durante los primeros 3 meses tras la sustitución; estos pacientes deben recibir tratamiento anticoagulante de "baja intensidad", para conseguir INR de 2,0 a 3,0 durante este tiempo, y luego seguir con antiplaquetarios. Solamente deberían seguir con anticoagulantes los pacientes con fibrilación auricular, trombos en aurícula, embolización sistémica previa o disfunción ventricular grave19.
En este sentido, intentando optimizar la anticoagulación dependiendo del tipo de pacientes y de la válvula protésica, se han realizado recomendaciones, en función de los numerosos trabajos realizados en esta materia y la evidencia científica que los mismos aportan. Por ello, hoy se recomienda ajustar las dosis de anticoagulante de manera individualizada. A continuación, se presenta el resumen de las recomendaciones del American College of Chest Physicians (ACCP) para el manejo del tratamiento antitrombótico en pacientes con prótesis valvulares cardíacas, presentado recientemente en su sexta edición en Chest el año 200120,21. Estas recomendaciones son sensiblemente diferentes (en general, se recomiendan valores de INR inferiores) a las de la European Society of Cardiology de 199522 y las propuestas por las ACC/AHA en 19988:
Anticoagulación en las válvulas protésicas mecánicas
Recomiendan que todos los pacientes con válvulas protésicas mecánicas reciban anticoagulantes orales (grado 1C). Se recomienda el uso de heparina sódica o de bajo peso molecular hasta que se alcance un INR terapéutico durante 2 días consecutivos con anticoagulantes orales (grado 2C). Los fármacos antiplaquetarios solos no han demostrado fehacientemente su seguridad en la protección trombótica en los pacientes con prótesis mecánicas, incluso en los pacientes con St. Jude Medical aórticas en ritmo sinusal.
Se recomienda conseguir con anticoagulantes orales un INR de 2,5 (rango establecido entre 2,0 y 3,0) en las siguientes prótesis valvulares: St. Jude Medical bidisco (grado 1A). Carbomedics bidisco (grado 1C+) y la Medtronic-Hall monodisco basculante (grado 1C+)23 en la posición aórtica, con aurícula izquierda de tamaño normal y paciente en ritmo sinusal.
Se recomienda conseguir con anticoagulantes orales un INR de 3,0 (rango, 2,5-3,5) en las prótesis mecánicas bidisco y disco basculante cuando se encuentran en la posición mitral (grado 1C+). También se recomienda este valor de INR en las prótesis mecánicas bidisco aórticas, que están en fibrilación auricular (grado 1C+).
Como alternativa a las recomendaciones previas, podemos encontrar la siguiente: anticoagulantes orales para INR de 2,5 (rango, 2,0-3,0) unido a aspirina a dosis de 80-100 mg/día24, en los pacientes con válvulas mecánicas en posición mitral de tipo bidisco o disco basculante o pacientes con bidisco aórticas, en fibrilación auricular (grado 2C).
Se recomienda conseguir un INR de 3,0 (rango, 2,5-3,5) y unido a 80-100 mg/día de aspirina, en los pacientes con válvulas antiguas de tipo jaula (bola o disco) (grado 2A). Esta misma pauta se recomienda en aquellos pacientes con prótesis mecánicas y factores de riesgo de trombosis asociados (grado 1C+).
Las indicaciones de asociación de dipiridamol al tramiento anticoagulante, en lugar de aspirina, requieren más evaluación, y de momento no se recomienda su uso.
En aquellos pacientes con prótesis valvulares mecánicas, que sufren un embolismo sistémico a pesar de un adecuado tratamiento anticoagulante, se recomienda añadir 80-100 mg/día de aspirina y el mantenimiento de un INR de 3,0 (rango, 2,5-3,5) (grado 1C+).
Anticoagulación en bioprótesis
Se recomienda que los pacientes con bioprótesis en posición mitral sean tratados con anticoagulantes orales durante los primeros 3 meses tras la implantación de la prótesis (grado 1C+). También se recomienda igual anticoagulación en las bioprótesis aórticas, aunque el grado de evidencia es inferior (grado 2C).
Dado el elevado riesgo de tromboembolismo durante los primeros 3 meses tras la implantación de la prótesis, podría usarse heparina (sódica o de bajo peso molecular) hasta que se consiga un INR terapéutico durante 2 días consecutivos, con anticoagulantes orales. No obstante, no hay evidencia para esta recomendación (grado 2C).
Se recomienda conseguir con anticoagulantes orales un INR de 2,5 (rango, 2,0-3,0) durante los primeros 3 meses de bioprótesis, sea mitral o aórtica (grado 1A). Se recomienda el mismo rango de anticoagulación, pero de manera indefinida, en aquellos pacientes con bioprótesis pero que están en fibrilación auricular (grado 1C+).
Se recomienda la anticoagulación a largo plazo con anticoagulantes orales para conseguir INR de 2,5 (rango, 2,0-3,0) (grado 1C) en los pacientes con válvulas bioprotésicas que presentan un trombo en la aurícula izquierda en el procedimiento quirúrgico. La duración no está definida y la recomendación no se basa en experiencias publicadas.
En los pacientes con bioprótesis con historia de embolismo sistémico, se recomienda tratamiento con anticoagulantes a largo plazo. El INR a conseguir y la duración del tratamiento no queda claro. El consenso (no basado en las experiencias publicadas), es mantener la anticoagulación durante 3-12 meses, y con el fin de conseguir un INR de 2,5 (grado 2C).
En los pacientes con bioprótesis, que están en ritmo sinusal, se recomienda el tratamiento con 80 mg/día de aspirina de manera indefinida (grado 2C).
HEMORRAGIA
En el otro lado de la balanza nos encontramos con las posibilidad de la hemorragia. El manejo de la anticoagulación en los pacientes portadores de prótesis valvulares en las situaciones en las que se presenta una hemorragia o han de ser intervenidos permanece controvertido.
Con respecto a los pacientes que presentan hemorragia, Ananthasubramaniam et al25 publicaron su experiencia en la retirada del tratamiento anticoagulante con warfarina en pacientes con sustitución valvular, que precisaban ingreso hospitalario por hemorragia grave. Analizan, de manera retrospectiva, 28 pacientes con sustitución valvular (12 mitrales, 12 aórticas y 4 mitrales más aórticas) que ingresan por hemorragia grave: 25 gastrointestinales o retroperitoneales, 2 hemorragias intracraneales y un hematoma subdural. Retiran la warfarina una media de 15 días y estudian las consecuencias de esta suspensión de la anticoagulación. Ningún paciente estuvo recibiendo otro tratamiento anticoagulante. En la evolución destaca que no hay ninguna complicación tromboembólica, de manera que los autores concluyen que el riesgo de tromboembolismo es bajo en pacientes con prótesis valvulares a los que se les retira la anticoagulación tras un episodio de hemorragia grave y establecen como seguro un período de 2 semanas sin la anticoagulación. También se debe mencionar que sólo 5 pacientes en el momento del ingreso presentaban valores considerados como supraterapéuticos de INR o de actividad de protrombina, 10 pacientes tuvieron una hemorragia recurrente. En definitiva, aunque hay que buscar el equilibrio entre las complicaciones hemorrágicas y las tromboembólicas, los autores resaltan la necesidad de una evaluación intensiva de la hemorragia y confían en la seguridad de la retirada de la anticoagulación durante un período "controlado". Cabe destacar que el estudio tiene importantes limitaciones, muchas de ellas reconocidas por los mismos autores en el artículo. Además de que la información se recoge de manera retrospectiva, pueden no estar incluidos en el análisis todos los pacientes con trombosis valvular y se han podido escapar diagnósticos de episodios tromboembólicos, los autores han podido infraestimar la posibilidad de riesgo tromboembólico al retirar el dicumarínico, debido a que el 85% de las sustituciones fueron de una sola válvula, de las que el 50% eran aórticas (4 de ellas biológicas), y la mayoría de los recambios (71,4%) se realizaron con prótesis de St. Jude; todo ello contribuye a disminuir la tasa de riesgo. Por otra parte, en el 25% de los pacientes la anticoagulación se suspendió en menos de 7 días, sin encontrar especificados los tipos de válvulas en estos casos. En resumen, el estudio no permite extraer conclusiones firmes, pero ayuda a tranquilizar al clínico en una situación, en que es imprescindible suspender la anticoagulación por la gravedad de la hemorragia.
No hay clasificaciones de hemorragia por anticoagulación reconocidas para poder ser utilizadas en los ensayos clínicos y realizar comparaciones entre los resultados de los diferentes estudios. Sería importante clasificar los tipos de hemorragia, debido a que ésta puede presentarse tanto como un pequeño sangrado, poco importante en la clínica (epistaxis corta, sin repercusión), como un acontecimiento grave, que compromete la vida del individuo. Fihn et al26 definieron tres grupos de categorías de hemorragia, que podrían utilizarse para la estandarización y la comparación de resultados: a) hemorragia menor (detectada, pero no requiere pruebas complementarias ni asistencia); b) hemorragia mayor (requiere tratamiento, evaluación médica o al menos la transfusión de dos unidades de sangre), y c) hemorragia con compromiso vital (precisa intervención quirúrgica o angiográfica, conduce a secuelas irreversibles o a la parada cardíaca). Sin embargo, en general, en la mayor parte de publicaciones seguimos encontrando la división en dos categorías, las hemorragias mayores y menores, definidas con criterios similares, pero no iguales, en cada caso.
En los pacientes portadores de prótesis valvulares, se observa una tasa de sangrado mayor entre un 1,2% al año y un 5,6% al año y la adición de salicilatos a los dicumarínicos aumenta las tasas de sangrado, fundamentalmente las hemorragias menores27. En un trabajo doble ciego, Turpie et al28 comparan las complicaciones hemorrágicas de los pacientes anticoagulados con warfarina para un INR de 3,0-4,5, frente a los anticoagulados de forma similar pero que se les añaden 100 mg de aspirina. La tasa de sangrado mayor fue del 10,3% en el primer grupo frente al 12,9% en el segundo.
En general, se consideran factores de riesgo para el sangrado en los pacientes anticoagulados:
1. Intensidad de tratamiento. El factor que más claramente influye el riesgo de sangrado es la intensidad de la anticoagulación. Varios estudios aleatorizados han demostrado cómo el riesgo de sangrado clínicamente importante disminuye cuando reducimos los rangos terapéuticos según el control de INR desde 3,0-4,5 a 2,0-3,029-32. En el trabajo de Saour et al, se aleatorizan a los pacientes para recibir warfarina a dosis moderadas (para INR de 2,65) frente a warfarina para conseguir anticoagulación en intensidad alta (INR de 9); en el primer grupo, la tasa de sangrado mayor es del 3,2%, mientras que en el grupo de alta intensidad la cifra se eleva hasta el 7,2%. Acar et al33 aleatorizaron 380 pacientes a recibir acenocumarol a dos rangos diferentes de INR (2,0-3,0 frente a 3,0-4,5), y encontraron una tasa de sangrado mayor del 6,9% en los que anticoagularon con la tasa de INR más baja, frente al 10% en los que anticoagularon con las tasas más altas. Más significativa fue la diferencia de los sangrados encontrada por Pengo et al34: en aquellos que anticoagularon con warfarina para INR de 2,5-35, la tasa de sangrado mayor fue del 3,8%, mientras que los anticoagulados para INR de 3,5 a 4,5, la tasa fue del 11%. Por otro lado, también hay estudios que demuestran que cuanto más alto es el control de INR (fundamentalmente por encima de 5), más episodios hemorrágicos se presentan35,36. De los estudios previos, se destaca también que las tasas de hemorragia intracraneal (0,2-1,4% al año), aumentan con la mayor intensidad de tratamiento anticoagulante, fundamentalmente en los pacientes más añosos (por encima de 75 años)27.
2. Características del paciente. En el caso de las hemorragias gastrointestinales, una historia de hemorragia predice la posibilidad de nuevos episodios de sangrado37. Otros factores que se asocian a una mayor posibilidad de sangrado son: historia de ictus, insuficiencia renal, hipertensión y anemia26,36,38,39. Aunque no está claro si el riesgo de sangrado aumenta con la edad, se recomienda monitorizar cuidadosamente a los pacientes más mayores y mantenerles en el rango terapéutico de INR.
3. Tiempo en rango terapéutico. Se ha observado una importante relación entre el tiempo en rango terapéutico y las complicaciones de la anticoagulación, tanto el sangrado como las tromboembólicas; esto se ha objetivado en diferentes tipos de pacientes, varias intensidades de anticoagulación y en distintos modelos de dosificación40,41.
Aunque la hemorragia se relaciona de forma directa con los factores previamente comentados, al menos la mitad de los episodios hemorrágicos pueden suceder con INR dentro de los rangos terapéuticos. Por tanto, la respuesta biológica a los dicumarínicos debe presentar un comportamiento idiosincrásico, que puede fluctuar de manera no predecible42.
El tratamiento, en el momento del sangrado activo, en el paciente anticoagulado es claro: precisa la retirada del anticoagulante y revertir sus efectos con plasma fresco si la situación es emergente, o administrar vitamina K y efectuar controles de los INR de manera seriada en situaciones no graves8.
Sin embargo, el manejo a largo plazo de los pacientes que han sangrado, pero que precisan la prevención de complicaciones embólicas, como es el caso de las prótesis valvulares, es más controvertido y complejo. Hay dos principios generales que se han de intentar llevar a cabo: por una parte, se debe identificar y corregir la causa del sangrado (fundamentalmente de forma endoscópica en los sangrados gastrointestinales) y, por otra, intentar disminuir la intensidad de la anticoagulación, esto es, recomendar y controlar al paciente en los límites inferiores de INR, mediante la monitorización frecuente de dicho parámetro. Para los pacientes con prótesis y persistencia del riesgo de sangrado, podría ser razonable conseguir un INR entre 2,0 y 2,541.
PROCEDIMIENTOS INVASIVOS
Frecuentemente, los clínicos nos vemos obligados a valorar el riesgo de hemorragia si los pacientes siguen anticoagulados, frente al de trombosis si se suspende la anticoagulación, en los casos en los que el paciente ha de ser sometido a procedimientos invasivos o quirúrgicos; resulta controvertido y son de difícil manejo. En estos casos se intenta evitar las complicaciones hemorrágicas derivadas de los anticoagulantes y la agresión realizada en el paciente, pero buscando el equilibrio, a su vez, con el riesgo de trombosis y embolismo. Tras la retirada de los dicumarínicos, se precisan alrededor de 4 días en disminuir el INR hasta 1,5 en la mayoría de los pacientes43. Cuando se consiguen estas cifras de INR, hay múltiples estudios que confirman que el procedimiento puede realizarse de una manera segura44. Cuando se reinstaura la warfarina, se tarda unos 3 días en conseguir un INR de 2,045. En definitiva, si los dicumarínicos se retiran 4 días antes del procedimiento quirúrgico y se reinstauran tan pronto como sea posible después de la cirugía, cabe esperar INR subterapéuticos, aproximadamente 2 días antes y otros 2 días después de la intervención. Asumiendo un riesgo del 10-20% de tromboembolia/año (muy alto para ejemplificar), la ausencia de valores terapéuticos durante 4 días significaría un riesgo potencial tromboembólico durante este tiempo del 0,12 al 0,24%, que es asumible en la mayoría de los casos. Para disminuir aún más estos riesgos, se utiliza la heparina (véase recomendaciones específicas). Independientemente de la intensidad de la anticoagulación, el riesgo de tromboembolismo perioperatorio puede estar aumentado por otros factores, como es el efecto protrombótico de la cirugía por sí misma y el rebote en hipercoagulabilidad que supone la retirada de los dicumarínicos44.
Tradicionalmente, el tratamiento estándar para los pacientes que precisaban la anticoagulación continuada (como es el caso de las prótesis valvulares) era la retirada de los dicumarínicos y el paso a heparina sódica intravenosa a dosis completas. Unas horas antes del procedimiento, se retira la heparina para conseguir normalizar la coagulación en el momento de la cirugía. En los últimos años están surgiendo trabajos con heparinas de bajo peso molecular (HBPM), con el fin de simplificar este proceso periquirúrgico. Johnson y Turpie46, en un estudio de cohortes con 112 pacientes anticoagulados por prótesis valvulares, fibrilación auricular o tromboembolismo venoso, que van a ser sometidos a intervenciones quirúrgicas, retiraron la warfarina y aplicaron dalteparina, y demostraron la ausencia de episodios tromboembólicos durante este proceso. Spandofer et al47 también demostraron la ausencia de complicaciones tromboembólicas en una serie de 20 pacientes anticoagulados con warfarina por sustitución valvular, fibrilación auricular o trombofilia que iban a ser sometidos a procedimientos invasivos; la warfarina se retiró 5-6 días precirugía y se aplicó enoxaparina 36 h tras la retirada del dicumarínico, suspendiéndose 12-18 h antes del procedimiento. Los resultados de estos estudios abren otras vías de procedimiento que son más simples y podrían ser una alternativa a la anticoagulación completa con heparina no fraccionada, pero faltan estudios aleatorizados y controlados que avalen estas afirmaciones.
Las extracciones y los procedimientos dentales suelen ocasionar poco sangrado, de manera que no deben realizarse modificaciones en la pauta de anticoagulación del sujeto48. En los casos en los que se precisa controlar el sangrado local, el uso de ácido tranexámico o epsilón aminocaproico en lavado bucal han demostrado ser eficaces.
Aunque no son las únicas recomendaciones, a continuación, se resumen las guías de la ACCP y su grado de evidencia en estos casos:
Los pacientes con alto riesgo de tromboembolismo, como es el caso de las prótesis valvulares mitrales o las antiguas de "jaula" o "bola", fibrilación auricular, trombos en aurícula izquierda, embolización sistémica previa o disfunción ventricular izquierda, que se han de someter a cirugía o procedimientos invasivos, se debe suspender la anticoagulación con dicumarínicos aproximadamente 4 días antes de la cirugía, permitiendo que el INR vuelva a valores normales; además, se debe comenzar un tratamiento con heparina sódica a dosis completas o con heparina de bajo peso molecular a dosis completas mientras desciende el INR (aproximadamente 2 días antes de la cirugía). La heparina sódica intravenosa se debe suspender 5 h antes de la cirugía para que el efecto anticoagulante haya desaparecido en el momento de comenzar la cirugía. En los casos en los que se utilice la heparina subcutánea o las de bajo peso, deben suspenderse 12-24 h antes de la cirugía con el mismo fin (bajo efecto o desaparición de los efectos anticoagulantes) (recomendación grado 2 C).
En los pacientes de riesgo de tromboembolismo intermedio, se debe suspender la anticoagulación con dicumarínicos aproximadamente 4 días antes de la cirugía; para cubrir la caída del INR, aproximadamente 2 días antes de la cirugía, se debe administrar heparina subcutánea a dosis bajas (5.000 U) o dosis profilácticas de heparina de bajo peso molecular. Después de la cirugía, se debe seguir con la heparina subcutánea a dosis bajas o la HBPM, además de comenzar con los dicumarínicos (recomendación grado 2C).
Para los pacientes con bajo riesgo de sangrado, se puede continuar con dicumarínicos a dosis para intensidad baja, interviniendo con INR de 1,3-1,5, que ha demostrado ser un tratamiento seguro en estudios aleatorizados con cirugías ginecológicas y ortopédicas. La dosis de dicumarínico se baja 4-5 días antes de la cirugía; las dosis habituales se reinstauran después de la cirugía y se suplementan, si es necesario, con dosis bajas de heparina subcutánea (5.000 U) (grado 2C).
Para los pacientes que van a ser sometidos a procedimientos dentales que no se consideran como de alto riesgo de sangrado, se recomienda no modificar el tratamiento dicumarínico. En los pacientes con alto riesgo de sangrado, sí se recomienda la suspensión del mismo (grado 2C).
En los pacientes sometidos a procedimientos dentales en los que se produce sangrado local que necesita ser controlado, se puede administrar tranexámico o epsilón aminocaproico en lavados bucales, sin interrumpir el tratamiento anticoagulante (grado 2B).
CONCLUSIONES
La implantación de prótesis valvulares no está exenta de complicaciones, además de precisar anticoagulación que, a su vez, puede generar problemas importantes. Es posible la trombosis protésica por la suspensión transitoria de la anticoagulación, así como las hemorragias graves secundarias a la misma, incluso se pueden presentar sangrados con valores terapéuticos de anticoagulación.
Llama la atención la gran cantidad de trabajos publicados sobre la anticoagulación incluso en pacientes con sustituciones valvulares protésicas. Sin embargo, los trabajos son muy diferentes entre sí, con pocas definiciones estandarizadas que permitan la comparación entre ellos, con diferencia de criterios y de conclusiones. Asimismo, no abundan los trabajos aleatorizados y de alta calidad, con gran cantidad de pacientes incluidos, que permitan generalizaciones en los tratamientos. Por último, también destaca la ausencia de trabajos con acenocumarol, el fármaco antitrombótico más usado en nuestro medio; la mayor parte de los trabajos se han realizado con warfarina.
Todo ello nos lleva a recomendar las guías actualizadas de asociaciones científicas de prestigio y con experiencia, como es la ACCP, aun sabiendo que no son las únicas recomendaciones y con la duda de si son las mejores pautas posibles, siendo éste un capítulo abierto, que irá cambiando según se consigan más evidencias científicas en el futuro. Se recomienda individualizar en lo posible el tratamiento, teniendo en cuenta los factores propios del paciente (valvulopatía, tamaño de la aurícula, fibrilación auricular), los propios de la prótesis (tipo, localización, única o múltiple) y las circunstancias (factores favorecedores de trombosis, hipercoagulabilidad, factores favorecedores de sangrado).
AGRADECIMIENTOS
Los autores del trabajo agradecen su colaboración, en el aporte de documentación y apoyo en su desarrollo, a los Dres. Pérez de la Sota, del Servicio de Cirugía Cardíaca y al Dr. G. Sirgo del Servicio de Medicina Intensiva, ambos del Hospital 12 de Octubre de Madrid.