La sedación es un procedimiento habitual en cuidados intensivos (CI) que ayuda a asegurar la comodidad y adaptabilidad del paciente a un medio considerado frecuentemente como hostil. Se estima que un 2-30% de los enfermos con ventilación mecánica (VM) en CI desarrollarán fenómenos de sedación subóptima, entre los que se incluye la sedación difícil1,2.
La sedación difícil es «toda situación en la que el paciente en VM necesita dosis de sedantes mayores de lo habitual para conseguir el grado de profundidad de sedación deseado, o bien cuando aparecen problemas derivados del descenso de la dosis de sedantes que se están administrando»3. Este cuadro suele relacionarse con una analgesia inadecuada, con fenómenos de tolerancia a sedantes, o con el delirium hiperactivo, donde se incluye la deprivación abstinencia, y constituye un reto en el manejo del paciente crítico, en quien un abordaje sistemático y por objetivos puede ser útil.
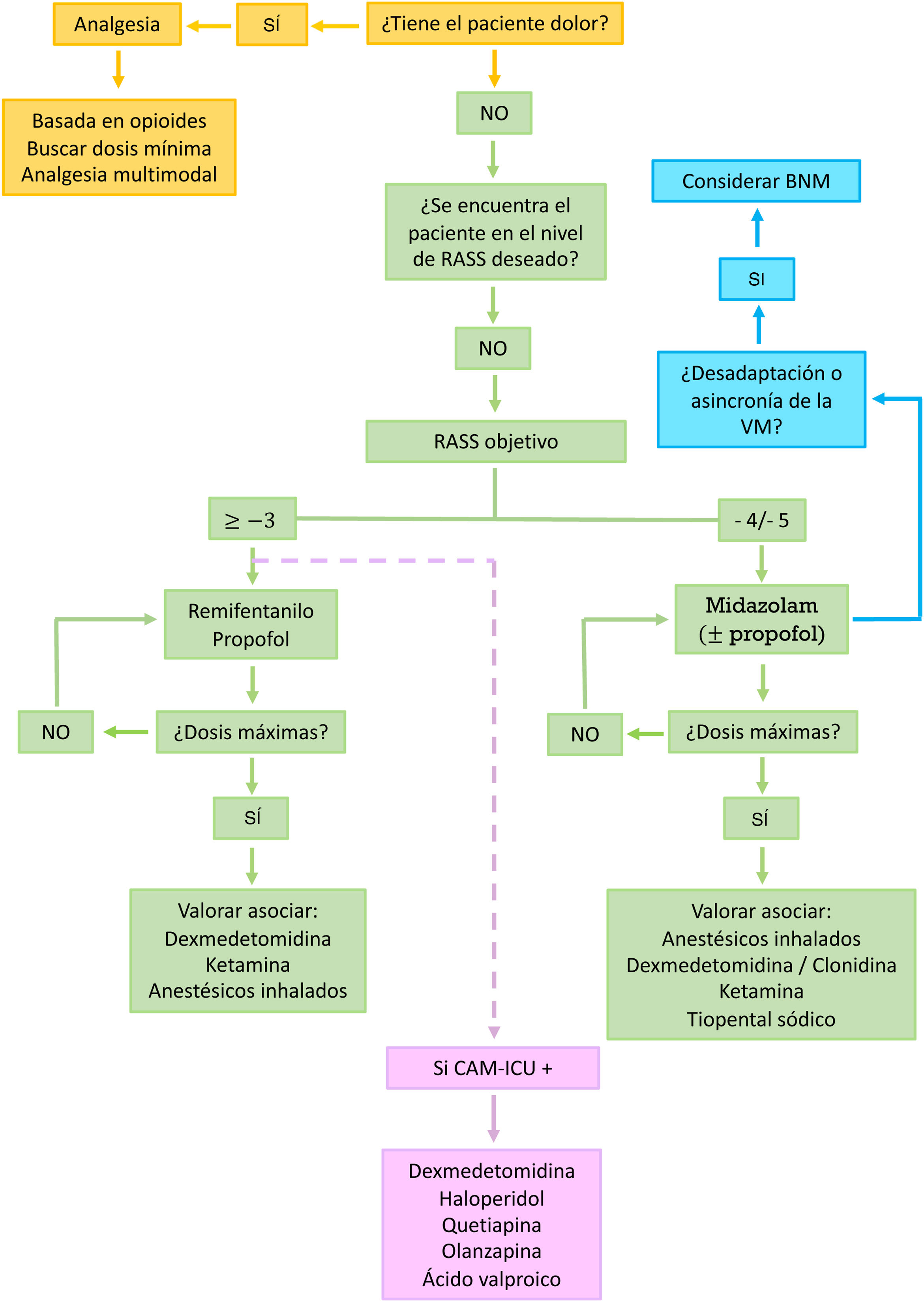
Abordaje propuesto ante un paciente con sedación difícilIdentificación del dolor y analgesiaLa identificación del dolor y una buena analgesia constituyen el primer escalón4-6 (fig. 1).
Algoritmo recomendado para el manejo del paciente con sedación difícil. Los fármacos mencionados no están enumerados según un orden de prioridad. Se recomienda basar la elección del fármaco teniendo en cuenta las características del paciente y los posibles efectos secundarios.
La dexmedetomidina se recomienda en la sedación secuencial (cuando queramos pasar de una sedación profunda a una sedación ligera), para el tratamiento de deprivaciones alcohólicas o farmacológicas (incluidas las benzodiacepinas), en pacientes con oxigenadores de membrana extracorpórea (ECMO) y en situaciones de delirium hiperactivo. La ketamina debe valorarse en aquellos pacientes con mal control del dolor, con estatus asmático, en los tratados con ECMO o en los inestables hemodinámicamente. Los anestésicos inhalados, en pacientes seleccionados, pueden ser considerados como primera opción, incluso por delante de las benzodiacepinas, para mantenimiento de un RASS ≤−4, también puede utilizarse en pacientes con estatus asmático o epiléptico. Los antipsicóticos típicos (haloperidol) y atípicos (quetiapina y olanzapina), aunque no han demostrado acortar la duración del delirium, de la VM ni la estancia en CI, pueden ser empleados para el control de síntomas como la agitación, la ansiedad o las alucinaciones. El ácido valproico puede usarse en aquellos casos de síntomas refractarios a los antipiscóticos. Para ello, podemos utilizar pautas de 1.500mg/día repartidos en 3-4 dosis, que podrán precederse de una carga de 28mg/kg.
CAM-ICU: Confusion Assessment Method for the ICU.
El dolor puede detectarse mediante escalas de autovaloración (verbal numérica o visual analógica) en pacientes comunicativos, o mediante escalas conductuales en no comunicativos. En sedaciones profundas (Richmond Agitation-Sedation Scale, RASS, de −5), donde la validez de las escalas conductuales es cuestionada, podrán utilizarse métodos basados en la variación de la frecuencia cardiaca (Analgesia Nociception Index®), que integren distintos parámetros fisiológicos (Nociception Level Index®) o que registren la respuesta simpática ante una noxa (videopupilometría)5.
La base de la analgesia en CI será siempre un opioide5,6. Para dolores hiperagudos que precisen de control inmediato serán de elección el remifentanilo y el fentanilo, que poseen una potencia e inicio de acción similares (de 1 a 3 min) con una corta duración. Las características farmacocinéticas del remifentanilo obligarán a su administración continuada, mientras que el fentanilo podrá usarse en dosis aisladas (50-150 μg) o en perfusión (30-100 μg/h).
La morfina, al estar dotada de una menor liposolubilidad, tiene un retraso en su efecto máximo (15-30 min), por lo que es un analgésico menos idóneo para el control inmediato del dolor. Sin embargo, su mayor vida media (hasta 6h) el opiáceo ideal para administración intermitente.
El metabolismo a través de esterasas plasmáticas del remifentanilo lo convierte en el opioide más adecuado para pacientes con insuficiencia renal o hepática.
En algunos casos de sedación difícil, el uso de una analgesia multimodal que incorpore, entre otros, la dexmedetomidina, la ketamina o los gabapentinoides, ayudará a optimizar el control del dolor y a disminuir la dosis total de opioides (tabla 1)5,6.
Fármacos que considerar dentro de una estrategia de analgesia multimodal
| Fármaco | Recomendación |
|---|---|
| Ketamina | La analgesia se consigue con dosis subanestésicas; es rara la aparición de efectos secundarios psicomiméticosEs útil para el control del dolor postoperatorio, en pacientes con inestabilidad hemodinámica, politraumatizados, grandes quemados o en los fenómenos de tolerancia/hiperalgesia asociadas a opioidesPuede emplearse en combinación con fentanilo o morfinaPauta intravenosa: 0,05-0,5 mg/kg/h±bolo de 0,125-0,25 mg/kg |
| Dexmedetomidina | Ampliamente valorada como coadyuvante analgésico en el postoperatorio de cirugía cardiaca y neurocirugíaRecomendada en la tolerancia o hiperalgesia asociadas a opioidesPuede valorarse el uso de dosis de inicio más bajas que las recomendadas para el tratamiento del delirium (desde 0,2 μg/kg/h) |
| Gabapentinoides | Útiles en el manejo del dolor de características neuropáticas y de la cefalea refractaria en pacientes con hemorragia subaracnoidea y como coadyuvante analgésico en el postoperatorio de cirugía cardiacaInicio lento de acción. Se debe evitar la escalada brusca de dosis, ya que esta favorece la aparición de efectos secundarios. Es necesario el ajuste de dosis en la insuficiencia renal. Pauta oral:Gabapentina: 300-1.200 mg/díaPregabalina: 100-300 mg/día |
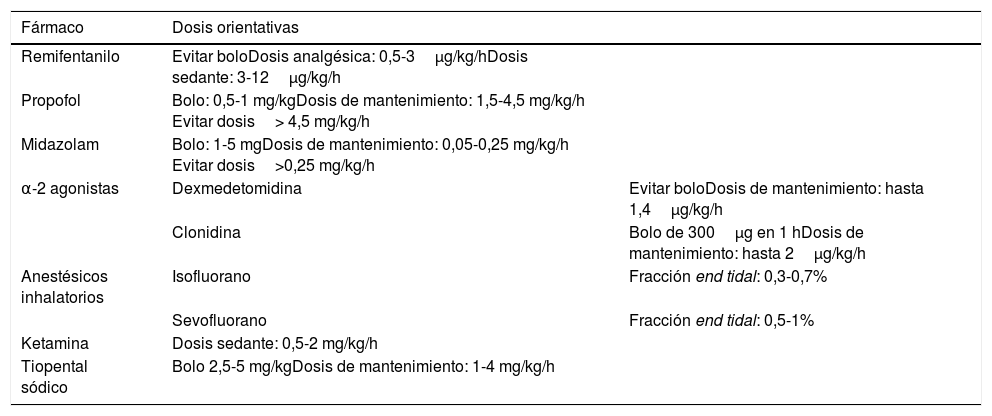
Para ello se recomienda definir un objetivo diario de sedación4-6, no hacer uso de dosis de sedantes superiores a las máximas recomendadas (tabla 2)3,7 y, en pacientes con RASS ≤−4, manejar las asincronías/desadaptaciones de la VM mediante bloqueo neuromuscular puntual o continuado en vez de con un aumento de la dosis de sedación8.
Fármacos en sedación difícilsedación difícil y sus dosis orientativas
| Fármaco | Dosis orientativas | |
|---|---|---|
| Remifentanilo | Evitar boloDosis analgésica: 0,5-3μg/kg/hDosis sedante: 3-12μg/kg/h | |
| Propofol | Bolo: 0,5-1 mg/kgDosis de mantenimiento: 1,5-4,5 mg/kg/h Evitar dosis> 4,5 mg/kg/h | |
| Midazolam | Bolo: 1-5 mgDosis de mantenimiento: 0,05-0,25 mg/kg/h Evitar dosis>0,25 mg/kg/h | |
| α-2 agonistas | Dexmedetomidina | Evitar boloDosis de mantenimiento: hasta 1,4μg/kg/h |
| Clonidina | Bolo de 300μg en 1 hDosis de mantenimiento: hasta 2μg/kg/h | |
| Anestésicos inhalatorios | Isofluorano | Fracción end tidal: 0,3-0,7% |
| Sevofluorano | Fracción end tidal: 0,5-1% | |
| Ketamina | Dosis sedante: 0,5-2 mg/kg/h | |
| Tiopental sódico | Bolo 2,5-5 mg/kgDosis de mantenimiento: 1-4 mg/kg/h |
Se recomienda hacer uso de la dosis mínima de fármaco necesaria para alcanzar el objetivo establecido de profundidad de sedación.
La profundidad de la sedación debe ser definida y monitorizada mediante escalas como la RASS. Se recomienda que, en ausencia de contraindicaciones, los pacientes críticos mantengan sedaciones ligeras (RASS de 0 a −2), ya que estas se asocian con menor tiempo a la extubación y menor incidencia de traqueotomías, mientras que sedaciones profundas (RASS ≤−4) pueden aumentar la mortalidad, la incidencia de delirium y la duración de la VM4-6.
El propofol y el remifentanilo tienen un inicio y fin de acción rápidos y no se acumulan en la insuficiencia renal o hepática, cualidades que los convierten en fármacos ideales para sedaciones ligeras. Sin embargo, en pacientes con inestabilidad hemodinámica grave o en aquellos que necesiten sedaciones profundas asociadas o no a bloqueo neuromuscular, deberemos considerar el uso de benzodiacepinas (por ejemplo, midazolam)4,7. En sedaciones profundas, en las que el RASS no detectará la sobresedación, o en situaciones de bloqueo neuromuscular, en las que es crucial evitar la infrasedación, es recomendable el ajuste de la sedación mediante una monitorización objetiva (por ejemplo, índice biespectral)5.
Cuando la dosis máxima de sedante no consiga el RASS objetivo, se deberá valorar la asociación de fármacos, ya que dosis superiores a las máximas recomendadas pueden conllevar efectos secundarios importantes. El «síndrome de infusión al propofol», asociado a dosis >4,5mg/kg/h, es un cuadro grave con una mortalidad estimada superior al 80%9. En el caso del midazolam, aunque no exista correlación directa entre dosis y mortalidad, se desaconseja el uso de dosis> 0,25mg/kg/h porque prolongan la duración de la VM y aumentan la incidencia de delirium y la estancia en CI3,5.
Aparte de las combinaciones posibles entre opioides, propofol y midazolam, pueden considerarse asociaciones con (tabla 2):
- •
α-2 agonistas: la dexmedetomidina ha emergido, por encima de la clonidina y a igual nivel que el propofol, como uno de los fármacos que deben considerarse en pacientes de CI tanto de perfil médico como posquirúrgico que requieran una sedación ligera. Esto se debe en parte, a que, en su comparación con el midazolam, parece asociarse a una menor prevalencia de delirium y a menor duración de la VM5. La mayor afinidad α-2 de la dexmedetomidina, que condiciona una menor incidencia de efectos adversos cardiovasculares, así como su disponibilidad intravenosa, le otorgan un mayor atractivo frente a clonidina, a pesar de que ningún estudio ha demostrado su superioridad como sedante10.
- •
Anestesia inhalatoria (isofluorano y sevoflurano): la excelente relación dosis-respuesta, sus propiedades neuro- y cardioprotectoras y el desarrollo de dispositivos que permiten su administración en CI la convierte en una alternativa plausible. Son fármacos eficaces y seguros que, comparados con los anestésicos intravenosos, han demostrado un menor tiempo al despertar y a la extubación11.
- •
Ketamina: a dosis subanestésicas es un buen adyuvante analgésico, pero pocos estudios evalúan su papel en la sedación prolongada del crítico, aunque parece que sus efectos secundarios, incluido el delirium, son equiparables a los del resto de los sedantes12.
- •
Tiopental sódico: puede utilizarse como último recurso en casos de sedación difícil con RASS objetivo ≤−4. Su tendencia a acumular y su efecto cardiodepresor obligan a una cuidadosa titulación de su dosis con métodos objetivos (electroencefalografía o índice biespectral).
La identificación, prevención y tratamiento del delirium deben formar parte de la rutina del paciente en CI4-6.
Para la prevención y tratamiento del delirium, el uso de medidas no farmacológicas destinadas a mejorar la capacidad cognitiva, el sueño, la visión, la audición o la movilidad del paciente pueden resultar útiles a pesar de que su aplicación en CI sigue siendo baja2,5,6. Por el contrario, el uso de contenciones mecánicas, que en España se sitúa en torno al 15%, no ha demostrado disminuir el riesgo de caídas o de autorretirada de dispositivos, y se asocia con una mayor prevalencia de agitación y delirium, motivo por el cual actualmente se recomienda evitar su empleo2,5,13,14.
En pacientes en VM con delirium hiperactivo, la dexmedetomidina es el fármaco de elección15. Aunque el uso de antipsicóticos (típicos: haloperidol o atípicos: quetiapina, olanzapina, risperidona) o de otros fármacos adyuvantes como el ácido valproico no está recomendado de rutina, estos pueden emplearse para el tratamiento de los síntomas positivos (agitación, ansiedad, agresividad…)5. En el caso de que el delirium sea secundario a deprivación-abstinencia tanto de tóxicos como de alcohol, la asociación de un fármaco GABA-érgico junto con un α-2 agonista puede resultar la estrategia más útil.
Una adecuada conciliación entre la medicación crónica del paciente y la recibida en CI es fundamental para evitar el desarrollo de cuadros de sedación difícil relacionados con la retirada brusca de fármacos como benzodiacepinas, antipsicóticos, opioides y antidepresivos, entre otros.
En conclusión, la sedación difícil es un reto en el que el uso de un enfoque escalonado, centrado primero en la analgesia y después en una sedación dinámica guiada por objetivos, complementados ambos con un adecuado diagnóstico y tratamiento del delirium, puede constituir la estrategia más adecuada para el manejo de estos enfermos.
FinanciaciónEl presente manuscrito no ha recibido financiación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses respecto a esta publicación.
Al los Drs. Carlos Chamorro y Miguel Ángel Romera por su exhaustiva revisión del texto y sus consejos para su redacción.