INTRODUCCIÓN
El número de casos de meningitis bacteriana en España en los últimos años oscila entre 870 y 1.150 casos/año (años 2002/2003 y 2001/2002, respectivamente). El serogrupo B constituye el 47,6% y el C el 20%. Un 1,7% corresponde a otros serogrupos que no son especificados por el centro emisor, en un 5,2% el serogrupo es desconocido y no grupado, y por último, en un 25,3% de los casos el meningococo es probable, pero no está confirmado1. Suele presentarse principalmente en niños y adolescentes, disminuyendo su incidencia con la edad adulta. En el continente americano se objetiva entre un 5% y un 33% correspondientes a los serogrupos W-135 e Y, respectivamente2. En los últimos años se han descrito meningitis causadas por bacterias del género Neisseria asociadas a déficit de factores del complemento, principalmente la vía alternativa (factor D, factor H o properdina) y últimos componentes del sistema de complemento (C5, C6, C7, C8 o C9)3. La prevalencia de déficit de complemento oscila entre el 0,03% y el 0,09% en la población, alcanzando hasta un 30% en pacientes con enfermedad meningocócica, especialmente en el caso de los serogrupos más infrecuentes4. Presentamos el caso de una paciente que ingresó con sospecha de meningitis aguda fulminante aislándose N. meningitidis serogrupo W-135 en cultivo de líquido cefalorraquídeo (LCR) y asociada a un déficit de fracción C1 del complemento.
CASO CLÍNICO
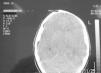
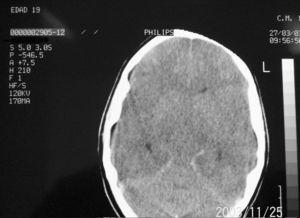
Mujer de 19 años de origen norteamericano, con antecedentes de meningitis por Haemophilus influenzae en la infancia sin secuelas neurológicas. Acude a Urgencias por un cuadro de cefalea intensa, fiebre no termometrada y síndrome catarral los días previos. En la exploración física destaca ligera agitación psicomotriz, sin focalidad neurológica. No presenta rigidez de nuca ni lesiones cutáneas. La analítica muestra 12.600 leucocitos (85% de neutrófilos, el 6% linfocitos y el 9% monocitos) y la punción lumbar 32 células (80% de polimorfonucleares y el 20% de mononucleares), glucosa 60 mg/dl y proteínas 24 mg/dl, compatible con meningitis aguda bacteriana. La tomografía axial computarizada craneal sin contraste fue normal. La enferma empeora neurológicamente durante su estancia en Urgencias, con aumento de la cefalea, vómitos y crisis comicial tónico-clónica con disminución del nivel de conciencia, por lo que se administra 10 mg de diazepam intravenoso y se procede a intubación orotraqueal y conexión a ventilación mecánica. Tras su ingreso en la Unidad de Cuidados Intensivos (UCI) se inicia tratamiento con aciclovir 600 mg/8 h; ceftriaxona 2 g/12 h; vancomicina 1g/12 h y ampicilina 2 g/4 h junto con dexametasona 9 mg/6 h y fenitoína 150 mg/8 h. A las tres horas presenta inestabilidad hemodinámica, junto con episodio de bradicardia seguido de taquicardia sinusal, poliuria y datos analíticos compatibles con diabetes insípida. En la exploración neurológica (sin nueva dosis de sedación tras la administración de diazepam al ingreso) se objetiva coma con escala Glasgow 3, con pupilas midriáticas y arreactivas. Se realiza nueva tomografía axial computarizada craneal que muestra edema cerebral difuso (fig. 1), por lo que se intensifican las medidas antiedema sin conseguir revertir la situación. Ante la sospecha de muerte clínica encefálica se realiza electroencefalograma que refleja ausencia de actividad bioeléctrica. El estudio microbiológico del líquido cefalorraquídeo identifica N. meningitidis W-135. El análisis inmunológico confirma un déficit del complemento, la fracción C1q 7,5 mg/dl (límites normales 10-25), no conocido previamente por la paciente o su familia.
Figura 1. Tomografía computarizada de cráneo.
DISCUSIÓN
A propósito del caso presentado, realizamos un análisis a partir de la literatura revisada de la asociación entre infección por N. menigitidis y trastornos de la inmunidad, en especial una mayor susceptibilidad para desarrollar enfermedad meningocócica en pacientes con déficit de complemento, así como una menor mortalidad en comparación con la infección meningocócica en la población sin déficit del mismo.
La mortalidad de la infección meningocócica es variable, entre un 14% en el caso de meningitis hasta un 25% si se asocia con meningococemia. En un estudio retrospectivo realizado por Ross et al encontraron que la mortalidad era del 19% si se consideraban todos los casos de enfermedad meningocócica. En pacientes con déficit de complemento la mortalidad puede variar entre el 3% y el 7%5. Si se trata de un déficit de factores de la vía clásica la mortalidad es del 1,8%, mientras que en el caso de la vía alternativa y común es del 3,6%. En principio esta diferencia de mortalidad en pacientes con y sin déficit de complemento no resulta fácilmente comprensible5. La posibilidad de que la enfermedad pueda ser menos grave en pacientes con déficit de complemento no parece ser el motivo de dicha diferencia, dado que las complicaciones en el transcurso de la enfermedad son similares en ambos grupos de pacientes5. Los autores en este estudio concluyen que quizás la explicación para dicha diferencia sea la dificultad, en el caso de déficit de complemento, en el proceso de formación del complejo de ataque a la membrana, limitando de este modo la lesión tisular posterior.
En otro estudio se analiza la menor mortalidad de la enfermedad meningocócica en pacientes que presentan déficit del complemento, en concreto el factor C6, con respecto de pacientes sin dicho déficit y establece que puede existir un daño tisular menor debido a la activación reducida del complemento por parte de las endotoxinas3, corroborando de este modo los resultados obtenidos en estudios previos.
Platonov et al compararon la mortalidad de la enfermedad meningocócica en pacientes con y sin déficit del complemento, sugiriendo que la formación del complejo de ataque de membrana puede contribuir a la activación de los leucocitos y a la lesión de las células endoteliales; por lo que la ausencia de este fenómeno puede contribuir a la menor mortalidad encontrada en pacientes con déficit del complemento6. Por otro lado, el diagnóstico de déficit de complemento se analiza habitualmente en los pacientes que superan la enfermedad meningocócica, mientras que el sistema de complemento rara vez se estudia en los pacientes que fallecen. Aunque en principio esta circunstancia podría confundir la estimación de la asociación entre mortalidad y déficit de complemento, el hecho de que haya más estudios que determinen los factores de complemento en los supervivientes que en los fallecidos refuerza la idea de que el déficit de alguno de los factores del complemento se asocia a una menor mortalidad.
El complemento es un sistema de proteínas séricas que intervienen en la defensa inmunológica del huésped. La interacción de una bacteria con el suero de un sujeto normal desencadena la activación en cascada del complemento, bien por la vía clásica a través de los componentes C1, C2 y C4, o bien por la vía alternativa, mediante el factor D, C3 y factor B, produciéndose la lisis y activación de C3 y posterior activación de los componentes finales del complemento C5-9. El fragmento C3b también se une a un producto derivado del factor B (llamado Bb) para formar el C3bBb, conocido como convertasa de C3 de la vía alternativa. Asimismo, la activación de la vía clásica da lugar a la escisión de C4 y C2, dando lugar al complejo C4b2a, o convertasa de la vía clásica. Tanto una como otra intervienen en la formación de la forma activa de C3 con la posterior formación del complejo de ataque a la membrana C5-9, que se inserta en las membranas celulares y produce la lisis osmótica de la célula7. El déficit de los componentes del sistema del complemento conlleva una pérdida de la lisis bacteriana, con lo que la fagocitosis leucocitaria está alterada8.
El déficit del complemento de la vía alternativa o vía final común está asociado de manera especial a infecciones (meningitis y neumonía) debidas a N. meningitidis9, y el déficit de complemento de la vía clásica generalmente se asocia a enfermedades autoinmunes (entre un 57% y un 85% de los sujetos homocigotos con déficit de complemento padecen enfermedades autoinmunes)5. El déficit de los componentes iniciales del complemento está asociado con infecciones causadas por Streptococcus pneumoniae, Haemophilus influenzae y N. meningitidis10 (en la anamnesis de la paciente destaca el diagnóstico de meningitis por H. influenzae). En cualquier caso, una mayor incidencia de infecciones, principalmente debidas al género Neisseria, es un hallazgo frecuente en el déficit de complemento (hasta un 25%)5.
La prevalencia de déficit de complemento en la población general se estima entre el 0,3%-0,9%9. Los serogrupos más frecuentes (A, B, C) están raramente asociados a déficit del complemento1, mientras que la prevalencia de déficit de complemento es del 31% en los enfermos con enfermedad meningocócica causada por serogrupos poco frecuentes (X, Y, Z, W135 y 29E)4. Otro estudio posterior ha observado que el 77% de los pacientes son varones5, con una media de edad de 17 años, y que en un 10,5% de todos los pacientes con déficit de la vía final del complemento coexiste una enfermedad reumatológica, mientras que en el caso de déficit de C1, C2 o C4, el porcentaje se eleva hasta el 64%5. El 40% de los pacientes con déficit de complemento y enfermedad meningocócica presentan pródromos en los días previos11, porcentaje similar al encontrado en pacientes sin dicho déficit, por lo que no parecen existir diferencias con respecto a la clínica prodrómica en pacientes con y sin déficit de complemento.
La recurrencia de esta enfermedad es 10 veces mayor que en pacientes sin dicho déficit (6,3% frente al 0,6%)5. En otras series el número de recaídas llega hasta un 20% según la etnia de la población6. En contraste, en los países donde el porcentaje de individuos con enfermedad meningocócica es menor, la proporción de pacientes con déficit de complemento es mayor. Este es el caso de Israel, donde la incidencia es baja frente a Sudáfrica o Rusia donde la incidencia anual es mayor12.
El diagnóstico del déficit de complemento se realiza por el análisis del componente hemolítico total (CH50)13. Si uno de los componentes de la vía clásica o alternativa del complemento está ausente, el complemento hemolítico total será cero o muy bajo. Si se sospecha déficit de la vía alternativa, se puede utilizar un prueba similar usando células de conejo desensibilizadas (APH50)4. La fracción C1 es un complejo macromolecular del que C1q es el mayor componente. La unión de C1q al complejo Ag-Ac es útil para prevenir la macroagregación5. En ausencia de C1q se produce una rápida agregación y precipitación de estos complejos.
En nuestra paciente se objetiva déficit de la vía clásica del complemento, fracción C1q, así como un episodio previo de meningitis en la infancia. No presentó meningococemia y el curso de la enfermedad fue fulminante en las horas siguientes a su ingreso por edema cerebral difuso sin respuesta a medidas antiedema, así como muerte encefálica posterior.