Determinar los motivos de prescripción, características de los pacientes y factores que influyeron en la evolución de pacientes críticos que utilizaron micafungina (MCF) durante su estancia en UCI españolas.
Material y métodoEstudio retrospectivo, observacional y multicéntrico. Se han incluido los pacientes ingresados en UCI entre marzo de 2011 y octubre de 2012 (20 meses) que recibieron MCF por cualquier motivo. La gravedad al inicio del tratamiento se midió con las escalas APACHE II, SOFA, Child-Pugh e índice MELD. Los motivos de utilización de MCF se clasificaron como profilaxis, tratamiento anticipado, tratamiento empírico y tratamiento dirigido. Las características de empleo valoradas fueron dosis de carga, dosis diaria y días de tratamiento. Los variables continúas se expresan como medias y desviación estándar o medianas y las categóricas como porcentajes. Se realizó análisis multivariante para identificar las variables relacionadas con mortalidad intra-UCI.
ResultadosSe incluyeron 139 pacientes en 19 UCI españolas con edad de 57,3 (17,1) años, 89 (64%) hombres, con patología quirúrgica (53,2%) y/o médica (44,6%), APACHE II de 20,6 (7,7) y SOFA de 8,4 (4,3) que recibían ventilación mecánica (84,2%), nutrición parenteral (59%), depuración extrarrenal (37,4%) y esteroides (37,4%). MCF se indicó como tratamiento empírico de una infección probada en 51 (36,7%) casos, como tratamiento anticipado en 50 (36%), en especial por aplicación del Candida score (32 casos), como tratamiento dirigido de una infección documentada en 23 (16,5%) y finalmente como profilaxis en 15 (10,8%) casos. En 108 (77%) casos se administró una dosis/día de 100mg y solo en 9 casos (6,5%) dosis de carga. La duración media del tratamiento fue de 13,1 (13) días. Fallecieron en UCI 59 (42,4%) pacientes y 16 después de alta (mortalidad hospitalaria del 53,9%). Los factores con riesgo independiente de mortalidad intra-UCI fueron el índice de Child-Pugh (OR 1,45: IC 95% 1,162-1,813; p=0,001) y el índice MELD (OR 1,05; IC 95% 1,011-1,099; p=0,014).
ConclusionesMCF se administra mayoritariamente a dosis de 100mg/día, sin dosis de carga y en el 72,7% de los casos como tratamiento anticipado o tratamiento empírico. Los factores que mejor predicen la mortalidad fueron los indicadores de insuficiencia hepática en el momento de iniciar el tratamiento.
To determine the reasons of prescription, the characteristics of patients and factors that affected the outcome of critically ill patients treated with micafungin (MCF) during their stay in Spanish ICUs.
Material and methodsObservational, retrospective and multicenter study. Patients admitted to the ICU between March 2011 and October 2012 (20-month period) treated with MCF for any reason were included in the study. Severity of patients at the beginning of treatment was measured with the APACHE II, SOFA, Child-Pugh and MELD scores. Reasons for the use of MCF were classified as prophylaxis, preemptive treatment, empirical treatment and directed treatment. Continuous variables are expressed as mean and standard deviation or median, and categorical variables as percentages. A multivariate analysis was performed to identify variables related to intra-ICU mortality.
ResultsThe study population included 139 patients admitted to 19 Spanish ICUs, with a mean age of 57.3 (17.1) years, 89 (64%) men, with surgical (53.2%) and/or medical (44.6%) conditions, APACHE II score of 20.6 (7.7) and SOFA score of 8.4 (4.3), with 84.2% of patients requiring mechanical ventilation, 59% parenteral nutrition, 37.4% extrarenal depuration procedures and 37.4% treatment with steroids. MCF was indicated as empirical treatment of a proven infection in 51 (36.7%) cases, pre-emptive treatment in 50 (36%) especially as a result of the application of the Candida score (32 cases), directed treatment of fungal infection in 23 (16.5%) and as prophylactic treatment in 15 (10.8%) cases. In 108 (77%) cases, a daily dose of 100mg was administered, with a loading dose in only 9 cases (6.5%). The mean duration of treatment was 13.1 (13) days. A total of 59 (42.4%) patients died during their stay in the ICU and 16 after ICU discharge (hospital mortality 53.9%). Independent risk factors for intra-ICU mortality were the Child-Pugh score (OR 1.45, 95% CI 1.162-1.813; P=.001) and the MELD score (OR 1.05, 95% CI 1.011-1.099; P=.014).
ConclusionsMCF is usually administered at a dose of 100mg/day, without loading dose and in 72.7% of cases as pre-emptive or empirical treatment. Factors that better predicted mortality were indicators of liver insufficiency at the time of starting treatment.
En las 2 últimas décadas se ha detectado en los pacientes críticos ingresados en los servicios o unidades de cuidados intensivos (UCI) un incremento de infecciones producidas por hongos, en especial por las diferentes especies de Candida1–5. Paralelamente se han descrito los escenarios clínicos en los que es frecuente identificar estas infecciones y se han propuesto diferentes escalas (Candida score, índice de Pittet) para seleccionar a aquellos pacientes con mayor riesgo de infección fúngica lo que ha llevado al desarrollo de nuevas estrategias terapéuticas (tratamiento anticipado)6–8. Diferentes sociedades científicas han publicado guías para el diagnóstico y tratamiento de estas infecciones coincidiendo todas ellas en la recomendación de utilizar candinas en el tratamiento empírico y dirigido de infecciones fúngicas probables o probadas en pacientes críticos con inestabilidad hemodinámica o exposición previa a azoles9–12.
En nuestro país existen comercializados 3 antifúngicos de la familia de las candinas. El último que fue aprobado para su uso clínico, en el año 2010, fue la micafungina (MCF)13. Este nuevo antifúngico ha demostrado una potente actividad in vitro frente a todas las especies de Candida spp., incluidas especies de C. no-albicans como Candida glabrata (C. glabrata) o Candida krusei que son más resistentes a fármacos como el fluconazol14,15. Su desarrollo clínico previo a la comercialización incluyó a más de 3.000 pacientes en distintos ensayos clínicos en todo el mundo, de los que más de 300 estaban en edad pediátrica16. La MCF ha demostrado su eficacia en estudios de equivalencia en candidiasis invasivas (adultos y niños, incluidos neonatos), en profilaxis de la infección por Candida spp. en pacientes sometidos a trasplante de células precursoras hematopoyéticas (adultos y niños, incluidos neonatos) y en la candidiasis esofágica (adultos) por lo cual ha sido aprobada para esas indicaciones por las agencias reguladoras de medicamentos16–21.
En los pacientes críticos la experiencia es limitada19 por lo que es necesario conocer en la práctica clínica real las indicaciones por las que se prescribe así como los factores que determinan la evolución de los pacientes en los que se administra. Por este motivo se ha desarrollado este estudio con la intención de describir el escenario de su utilización en el entorno de pacientes críticos, en UCI españolas.
Material y métodosDiseño del estudio. Estudio retrospectivo, observacional, de participación voluntaria y multicéntrico. Los datos se han obtenido de las historias clínicas de los pacientes ingresados en las UCI participantes. El estudio fue aprobado por el CEIC del hospital coordinador.
Sujeto de estudio. Se ha definido como el paciente ingresado en las UCI participantes entre marzo de 2011 y octubre de 2012 (ambos inclusive) que recibió MCF durante 5 o más días por cualquier motivo o indicación. El período de observación retrospectiva de cada paciente finalizó cuando el paciente fue dado de alta del hospital.
Variables del estudio. Para cada sujeto de estudio se ha cumplimentado un cuaderno de recogida de datos en el que se han incluido variables demográficas, características de los pacientes, nivel de gravedad al inicio del tratamiento valorados por el APACHE II22 y el SOFA23, motivos de indicación de MCF, localización de la infección, etiología, respuesta inflamatoria sistémica, dosis y días de tratamiento con MCF, forma de administración de la MCF (dosis de carga, primera elección, rescate, combinado), respuesta clínica y microbiológica, tolerabilidad, en especial función hepática valorada mediante la aplicación del índice MELD24 y del Child-Pugh25 al inicio y final del tratamiento con MCF, motivos de finalización y estado vital al alta de UCI y del hospital independientemente del motivo del exitus (mortalidad global). Los enfermos se clasificaron, de acuerdo con la enfermedad de base, en médicos, quirúrgicos, traumáticos y coronarios. Los pacientes coronarios fueron aquellos cuyo motivo de ingreso fue un síndrome isquémico agudo como angina o infarto de miocardio. Los pacientes traumáticos incluían a los pacientes cuyo motivo de ingreso eran lesiones agudas producidas por un traumatismo. Se incluyeron como pacientes quirúrgicos aquellos cuyo motivo de ingreso en UCI fue el control postoperatorio de una intervención programada. Los pacientes médicos eran aquellos cuyo motivo de ingreso no era ninguno de los anteriores, incluyéndose aquellos que ingresaron por complicaciones médicas después de una intervención quirúrgica.
Para identificar las distintas comorbilidades se han empleado las siguientes definiciones: diabetes mellitus, cuando el paciente precisa de insulina antes del ingreso en el hospital; enfermedad pulmonar obstructiva crónica, cuando se dispone de una espirometría forzada con una reducción del volumen espiratorio máximo en el primer segundo y del cociente volumen espiratorio máximo en el primer segundo/capacidad vital forzada; cirrosis hepática, si se ha confirmado mediante biopsia o existen signos de hipertensión portal como varices esofágicas o ascitis; neoplasia sólida, si se dispone de confirmación histológica; neoplasia hematológica, si está confirmada por diagnóstico de seguridad; inmunodeficiencia, si cumple los criterios de sida aceptados por los Centers for Disease Control 26 o si presenta otras inmunodeficiencias, ya sean congénitas o adquiridas; trasplante de órganos, si existe trasplante previo de pulmón, corazón, riñón, médula ósea u otros; neutropenia, si el recuento total de neutrófilos es menor de 500/l, previo al inicio del tratamiento con MCF; insuficiencia renal, cuando el paciente precisa cualquiera de las técnicas de depuración extrarrenal (hemodiálisis, diálisis peritoneal) en el momento de ingreso en el hospital; utilización de corticoides, si consume una dosis/día equivalente a 20mg de prednisona durante al menos 2 semanas; quimioterapia, haber recibido tratamiento con citostáticos en los 30 días previos al día del inicio de tratamiento con MCF, ya sea como tratamiento de una neoplasia, de un trasplante o por una enfermedad autoinmune. Los criterios utilizados para el diagnóstico de las distintas infecciones han sido los establecidos por los Centers for Disease Control27 y que son empleados en los estudios de vigilancia de pacientes críticos que se siguen en nuestro país28.
La variable principal del estudio ha sido la forma de prescripción de la MCF que se ha clasificado como: a) tratamiento profiláctico, b) tratamiento anticipado (sepsis grave, sin foco de infección), c) tratamiento empírico de una infección probada, y d) tratamiento dirigido de una infección documentada.
El tamaño muestral de este estudio observacional viene determinado por un criterio de viabilidad para llevar a cabo un estudio de estas características y no está basado, por tanto, en consideraciones de potencia estadística.
Análisis estadístico. Se presentan resúmenes descriptivos de los resultados en forma de tablas o gráficos. Las variables continuas se expresan como media, desviación estándar (DE), mínimo, percentil 25, percentil 50 (mediana), percentil 75 y las variables categóricas en forma de porcentajes de cada categoría. Con la finalidad de identificar las variables que mantienen asociación con la mortalidad intra-UCI, se llevó a efecto un análisis logístico multidimensional. En el análisis se incluyeron todas aquellas variables que en el análisis bivariado mostraron asociación significativa con la mortalidad. Las variables se introdujeron paso a paso en el modelo multivariante según el test de máxima verosimilitud hasta obtener el modelo final. Los análisis estadísticos se realizaron con el programa informático SPSS/18.0 (IBM Corp).
ResultadosSe han incluido 139 pacientes en 19 UCI (media 7,3; mínimo 1-máximo 20) con un APACHE II en el momento de iniciar el tratamiento con la MCF de 20,6 (DE 7,7) y un SOFA de 8,4 (DE 4,3). Entre sus características principales destacan una edad media de 57,3 (17,1) años, 89 (64%) eran hombres y las patologías de base predominantes fueron quirúrgicas (53,2%) y médicas (44,6%). La estancia de los pacientes en UCI y en el hospital fue de 23,5 [13-45] y 44 [25-78] días de mediana respectivamente. Presentaron numerosas comorbilidades entre las que destacan la diabetes mellitus (25,2%), inmunosupresión (23,0%), enfermedad pulmonar obstructiva crónica (18,7%), insuficiencia renal crónica (15,1%) y neoplasia sólida (15,1%). La mayoría de ellos utilizaban 4 o más dispositivos invasivos (84,2%), habían recibido antibióticos previamente (77%), precisaban de nutrición parenteral total (59%) y habían sido sometidos a cirugía antes de su ingreso en UCI (46%).
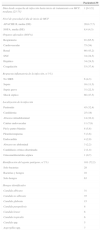
Las formas de prescripción de la MCF (tabla 1) fueron principalmente el tratamiento empírico de una infección probada en 51 (36,7%) casos, seguido del tratamiento anticipado en 50 (36,0%), en especial por aplicación del Candida score (32 casos), del tratamiento dirigido de una infección documentada en 23 (16,5%) y finalmente como profilaxis en 15 (10,8%) casos, en especial en el postoperatorio de cirugía gastroduodenal (10 casos) siendo menos frecuente como profilaxis en pacientes hematológicos con fiebre. Entre los motivos que han decidido su elección para tratamiento de una infección probada con o sin diagnóstico etiológico conocido (tabla 1) están la presencia de un paciente inestable (81; 58,3%), la sospecha de hongo multirresistente (78; 56,1%), la presencia de insuficiencia renal (62; 44,6%), la localización de la infección (60; 43,2%) y el espectro de MCF (57; 41,0%).
Formas de prescripción y motivos por los que se ha elegido micafungina para el tratamiento de pacientes críticos con sospecha o seguridad de infección fúngica
| Pacientes139 | |
|---|---|
| Formas de prescripción de MCF, n.o(%) | |
| Tratamiento profiláctico | 15 (10,8) |
| Postoperatorio de cirugía gastroduodenal | 10 (7,2) |
| Síndrome febril en paciente hematológico | 3 (2,2) |
| Tratamiento anticipado | 50 (36) |
| Aplicación del Candida score | 24 (17,3) |
| Candidiasis multifocal | 8 (5,8) |
| Tratamiento empírico de infección probada | 51 (36,7) |
| Tratamiento dirigido de infección probada | 23 (16,5) |
| Motivos de elección de MCF como tratamiento de una infección probada, n.o(%)a | |
| Paciente inestable | 81 (58,3) |
| Sospecha de resistencia a azoles | 78 (56,1) |
| Presencia de insuficiencia renal | 62 (44,6) |
| Localización de la infección | 60 (43,2) |
| Espectro de acción de MCF | 57 (41) |
| Protocolo del hospital | 36 (25,9) |
| Guías de uso de antifúngicos de la UCI | 25 (18) |
| Opinión del consultor | 25 (18) |
| Fracaso de tratamiento previo | 17 (12,2) |
| Identificación de un hongo resistente a azoles | 10 (7,2) |
| Intolerancia a antifúngicos previos | 2 (1,4) |
MCF: micafungina; UCI: unidad de cuidados intensivos.
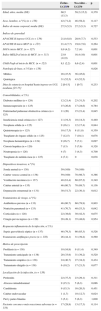
Las infecciones que motivaron la indicación de la MCF se incluyen en la tabla 2 predominando las peritonitis y/o abscesos abdominales (59; 42,4%) y las candidemias (25; 18,0%). En el 81,3% de los casos la infección se presentó como sepsis grave o shock séptico. La repercusión sistémica de las infecciones ha afectado predominantemente al aparato respiratorio (un 65,5% de los casos), al cardiovascular (54%) y al renal (43,2%). Se llegó a conocer el responsable de la infección en 101 casos y en 73 (53,5%) se identificaron uno o más hongos, en especial Candida albicans en 31 casos, y C. glabrata en 15 casos. En 7 ocasiones fue un Aspergillus spp.
Características de las infecciones tratadas con micafungina en pacientes críticos
| Pacientes139 | |
|---|---|
| Días desde sospecha de infección hasta inicio de tratamiento con MCF, mediana [25-75] | 1 [0-3,5] |
| Nivel de gravedad el día de inicio de MCF | |
| APACHE II, media (DE) | 20,6 (7,7) |
| SOFA, media (DE) | 8,4 (4,3) |
| Órganos afectados (SOFA) | |
| Respiratorio | 91 (65,5) |
| Cardiovascular | 75 (54) |
| Renal | 60 (43,2) |
| SNC | 34 (24,5) |
| Hepático | 34 (24,5) |
| Coagulación | 53 (37,4) |
| Respuesta inflamatoria de la infección, n.o(%) | |
| No SIRS | 6 (4,3) |
| Sepsis | 16 (11,5) |
| Sepsis grave | 31 (22,3) |
| Shock séptico | 66 (47,5) |
| Localización de la infección | |
| Peritonitis | 45 (32,4) |
| Candidemia | 25 (18) |
| Absceso intraabdominal | 14 (10,1) |
| Catéter endovascular | 11 (7,9) |
| Piel y partes blandas | 8 (5,8) |
| Pleuritis/empiema | 5 (3,6) |
| Endocarditis | 4 (2,9) |
| Absceso no abdominal | 3 (2,2) |
| Candidiasis crónica diseminada | 2 (1,4) |
| Osteomielitis/artritis séptica | 1 (0,7) |
| Identificación del agente patógeno, n.o(%) | 101 (72,2) |
| Solo bacterias | 28 |
| Bacterias y hongos | 10 |
| Solo hongos | 63 |
| Hongos identificados | |
| Candida albicans | 31 |
| Candida no albicans | 35 |
| Candida glabrata | 15 |
| Candida parapsilosis | 8 |
| Candida krusei | 6 |
| Candida tropicalis | 6 |
| Candida spp. | 5 |
| Aspergillus spp. | 7 |
APACHE: Acute Physiology and Chronic Health Evaluation; DE: desviación estándar; MCF: micafungina; SIRS: systemic inflammatory response syndrome; SNC: sistema nervioso central; SOFA: Sepsis-related Organ Failure Assessment.
La MCF se ha indicado como antifúngico de primera elección en 82 (59%) casos y como tratamiento de rescate en 57 (41%) en especial tras la utilización de fluconazol (34 ocasiones) y voriconazol (9 casos) (tabla 3). La mediana de días de estancia en UCI previos a la indicación de MCF fue de 7 [1-13,5] días. La dosis diaria más utilizada fue la de 100mg/día en 108 (77,7%) casos seguido de 150mg/día en 25 (18,8%). Solo en 9 (6,5%) casos se administró dosis de carga. La duración media del tratamiento con MCF ha sido de 13,1 (13) días, mediana 11 [6-14] días.
Características de empleo de la micafungina en pacientes críticos
| Pacientes139 | |
|---|---|
| Utilización previa de otros antifúngicos, n.o(%) | |
| Tratamiento de primera elección | 82 (59) |
| Tratamiento de rescate | 57 (41) |
| Antifúngicos utilizados previamente, n.o(%)a | |
| Fluconazol | 34 (24,5) |
| Anfotericina B (diversas formulaciones) | 8 (5,8) |
| Anidulafungina | 8 (5,8) |
| Caspofungina | 4 (2,9) |
| Voriconazol | 9 (6,5) |
| Posaconazol | 3 (2,2) |
| Itraconazol | 1 (0,7) |
| Días de uso de antifúngicos previos a MCF, mediana [25-75] | 7 [2,5-13,5] |
| Días de estancia en UCI hasta inicio de MCF, mediana [25-75] | 6 [1-13,5] |
| Dosis de carga, n.o(%) | |
| No | 130 (93,5) |
| 150 mg | 7 (5,0) |
| 200 mg | 2 (1,4) |
| Dosis diaria, n° (%) | |
| 50 mg | 1 (0,7) |
| 100mg | 108 (77,7) |
| 150mg | 25 (18) |
| 200mg | 3 (2,2) |
| Otras dosis | 2 (1,4) |
| Días de tratamiento con MCF, mediana[25-75] | 11 [6-14] |
MCF: micafungina; UCI: unidad de cuidados intensivos.
La respuesta clínica al finalizar el tratamiento con MCF fue valorada como de curación o mejoría en 72 (51,8%) ocasiones y de fracaso o sin cambios en 34 (24,4%) siendo el resto de caso no evaluables o indeterminados. La mayoría de los casos no evaluables correspondieron a tratamientos anticipados en los que no se pudo identificar una infección fúngica. La respuesta microbiológica fue clasificada como erradicación en 38 ocasiones (27,3%) y persistencia en 8 (5,8%) casos no siendo posible valorar la respuesta en el resto de los casos por falta de microbiología o por no realizarse seguimiento microbiológico. Los motivos para retirar la medicación se incluyen en la tabla 4.
Respuesta clínica y microbiológica de las infecciones tratadas con micafungina
| Pacientes139 | |
|---|---|
| Respuesta clínica al finalizar el tratamiento con MCF, n.o(%) | |
| Curación | 28 (20,1) |
| Mejoría | 44 (31,7) |
| Fracaso | 22 (15,8) |
| Sin cambios | 12 (8,6) |
| Indeterminado/no evaluablea | 33 (23,7) |
| Respuesta microbiológica al finalizar el tratamiento con MCF, n.o(%) | |
| Negativización de cultivos | 38(27,3) |
| No seguimiento microbiológico | 30 (21,6) |
| Persistencia del mismo hongo | 8 (5,8) |
| Aparición de otro microorganismo | 5 (3,6) |
| Indeterminado/no evaluableb | 58 (41,7) |
| Motivos de finalización tratamiento con MCF, n.o(%) | |
| Fin del tratamiento por curación o mejoría | 45 (32,4) |
| Exitus | 21 (15,5) |
| Cultivos para hongos negativos | 10 (7,2) |
| Ajuste o desescalada | 10 (7,2) |
| Fracaso terapéutico | 6 (4,3) |
| LET | 3 (2,2) |
| Reacciones adversas | 1 (0,7) |
| Retirada HVVC | 1 (0,7) |
HCVV: hemofiltración venovenosa continua; LET: limitación del esfuerzo terapéutico; MCF: micafungina.
El índice MELD se determinó al inicio del tratamiento en 111 ocasiones y en 104 pacientes en la semana posterior tras finalizar el tratamiento, siendo las medianas de 19 [11-24] y 14,5 [8-22] (p<0,001) respectivamente. La graduación de la función hepática mediante la aplicación de la escala de Child-Pugh se ha realizado en 124 casos al inicio del tratamiento y en 116 en la semana posterior a su finalización, observándose en las 2 ocasiones una mediana de 7 [6-8]. Los cambios en ambos índices durante el tratamiento con MCF se incluyen en la tabla 5. En 30 (21,6%) pacientes se han registrado 76 reacciones adversas durante la administración de MCF y solo una de ellas ha sido motivo de retirada de la medicación. Han predominado la presencia de hiperbilirrubinemia (11,5%), anemia (9,4%), fiebre (8,6%), hipocalcemia (7,2%), hipopotasemia (5,8%), hipomagnesemia (4,3%), diarrea (4,3%), bradicardia (1,4%), eritrodermia (1,4%), escalofríos (0,7%), dolores musculares (0,7%), náuseas (0,7%), fallo hepático (0,7%) y rash cutáneo y eosinofilia (0,7%). En 33 ocasiones los efectos adversos se han clasificado como moderados, en 30 como leves y en 13 como graves destacando en esta valoración 8 casos de hiperbilirrubinemia, 2 de anemia, y uno de hipocalcemia, de fiebre y un fallo hepático respectivamente. En 52 (68,4%) ocasiones la relación del efecto adverso con el uso de MCF ha sido valorada como dudosa, en 20 (26,3%) como posible y en 4 (5,3%) como probable, siendo clasificados en esta categoría un caso de fiebre, de hipomagnesemia, de fallo hepático y de rash cutáneo asociado a eosinofilia.
Valoración de la función hepática en pacientes críticos tratados con micafungina
| Pacientes139 | |
|---|---|
| Índice MELD al inicio del tratamiento, mediana [25-75] n=111 | 19 [11-24] |
| Índice MELD en la semana posterior a la finalización del tratamiento, mediana [25-75] n=104 | 14,5 [8-22] |
| Disminución del índice MELD durante el tratamiento, n.o (%) | 59 (42,4) |
| Incremento del índice MELD durante el tratamiento, n.o (%) | 25 (18) |
| Sin cambio durante el tratamiento, n.o (%) | 20 (14,4) |
| Índice de Child-Pugh al inicio del tratamiento, mediana [25-75], n=124 | 7 [6-8] |
| Índice de Child-Pugh en la semana posterior a la finalización del tratamiento, mediana [25-75] n=116 | 7 [6-8] |
| Disminución del Child-Pugh durante el tratamiento, n.o (%) | 35 (25,2) |
| Incremento del índice MELD durante el tratamiento, n.o (%) | 17 (12,2) |
| Sin cambio durante el tratamiento, n.o (%) | 64 (46) |
| Utilización de fármacos hepatotóxicos de forma simultánea con MCF | 37 (26,6) |
| Paracetamol | 15 (10,8) |
| Azolesa | 8 (5,8) |
| Eritromicina | 5 (3,6) |
| Metoclopramida | 5(3,6) |
| Omeprazol | 3 (2,2) |
| Metotrexato | 2 (1,4) |
| Otros | 12 (8,6) |
MCF: micafungina; MELD: model for end-stage liver disease.
Fueron exitus durante su estancia en UCI 59 (42,4%) pacientes y otros 16 después de alta de UCI (mortalidad hospitalaria 53,9%). En la tabla 6 se incluye el análisis bivariado de las variables analizadas dependiendo de la mortalidad intra-UCI. Los factores relacionados con mortalidad fueron: trasplante de médula ósea (p=0,038), uso de NTP (p=0,042), necesidad de depuración extrarrenal (p=0,012) y los indicadores de fracaso orgánico al inicio del tratamiento: SOFA (p<0,001), índice MELD (p<0,001) e índice de Child-Pugh (p<0,001). La localización del foco de infección en un catéter ha sido un factor asociado con menor mortalidad (p=0,024). Los factores con riesgo independientes de mortalidad intra-UCI fueron el índice de Child-Pugh (OR 1,45: IC 95% 1,162-1,813; p=0,001) y el índice MELD (OR 1,05; IC 95% 1,011-1,099; p=0,014) al inicio del tratamiento. La capacidad de discriminación del modelo se comprobó calculando el área bajo la curva y su intervalo de confianza del 95% obteniéndose un resultado de 0,752 (0,658-0,846).
Factores de riesgo relacionados con mortalidad intra-UCI. Análisis univariante
| Exitus-UCIa59 | No exitus -UCI79 | p | |
|---|---|---|---|
| Edad, años, media (DE) | 60,5 (13,3) | 58,2 (15,2) | 0,370 |
| Sexo, hombre, n.o(%) (n=138) | 42 (71,2) | 46 (58,2) | 0,117 |
| Índice de masa corporal, media (DE) | 27,5 (5,5) | 27,2 (5,3) | 0,727 |
| Índices de gravedad | |||
| APACHE II ingreso UCI, (n=134) | 21,8 (8,8) | 20,9 (7,7) | 0,533 |
| APACHE II inicio MCF (n=127) | 21,4 (7,7) | 19,8 (7,6) | 0,264 |
| SOFA inicio MCF, (n=127) | 9,9 (4,2) | 7,2 (4) | 0,001 |
| Índice MELD al inicio de MCF, (n=111) | 23,9 (12,9) | 16,4 (10) | 0,001 |
| Child-Pugh al inicio de MCF, (n=123) | 8,1 (2,2) | 6,6 (2,4) | 0,001 |
| Patología de base, n.o(%)(n=138) | 0,826 | ||
| Médica | 28 (47,5) | 36 (45,6) | |
| Quirúrgica | 31 (52,5) | 43 (52,5) | |
| Días de estancia en hospital hasta ingreso en UCI, mediana [25-75] | 2 [0-15] | 1 [0-7] | 0,233 |
| Comorbilidades, n.o(%) | |||
| Diabetes mellitus (n=129) | 12 (21,4) | 23 (31,5) | 0,202 |
| Inmunosupresión (n=125) | 15 (26,8) | 17 (24,6) | 0,784 |
| Enfermedad pulmonar obstructiva crónica (n=125) | 11 (20) | 15 (21,4) | 0,845 |
| Insuficiencia renal crónica (n=127) | 11 (19,3) | 10 (14,3) | 0,440 |
| Neoplasia sólida (n=125) | 9 (16,1) | 12 (17,4) | 0,844 |
| Quimioterapia (n=125) | 10 (17,5) | 8 (11,8) | 0,359 |
| Trasplante de órgano sólido (n=125) | 7 (12,5) | 7 (10,1) | 0,678 |
| Neoplasia hematológica (n=124) | 9 (16,7) | 5 (7,1) | 0,097 |
| Cirrosis hepática (n=120) | 7 (13) | 5 (7,6) | 0,328 |
| Neutropenia (n=126) | 4 (7) | 3 (4,3) | 0,700 |
| Trasplante de médula ósea (n=125) | 4 (7,1) | 0 | 0,038 |
| Dispositivos invasivos, n.o(%) | |||
| Sonda uretral (n=138) | 59 (100) | 79 (100) | |
| Catéter venoso central (n=138) | 59 (100) | 78 (98,7) | 0,386 |
| Ventilación mecánica (n=137) | 48 (81,4) | 68 (87,2) | 0,349 |
| Catéter arterial (n=135) | 46 (80,7) | 70 (89,7) | 0,136 |
| Depuración extrarrenal (n=131) | 30 (51,7) | 22 (30,1) | 0,012 |
| Tratamientos de riesgo, n.o(%) | |||
| Antibióticos previos (n=133) | 46 (80,7) | 60 (78,9) | 0,803 |
| Nutrición parenteral (n=133) | 41 (70,7) | 40 (53,3) | 0,042 |
| Corticoides (n=128) | 22 (38,6) | 30 (42,3) | 0,675 |
| Cirugía previa ingreso (n=129) | 28 (49,1) | 35 (48,6) | 0,954 |
| Respuesta inflamatoria de la infección, n.o(%) | |||
| Sepsis grave/shock séptico (n=137) | 46 (79,3) | 66 (85,3) | 0,526 |
| Tratamiento antifúngico previo (n=138) | 26 (44,1) | 31 (39,2) | 0,569 |
| Motivo de prescripción | |||
| Profilaxis (n=138) | 10 (16,9) | 9 (11,4) | 0,349 |
| Tratamiento anticipado (n=138) | 20 (33,9) | 31 (39,2) | 0,520 |
| Tratamiento empírico (n=138) | 24 (40,7) | 27 (34,2) | 0,434 |
| Tratamiento dirigido (n=138) | 6 (10,2) | 17 (21,5) | 0,077 |
| Localización de la infección, (n=138) | |||
| Peritonitis | 22 (37,3) | 23 (29,1) | 0,311 |
| Absceso intraabdominal | 9 (15,3) | 5 (6,3) | 0,086 |
| Candidemia | 9 (15,3) | 16 (20,3) | 0,451 |
| Catéter endovascular | 1 (1,7) | 10 (12,7) | 0,024 |
| Piel y partes blandas | 3 (5,1) | 5 (6,3) | 1,000 |
| Paciente con una o más reacciones adversas (n=134) | 17 (28,8) | 13 (17,3) | 0,114 |
APACHE: Acute Physiology and Chronic Health Evaluation; DE: desviación estándar; MCF: micafungina; MELD: model for end-stage liver disease; SOFA: Sepsis-related Organ Failure Assessment; UCI: unidad de cuidados intensivos.
La principal aportación de este estudio ha sido describir el escenario clínico en el que se emplea MCF en pacientes críticos ingresados en UCI españolas. La mayoría de la información clínica disponible de la utilización de este antifúngico se basa en estudios aleatorizados, prospectivos, doble ciego, en los que los pacientes son seleccionados según rígidos criterios de inclusión y múltiples criterios de exclusión y en los que los pacientes críticos son solo una parte de ellos17,18,20,21.
La administración de MCF se realizó en casi la mitad de los casos como profilaxis o tratamiento anticipado en situaciones clínicas en las que el riesgo de desarrollo de una infección fúngica podría influir en la evolución de la enfermedad de base. Así, en nuestro estudio, se ha empleado como profilaxis en el postoperatorio de pacientes de cirugía gastroduodenal en la que se conoce una mayor presencia de hongos cuando se produce el fallo de sutura y la peritonitis secundaria, y también en el manejo del síndrome febril (sin infección documentada) en pacientes neutropénicos. Las evidencias de su efectividad en el primer escenario son escasas. Un reciente estudio, prospectivo, multicéntrico, comparativo y doble ciego, aun no publicado (http://clinicaltrials.gov/show/NCT01122368) ha comparado la administración de MCF frente a placebo en el postoperatorio de pacientes con alto riesgo quirúrgico sin demostrar diferencias en la tasa de infecciones fúngicas comprobadas entre ambos grupos (un 8,9% versus un 11,1% para el placebo y MCF respectivamente). Sobre el tratamiento de la neutropenia febril se han publicado varios estudios clínicos. En un ensayo clínico comparativo con fluconazol en pacientes trasplantados con células hematopoyéticas, la MCF demostró superioridad con respecto al comparador29, y en los estudios abiertos no comparativos en pacientes en tratamiento con quimioterapia por enfermedad hematológica maligna30–35 ha demostrado su efectividad en el manejo de la neutropenia febril. De igual manera se utiliza la MCF en pacientes con candidiasis multifocal o por aplicación del Candida score. En ambos casos se conoce la existencia de una colonización previa por Candida spp. y existen otros factores de riesgo que se han relacionado con infección fúngica invasiva. Un estudio reciente36 ha validado la fiabilidad del Candida score en la detección de infección fúngica invasiva y ha demostrado que los pacientes con cirugía abdominal complicada con un valor de Candida score>3 puntos desarrollaron una infección fúngica invasiva en el 30,3% de los casos lo que justificaría la utilización de antifúngicos en esta situación clínica.
En la otra mitad de los casos se ha empleado la MCF para el tratamiento de infecciones probadas en las que se sospecha o se conoce la presencia de hongos siendo este el escenario en el que se han realizado la mayoría de los ensayos clínicos con este antifúngico16–21. Las infecciones en las que se ha utilizado MCF en nuestro estudio con mayor frecuencia han sido peritonitis y/o abscesos abdominales y candidemias. Mientras que en candidemias existe evidencia con un número suficiente de pacientes en el que se demuestra su equivalencia en la respuesta clínica y microbiológica frente a caspofungina17 y anfotericina B liposomal18, no ocurre lo mismo en infecciones abdominales complicadas en las que el número de casos incluido fue muy reducido. La serie de pacientes de nuestro estudio sería una de las que aporta mayor información de la utilización de la MCF en este tipo de infecciones. En estudios experimentales previos37,38, la MCF ha demostrado conseguir concentraciones superiores a 1μg/ml en líquido ascítico y en exudado peritoneal en pacientes con peritonitis y una relación pK/pD en exudado peritoneal>100 para la mayoría de las cepas de Candida spp. lo que aseguraría su eficacia en el lugar de la infección aunque se necesita más información clínica para valorar su superioridad con respecto a las otras candinas.
En la práctica clínica real los pacientes en los que se ha indicado MCF en nuestro estudio están más graves que los incluidos en los estudios realizados en las fases previas a su comercialización e ingresados en UCI19, en la mayoría de los casos con fracaso de 2 o más órganos o sistemas como lo demuestra el valor del SOFA en el momento de su prescripción (superior a 8 puntos), con numerosas comorbilidades entre las que destaca la presencia de neoplasias sólidas o hematológicas en una cuarta parte de los casos. Este modelo de paciente ha aumentado su presencia en las UCI de nuestro país, como indican los datos del registro ENVIN-UCI en el año 2013, en el que el 13,4% de los pacientes ingresados más de 24h tenían un cáncer activo39.
La mayoría de los pacientes del presente estudio en los que se ha utilizado MCF precisaron de técnicas invasivas para el tratamiento o monitorización de las enfermedades de base y/o del fracaso de órganos o sistemas asociados a la enfermedad de base y a sus complicaciones. Casi todos precisaron ventilación mecánica y monitorización hemodinámica, y en una tercera parte, necesitaron técnicas de depuración extrarrenal. En esta última situación clínica se han realizado estudios específicos con las 3 candinas comercializadas40–42, observándose pequeñas diferencias en la adsorción de las moléculas a la membrana, que favorecen a MCF, sin que se haya podido demostrar por ello un impacto clínico relevante. En un estudio de práctica habitual que emplea los cartuchos utilizados mayoritariamente en nuestro país, la MCF ha demostrado niveles adecuados desde la primera dosis sin necesidad de dosis de carga40.
La mayoría de los hongos responsables de las infecciones tratada con MCF son del género Candida. Más de la mitad pertenecen a especies de Candida-no albicans, en especial C. glabrata. Esta proporción es frecuente en la etiología de las infecciones por hongos de pacientes críticos ingresados en UCI en las que predominan mayoritariamente las infecciones por Candida spp. (>95%) siendo mucho menos frecuentes las infecciones por Aspergillus spp. Aunque la única candina que tiene indicación para el tratamiento de las infecciones por Aspergillus spp. es la caspofungina43, en nuestro estudio se han tratado infecciones por este microorganismo con MCF en la mayoría de los casos en asociación con otros antifúngicos. Existen datos microbiológicos que demuestran la eficacia microbiológica de la MCF sobre Aspergillus44 pero la información clínica disponible es escasa y limitada a estudios observacionales45.
La respuesta clínica de la utilización de MCF en la práctica clínica es compleja de determinar ya que en la mitad de las indicaciones se ha utilizado como profilaxis o como tratamiento anticipado donde el objetivo era evitar que se desarrollara una infección producida por hongos. De igual manera, la respuesta microbiológica es difícil de evaluar ya que en los casos de profilaxis no existía una identificación previa de hongos y en los casos de tratamiento anticipado los aislamientos de hongos se han producido en muestras biológicas de mucosas sin significado clínico patológico. Solo en los casos en los que exista una infección fúngica probada como es la candidemia, es posible evaluar la respuesta clínica y microbiológica.
La mortalidad intra-UCI de los pacientes incluidos en nuestro estudio es elevada, superior al 42% y en general superior a la de los estudios aleatorizados de candidemias y/o candidiasis invasivas en los que se empleó MCF. En esos estudios la mortalidad osciló en torno al 30%17–19. Es posible que estas diferencias se deban a que en los ensayos clínicos se excluyeron los pacientes con elevado riesgo de fallecer y con fracasos establecidos de órganos o sistemas, mientras que en nuestro caso se analizaron todos aquellos que utilizaron MCF durante 5 o más días sin excluir a ningún paciente por la patología de base.
Los factores que se han asociado de forma independiente con la mortalidad intra-UCI han sido los indicadores de daño hepático, el índice MELD y el índice de Child-Pugh calculados el día de inicio del tratamiento con MCF. Ambos indicadores expresan el grado de fracaso de la función hepática y en nuestro estudio discriminaron la evolución de los pacientes mejor que otros indicadores de gravedad como el APACHE II y el SOFA. Estos indicadores de función hepática no se incluyen habitualmente en la valoración de los pacientes ingresados en UCI por lo que se desconoce su capacidad predictiva de evolución en la población de pacientes críticos. Ningún paciente en los que se utilizó MCF presentaba signos de hepatopatía grave en el momento de iniciar el tratamiento con MCF aunque en una cuarta parte de los casos se observó un empeoramiento del índice MELD y/o del índice de Child-Pugh durante el tratamiento por lo que se recomienda controlar ambos indicadores en aquellos pacientes con función hepática alterada en el momento de iniciar el tratamiento con MCF.
Las principales limitaciones de nuestro estudio se relacionan con su diseño retrospectivo y multicéntrico que introduce un sesgo de valoración, ya sea por la intervención de múltiples observadores, ya sea por las limitaciones de la documentación archivada ya que en algún caso no se ha encontrado información de todas las variables incluidas en el cuaderno de recogida de datos. Por otro lado, la valoración de la respuesta clínica y microbiológica está condicionada por el motivo de indicación del antifúngico no siendo igual para los casos en los que se emplea para tratamiento como para los casos en los que se utiliza como profilaxis. Finalmente, los indicadores de gravedad Child-Pugh y el índice MELD han sido desarrollados para pacientes con cirrosis hepática y hasta el momento no se han validado en pacientes no cirróticos.
En resumen, nuestro estudio ha identificado varios tipos de pacientes críticos (médicos y quirúrgicos) en los que se utiliza MCF, los motivos por los que se ha utilizado, las infecciones en las que es más frecuente su empleo y los factores de riesgo relacionados con la evolución en UCI. En este sentido, en esta población los indicadores que mejor discriminan la evolución de los pacientes son aquellos que evalúan la función hepática en el momento de iniciar el tratamiento.
FinanciaciónEl estudio ha sido financiado en parte con una donación de Astellas. España.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Debemos agradecer la colaboración de Sergio Mojal, del Instituto Municipal de Investigación del Hospital del Mar por su asesoramiento metodológico y análisis estadísticos.
Los médicos y los hospitales que forman parte del Grupo de Estudio de Micafungina en UCI, ordenados por casos aportados al estudio, son los siguientes: A. Villasboas, A. Pérez, F. Álvarez Lerma, Hospital del Mar. Barcelona (20 casos); C. López Rojas, H. Puigderrajols, M. Pérez-Carrasco, J. Rello, Hospital General Vall d’ Hebrón. Barcelona (19 casos); J.D. Jiménez Delgado, M. Cidoncha Gallego, Hospital Don Benito-Villanueva. Badajoz (12 casos); M.V. Trasmonte Martínez, Hospital Infanta Cristina. Badajoz (12 casos); M. Nieto Cabrera, C. Gijón Moreno, Hospital Clínico San Carlos. Madrid (10 casos); G. Parra Larregui, A. Zapata González, Hospital La Vega. Murcia (10 casos); E. Herrero Gutiérrez, Hospital Torrevieja Salud. Torrevieja (Alicante) (10 casos); B. Balsera Garrido, M. Vallverdú Vidal, Hospital Universitari Arnau de Vilanova. Lleida (9 casos); J. Ballesteros Herráez, S. Martín Oliva, M.T. Martín Posadas, Hospital Clínico. Salamanca (8 casos); J.E. Romo Gonzales, Hospital Universitario de Guadalajara (6 casos); J.L. Teja Barbero, Hospital Marqués de Valdecillas. Santander (UCI 1) (5 casos); F. Vecilla Morilla, Fundación Hospital Manacor, Baleares (4 casos); J.L. Teja Barbero, Hospital Marqués de Valdecillas. Santander (UCI 3) (3 casos); J. Almirall Pujol, Hospital de Mataró. Consorce Sanitari Maresma. (Barcelona) (3 casos); A. Rodríguez Oviedo, Hospital Universitari Joan XXIII (2 casos); I. Lipperheide Vallhonrat, Clínica Puerta de Hierro. Madrid (2 casos); B. Alvarez Sánchez, Hospital General Universitario. Alicante (2 casos); E. Alamparte, A. Ortega Montes, Hospital Montecelo. Pontevedra (1 caso); A. Silva, Hospital Clínic. Barcelona (1 caso).