Evaluar si un modelo experimental de lesiones tipo masa (LM) transitoria en rata produce la liberación precoz a sangre periférica de enolasa neuroespecífica (NSE) y proteína S100B como expresión del daño cerebral inducido.
DiseñoEstudio experimental con grupo control.
ÁmbitoQuirófano experimental del Instituto de Biomedicina (IBiS) del Hospital Universitario Virgen del Rocío.
ParticipantesCatorce ratas adultas Wistar.
IntervencionesSe extrajo muestra sanguínea basal y posteriormente se realizó: grupo LM, a través de un trépano, se infló el globo de una sonda con 500μL/20s; posteriormente, se realizaron 4 extracciones sanguíneas cada 20min. Grupo control, se repitieron de forma sistemática todos los pasos salvo que no se realizo trépano.
Variables de interés principalPeso, mortalidad precoz, concentración en suero de NSE y S100B.
ResultadosEncontramos diferencias entre las concentraciones de NSE y S100B a lo largo del tiempo dentro del propio grupo LM (p<0,001), no sucediendo este hecho en el grupo control. Excepto en la determinación basal, encontramos diferencias en los valores medios de NSE y S100B entre ambos grupos. Tras el daño cerebral, la NSE y la S100B presentaron un incremento progresivo en el tiempo en todas las determinaciones realizadas con una r=0,765; p=0,001, y r=0,628; p=0,001, respectivamente. Por contra, en el grupo control no encontramos dicha correlación para ninguno de los dos biomarcadores.
ConclusionesLas concentraciones en suero de NSE y S100B reflejan de forma precoz el daño cerebral que acontece sobre la sustancia gris y blanca en un modelo experimental de LM en rata.
To determine whether a model of transient mass-type brain damage (MTBD) in the rat produces early release of neurospecific enolase (NSE) and protein S100B in peripheral blood, as an expression of the induced brain injury.
DesignAn experimental study with a control group.
SettingExperimental operating room of the Institute of Biomedicine (IBiS) of Virgen del Rocío University Hospital (Seville, Spain).
ParticipantsFourteen adult Wistar rats.
InterventionsBlood was sampled at baseline, followed by: MTBD group, a trephine perforation was used to insert and inflate the balloon of a catheter at a rate of 500μl/20sec, followed by 4 blood extractions every 20min. Control group, the same procedure as before was carried out, though without trephine perforation.
Primary study variablesWeight, early mortality, serum NSE and S100B concentration.
ResultsDifferences in NSE and S100B concentration were observed over time within the MTBD group (P<.001), though not so in the control group. With the exception of the baseline determination, differences were observed between the two groups in terms of the mean NSE and S100B values. Following MTBD, NSE and S100B progressively increased at all measurement timepoints, with r=0.765; P=.001 and r=0.628; P=.001, respectively. In contrast, the control group showed no such correlation for either biomarker.
ConclusionsSerum NSE and S100B concentrations offer an early indication of brain injury affecting the gray and white matter in an experimental model of mass-type MTBD in the rat.
El traumatismo craneoencefálico (TCE) grave es una patología heterogénea y compleja, dado que las lesiones encefálicas suelen ser múltiples, los mecanismos lesionales diferentes y las respuestas entre individuos variables según edad y comorbilidades asociadas. Entre los mecanismos lesionales que ensombrecen el pronóstico vital y funcional de los pacientes, la hipertensión endocraneal no controlada se reconoce, desde hace mucho tiempo, como un factor fundamental. En la génesis de la hipertensión endocraneal traumática sostenida, aproximadamente, entre un 30-50% el factor subyacente son las lesiones tipo masa (LM) en nuestro medio1–3. Sin embargo, el efecto deletéreo sobre las estructuras encefálicas de las elevaciones transitorias de la presión intracraneal (PIC) en el TCE grave por LM no está bien documentado, debido a la dificultad de su estudio en la cabecera del paciente. Por tanto, para profundizar en el conocimiento del daño cerebral provocado por el aumento transitorio de la PIC, es crucial el empleo de modelos experimentales que nos permitan desarrollar situaciones específicas y reproducibles. Si bien son numerosos los estudios en modelos animales de TCE, hasta donde conocemos, los modelos de experimentación animal que emulan LM se han centrado únicamente en la valoración de aspectos relacionados con la neuromonitorización invasiva y las técnicas de imagen4–7. Actualmente, los biomarcadores de daño cerebral, en los que nuestro grupo se ha centrado para investigar su capacidad diagnóstica y predictiva, así como en las rutas asociadas a la lesión cerebral secundaria desde un punto de vista clínico, permiten explorar si una determinada lesión primaria o secundaria, como es el caso del aumento de la PIC, provocan daño cerebral2,8–12.
Entre los diversos biomarcadores de daño cerebral estudiados, actualmente, la enolasa neuroespecífica (NSE) y la proteína (Pt) S100B son los dos más precisos en este campo13–18. La NSE, una isoenzima dimérica de un peso molecular de 78kDa se encuentra, principalmente, en el citoplasma de las neuronas y, en menor medida, en plaquetas y eritrocitos. Este hecho hace que sus determinaciones puedan verse afectadas ante la hemólisis de la muestra sanguínea19,20. La función de esta enzima se encuentra relacionada con los aumentos de cloruro durante la actividad neuronal. Tras el daño cerebral, la NSE es liberada de forma pasiva tras la rotura celular. Su vida media se encuentra estimada en 24h, y su aclaramiento es renal13,17,18,21. La Pt S100B forma parte de las estructura de los astrocitos y de las células de Schwann2,8,10. Se han descrito localizaciones extracraneales, como en los tumores tipo melanoma, en el musculo esquelético, la piel y la grasa16. Es una proteína fijadora de calcio, de bajo peso molecular (21kDa), eliminada por vía renal con una vida media estimada entre 30min y 2h10,16. En condiciones fisiológicas sus concentraciones son bajas (nM) y actúa como factor neurotrópico22. Tras la lesión cerebral, sus niveles aumentan por una combinación de fenómenos pasivos, tras la lesión de los propios astrocitos, así como por secreción activa22,23.
El objetivo del presente trabajo es evaluar si un modelo experimental de LM transitoria en rata induce la liberación precoz a sangre periférica de NSE y Pt S100B como expresión del daño cerebral inducido.
Material y métodoLos procedimientos se llevaron a cabo en el quirófano experimental del Instituto de Biomedicina de Sevilla (IBiS) del Hospital Universitario Virgen del Rocío de Sevilla. Este proyecto de investigación fue supervisado y aprobado por el comité de experimentación animal de nuestro centro antes de su inicio. Se cumplieron todas las normas éticas de investigación y los requerimientos legales que establece la legislación correspondiente (Directiva 2010/63/EU).
El modelo de trabajo se realizó mediante el uso de ratas Wistar. Los procedimientos se desarrollaron en machos para eliminar la influencia hormonal del ciclo estral. Hasta el momento de la intervención, los animales fueron estabulados en jaulas independientes, en un lugar seco, apartado de fuentes infecciosas y áreas quirúrgicas. Se mantuvo una temperatura estable entre 23 y 27°C, así como un ciclo de luz/oscuridad de 12h. Se les proporcionó alimento y agua sin restricciones hasta el momento de la cirugía.
Los animales fueron anestesiados haciendo uso de una preparación compuesta por: 50mg de hidrocloruro de ketamina (Ketolar©, Pfizer; 50mg/cc), 2cc de xilacina (Rompun© 2%, Bayer; 20mg/cc) y 1mg de atropina (Atropina Bayer©, 1mg/cc). La dosis óptima, para lograr un buen grado de analgesia y sedación, fue establecida en 0,025 cc/g inyectados a nivel intraperitoneal. La efectividad de dicha dosis había sido previamente testada por nuestro grupo en otros modelos de experimentación11. Se consideró una profundidad anestésica apropiada ante la ausencia del reflejo corneal, así como ausencia del reflejo de retirada tras la presión en las patas inferiores. En ese momento, el peso del animal era registrado y se rasuraba la región cefálica e inguinal de forma bilateral. Se monitorizó la frecuencia cardiaca y respiratoria durante el procedimiento. Durante la intervención el animal permanecía en respiración espontánea. Para evitar el desarrollo de hipotermia, se utilizaron mantas térmicas y un soporte térmico (KDH Hot Plate. Kedee. China Jinhua Kedi co. Ltd.) que garantizara una temperatura de 37°C. Una vez finalizado el procedimiento, el animal era sacrificado mediante una dosis letal de ketamina (0,01cc/kg). Se consideró mortalidad precoz cuando el animal fallecía antes de lo esperado, de forma no controlada.
Grupos de estudio y procedimientosSe desarrollaron 2 grupos de estudio:
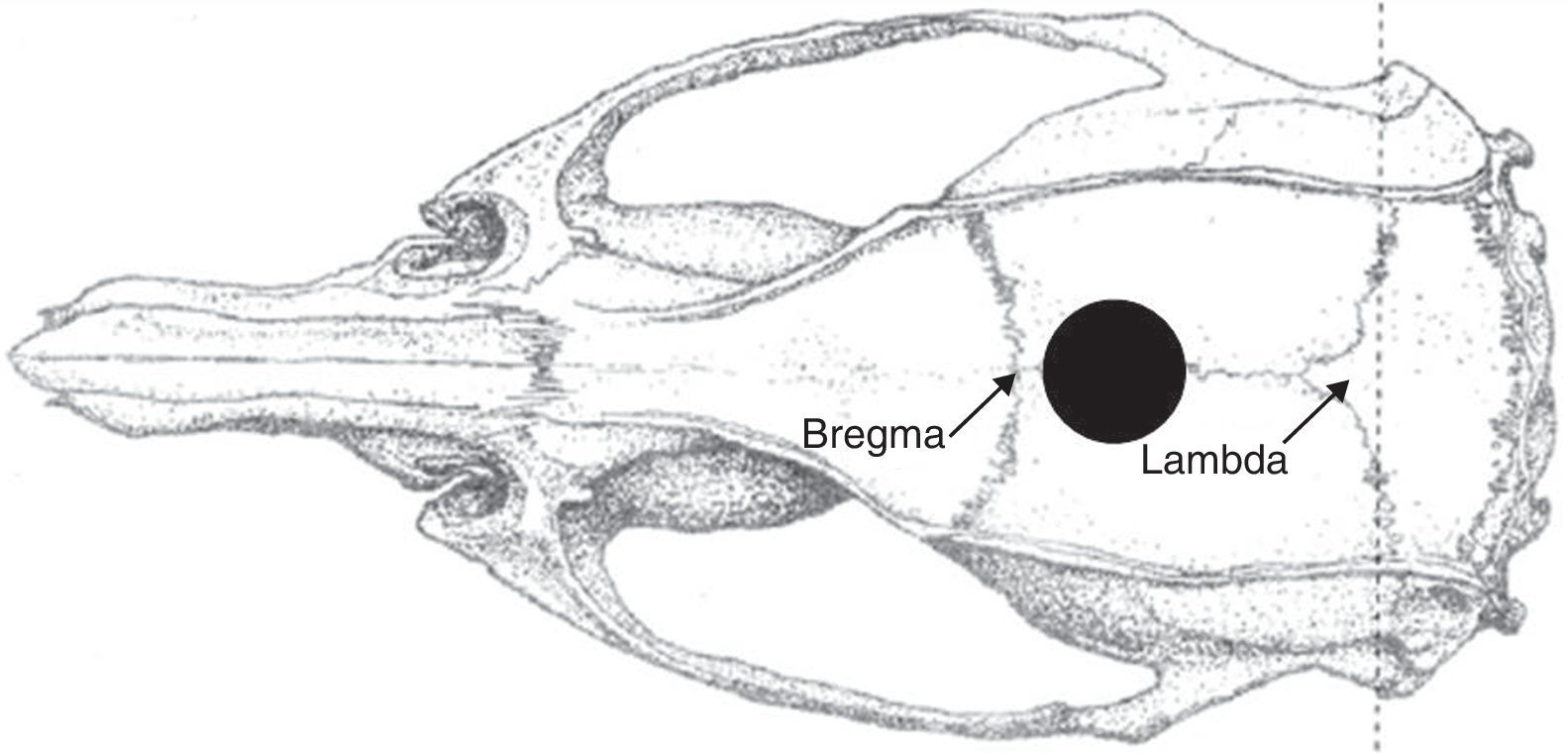
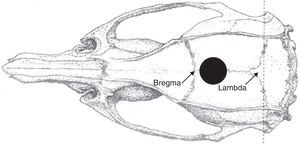
Grupo LM: modelo de lesión cerebral tipo masaComo primer paso, el animal era situado en decúbito supino. Haciendo uso de una lente binocular, se practicaba incisión a nivel inguinal con apertura por planos, hasta exponer la vena femoral. En dicho momento se realizaba extracción de la muestra sanguínea basal. Una vez realizada la hemostasia pertinente y aproximando los extremos cutáneos con seda, los animales se inmovilizaban en decúbito prono en un marco estereotáxico (Stoelting©). La nariz era situada en el mismo eje del cuerpo, usando el sistema de sujeción del propio marco, con precaución de no atrapar la lengua. Posteriormente, se inmovilizaba la cabeza mediante los fijadores laterales. Estos eran ajustados hasta reconocer el reflejo timpánico-ocular. Tras esto se practicaba una incisión en la línea media de la cabeza, para exponer el cráneo. Tal y como se muestra en la figura 1, en la región inmediatamente posterior al punto bregma se practicaba un trépano. A través de este orificio, se introducía una sonda modificada de silicona tipo foley (Argyle©) de 6 French. Una vez alojada la sonda en el espacio epidural, se inflaba el balón de su extremo distal con 500μL de suero fisiológico durante 20s. Finalmente, el balón se desinflaba y se extraía rápidamente la sonda. Una vez en el exterior, se confirmaba que el balón continuaba intacto tras el procedimiento y que no había sido rasgado tras su paso por el trépano.
Una vez concluido el procedimiento, el animal se soltaba del marco estereotáxico. Tras situarlo en decúbito supino, se realizaban cuatro extracciones sanguíneas sucesivas, alternando ambas venas femorales, cada 20min. Tras la última extracción, se administraba una dosis letal de ketamina. Una vez fallecido el animal, mediante craniectomía, se exponía el encéfalo. De esta forma se constataba, de forma macroscópica, que la sonda no hubiera perforado la duramadre, ni se hubiera introducido a nivel intraparenquimatoso.
Grupo controlEn este grupo se repitieron de forma sistemática todos los pasos expuestos en el grupo LM, salvo que una vez posicionado el animal en el marco estereotáxico con el cráneo expuesto, no se practicó el trépano ni se introdujo la sonda. Se mantuvo estrictamente la secuencia temporal de extracciones sanguíneas descrita previamente. Tampoco se hizo craniectomía para la comprobación del encéfalo una vez fallecido el animal.
Determinaciones sanguíneasPara la determinación de los niveles séricos de NSE y Pt S100B, las muestras de sangre fueron recogidas en tubos de 1,5mL con gel separador. Tras los procedimientos, los tubos fueron centrifugados a 13.300rpm durante 5min. Los sueros obtenidos se alicuotaron en criotubos y fueron almacenados en ultracongeladores a −80°C hasta su análisis.
Determinación de los niveles de enolasa neuroespecíficaLa cuantificación de los niveles séricos de NSE se realizó mediante un método de inmunoanálisis de electroquimioluminiscencia. El kit comercial empleado fue el Elecsys 2010 immunoassay system (Roche Diagnostics, Alemania). Este kit emplea una técnica tipo sándwich con una duración total de 18min y un volumen mínimo de muestra de 20μL. El límite inferior de detección es de 0,05μg/L. Valores inferiores a 370μg/L pudieron ser cuantificados sin dilución. Los estudios de repetitividad y precisión intermedia de la técnica muestran una desviación estándar <3,87μg/L y un coeficiente de variación <4,4%.
Determinación de los niveles de proteína S100BLa cuantificación de los niveles de Pt S100B (μg/L) se realizó mediante inmunoanálisis de electroquimioluminiscencia, para lo cual se utilizó el kit comercial Elecsys 2010 immunoassay system (Roche Diagnostics, Alemania). Este test es capaz de cuantificar los dímeros S100AB así como los S100BB. Sigue una técnica tipo sándwich la cual tiene una duración total de 18min y requiere un volumen de muestra de 20μL. El intervalo de medición es de 0,005-39μg/L. Los valores inferiores al límite de detección se indicaron como <0,005μg/L y los superiores fueron diluidos hasta obtener un valor cuantitativo (en ningún caso fue necesario). Los estudios de repetitividad y precisión intermedia de la técnica muestran una desviación estándar <0,056μg/L y un coeficiente de variación <2,8%.
Análisis estadísticoSe realizó un análisis exploratorio y descriptivo de los datos, calculándose estimadores puntuales e intervalos de confianza al 95% (IC 95%) para las distintas variables incluidas en el estudio.
Para la comparación de las variables numéricas (peso, concentración serológica de NSE y Pt S100B) de los animales entre los 2 grupos (LM y control) se utilizó el test de comparación de medias t-Student, una vez validados los requisitos de independencia, aleatoriedad, normalidad e igualdad de varianzas.
Se realizó un análisis de la varianza de medidas repetidas considerando como factor intrasujeto las concentraciones de NSE y Pt S100B varias veces en cada animal (momento basal, a los 20, 40, 60 y 80min). Como factor intersujeto se consideró el grupo al que pertenecían las determinaciones (grupo LM y control). Este procedimiento del modelo lineal general contrasta hipótesis nulas sobre los efectos tanto del factor intersujetos como del factor intrasujeto, permitiendo estudiar las interacciones entre los factores y los efectos individuales de estos. El procedimiento ofrece un análisis univariado y multivariado para datos de medidas repetidas. Se realizan comparaciones «a posteriori » con la corrección de Bonferroni para identificar en qué momentos (basal, a los 20, 40, 60 y 80min) se han producido las diferencias detectadas.
Por último, la relación entre el tiempo y la concentración de los biomarcadores de lesión cerebral en cada uno de los grupos estudiados fue valorada mediante el coeficiente de correlación de Pearson o Spearman según criterios de aplicación, aplicando el test de correlación o independencia para valorar la significación de la asociación en cada uno de los grupos estudiados.
Para los contrastes de hipótesis se consideró un nivel de significación del 0,05 en todos los casos.
Para llevar a cabo el análisis, se utilizó Statistical Package for the Social Sciences (SPSS) (versión 20.0, Chicago, IL, EE. UU.).
ResultadosFueron intervenidos un total de 14 animales. La distribución entre ambos grupos fue la siguiente: 10 animales en el grupo LM y 4 animales en el grupo control.
El peso medio de los animales del grupo LM fue de 371,8g (DE 34,7g) y del grupo control de 377,0g (DE 30,4g). No encontramos diferencias estadísticamente significativas en la distribución del peso de los animales entre ambos grupos, siendo la diferencia de las medias de peso de −5,1g (IC 95%: −50,8 a 40,6), p=0,808.
La inspección macroscópica del encéfalo no mostró en ningún caso que el balón o la sonda hubieran perforado la duramadre, quedando alojadas en el espacio epidural. La mortalidad precoz en el grupo LM fue de 2 animales (16,6%). Estas muertes acontecieron inmediatamente después de realizarse el daño cerebral mediante el inflado del balón. No hubo ningún animal que falleciera antes de lo previsto en el grupo control.
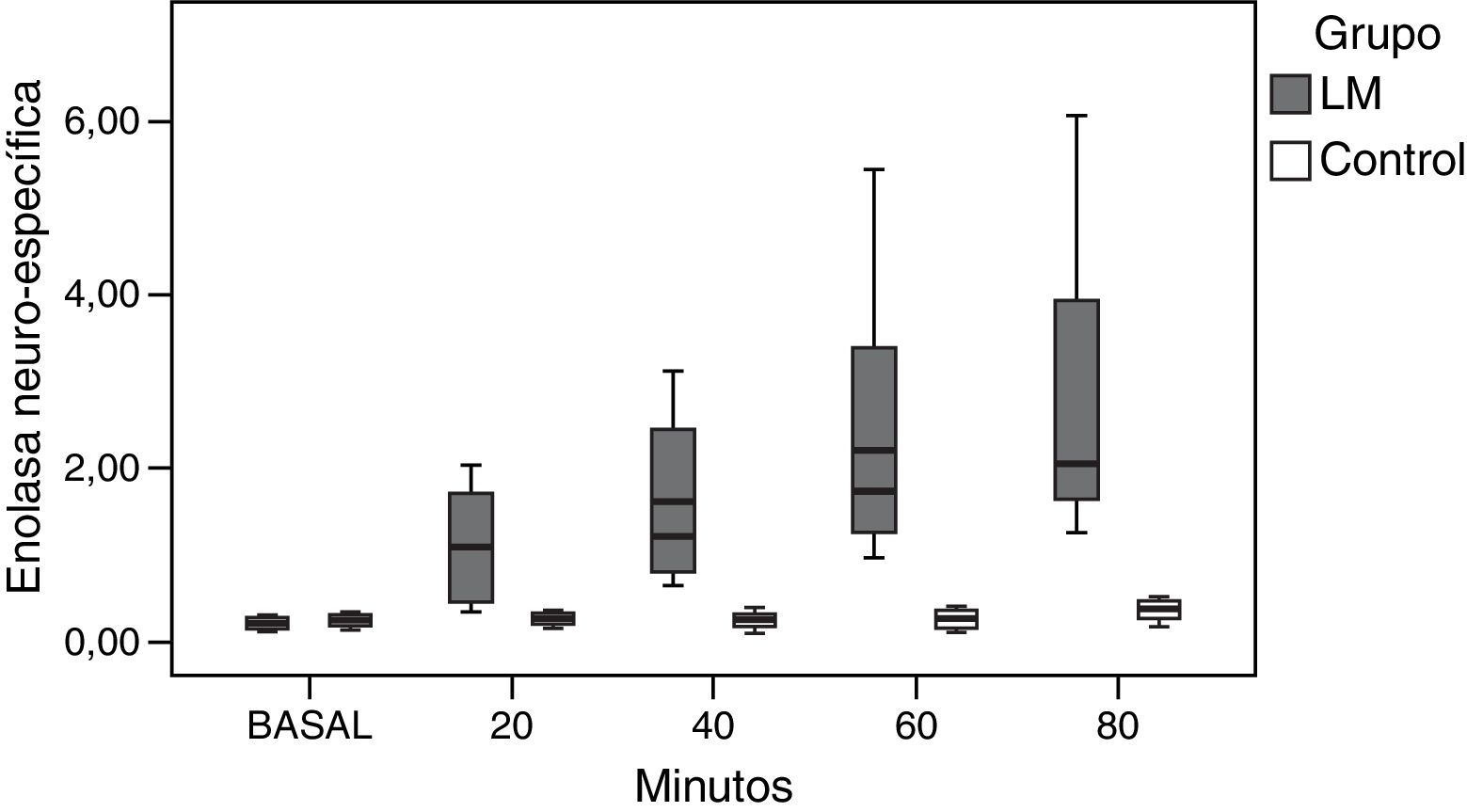
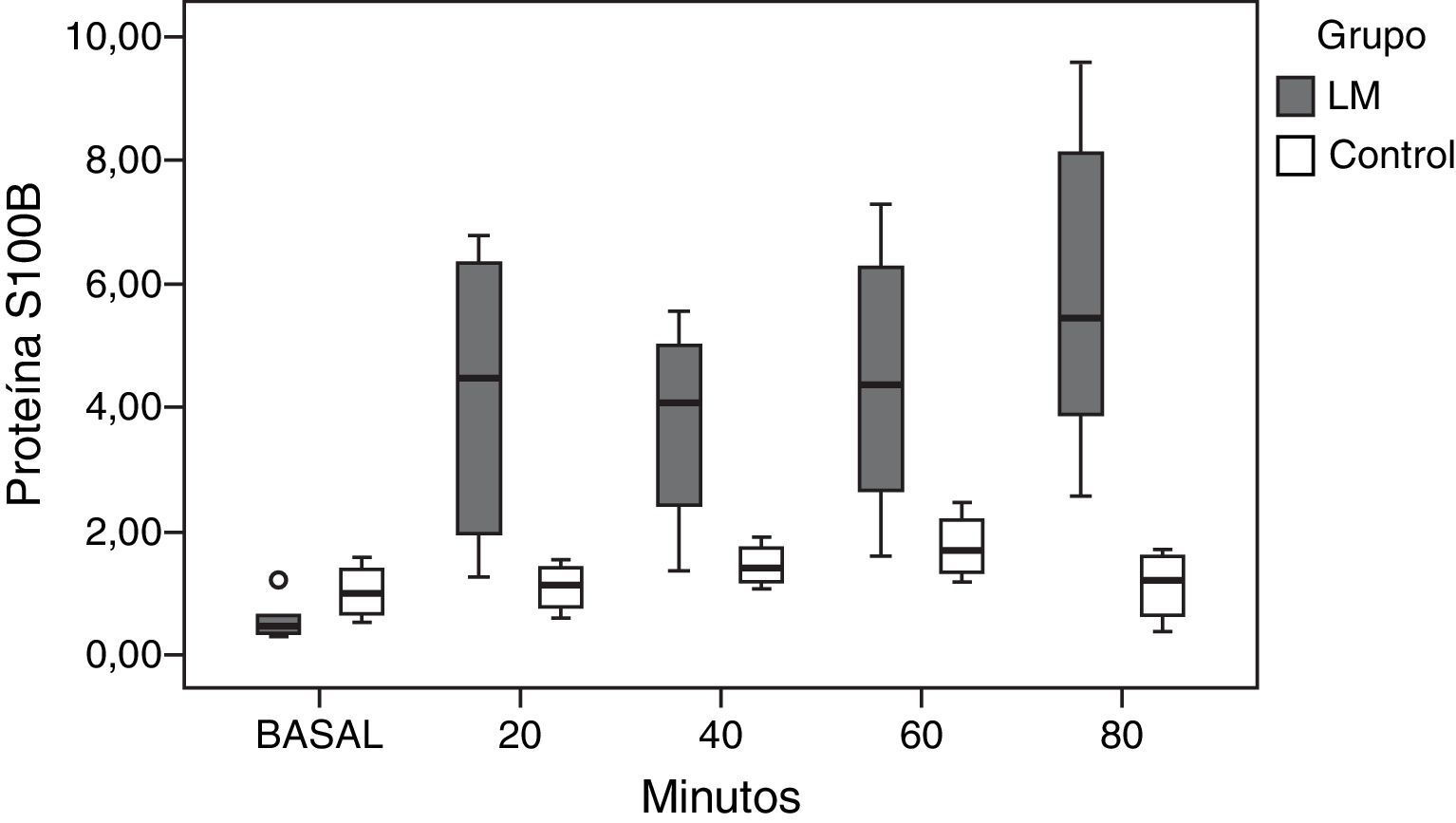
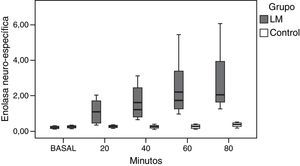
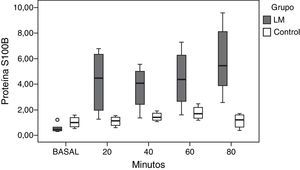
Se realizaron un total de 62 determinaciones sanguíneas. Fueron descartadas las determinaciones basales de los 2 animales que fallecieron antes de lo esperado en el grupo HTEC. La distribución de las concentraciones de NSE y Pt S100B a lo largo del tiempo de estudio se muestra en las figuras 2 y 3.
En la primera determinación realizada, antes del daño cerebral, tanto la NSE como la Pt S100B, no presentaron diferencias en sus concentraciones entre el grupo LM y el grupo control. Por tanto, la distribución de ambos biomarcadores fue la misma, independientemente del grupo de estudio al que pertenecían los sueros (figs. 2 y 3). Las diferencias de las medias fue de -0,068μg/L (IC 95%:-0,158; 0,023), p=0,128 para la NSE, y de -0,383μg/L (IC 95%: -0,929; 0,163) para la Pt S100B, p=0,149.
Comportamiento de la enolasa neuroespecífica tras el daño cerebralUna vez generado el daño cerebral, pudimos objetivar que existían diferencias estadísticamente significativas entre las concentraciones de NSE a lo largo del tiempo dentro del propio grupo LM (p<0,001). En el grupo control no encontramos diferencias en los niveles de NSE, entre los diferentes momentos estudiados (p=0,342) (fig. 2).
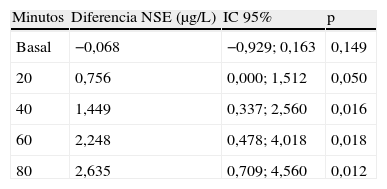
Se compararon los valores de NSE entre el grupo LM y el grupo control, tal y como se muestra en la tabla 1. Salvo en la determinación basal, encontramos diferencias estadísticamente significativas en los valores medios de NSE entre ambos grupos en el resto de las determinaciones.
Diferencias en las concentraciones medias de enolasa neuroespecífica entre el grupo de lesión masa y el grupo control en los diferentes momentos de estudio
| Minutos | Diferencia NSE (μg/L) | IC 95% | p |
| Basal | −0,068 | −0,929; 0,163 | 0,149 |
| 20 | 0,756 | 0,000; 1,512 | 0,050 |
| 40 | 1,449 | 0,337; 2,560 | 0,016 |
| 60 | 2,248 | 0,478; 4,018 | 0,018 |
| 80 | 2,635 | 0,709; 4,560 | 0,012 |
IC: intervalo de confianza; NSE: enolasa neuroespecífica.
Se objetivó una correlación positiva, en el grupo LM, entre el momento de extracción y los niveles de NSE (r=0,765; p=0,001). No se detectó dicho comportamiento en las concentraciones de NSE en el grupo control (r=0,328; p=0,158).
Comportamiento de la proteína S100B tras el daño cerebralExistieron diferencias significativas en las concentraciones serológicas de Pt S100B para cada una de las determinaciones realizadas en el grupo LM (p=0,001). No sucedió lo mismo en el grupo control, en el que no encontramos diferencias en las concentraciones de Pt S100B a lo largo del tiempo (p=0,406) (fig. 3).
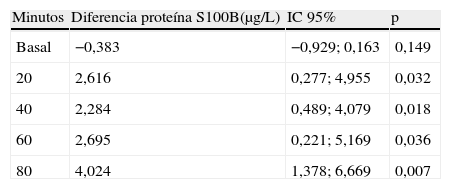
Se compararon los valores de Pt S100B entre el grupo LM y el grupo control. Excepto en la determinación basal, hubo diferencias estadísticamente significativas en los valores medios de Pt S100B en todos los momentos del estudio, tal y como se presenta en la tabla 2.
Diferencias en las concentraciones medias de proteína S100B entre el grupo de lesión masa y el grupo control en los diferentes momentos del estudio
| Minutos | Diferencia proteína S100B(μg/L) | IC 95% | p |
| Basal | −0,383 | −0,929; 0,163 | 0,149 |
| 20 | 2,616 | 0,277; 4,955 | 0,032 |
| 40 | 2,284 | 0,489; 4,079 | 0,018 |
| 60 | 2,695 | 0,221; 5,169 | 0,036 |
| 80 | 4,024 | 1,378; 6,669 | 0,007 |
IC: intervalo de confianza.
Tras el daño cerebral, la Pt S100B presentó un incremento progresivo en sus valores en todas las determinaciones realizadas (r=0,628; p=0,001). Por contra, en el grupo control las concentraciones serológicas de Pt S100B se mantuvieron estables (r=0,208; p=0,378).
DiscusiónNuestros resultados muestran que el aumento transitorio de la PIC inducido de forma experimental, en un modelo de LM en rata, provoca que se liberen a la sangre periférica la NSE y la Pt S100B. Ambos biomarcadores, indicadores aceptados de afectación encefálica, presentaron una liberación precoz al suero durante la fase aguda del daño cerebral, y progresiva durante el tiempo de estudio, si bien la NSE mostró un comportamiento más homogéneo a lo largo del tiempo.
En nuestro modelo experimental de daño cerebral tipo LM, la liberación de los biomarcardores presentó una relación tiempo-dependiente. Las diferencias detectadas entre las distintas extracciones dentro del propio grupo LM, así como el incremento progresivo en los niveles serológicos de la NSE y la Pt S100B reflejan, de una forma precoz, la evolución del daño cerebral y la apertura o disrupción de la barrera hematoencefálica (BHE). Tras la lesión, el incremento temporal en las concentraciones de NSE fue más uniforme en comparación con la Pt S100B. Postulamos que este hecho pudo deberse a la vida media más larga de la NSE, lo cual dio lugar a un incremento, homogéneo y progresivo en sus niveles, durante nuestro tiempo de estudio21,24. Independientemente, trabajos en neuroproteómica han mostrado una mayor especificidad de la NSE en comparación con otros biomarcadores tras la lesión cerebral traumática25. No obstante, coincidimos con los autores que manifiestan que tanto los niveles serológicos de NSE, como los de la Pt S100B, son una expresión de las alteraciones generadas a nivel neuronal y glial respectivamente26,27.
En general, los modelos de lesión cerebral traumática en animales son clasificados en función del tipo de daño generado o el mecanismo de intercambio de energía utilizado. Los que provocan lesión cerebral difusa se pueden subdividir en 3 grupos. Aquellos que realizan un impacto directo sobre el cráneo mediante percusión de líquido, proyección de un cuerpo inerte a baja energía o mediante gravedad. En segundo lugar, encontramos los modelos de experimentación que realizan un intercambio de energía sobre el cerebro mediante mecanismos bruscos de aceleración-desaceleración28–32. Asimismo, el modelo de lesión cerebral tipo blast injury, muy en boga por los conflictos bélicos y actos de terrorismo de las últimas décadas, expone al animal a una onda expansiva generada mediante compresores o detonaciones en espacios confinados24,33. Por último, encontramos los modelos experimentales que simulan las LM. Estos modelos generan ascensos agudos y mantenidos de la PIC mediante inyección de sangre autóloga en el espacio epidural o bien mediante la expansión controlada de un balón situado en el extremo distal de un catéter4–7,34. Para el objetivo de nuestro estudio este último modelo fue considerado el más idóneo.
Diversas publicaciones han puesto de manifiesto la sensibilidad y especificidad de los biomarcadores elegidos para evidenciar daño y alteraciones de las estructuras encefálicas. Así, los modelos in vitro de daño celular cerebral traumático han demostrado un aumento de los niveles de Pt S100B tras la lesión, discutiéndose en la actualidad el papel de esta proteína tras el traumatismo craneal, ya que algunas investigaciones muestran que la Pt S100B, considerada hasta ahora un marcador lesional, puede tener un papel mucho más relevante en la recuperación de la homeostasis cerebral y en la recuperación funcional14,32,35. Aunque se desconocen de forma precisa los mecanismos de plasticidad neuronal activados tras el TCE, la adición de esta proteína, de forma artificial o mediante un daño celular aplicado sobre neuronas en presencia de astrocitos, muestra una reducción del daño y una promoción de la recuperación neuronal35,36. Este efecto neuroprotector de la Pt S100B también ha sido descrito en cultivos celulares en los que se ha aplicado un daño inducido por glutamato, el cual se sabe que es un potente inductor de muerte neuronal12,37.
En modelos de daño cerebral isquémico inducido en rata se ha hallado una relación entre los niveles de NSE en líquido cefalorraquídeo y el número de neuronas lesionadas30,38. Dado que el paso de la NSE a sangre depende de la permeabilidad, disrupción o apertura de la BHE, las concentraciones serológicas de este biomarcador pueden reflejar no solo la magnitud de la lesión cerebral sino el grado de alteración de la BHE. No obstante, estudios posteriores en modelos experimentales traumáticos, tipo blast injury, han mostrado un aumento en los niveles de NSE tras la lesión24,33. A su vez, señalan que las concentraciones serológicas de NSE varían en función de la gravedad e intensidad del daño cerebral inducido, coincidiendo con los modelos de lesión isquémica24,38. Las determinaciones de NSE en estos estudios fueron realizadas a partir del primer día tras la lesión, por lo que nuestro estudio muestra, por primera vez, la liberación precoz de NSE a sangre de forma precoz durante la fase aguda del daño cerebral.
Nuestro trabajo presenta algunas limitaciones. Con relación al modelo experimental de LM, el tiempo de inflado del balón a nivel intracraneal fue inferior al de otros estudios. La mayoría de los trabajos publicados en este campo corresponden al grupo de Burger et al., los cuales en su protocolo de trabajo mantenían 30min el balón inflado4,6,7. No obstante, el objetivo de nuestro estudio difería en cuanto que pretendíamos investigar el efecto del aumento transitorio de la PIC a nivel extraaxial. No obstante, en nuestro modelo el incremento transitorio del balón fue un estímulo lesional suficiente para objetivar la elevación de los biomarcadores sujetos a estudios. Por otro lado, al tratarse de un estudio preliminar con el objetivo de testar una hipótesis, no realizamos monitorización invasiva de la PIC. Entendemos que, a pesar de la homogeneidad del estímulo lesional, hubiera sido una variable interesante a registrar, dato que en estudios posteriores monitorizaremos. Con todo, no deseábamos que los niveles de NSE y la Pt S100B pudieran afectarse por la propia inserción del catéter de PIC. Otro aspecto que consideramos de interés es ampliar el período de estudio y el número de determinaciones a realizar, para conocer de una forma más precisa el comportamiento temporal de los biomarcadores. Por último, podríamos considerar que el origen extracraneal de la NSE y la Pt S100B supondrían un artefacto en sus niveles. Sin embargo, la comparación intergrupos (grupo LM vs. grupo control) mostró que a pesar de realizar en todos los animales los mismos procedimientos de apertura cutánea, muscular etc. la única diferencia remarcable entre ellos fue la realización o no del daño cerebral. A su vez, la hemólisis se considera uno de los principales limitantes en la fiabilidad de las concentraciones de la NSE. Sin embargo, la concentración de esta enzima en los eritrocitos de rata es insignificante en comparación con su concentración en humanos20.
Como fortalezas quisiéramos resaltar que para el estudio del daño cerebral inducido el modelo de LM en rata que presentamos es bastante apropiado por la sencillez de realización, reproductibilidad y condiciones experimentales homogéneas, con la consecuencia lógica de disminución de los factores de confusión4,11,39. A ello se une la facilidad de manejo y estabulación de las ratas y su bajo coste comparado con otros animales de experimentación.
ConclusionesEl aumento transitorio de la PIC por una LM en un modelo de experimentación animal provoca, de forma precoz, la liberación de los biomarcadores cerebrales estudiados, expresión, a su vez, de las alteraciones producidas en la estructura o función de la sustancia gris y blanca cerebral. Este hecho nos abre la posibilidad de explorar en un futuro líneas terapéuticas que minimicen el daño cerebral o frenen el avance de la lesión secundaria. Esto podría realizarse mediante el diseño de ensayos preclínicos, al disponer de end-points bioquímicos, fácilmente determinables, que permitirían evaluar de manera objetiva la respuesta neuroprotectora de fármacos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este estudio se ha podido desarrollar gracias a la donación de los reactivos para la determinación de NSE y Pt S100B mediante electroquimioluminiscencia por Roche Diagnostics, Mannheim, Alemania.