La monitorización es crucial en el cuidado del paciente crítico. Detecta disfunciones orgánicas y provee orientación en el abordaje terapéutico. Los intensivistas monitorizan habitualmente la función de varios sistemas orgánicos y el cerebro no es la excepción. La monitorización EEG continuo es una vía no invasiva e ininterrumpida para valorar la actividad eléctrica cortical con aceptable resolución espacial y excelente resolución temporal. La efectividad diagnóstica del estado epiléptico no convulsivo como causa de compromiso de la consciencia no explicable por otras causas se ha incrementado con el empleo del EEG continuo; sin embargo, no es la única indicación para valorar la actividad eléctrica cortical cerebral. Este manuscrito intenta resumir las indicaciones, modos de empleo y metodología para el empleo del monitoreo electroencefalográfico continuo en la unidad de cuidados intensivos con la finalidad que el intensivista se familiarice con el mismo.
Monitoring is a crucial part of the care of the critically ill patient. It detects organ dysfunction and provides guidance on the therapeutic approach. Intensivists closely monitor the function of various organ systems, and the brain is no exception. Continuous EEG monitoring is a noninvasive and uninterrupted way of assessing cerebral cortical activity with good spatial and excellent temporal resolution. The diagnostic effectiveness of non-convulsive status epilepticus as a cause of unexplained consciousness disorder has increased the use of continuous EEG monitoring in the neurocritical care setting. However, non-convulsive status epilepticus is not the only indication for the assessment of cerebral cortical activity. This study summarizes the indications, usage and methodology of continuous EEG monitoring in the intensive care unit, with the aim of allowing practitioners to become familiarized the technique.
La monitorización se define como el acto de observar el curso de uno a más parámetros con la finalidad de detectar anomalías. El monitoreo del estado neurológico resulta esencial durante la lesión cerebral aguda como así también en el paciente critico sin lesión neurológica. En general, el monitoreo persigue los siguientes objetivos: a) establecer e identificar la función de un órgano o sistema; b) interpretar la fisiopatología; c) proveer datos fisiológicos que diagnostiquen situaciones anómalas; d) guiar la terapéutica; y d) ayudar a pronosticar. El neuromonitoreo recorre un amplio espectro, desde la evaluación clínica hasta la obtención y adquisición de variables sofisticadas que evalúan los distintos aspectos del funcionamiento cerebral. Uno de estos parámetros es el electroencefalograma (EEG), que de una manera simple, continua y no invasiva provee información de la actividad neuronal ante cambios estructurales y/o funcionales1. Debido a esto, el uso del EEG se ha incrementado de manera significativa en las últimas décadas2. En este artículo repasaremos brevemente la utilidad e indicaciones del EEG en el paciente crítico.
¿Qué es el electroencefalograma y cómo trabaja?El EEG registra y grafica la actividad eléctrica neuronal a través de electrodos localizados en la superficie del cráneo. Las ondas obtenidas representan la corriente eléctrica generada por la actividad de las neuronas al comunicarse unas con otras. Habitualmente se emplean 21 electrodos, sin embargo, en ciertos casos se pueden utilizar menos, sobre todo en el postoperatorio neuroquirúrgico o ante la presencia de drenaje ventricular u otros dispositivos de neuromonitoreo. La tasa de detección de convulsiones es aceptablemente buena, promediando un 93, 68 y 40% con 7, 4 y un electrodo respectivamente3. Los electrodos se posicionan bajo el sistema denominado «10-20» de la Sociedad Internacional de Neurofisiología Clínica Americana (SINCA)4. Por convención, los electrodos con numeración impar se ubican en el hemisferio izquierdo, mientras que los pares se colocan en el derecho. Los números pequeños corresponden a electrodos parasagitales, mientras que los números grandes corresponden a electrodos temporales. La letra de cada electrodo corresponde al lóbulo cerebral, por ejemplo, F: frontal, Z: central, P: parietal, etc.4 (fig. 1e, material adicional).
El EEG se obtiene mediante la aplicación de la tecnología del amplificador diferencial, la cual toma 2 entradas eléctricas y muestra la señal de salida como la diferencia entre las 2 entradas1,4 (fig. 2e, material adicional).
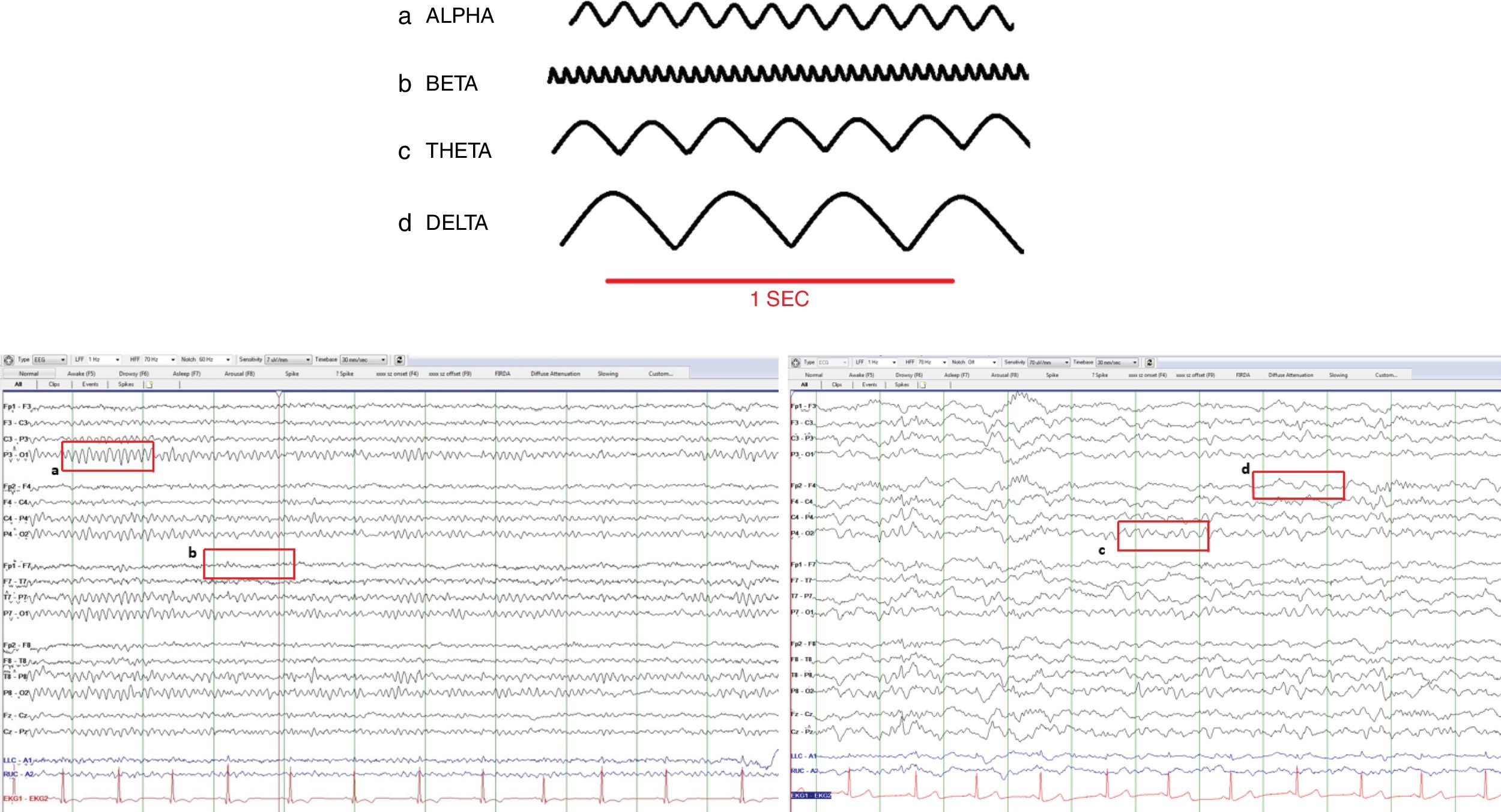
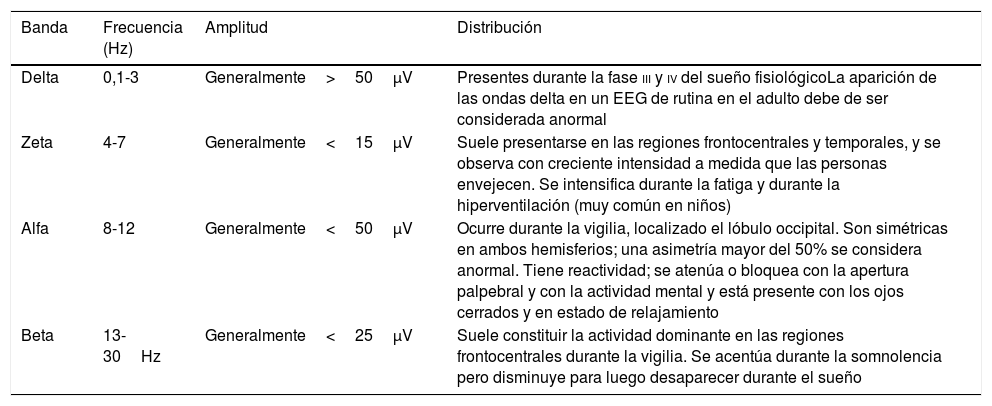
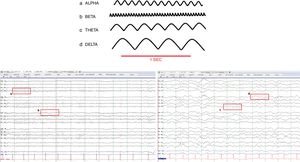
El EEG se puede categorizar en base a la amplitud, frecuencia, simetría y patrones de ondas. La amplitud está medida en microvoltios y la frecuencia en hercios (número de ondas por segundo). Las ondas en el EEG se clasifican de acuerdo a su frecuencia en 4 bandas: delta, zeta, alfa y beta (tabla 1, fig. 1). La lectura de los distintos tipos de ondas se efectúa en diferentes montajes.
Ondas cerebrales normales
| Banda | Frecuencia (Hz) | Amplitud | Distribución |
|---|---|---|---|
| Delta | 0,1-3 | Generalmente>50μV | Presentes durante la fase iii y iv del sueño fisiológicoLa aparición de las ondas delta en un EEG de rutina en el adulto debe de ser considerada anormal |
| Zeta | 4-7 | Generalmente<15μV | Suele presentarse en las regiones frontocentrales y temporales, y se observa con creciente intensidad a medida que las personas envejecen. Se intensifica durante la fatiga y durante la hiperventilación (muy común en niños) |
| Alfa | 8-12 | Generalmente<50μV | Ocurre durante la vigilia, localizado el lóbulo occipital. Son simétricas en ambos hemisferios; una asimetría mayor del 50% se considera anormal. Tiene reactividad; se atenúa o bloquea con la apertura palpebral y con la actividad mental y está presente con los ojos cerrados y en estado de relajamiento |
| Beta | 13-30Hz | Generalmente<25μV | Suele constituir la actividad dominante en las regiones frontocentrales durante la vigilia. Se acentúa durante la somnolencia pero disminuye para luego desaparecer durante el sueño |
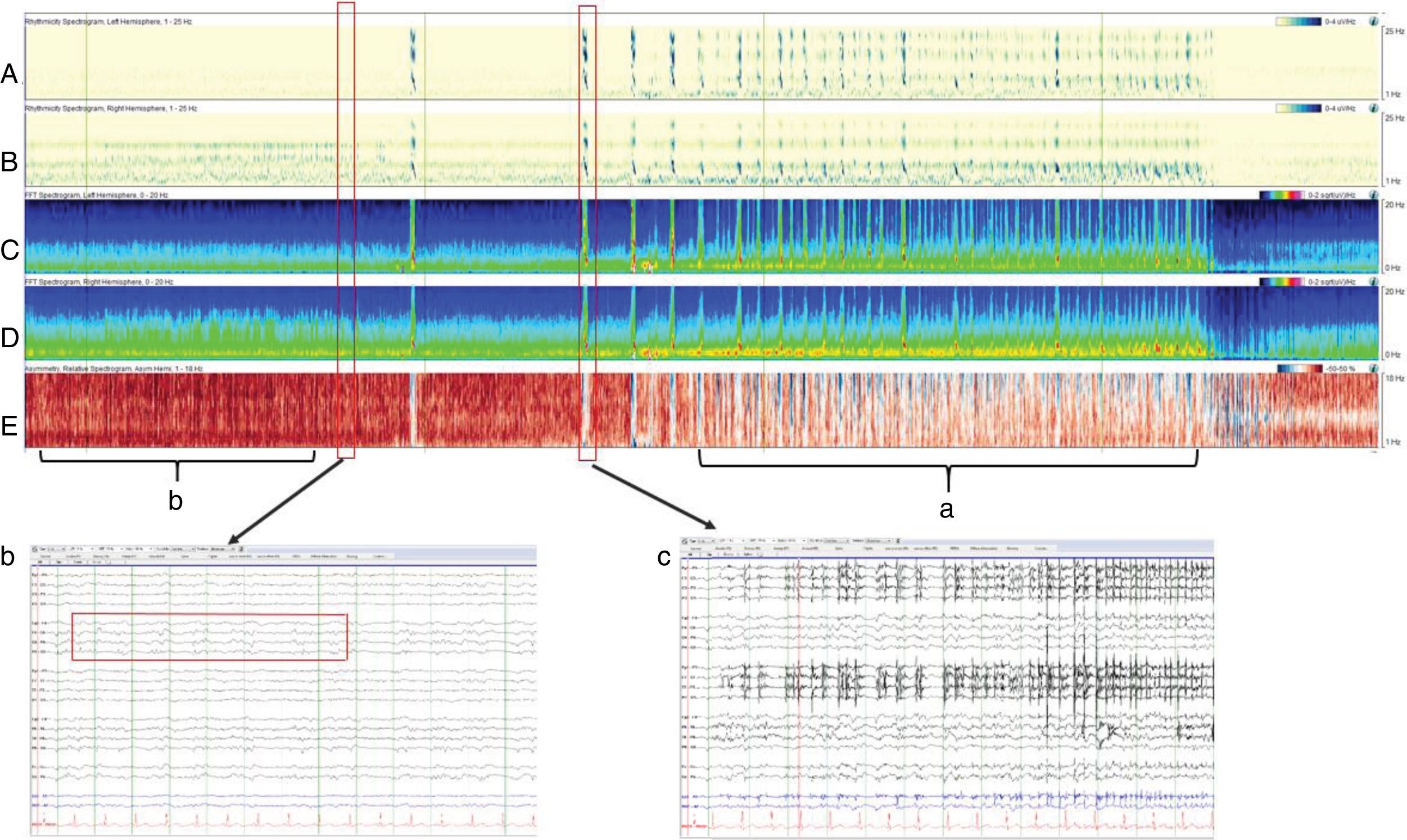
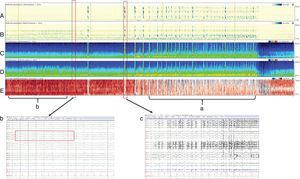
El monitoreo EEG puede prolongarse de ser necesario, y para ello es importante utilizar la modalidad cuantitativa (qEEG). El qEEG, es una alternativa digitalizada del análisis del EEG que permite la exposición gráfica de los cambios de las frecuencias cerebrales en el tiempo. Este sistema está basado en algoritmos matemáticos, que transforman el EEG convencional en uno compacto utilizando el análisis de Fourier, el cual permite comprimir el tiempo, reducir canales (electrodos) y representar de manera gráfica y codificada en colores las distintas ondas. De esta manera, varias horas del EEG regular pueden reducirse en solo una vista simple de pantalla con los ejes de valores de tiempo-frecuencia, permitiendo observar en tiempo real el EEG regular compactado con lo cual se logra mayor facilidad de interpretación. Esto permite la detección de cambios sutiles no visibles sin entrenamiento adecuado y también con ello se obtiene con mayor claridad la evaluación de cambios continuos y repetitivos, como es el caso del estado epiléptico continuo (fig. 2).
Cuatro horas de qEEG en un paciente de 56 años de edad con alteración del sensorio, fiebre y rigidez de nuca. El paciente fue diagnosticado con meningitis estreptocócica complicada con estatus epiléptico no-convulsivo. Múltiples convulsiones electrográficas fueron grabadas, originadas en el hemisferio derecho (evidenciado por la mayor amplitud en el hemisferio derecho con relación al hemisferio izquierdo. Paneles C y D) y (a) por el espectrograma de asimetría relativa (panel E) con mayor imagen roja (hemisferio derecho) que azul (hemisferio izquierdo). Además, (b) el espectrograma de asimetría relativa se observa de color rojo antes de la convulsión debido a la gran actividad interictal que se ve en el hemisferio derecho. Los paneles A y B son detectores de ritmicidad, una medida en la que el trazado se vuelve más oscuro cuando hay una actividad periódica o rítmica, y se observa como una banda oscura a la frecuencia de la actividad periódica. Este espectrograma muestra ritmicidad entre 1-25Hz y en este ejemplo se demuestra una asimetría de ritmicidad con predominancia del hemisferio derecho, especialmente en las frecuencias lentas (delta). (c) EEG demostrando una de las convulsiones de baja amplitud originada en el cuadrante posterior derecho (P4,P8,O2) que evoluciona de manera difusa sobre el hemisferio derecho, con una actividad delta monomórfica con picos sobreimpuestos. Esta actividad tiene un amplio campo sobre el hemisferio derecho.
Debido a su fácil interpretación y después de un rápido entrenamiento, la detección de convulsiones en el qEEG puede ser hecha por otros proveedores de cuidados de la salud (enfermeras, técnicos en EEG y residentes) de manera similar a neurofisiólogos expertos5.
Electroencefalograma en la unidad de cuidados intensivosEstados epilépticos convulsivos y no convulsivosLas convulsiones sin manifestación clínica y los estados epilépticos no-convulsivos en los pacientes en la unidad de cuidados intensivos (UCI) han sido reportados hasta en un 48% y un 14% respectivamente6. Las causas de estados no convulsivos son las mismas que las de estados epilépticos convulsivos, entre las que se incluyen lesiones estructurales, trastornos metabólicos, toxinas, epilepsia, infecciones e interrupción de la administración de fármacos (i.e. baclofeno) o tóxicos como el alcohol. El estado no-convulsivo no es infrecuente en UCI7, sobre todo durante daño cerebral agudo7,8, estado epiléptico convulsivo reciente6, postoperatorio de tumores, hematomas subdurales, hemorragia subaracnoidea)9, intoxicaciones y alteraciones metabólicas (hipoglucemia) y de electrólitos (hiponatremia)10,11.
El consenso de la SINCA estableció las indicaciones del EEG continuo (CEEG) en pacientes críticos12:
- a.
Persistente alteración del sensorio después de un estado convulsivo clínico.
- b.
Alteración del sensorio asociado con lesión cerebral supratentorial.
- c.
Alteración del sensorio sin causa clara y sin evidencia de lesión cerebral aguda.
- d.
Descargas periódicas continuas en un EEG de rutina o de urgencia.
- e.
Parálisis farmacológica en pacientes con alto riesgo de convulsiones.
- f.
Eventos paroxísticos que se sospechan que pueden ser convulsiones.
Además recomiendan el uso del CEEG como una herramienta adicional en la detección de isquemia cerebral en poblaciones de alto riesgo, como puede ser en casos de hemorragia subaracnoidea12.
Recientemente un grupo de expertos determinaron de manera consensuada los criterios diagnósticos del estado epiléptico no-convulsivo13 (tabla 1e, material adicional).
Si bien los pacientes críticos habitualmente presentan descargas epileptiformes rítmicas superiores a 3Hz, descargas menores también pueden tener origen convulsivo. A pesar de ello, no necesariamente estos patrones de descarga se asocian siempre a daño cerebral o epilepsia. Estos patrones denominados «ictales–Interictales»14, son de significación incierta ya que pueden obedecer a convulsiones o representar un marcador de la severidad del daño encefálico14. Es recomendable que el monitoreo EEG se inicie tan pronto se sospeche la presencia de estados no-convulsivos, debiéndose continuar por un lapso mínimo de 24h, con lo cual es posible detectar hasta el 88% de los casos. Adicionalmente entre un 5-7% se diagnosticará si el monitoreo continúa por 48-72h7. Aproximadamente el 25% de pacientes que han sufrido parada cardiaca desarrollarán convulsiones y el EEG es necesario para el diagnóstico de estas, sobre todo en los pacientes que han sido sometidos a hipotermia terapéutica15. Asimismo, el EEG ayuda a diferenciar un estado epiléptico mioclónico de mioclonías subcorticales, ambos estados con significación clínica diferente y respuesta disímil a la terapéutica.
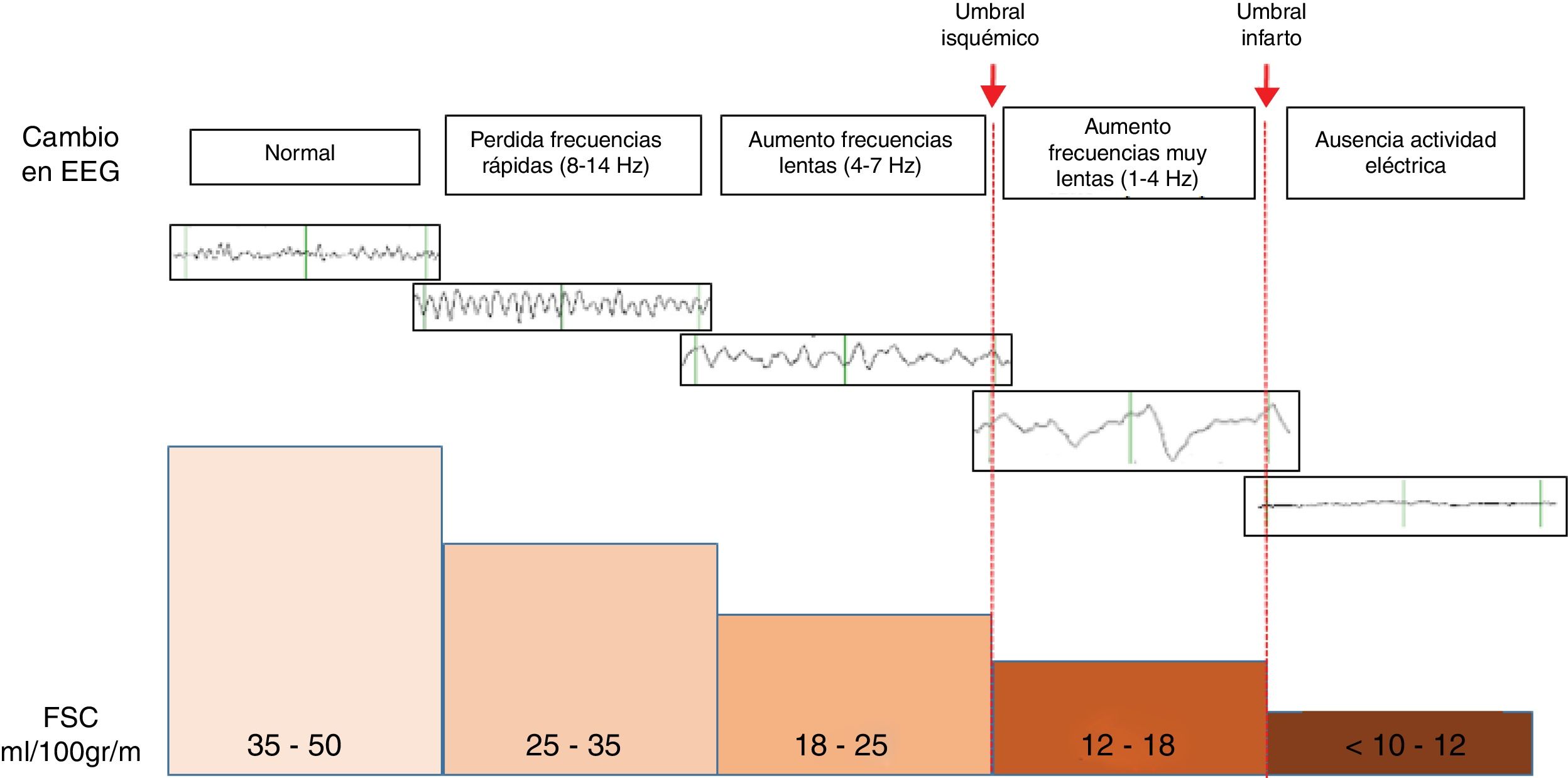
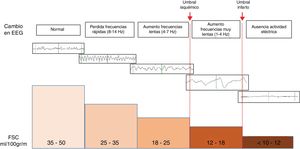
Detección de isquemia cerebralMediante el EEG se pueden coadyuvar en el diagnóstico de isquemia cerebral, ya que los cambios morfológicos del mismo corren paralelos a cambios en el flujo sanguíneo cerebral (FSC). En general cuando el FSC desciende entre 25-35ml/100g/min, las frecuencias rápidas alfa (8-12Hz) y beta (13-30Hz) se verán atenuadas en el EEG. Y si la caída del FSC se acentúa y llega a 17-18ml/100g/min, las ondas de frecuencias lentas delta (0,5-3Hz) y zeta (4-7Hz), se verán incrementadas en el EEG16 (fig. 3).
La actual recomendación para el empleo del EEG como herramienta para la detección de isquemia cerebral se limita a la población de pacientes con hemorragia subaracnoidea aneurismática (HSA)3,12, sobre todo en aquellos con mayor riesgo de desarrollar vasoespasmo y déficit isquémico tardío (mal grado neurológico inicial, o abundante sangrado subaracnoideo y/o intraventricular)7. La isquemia cerebral tardía ocurre en el 20-30% de los pacientes con HSA y es definida como el deterioro clínico (nuevo déficit neurológico localizado, disminución de la conciencia o ambos) de más de una hora duración, sin una causa determinada, y/o un nuevo infarto en la tomografía cerebral que no fue visible en la imagen de admisión o inmediatamente después de la operación de exclusión del aneurisma17.
El monitoreo EEG debe iniciarse durante el periodo de mayor riesgo de isquemia, esto es, entre el 3 y 14 día postsangrado subaracnoideo. La revisión e interpretación del EEG deberá ser frecuente, para poder detectar e intervenir de manera temprana. Es difícil detectar la isquemia cerebral tardía durante largos periodos de tiempo con el EEG regular, por lo que se recomienda monitorizar y analizar con el qEEG12. Los cambios cuantitativos de la relación alfa-delta son el indicador neurofisiológico más fidedigno del diagnóstico de isquemia cerebral tardía en pacientes con HSA. Claassen et al.18 demostraron que la reducción de un 10% de la relación alfa-delta, comparado con el estado basal, tiene un 100% de sensibilidad y un 76% de especificidad para el diagnóstico de isquemia cerebral tardía. Los cambios cuantitativos de la relación alfa-delta se han observado de manera temprana y anticipada, término medio, entre 5-60h antes de manifestarse algún signo o síntoma clínico, y entre 24-48h antes que otros métodos complementarios de diagnósticos, sobre todo cuando el examen neurológico no es confiable3.
Monitoreo de la profundidad de sedación (índice biespectral)El índice biespectral, más conocido por BIS pos sus siglas en inglés, examina ciertos rasgos obtenidos del análisis del poder espectral del EEG, de manera tal que la señal generada en la región frontal es procesada y convertida mediante la aplicación de un algoritmo contenido en un software interno en una onda y en un número que objetiva la medición19,20.
En sus orígenes, el BIS fue diseñado para evaluar la profundidad de la anestesia, con el objetivo de mejorar la titulación de los fármacos empleados, minimizando las dosis, sus efectos adversos y los costos, al mismo tiempo que permite controlar el proceso del despertar. Los valores oscilan entre 0 y 10019,20 (fig. 3e, material adicional).
Sus aplicaciones en la UCI potenciales son:
- a.
Al tener correlación aceptable con las distintas escalas subjetivas de valoración clínica de sedación y analgesia puede utilizarse para optimizar la misma durante ventilación mecánica21-23.
- b.
Ayuda, pero no suplanta bajo ningún concepto al EEG en el monitoreo de fármacos empleados durante el manejo del estatus epiléptico refractario (<30 se correlaciona con patrón onda–supresión «burst supression» en el registro del EEG)20,24.
- c.
Aporta valor pronóstico luego de encefalopatía anoxoisquémica sometidos a hipotermia terapéutica (<22 luego de parada cardiaca se asocia con mal pronóstico)25,26.
- d.
Auxiliar en el diagnóstico de muerte encefálica27.
El BIS tiene limitaciones de distinta índole que impiden la obtención de un registro limpio exento de artefactos19,20. Los estudios disponibles a la fecha carecen de sensibilidad y especificidad adecuada y el método no ha sido validado universalmente en distintas poblaciones de pacientes neurocríticos, razón por la cual los datos disponibles no soportan su empleo en la lesión cerebral28.
Uso del electroencefalograma en encefalopatías y encefalitisAunque inespecífico, el uso del EEG en pacientes confusos, agitados, con alteración del estado de consciencia, puede ser de gran ayuda. Por ejemplo, el EEG puede evidenciar actividad beta en exceso debido al sobreuso de benzodiacepinas; atenuación de los voltajes alfa en pacientes con lesiones estructurales que comprometen la corteza cerebral; o la presencia de actividad delta polimórfica en pacientes con lesiones que afectan la sustancia blanca subcortical e interrumpen las fibras tálamo-corticales ascendentes.
En el caso de pacientes sépticos, los cambios electroencefalográficos tienen una correlación lineal con el grado de severidad de la encefalopatía. En primera instancia, se observa la aparición intermitente de frecuencias lentas, delta y zeta; que luego se tornan continuas. A posteriori se observa la aparición de «ondas trifásicas» y en los casos severos hay supresión del voltaje o la presencia del patrón brote supresión29.
Las «ondas trifásicas», son complejos de medio a alto voltaje con un patrón de 3 fases: la primera fase es una deflexión negativa; seguida por una positiva y luego por otra negativa, con un retraso de dirección anteroposterior, de manera tal que la primera deflexión se visualiza unos ∼200ms antes que en la última deflexión. Su expresión máxima se sitúa en las regiones centrales y tienen la característica de incrementar su voltaje con el despertar (fig. 4e, material adicional). El patrón trifásico se asocia a distintos grados de compromiso de la consciencia, y aunque fueron originalmente descritas en encefalopatía hepática, también están presentes en otras encefalopatías ya sea metabólicas y/o tóxicas (toxicidad por baclofeno o litio). También han sido descritas en encefalopatías estructurales, secundarias a ictus isquémicos o tumores. La encefalopatía urémica también puede presentar ondas trifásicas, aunque algunos expertos opinan que estas ondas producidas por la uremia son de menor amplitud (<70μV) que las originadas por la hiperamonemia30. Además, algunos estudios han indicado que enfermedades que causan atrofia cortical o de la sustancia blanca favorecen la aparición de ondas trifásicas ante un evento desencadenante, como por ejemplo infecciones o alteraciones metabólicas31. Adicionalmente el individuo encefalopático puede objetivar otros patrones anómalos como la presencia intermitente de ondas zetas frontales, actividad lenta difusa y actividad delta paroxística bilateral de alto voltaje32.
La mayor anormalidad vista en el EEG en encefalitis virales o bacterianas son las ondas deltas difusas. Similar a la encefalopatía séptica, el registro EEG se normalizará o no de acuerdo a la evolución clínica del paciente33,34. Los pacientes con meningitis meningocócica con buen pronóstico tendrán mejora del EEG dentro de los 6-9 días iniciales. Si las anomalías persisten más de 2 semanas, se debería sospechar complicaciones secundarias (infarto, vasculitis)33. En la encefalitis herpética, el EEG puede reflejar la severidad y localización de la infección. En cualquier instancia, se pueden apreciar ondas lentas difusas o focales, y aproximadamente una semana después se observarán descargas periódicas o seudoperiódicas35,36. Estas descargas son las más características en la encefalitis herpética y habitualmente son focales o unilaterales, de gran amplitud que ocurren a un frecuencia de 0,5-3Hz expresadas predominantemente en los lóbulos temporales35,36. A pesar de que estas descargas no son patognomónicas de la encefalitis herpética, su presencia asociada con un cuadro febril agudo, con o sin convulsiones focales y con un análisis del líquido cefalorraquídeo consistente con pleocitosis, indica fuertemente un cuadro de encefalitis herpética.
En los últimos años ha habido un aumento en el diagnóstico y reconocimiento de la encefalitis límbica, la que se caracteriza por la tríada de: (1) compromiso subagudo de memoria a corto plazo y anterógrado, (2) convulsiones parciales complejas originadas en el lóbulo temporal y (3) síntomas psiquiátricos. Schmitt et al.37 reconocieron un patrón único en las encefalitis límbicas causadas por anticuerpos antirreceptores NMDA (encefalitis anti-NMDA), caracterizado por la presencia de ondas delta rítmicas de 1-3Hz con ráfagas superpuestas de actividad beta de 20-30Hz que montan las ondas deltas. Las denominaron «extreme delta brush», debido a similitud con los complejos rítmicos beta-delta visto en prematuros.
El uso del electroencefalograma en el pronóstico del paciente comatosoEl EEG puede ser de gran utilidad para establecer el pronóstico de pacientes comatosos, en especial en víctimas de encefalopatía anoxoisquémica. Algunos patrones electrográficos han sido asociados con pobre pronóstico. La Sociedad Europea de Medicina intensiva y el Consejo Europeo de Resucitación indican que la ausencia de reactividad en el EEG ante un estímulo externo y la presencia de brote-supresión o estado epiléptico dentro de las 72h después del paro cardiaco pronostican pobre recuperación neurológica (discapacidad neurológica severa, estado vegetativo persistente o muerte), con un falso positivo de hasta un 6%38. Empleando la terminología estandarizada por la SINCA, un patrón de supresión dominante con descargas periódicas continuas, o un patrón de brote supresión con o sin descargas periódicas, son predictores de malos resultados después de un paro cardiaco sin falsos positivos39.
El EEG también ha sido utilizado como herramienta de pronóstico en HSA. Claassen et al.40 reportaron que en pacientes con ausencia de reactividad en el EEG la presencia de descargas eléctricas periódicas generalizadas o descargas eléctricas periódicas bilaterales e independientes estaba asociada con pobre pronóstico. Además, los pacientes que desarrollan convulsiones durante la evolución del sangrado subaracnoideo tienen 3 veces más probabilidades de presentar discapacidad severa o muerte41. Finalmente, en pacientes con traumatismo craneoencefálico se ha evidenciado que la no reactividad del EEG ante estímulos auditivos o dolorosos42, la ausencia de ritmo alfa en región occipital o del patrón 2 del sueño (N2), como así también la presencia predominante de actividad delta, son todos rasgos eléctricos que se encuentran estrechamente asociados a mal pronóstico43.
Muerte encefálicaLa recomendación del uso del EEG como examen auxiliar para el diagnóstico de muerte encefálica varía a lo largo del mundo. En Estados Unidos el EEG es recomendado pero no es mandatorio. En Canadá no es recomendado y en Europa solo algunos países indican su realización. En Francia44, en ausencia de la influencia de fármacos sedativos, desórdenes del metabolismo o hipotermia, la inactividad encefálica debe de ser confirmada con 2 EEG realizados a un intervalo de 4h y con un mínimo de 30min de buena calidad de grabación. En el caso de muerte encefálica secundaria a paro cardiorrespiratorio, es recomendado un periodo de observación de 12h debido a que el EEG puede demostrar ausencia de actividad cerebral en las horas inmediatas después del paro. El «silencio electrocerebral» visto en el EEG es definido como la falta de actividad encefálica mayor de 2μV, a pesar del estímulo auditivo y doloroso, a una sensibilidad entre 3-5μV/mm, sin un filtro menor de 70Hz (excepto por el filtro notch de 50Hz) y un filtro no mayor a 0,5Hz. Por lo menos 8 electrodos deben de ser colocados y otras cuestiones técnicas deben cumplirse rigurosamente. En Estados Unidos45, en los años 60, el EEG fue utilizado como uno de los exámenes auxiliares para el diagnóstico de muerte encefálica, pero desde entonces la definición y determinación de muerte encefálica fue refinada y con esto se minimizó el uso del mismo para tal fin. Igual que en Francia, una vez descartadas causas reversibles de coma, la carencia de actividad neuronal mayor de 2μV a una sensibilidad>2μV/mm con filtro a 0,1 o 0,3Hz y a 70Hz por 30min de buena grabación apoya el diagnóstico de muerte encefálica.
Duración del monitoreo
La respuesta a este interrogante no debiera tomarse como una controversia; todo dependerá de la indicación del monitoreo y la finalidad con la que se emplea o indica.
Ante la sospecha de convulsiones sin manifestación clínica y/o estado epiléptico no-convulsivo, el EEG debería de ser iniciado inmediatamente y continuarlo por lo menos por 24h. El diagnóstico se podrá hacer en un 45-58% de los casos con 30-60min de monitoreo electroencefalográfico12. Pero con 24-48h de monitoreo, la probabilidad diagnóstica se incrementa hasta un 95%7. Por regla general, un periodo de monitoreo más prolongado, 48h o más, puede ser necesario en pacientes comatosos, que tengan descargas periódicas o bajo sedación profunda. Sin embargo, uno podría refinar el tiempo de monitoreo. Westover et al.46 describieron menos del 5% de probabilidad de detectar convulsiones en las siguientes 72ho cuando no había descargas epileptiformes en las 2 primeras horas de monitoreo electroencefalográfico.
Cuando el diagnóstico de estado no convulsivo ha sido determinado, el EEG debería de continuarse durante todo el periodo de utilización de anticonvulsivantes intravenosos (midazolam, propofol); hasta por lo menos 24h después de la última convulsión12; y un día más, luego del cese de antiepilépticos intravenosos47.
El tiempo óptimo de monitoreo en pacientes con encefalopatías o encefalitis es desconocido. En este grupo de pacientes el tiempo del monitoreo deberá de ser acondicionado para cada uno de ellos. El uso del CEEG no ha demostrado ser de más utilidad que el EEG de rutina para pronóstico después de un paro cardiaco48, y tienen la misma utilidad en pacientes con encefalopatía anoxoisquémica durante el periodo de hipotermia49.
Obviamente existen pro y limitaciones del CEEG. Entre las ventajas podemos mencionar:
- ∘
Brinda información permanente, a tiempo real y al pie de la cama, incrementando claramente la posibilidad de detectar ciertas anomalías, por ejemplo descargas convulsivas u ondas de aparición intermitente (trifásicas).
- ∘
Incrementa la sensibilidad para la detección de descargas no convulsivas y permite discernir entre descargas epilépticas y actividad motora de otro origen.
- ∘
Suministra información aun con el paciente bajo sedoanalgesia profunda o bloqueo neuromuscular.
- ∘
Permite la detección de situaciones dinámicas (isquemia secundaria a vasoespasmo en HSA).
- ∘
Es de suma utilidad a la hora de establecer de manera segura la terapéutica, ejemplo dosis y tiempo de suministro de fármacos (barbitúricos, propofol) en estatus epiléptico refractario.
- ∘
Potencialidad como herramienta auxiliar al pronosticar (encefalopatía anoxoisquemica, muerte encefálica).
En cuanto a sus limitaciones citaremos:
- ∘
La interpretación de los resultados requiere entrenamiento y curva de aprendizaje.
- ∘
Incrementa el esfuerzo y carga laboral.
- ∘
Asistencia permanente del especialista en electrofisiología.
- ∘
Está sujeto a distintos factores, propios del paciente (movimientos, sudoración, marcapasos) o del ambiente (ruidos, monitores, bombas de infusión) que pueden interferir en la correcta lectura del trazado.
- ∘
El monitoreo continuo genera gigabytes de data, difícil de almacenar y mantener.
Los sistemas de monitoreo EEG convencional permiten al digitalizarse almacenar cantidad incalculable de datos. Con anterioridad hemos mencionado que para facilitar el análisis e interpretación se han desarrollado diversas modalidades cuantitativas que comprimen la información, facilitando la comprensión de los fenómenos observados aun por no especialistas en neurofisiología. Ya fue mencionado más arriba el qEEG. Variantes de esta última modalidad se están desarrollando y testeando con la finalidad de facilitar la lectura del registro, como1:
- -
Análisis espectral de densidad de colores el cual no es más que un gráfico x/y que valora frecuencia y tiempo, las cuales luego se comprimen y grafican.
- -
Mapeos topográficos del poder espectral del EEG los cuales permiten fundamentalmente evaluar asimetrías.
- -
Evaluación de tendencias en distintas características del EEG convencional.
- -
Integración de amplitud de ondas.
- -
Video EEG
Por otra parte, la escasez de técnicos auxiliares, equipos de EEG y neurólogos entrenados disponibles limita el monitoreo, adicionando dificultades como el tedioso proceso de colocación de los electrodos y el tiempo necesario para efectuar el monitoreo. Todo ello limita el uso inmediato del EEG en situación de urgencia como también en el caso de estado epiléptico no-convulsivo. Recientemente han sido desarrollados diversos dispositivos con un número reducido de electrodos, y estos pueden ser colocados rápidamente y sin necesidad de esperar a un técnico entrenado. Estos dispositivos son de alta sensibilidad para diagnóstico de convulsiones (98-100%), fáciles de usar e interpretar por diversos miembros proveedores de la salud50 y además tienen el potencial de ayudar al tamizaje inmediato de estado epilépticos no-convulsivo y observar la respuesta al inicio de la terapéutica.
ConclusiónEl empleo del CEEG como auxiliar del neuromonitoreo en la UCI es considerado hoy día una herramienta importante para el cuidado del paciente crítico, independientemente de la presencia de lesión cerebral primaria. Estados epilépticos no-convulsivos son altamente prevalentes y se asocian con mayor morbimortalidad51. Además, los estados epilépticos no-convulsivos pueden ser incorrectamente diagnosticados debido a la mala interpretación y mala clasificación del EEG con «actividad epileptiforme», lo que se puede evitar gracias a las recomendaciones internacionales y terminología estandarizada de la SINCA. Un gran número de estudios clínicos han sido publicados apoyando el uso del CEEG en la UCI, sin embargo el CEEG está aún infrautilizado. Aunque los estudios publicados carecen de un gran número de pacientes y la interpretación del EEG quizás no fue hecha por neurofisiólogos, el CEEG puede ser usado para alertar al equipo de la UCI sobre el posible cambio del estado neurológico de un paciente; ayudar al manejo terapéutico, a la respuesta ante el medicamente, al pronóstico y al diagnóstico del paciente. A pesar de esto, se necesitan estudios adicionales para tener suficiente evidencia del impacto del CEEG sobre los resultados de los pacientes que fueron monitoreados durante su estancia en la UCI.
Conflicto de interesesNinguno para los autores.