La respuesta inflamatoria del huésped viene determinada por la virulencia del microorganismo, la duración del estímulo y el equilibrio entre la respuesta inflamatoria y la antiinflamatoria. Diversos estudios han mostrado la importancia de la genética en las infecciones graves. La respuesta inmune innata es el mecanismo que impide la invasión y propagación de microorganismos durante las primeras horas tras la infección. Cada uno de los procesos implicados en la respuesta innata puede alterarse por polimorfismos de los genes implicados, pudiendo esto resultar en una mayor susceptibilidad o resistencia a la infección. Los resultados obtenidos en los diferentes estudios genéticos no prueban de forma irrefutable el papel o la función de un gen en la patogénesis de la infección respiratoria. Sin embargo, permiten generar nuevas hipótesis, indican nuevos genes candidatos en base a su papel en la respuesta inflamatoria y proporcionan el primer paso en la comprensión de los factores genéticos subyacentes.
The inflammatory response depends on several factors, including pathogenicity and duration of the stimulus, and also on the balance between inflammatory and antiinflammatory response. Several studies have presented evidence of the importance of genetic factors in severe infections. The innate immune response prevents the invasion and spread of pathogens during the first hours after infection. Each of the different processes involved in innate immunity may be affected by genetic polymorphisms, which can result in susceptibility or resistance to infection. The results obtained in the different studies do not irrefutably prove the role or function of a gene in the pathogenesis of respiratory infections. However, they can generate new hypotheses, suggest new candidate genes based on their role in the inflammatory response, and constitute a first step in understanding the underlying genetic factors.
La variabilidad genética entre los diferentes individuos podría explicar por qué la neumonía adquirida en la comunidad (NAC) puede manifestarse como una enfermedad muy grave en algunas personas, y cursar de forma leve en otras. Sorensen et al.1 publicaron un estudio sobre las causas de muerte prematura en 1.000 familias con niños adoptados a edad temprana y comprobaron que si los padres biológicos de estos niños habían fallecido por una infección antes de los 50 años de edad, su hijo tenía un riesgo relativo de morir por infección de 5,81; por el contrario, el fallecimiento de los padres adoptivos por una infección no confería un mayor riesgo al hijo adoptado de fallecer por esta causa. Por tanto, la susceptibilidad y la respuesta a la infección parecen tener una influencia genética importante.
Para algunas enfermedades, la mutación en un solo gen es necesaria y suficiente para producir el fenotipo clínico y provocar la enfermedad. Estas enfermedades monogénicas raras se asocian con frecuencia a infecciones bacterianas recurrentes y se detectan en la infancia.
Sin embargo, la mayoría de los rasgos fenotípicos de las enfermedades comunes están determinados por muchos genes que colaboran en diferentes loci y carecen del patrón de herencia simple (mendeliana) que caracteriza a las enfermedades monogénicas. Estas enfermedades complejas o poligénicas son el resultado de la combinación de diferentes factores genéticos y ambientales, e incluyen enfermedades tan frecuentes como la diabetes, la hipertensión, la arteriosclerosis y la susceptibilidad a la infección. Estas enfermedades tienen un patrón de herencia no mendeliano.
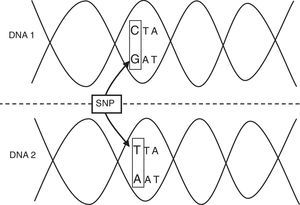
La incidencia de presentación de las enfermedades infecciosas muestra que la variante genética que está asociada a estos procesos debe ser relativamente frecuente (un polimorfismo), más que una mutación rara. Un polimorfismo genético es una región del genoma humano (GH) que varía entre los individuos de una población. Esta variante alélica debe afectar a una porción significativa de la población normal, generalmente a más del 1%, y puede tratarse de la sustitución de un solo nucleótido o afectar al número de secuencias cortas repetitivas (microsatélites) de nucleótidos, que constituyen más del 50% del GH2,3. Los denominados polimorfismos de un solo nucleótido (SNP) son la forma más importante y frecuente de variación en el GH (tabla 1; fig. 1). Los polimorfismos que cambian la secuencia de aminoácidos de un gen o aquellos que están situados en su región reguladora son los que tienen mayor probabilidad de tener repercusiones funcionales2,3.
Definiciones genéticas comunes
| Herencia mendeliana | Transmisión de características hereditarias que ocurre de acuerdo con las leyes de Mendel. Patrón de herencia que caracteriza a las enfermedades monogénicas |
| Polimorfismo de nucleótido único | Variación de la secuencia de ADN. Un solo nucleótido -A, T, C o G- en el genoma difiere entre los miembros de una especie biológica o pares de cromosomas |
| Haplotipo | Combinación de variantes alélicas que tienden a heredarse juntas |
| Microsatélites | Secuencias cortas repetitivas de ADN |
| Alelo | Una o más formas alternativas de una secuencia de ADN |
| Gen | Un segmento de ADN que está involucrado en la producción de una proteína o una molécula de ARN |
| Polimorfismo | Diferencia en la secuencia de ADN entre los individuos |
| Exón | Cualquier segmento de un gen que se representa en el ARNm |
| Intrón | Un segmento no codificante del gen que es retirado del ARN maduro |
| Heterocigoto | Dos alelos diferentes en un determinado locus |
| Homocigoto | Dos alelos idénticos en un determinado locus |
| Análisis de ligamiento | La identificación de regiones cromosómicas asociadas con la susceptibilidad a la enfermedad mediante el estudio de ligamiento en familias afectadas |
| Desequilibrio de ligamiento | Dos alelos en diferentes loci que aparecen juntos en un individuo más a menudo de lo que se puede predecir por el azar |
El sistema inmune innato constituye la primera línea de defensa que impide la invasión y diseminación de los patógenos durante las primeras horas posteriores a la infección. En primer lugar, el huésped tiene que reconocer al patógeno invasivo e inducir su eliminación, bien sea mediante la lisis mediada por complemento, bien fagocitándolo; a su vez, debe desarrollar una respuesta inflamatoria; y, finalmente, debe desencadenar una respuesta antiinflamatoria que sea capaz de restaurar el equilibrio homeostático. Cada uno de estos procesos puede verse afectado por los polimorfismos de los genes implicados, que pueden provocar una susceptibilidad o una resistencia frente a la infección. Es preciso tener en cuenta, además, que aunque genes diferentes dentro de un mismo cromosoma pueden determinar la susceptibilidad a la infección de forma independiente, también puede suceder que la asociación observada entre un gen y una enfermedad solo esté reflejando lo que está sucediendo en un gen vecino. Existen evidencias de que muchos alelos se segregan en bloque formando haplotipos. Mientras que un SNP representa una variante de un solo nucleótido, un haplotipo representa una secuencia de nucleótidos considerablemente más larga, que tiende a segregarse en bloque y dentro de la cual se localizan varios genes2–4.
Polimorfismos implicados en el reconocimiento de antígenosLa inmunidad innata ha desarrollado un sistema de reconocimiento de un patrón molecular común y constante de la superficie de los microorganismos -denominado patrón molecular asociado a microorganismos (PMAP)- a través de los llamados receptores reconocedores de patrones (RRP).
Entre los principales PMAP que actúan como dianas para la activación del sistema inmune innato se encuentran productos de la fisiología microbiana como lipopolisacáridos (LPS) (gramnegativos), ácido lipoteicoico y peptidoglucano (grampositivos), zymosan (levaduras), secuencias de ADN con dominios CpG no metilados, manosa o ARN bicatenario (virus). Por otra parte, hay distintos tipos de proteínas que son capaces de reconocer PMAP. Entre estos RRP se encuentran proteínas del sistema del complemento, como la lectina de unión a manosa (MBL), y los receptores de membrana, como los receptores tipo Toll (TLR) y CD14, expresados fundamentalmente en la superficie de las células que primero entran en contacto con el patógeno durante la infección (células de la superficie epitelial), y en las células presentadoras de antígenos (monocitos/macrófagos y células dendríticas).
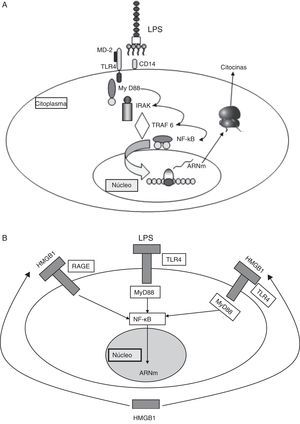
Al unirse los PMAP a los RRP se inicia una cascada de señalización intracelular que conlleva una serie de procesos antimicrobianos y funciones defensivas5. En el caso de los TLR, esta señalización se produce a través de proteínas adaptadoras. Una de las más estudiadas es el factor 88 de diferenciación mieloide, que se une intracelularmente con una cinasa asociada al receptor de la interleucina (IL)-1; esto induce, a su vez, la activación del factor 6 asociado al receptor del factor de necrosis tumoral (TNF), que da lugar a que el factor de transcripción nuclear NF-κB se transloque al núcleo celular y active los promotores de genes que codifican una extensa gama de mediadores proinflamatorios y antiinflamatorios (fig. 2A).
A. Señalización a través de TLR-4. TLR-4 reconoce LPS, un importante componente de la pared celular de las bacterias gramnegativas, y activa el sistema inmune innato. El reconocimiento de LPS requiere CD14 además de TLR-4. La capacidad de respuesta del complejo TLR-4 y CD14 a LPS se ve reforzada por MD2. B. Patrones moleculares asociados a daño (véase el texto).
HMGB1: high-mobility group box 1; LPS: lipopolisacáridos; TLR: receptor tipo Toll.
Aunque los PMAP inician y perpetúan la respuesta inflamatoria, existen otros patrones moleculares que se asocian a daño celular (DAMP) que son liberados por las células lesionadas y que actúan a modo de señales endógenas que inducen y exacerban la respuesta inflamatoria. Estas moléculas representan un importante mecanismo de inflamación, cuya intensidad varía dependiendo del tipo de célula y tejido lesionado. Entre los principales DAMP se encuentran diversas proteínas intracelulares, como las proteínas de shock térmico (HSP), las high-mobility group box 1 y las proteínas derivadas de la matriz extracelular que se generan después de la lesión del tejido (fig. 2B).
Proteínas ligadoras de lipopolisacáridosLos LPS son componentes estructurales de la pared celular de las bacterias, principalmente de las gramnegativas. Los LPS se consideran uno de los factores biológicos fundamentales en el inicio del proceso infeccioso e inflamatorio. Su unión a proteínas específicas, como la proteína ligadora de LPS (LBP) o la proteína ligadora incrementadora de permeabilidad, está implicada en la activación o neutralización fagocitaria.
Dos grupos de investigadores6,7 han estudiado distintos polimorfismos de la LBP y de la proteína ligadora incrementadora de permeabilidad con resultados discrepantes. Mientras unos encuentran que un polimorfismo del gen de la LBP (Cys98Gly) se asocia a un riesgo aumentado de sepsis en varones y a un peor pronóstico6, los otros autores no pudieron reproducir esos resultados7. Recientemente Flores et al.8 identificaron un haplotipo de genes para LBP que se asoció a susceptibilidad a infecciones graves.
CD14La CD14 es una proteína de membrana que se expresa en los macrófagos y monocitos y, en menor proporción, en los neutrófilos. Además de unirse al lípido A del LPS, CD14 también se puede unir al peptidoglucano de Staphylococcus aureus, al lipoarabinomano de las micobacterias y a otros componentes de la pared de los estreptococos. Se ha descrito un SNP ubicado en la posición -159 de la región promotora del gen (cromosoma 5), que afecta a una transición citosina-timina, y que en los sujetos homocigotos para el alelo T condiciona mayores niveles circulantes de CD14 soluble y una mayor producción de IFN-γ. El genotipo CD14 -159 TT apareció con más frecuencia en una población de pacientes con shock séptico en relación con un grupo control de sujetos sanos, asociándose, además, a una mayor mortalidad9. Otros autores, por el contrario, no han sido capaces de corroborar estos resultados10.
Receptores tipo TollExisten al menos 11 TLR con distintas afinidades por diferentes antígenos microbianos. TLR-4 parece esencial en el reconocimiento de la endotoxina, mientras que TLR-2 es más importante en el reconocimiento del peptidoglucano de grampositivos. La activación de los TLR implica un aumento de la expresión de moléculas del complejo mayor de histocompatibilidad, de moléculas coestimuladoras y un aumento de la expresión de genes dependientes de NFκB, como IL-1, IL-6, IL-12 y TNF-α. Se han identificado varios SNP de TLR-4 y TLR-2 (cromosoma 9) que parecen incrementar el riesgo de infecciones bacterianas graves, aunque los resultados son discrepantes10–12. En otro estudio se ha observado que la variabilidad en el gen del TLR-5 afecta la capacidad para reconocer la flagelina, y los sujetos portadores de los haplotipos TLR-5 1174* 2-1175* 1 y TLR-5 1174* 1-1175* 2 presentan mayor riesgo de infección por Legionella pneumophila13 (tabla 2).
Asociación entre polimorfismos de un solo nucleótido en genes relacionados con la inmunidad y neumonía adquirida en la comunidad
| Polimorfismos de un solo nucleótido | Asociación con neumonía adquirida en la comunidad | Referencias |
| Lectina de unión a manosa | ||
| MBL2 Gly54Asp (G/A)-rs1800450 (alelo B)MBL2 Gly57Glu (G/A)-rs1800451 (alelo C)MBL2 Arg52Cys (C/T-rs5030737 (alelo D)Alelos B, C y D y -221 G/C-rs7096206 alelos X/Y) | Variante alélica se asocia con riesgo de enfermedad neumocócica invasivaVariantes alélicas se asocian a mayor gravedad y peor pronósticoNo asociación con NACNo asociación con NAC-P | Moens et al.14Garcia-Laorden et al.15 |
| Receptores Fcγ II | ||
| FCGR2 Arg131His (C/T)-rs1801274 | Homocigoto alelo 1 es un factor de riesgo de bacteriemia neumocócicaHomocigoto alelo 1 asociado con mayor gravedad de NACHomocigosis para variante H predispone a bacteriemia neumocócica | Yuan et al.19Endeman et al.18Solé-Violán et al.20 |
| Receptores tipo Toll | ||
| TLR2-16934 (T/A)-rs4696480TLR2 Arg677Trp (C/T)-rs5743706TLR2 Arg753Gln (G/A)-rs5743708TLR4 Asp299Gly (A/G)-rs4986790TLR5 Arg392 (C/T)-TLR5 Asn592Ser (A/G) | Homocigosis alelo 2 asocia con un mayor riesgo de neumoníaPortadores de alelo 2 mayor riesgo de sepsis por bacilos gramnegativosNo asociación con NACPortadores alelo 2 y de haplotipos TLR5 1174* 2-1175* 1 y TLR-5 1174* 1-1175* 2 presentan mayor riesgo de infección por Legionella pneumophila | Sutherland et al.9Lorenz et al.12Yuan et al.19Hawn et al.13 |
| Factor necrosis tumoral | ||
| TNFA-308 (G/A)-rs1800629TNFA-238 (G/A)-rs361525TNFA-308 (G/A)-rs1800629TNFA-238 (G/A)-rs361525TNFRSF1B+676 (G/T)-rs1061622Met196Arg | No asociación con NACPortadores de alelo 2 presentan mayor riesgo de resultados adversosHaplotipo TNF308*2-238*2 se asocia a una mayor mortalidadHeterogeneidad protege frente a mal pronóstico en NAC | Solé-Violán et al.25Kinder et al.21Henckaerts et al.22Solé-Violán et al.25 |
| Interleucina 6 | ||
| IL6-174 (C/G)-rs1800795 | Homocigosis para el alelo G protege frente a mal pronóstico de NAC neumocócica | Martín-Loeches et al. 29 |
| Proteínas del surfactante | ||
| SFTPA1 (aa19T/C)-rs1059047SFTPA1 (aa50 G/C)-rs1136450SFTPA1 (aa219C/T)-rs 4253527SFTPA2 (aa9 A/C)-rs1059046SFTPA2 (aa91 G/C)-rs17886395SFTPA2 (aa223C/A)-rs4253527SFTPD (aa11T/C)-rs721917 | Los haplotipos SFTPA2 1A10 y SFTPA1-SFTPA2-6A3-1A predisponen a NACLos haplotipos A10 y 6A-1A se asociaron con mal pronóstico | García-Laorden et al.36 |
| Proteínas del shock térmico | ||
| HSP70-2+1267 AA-rs1061581 | Genotipo HSP70-2 1267 predispone a shock séptico en pacientes con NAC | Waterer et al.34 |
La MBL es una molécula del sistema inmune innato que, tras su unión a diversos azúcares de las superficies microbianas, es capaz de activar el complemento. Además, la MBL puede actuar directamente como opsonina y unirse a receptores específicos expresados en la superficie de varios tipos de células. Esta proteína está codificada por un gen único (mbl2) localizado en el cromosoma 10 y existen 3 variantes alélicas estructurales y otras en la región promotora del gen que reducen significativamente sus niveles plasmáticos14. Nuestro grupo ha estudiado distintos polimorfismos de la MBL en pacientes con NAC y encontró que las variantes alélicas deficientes en MBL se asocian a mayor riesgo de desarrollar formas graves de la enfermedad y a peor pronóstico15. Sin embargo, no conferían mayor susceptibilidad a la NAC15 ni a la neumonía neumocócica16. La existencia de desequilibrio de ligamiento entre los genes de la MBL y de las proteínas del surfactante indica que la variabilidad genética de estas últimas podría ser la responsable de la susceptibilidad a la infección neumocócica observada en otros estudios (tabla 2)17.
Receptores para la porción Fc de la inmunoglobulina GLos receptores leucocitarios para la porción Fc de la inmunoglobulina G -FcγR- son esenciales en la defensa frente a ciertos microorganismos. La unión de la IgG a estos receptores activa el complemento, facilita la fagocitosis y activa la citotoxicidad celular. El cambio de histidina por arginina en la posición 131 de la secuencia de aminoácidos del gen codificante de los receptores FcγRIIa produce una disminución de su afinidad por la IgG2 y altera la defensa frente a los microorganismos capsulados18,19.
Solé-Violán et al.20 han observado en pacientes con NAC que la homocigosidad para la variante H131 predispone a neumonía bacteriémica y a un peor pronóstico (tabla 2).
Polimorfismos implicados en la respuesta inflamatoriaAl unirse los PMAP a los RRP se activa NF-κB, que es una proteína intracelular que se transloca al núcleo provocando la transcripción de citocinas proinflamatorias. La reacción inflamatoria es un componente esencial de los mecanismos de defensa del organismo.
Factor de necrosis tumoralEl TNF-α juega un papel clave en el desarrollo de la respuesta inflamatoria aguda tras un estímulo infeccioso y, por tanto, sus niveles tienen relevancia potencial en la evolución clínica. Se han descrito varios SNP en el locus del TNF (cromosoma 6)21,22. El mejor estudiado de todos ellos es el TNF-α-308, cuyo alelo A (transición de guanina por adenina) se asocia a incrementos significativos en la producción de la proteína. Este polimorfismo se ha asociado a un peor pronóstico en los pacientes en shock séptico23, si bien, una vez más, otros estudios han encontrado resultados contrapuestos (tabla 2)24,25. Ello puede explicarse si tenemos en cuenta que este polimorfismo se encuentra en desequilibrio de ligamiento con otros SNP de la región del promotor y de otros polimorfismos de genes vecinos, muchos de los cuales también tienen un papel importante en la respuesta inflamatoria. Este es el caso del alelo A de la linfotoxina alfa (LTA+250 A), que casi siempre se asocia con un alelo G en la posición TNF-α-308. El genotipo LTA+250 AA (transición de guanina por adenina en el primer intrón) se ha asociado a niveles aumentados de TNF y a un mayor riesgo de shock séptico en pacientes hospitalizados por NAC. Por el contrario, la insuficiencia respiratoria en ausencia de shock se relacionó estrechamente con el genotipo LTA+250 GG26. La proximidad de los genes de TNF y de LTA a otros genes inmunológicamente importantes en la región adyacente del cromosoma 6, como los loci de HLA, del complemento y de las HSP, puede complicar todavía más el análisis de los estudios de asociación.
Interleucina 6La IL-6 es un marcador pronóstico de la sepsis, aunque su relación causal no está clara. El genotipo GG del polimorfismo IL-6-174 se ha asociado a una mejor supervivencia en pacientes con sepsis grave27. También se ha identificado un haplotipo que confiere un mayor riesgo de muerte y de disfunción orgánica en pacientes ingresados en UCI28. Sin embargo, otros autores no han observado que este polimorfismo se asocie a diferente pronóstico (tabla 2)29.
Nuestro grupo ha estudiado la repercusión clínica de las variantes genéticas de la IL-6 en 1.227 pacientes con NAC. En el subgrupo de pacientes con NAC neumocócica, el genotipo IL-6 -174 GG se asoció a una menor gravedad y a un mejor pronóstico29. La IL-6 tiene un papel importante en la defensa inmune frente a la neumonía neumocócica, siendo el principal inductor de la síntesis de proteínas de fase aguda por el hepatocito, en particular del factor C3 del complemento y de la proteína C reactiva. Esta se une a los polisacáridos de la pared celular de Streptococcus pneumoniae facilitando su reconocimiento por las células inmunes del huésped30–32.
Polimorfismos implicados en la respuesta antiinflamatoriaLa evolución de la respuesta inflamatoria depende de varios factores, incluidas la virulencia y la duración del estímulo, y también del equilibrio entre respuesta inflamatoria y antiinflamatoria. Las citocinas antiinflamatorias son responsables de la regulación a la baja de la inmunidad celular y humoral, que provoca un periodo de relativa inmunosupresión denominado síndrome de respuesta antiinflamatoria compensadora (compensatory anti-inflamatory response syndrome). Los polimorfismos genéticos responsables de un síndrome de respuesta antiinflamatoria compensadora intenso o prolongado pueden asociarse a las mismas consecuencias dramáticas que una respuesta inflamatoria incontrolada.
Antagonista del receptor de la interleucina 1El antagonista del receptor de la IL-1 (IL-1RN) representa el oponente antiinflamatorio fisiológico de la IL-1 y, por consiguiente, protege frente a los efectos adversos de una respuesta inflamatoria excesiva. Existe una región polimórfica en el intrón 2 del gen de IL-1RN que contiene un número variable de repeticiones en tándem. Los alelos se denominan A1, A2, A3, A4 y A5, según el rango de frecuencias que presentan en la población sana. El alelo IL-1RNA2 se asocia a una mayor producción de IL-1RN tras la estimulación con LPS y es más frecuente en pacientes con sepsis grave, aunque no parece implicar un peor pronóstico33. Los individuos homocigotos para LTA+250 A e IL-1RNA2 parecen tener un mayor riesgo de muerte por sepsis, aunque estos resultados no se han confirmado en un estudio reciente18.
Vías activadas por la inflamaciónPatrones moleculares asociados a dañoVarias moléculas, entre las que se encuentran las high-mobility group box 1 y las HSP, constituyen «señales de alarma» que estimulan la respuesta inflamatoria. La SP70-2 es una importante proteína inmunomoduladora inducida en respuesta a estímulos inflamatorios. En un estudio realizado en 343 pacientes ingresados con NAC, Waterer et al.34 encontraron que el genotipo HSP70-2 1267 AA se asoció con un mayor riesgo de shock séptico, siendo los portadores del haplotipo HSP70-2+1267A/LTA+250A los pacientes con riesgo más elevado34.
Proteínas del surfactanteLas proteínas del surfactante (SP) son colectinas secretadas por los neumocitos tipo II. Durante las infecciones pulmonares agudas, estas moléculas pueden destruir, opsonizar y/o estimular la fagocitosis de los microorganismos y modular la inflamación pulmonar. Se conocen distintos polimorfismos en los genes de SP-A, B, C y D. El genotipo SP-B+1580CC supone una variación timina/citosina en la posición 1580 en el exón 4, lo que condiciona un cambio de treonina a isoleucina en la cadena de aminoácidos de la proteína y determina una alteración funcional de SP-B. Recientemente se ha demostrado una asociación entre este SNP y el riesgo de shock séptico e insuficiencia respiratoria en pacientes con NAC (tabla 2)35.
García-Laorden et al.36 evaluaron la asociación entre la variabilidad genética en las SP y la susceptibilidad y pronóstico de la NAC. El alelo SFTPD aa11-C se asoció significativamente con menores niveles séricos de SP-D. Además, varios haplotipos de SFTPA1, SFTPA2 y SFTPD se asociaron con una mayor susceptibilidad a la NAC, y con un peor pronóstico.
Proteínas de la coagulaciónInflamación y coagulación están íntimamente relacionadas. El factor tisular, producido por la adhesión de neutrófilos y por el daño celular, activa la cascada de la coagulación y estimula la respuesta inflamatoria. En la neumonía grave se produce una importante respuesta inflamatoria que estimula la actividad procoagulante y reduce la fibrinólisis. El inhibidor del activador del plasminógeno tipo 1 es el principal inhibidor del sistema fibrinolítico.
Se ha identificado un polimorfismo en el gen PAI-1, cuyos niveles elevados en suero determinan un estado de hipercoagulabilidad. Los individuos con neumonía portadores del alelo 4G tienen un mayor riesgo de desarrollar shock séptico y disfunción multiorgánica37. En otro estudio se encontró que los genotipos del inhibidor del activador del plasminógeno tipo 1 asociados a un aumento de las concentraciones circulantes presentaban una mayor susceptibilidad a la NAC38.
Futuro de los estudios genéticos en infeccionesLa creciente disponibilidad de datos sobre SNP en el GH y la gran diversidad de fenotipos clínicos con los que podrían estar relacionados ha estimulado la aparición de multitud de estudios de asociación entre polimorfismos de genes candidatos y distintos fenotipos de enfermedades comunes. Sin embargo, muy pocas de las asociaciones publicadas han podido ser inequívocamente reproducidas por otros investigadores. El escaso tamaño muestral y el inadecuado emparejamiento de los pacientes con el grupo control pueden haber contribuido a ello.
Los estudios de asociación genética con diseños de casos y controles metodológicamente estrictos, los estudios pangenómicos39 y el análisis de la expresión diferencial de genes permitirán identificar nuevos genes candidatos en base a su papel en la respuesta inflamatoria, y ayudarán a dilucidar los acontecimientos moleculares requeridos por un patógeno para invadir un huésped, y los de este para eliminarlo, lo que sin duda revolucionará el desarrollo de vacunas y antimicrobianos40. Finalmente, el estudio de perfiles farmacogenéticos específicos permitirá reconocer pacientes con distintas posibilidades de responder a ciertos fármacos y ajustar mejor el tratamiento antimicrobiano.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.