La tercera edición de las guías de la Surviving Sepsis Campaign de 2012 abre las puertas a la utilización de albúmina en el soporte hemodinámico de los pacientes con sepsis grave y shock séptico. Estas recomendaciones se apoyan en un reciente metaanálisis que incluye estudios con indicios de una insuficiente expansión plasmática en el grupo control y estudios realizados en niños con malaria con clara heterogeneidad estadística (p de interacción=0,02). Al excluir estos últimos, el intervalo de confianza del estimador de efecto fue compatible con un exceso de mortalidad en el grupo tratado con albúmina (OR=0,87 [IC95%: 0,71-1,07]). Tras la publicación del metaanálisis se han comunicado los resultados de nuevos estudios aleatorizados que no han encontrado beneficio en los pacientes tratados con albúmina. Dada la incertidumbre acerca del verdadero efecto de la albúmina (debido a la existencia de datos indirectos y a imprecisión) y el coste de la albúmina, se sugiere no utilizar albúmina en la reanimación inicial de pacientes con sepsis grave y shock séptico (GRADE2C).
The third edition of the Surviving Sepsis Campaign guidelines opens the door to the use of albumin for fluid resuscitation in patients with severe sepsis and septic shock. This recommendation is based on a recent meta-analysis that included studies with evidence of insufficient plasma expansion in the control group and studies performed in children with malaria with clear statistical heterogeneity (P for interaction=.02). After excluding pediatric studies, the confidence interval of the effect estimate was consistent with a mortality excess in the group treated with albumin (OR=.87 [95%CI: .71 to 1.07]). Two new randomized studies reported after publication of the meta-analysis found no benefit in patients treated with albumin. Given the uncertainty about the true effect of albumin (due to the existence of indirectness and imprecision) and its cost considerations, it is suggested not to use albumin in the initial resuscitation of patients with severe sepsis and septic shock (GRADE2C).
La utilización de soluciones de albúmina humana en pacientes críticos es controvertida1,2. El estudio SAFE3 —un ensayo multicéntrico bien diseñado que comparaba la administración de albúmina frente a suero salino en 6.997pacientes críticos— no encontró diferencias en la mortalidad. Sin embargo, el análisis de subgrupos encontró una tendencia a una menor mortalidad en los pacientes con sepsis tratados con albúmina (OR=0,87 [IC95%: 0,74-1,02]), que se hizo estadísticamente significativa tras controlar el efecto de las diferencias pronósticas basales mediante regresión logística (OR ajustada=0,71 [IC95%: 0,52-0,97]; p=0,03)4. Asimismo, en un metaanálisis de 17ensayos clínicos (dominado por el estudio SAFE) la administración de albúmina en pacientes con sepsis se asoció a una reducción de la mortalidad (OR=0,82 [IC95%: 0,67-1,0]; p=0,047)5.
Estos hallazgos propiciaron que un Grupo de Trabajo de la Sociedad Europea de Cuidados Intensivos (ESICM) sugiriera incluir albúmina en la reanimación inicial de los pacientes con sepsis grave (GRADE2B)6. Asimismo las guías de 2012 de la Surviving Sepsis Campaign sugieren la utilización de albúmina en la reanimación hemodinámica de la sepsis grave y shock séptico cuando los pacientes requieren cantidades sustanciales de cristaloides (GRADE2C)7. Las importantes limitaciones del metaanálisis (tabla 1) y las serias repercusiones económicas del uso generalizado de la albúmina aconsejan, sin embargo, una revisión crítica de la evidencia que sustenta estas recomendaciones.
Principales factores que comprometen la calidad de la evidencia
| 1. Evidencia procedente de «subgrupos» sin interacción estadísticamente significativa intra o entre estudios |
| 2. Desequilibrio entre el grupo experimental y el control en la intensidad de la expansión plasmática (posible «infra-tratamiento» del grupo control) |
| 3. Resultado sensible a la exclusión de estudios en niños con malaria, de baja calidad metodológica y con probable sobreestimación del efecto |
| 4. Imprecisión en la medición del efecto del tratamiento |
| 5. Estudios más recientes, no incluidos en el metaanálisis, no confirman la efectividad del tratamiento |
El objetivo de este documento es evaluar críticamente la calidad de la evidencia y establecer recomendaciones acerca del uso de soluciones de albúmina en pacientes adultos con sepsis grave y shock séptico, siguiendo la aproximación GRADE8.
El sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation) propone 4grados de evidencia (A: alta; B: moderada; C: débil, y D: muy débil). Los ensayos aleatorizados parten de un nivel de evidenciaA, que se reduce en uno o 2escalones en función de unos criterios explícitos relacionados con el riesgo de sesgo de los estudios, precisión de los resultados, consistencia entre los estudios, presencia de datos indirectos o existencia de sesgo de publicación.
Aunque GRADE propugna la evaluación de la calidad de la evidencia por separado para cada uno de los desenlaces clínicos relevantes, los datos sobre otros desenlaces distintos de la mortalidad son escasos, y estudios recientes sugieren que el uso de albúmina en pacientes críticos es seguro3,4,9,10. En consecuencia, nos limitaremos a valorar la calidad de la evidencia acerca de la mortalidad por todas las causas (tabla 2). La estrategia de búsqueda de la literatura se presenta en el suplemento online.
Perfil de evidencia
| Determinantes | Necesidad de ajustea | Justificación |
| Riesgo de sesgo | No (0) | Solo 5/17 estudios realizan ocultación de la secuencia de aleatorización (pero OR de estudios con ocultación menor que estudios sin ocultación). Nueve de 17 estudios (incluido el más influyente) eran subgrupos de pacientes con sepsis sin interacción significativa intra/entre-grupos. Sin embargo, características basales en el estudio más influyente balanceadas, por lo que no se realizó ajuste a la baja por riesgo de sesgo |
| Inconsistencia | No (0) | Tres estudios pediátricos (malaria) mostraron gran efecto de la albúmina (OR=0,29 [0,12-0,72]; OR adultos=0,87 [0,71-1,07]), con interacción estadística (p niños frente adultos=0,02). Se decidió no ajustar a la baja por inconsistencia y excluir estos estudios en la valoración de la imprecisión |
| Datos indirectos | Importante problema de datos indirectos (–1) | Desequilibrio en la expansión de volumen intravascular a favor del grupo experimental en estudios antiguos (incluido el estudio SAFE) |
| Imprecisión | Importante problema de imprecisión (–1) | Reducción absoluta del riesgo para los 14estudios (excluidos pediátricos) asumiendo mortalidad basal del grupo control: –2,9% [IC95%: –7,2% a +1,4%]. RAR para los 17 estudios (misma mortalidad basal): –4,3% (–8,2% a –0,00072), sobrepasando el umbral de decisión de –0,5% |
| Sesgo de publicación | No (0) | Tres estudios aleatorizados (Maitland 2011, EARSS, ALBIOS) presentados después de la publicación del metaanálisis no muestran beneficio de la albúmina. Su impacto en la OR ponderada (OR=0,90 [0,80 a 1,01]) está capturado por la valoración de la imprecisión, por tanto no se realiza ajuste adicional a la baja |
Ante todo, conviene aclarar que 9 de los 17 estudios incluidos en el metaanálisis de Delaney et al.5 (entre ellos el sub-estudio del SAFE4) no eran verdaderos ensayos aleatorizados sino subgrupos de pacientes con sepsis incluidos en ensayos de pacientes heterogéneos3,11-18. Un criterio básico para decidir si un análisis de subgrupos es adecuado es la existencia de una «p de interacción» significativa (el efecto del tratamiento debe ser estadísticamente diferente entre los distintos subgrupos)19. En el estudio SAFE, la p de interacción fue límite (p=0,06) y no se encontró interacción significativa albúmina-sepsis entre los 9estudios con subgrupos (p de interacción ponderada=0,67)4. Tampoco se encontraron diferencias en el efecto de la albúmina entre pacientes sépticos con o sin hipoalbuminemia incluidos en el estudio SAFE4 (pacientes con hipoalbuminemia: OR=0,79 [IC95%: 0,57-1,11]; pacientes sin hipoalbuminemia: OR=0,74 [IC95%: 0,50-1,10]; p de interacción=0,80).
En la revisión5 se incluyeron 6 estudios de dudosa credibilidad firmados por el Dr. Joaquim Boldt13-17,20, un autor incluido en la web Retraction Watch por falsificación de datos21. Sin embargo, la exclusión de estos 6estudios no alteró las conclusiones del análisis (OR=0,76 [IC95%: 0,62-0,95]; p=0,015).
Los demás estudios incluidos en el metaanálisis eran estudios pequeños con limitaciones metodológicas importantes11,12,18,22-28. Solo 5estudios (además del SAFE) realizaban ocultación de la secuencia de aleatorización18,22,23,25,27, y alguno de ellos no era un verdadero ensayo aleatorizado26. Las limitaciones metodológicas clásicas, sin embargo, no explican el efecto beneficioso detectado en el metaanálisis, ya que el beneficio estimado a partir de los estudios que realizaban una correcta ocultación de la secuencia de aleatorización fue mayor que el de los estudios que no lo hacían (OR relativa de estudios con/sin ocultación=0,85).
En nuestra opinión, estas limitaciones no reducen por sí mismas de forma clara la confianza en la estimación del efecto, por lo que parece razonable no reducir la calidad de la evidencia debido a riesgo de sesgo (tabla 2).
InconsistenciaLa I2 en el metaanálisis de la albúmina (fig. 1) fue de 0%, lo que podría interpretarse inapropiadamente como ausencia de heterogeneidad estadística. Sin embargo, se puede identificar un grupo de 3estudios realizados en niños con malaria22,25,26 que aparentemente se beneficiaron del tratamiento con albúmina en mayor grado que los adultos (estudios en niños: OR=0,29 [IC95%: 0,12-0,72]; adultos: OR=0,87 [IC95%: 0,71-1,07]; I2 para diferencia entre subgrupos=81,2%; p de interacción=0,02). Asimismo conviene destacar el pequeño número de episodios observados en el conjunto de los estudios pediátricos (28fallecimientos, muy por debajo del nivel óptimo de información29), lo que sugiere fuertemente que la reducción significativa de la mortalidad en estos estudios responde a un «efecto de estudios pequeños»29,30.
Esta situación plantea un dilema sobre la forma más adecuada de considerar los estudios pediátricos: si se mantienen en el metaanálisis se debería reducir la calidad de la evidencia en al menos un escalón debido a inconsistencia entre estudios; y si se excluyen, entonces el intervalo de confianza de la OR sobrepasa la unidad, con lo cual se crea un problema grave de imprecisión. En consecuencia, se decidió no reducir la calidad de la evidencia por inconsistencia y valorar la precisión con y sin exclusión de los estudios pediátricos (ver más adelante).
Datos indirectosDesde la perspectiva de esta revisión (efectividad de la albúmina en adultos con sepsis grave), la evidencia aportada por los referidos estudios en niños con malaria —que resulta finalmente determinante de la significación estadística de la OR ponderada— se debe considerar como evidencia indirecta, cuya aplicabilidad a la población diana es cuando menos cuestionable. Sin embargo, dado que el impacto de los pacientes pediátricos se contempla dentro del apartado de imprecisión, no se hizo ningún ajuste adicional a la baja por este concepto.
Por otro lado, algunos estudios incluidos en el metaanálisis comparan el tratamiento con albúmina (en distintas concentraciones) con otros coloides11,13-18,20,22-24,27,28, lo que constituye evidencia indirecta respecto al tratamiento. La valoración del impacto de esta evidencia indirecta parece oportuna, dada la posible toxicidad de algunos de los coloides6. Sin embargo, la OR en estudios que comparaban con cristaloides fue igualmente favorable a la albúmina (OR=0,78 [IC95%: 0,62-0,99]; p=0,04).
Un punto de especial interés es la intensidad de la expansión plasmática en el grupo control. En el sub-estudio del SAFE4, que representa el 64% del peso del metaanálisis, el grupo tratado con albúmina presentó a lo largo de los primeros días de evolución una mayor presión venosa central y una menor frecuencia cardiaca que los enfermos tratados con cristaloides, lo que sugería una mayor expansión plasmática en el grupo experimental. Sin embargo, el objetivo hemodinámico en este estudio se dejó a la discreción del clínico. Por lo tanto, la aplicabilidad de estos resultados a la práctica actual de reanimación hemodinámica basada en objetivos31 es cuestionable, y sugiere que el aparente beneficio observado en el grupo tratado con albúmina pudiera ser en realidad la consecuencia de una insuficiente expansión plasmática en el grupo control. Por otro lado, la insuficiente expansión plasmática perjudicaría al grupo control de los pacientes con sepsis pero no al grupo control de los pacientes sin sepsis en los que la expansión plasmática es menos relevante, lo que podría explicar los indicios de interacción albúmina-sepsis (p de interacción=0,06).
Se consideró que estos indicios de una insuficiente expansión plasmática en el grupo control comprometían seriamente la credibilidad de la estimación del efecto y, en consecuencia, se decidió reducir en un grado la calidad de la evidencia debido a datos indirectos.
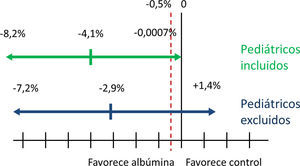
ImprecisiónEn el ámbito de una guía de práctica clínica se considera que existe imprecisión cuando el intervalo de confianza de la medida de efecto rebasa el umbral de decisión clínica entre recomendar y no recomendar un tratamiento29. Los límites de ese umbral dependen de los efectos adversos, de la toxicidad y del coste del tratamiento. Dado el coste de la albúmina en comparación con los cristaloides, en caso de que las 2intervenciones fueran igualmente eficaces elegiríamos los cristaloides. Este razonamiento lleva implícita la existencia de un cierto umbral de decisión, que fijaremos provisionalmente en una reducción absoluta del riesgo del 0,5% (es decir, un número necesario a tratar [NNT] de 200).
La precisión de la estimación en relación a este umbral se presenta en la figura 2, en la que se asume una mortalidad basal del 36% (similar a la del grupo control del metaanálisis). Si se excluyen los estudios pediátricos (línea horizontal inferior), la reducción absoluta del riesgo es de –2,9% y su intervalo de confianza es compatible con un aumento de la mortalidad [IC95%: –7,2% a +1,4%]. Si se incluyen los estudios pediátricos (línea horizontal superior), el intervalo de confianza cruzaría al umbral de decisión clínica (reducción absoluta del riesgo de –4,3% [IC95%: –8,2% a 0,0%]).
En cualquiera de los 2casos, la amplitud del intervalo de confianza cuestiona seriamente la adecuación de la evidencia para establecer recomendaciones sobre la utilización de la albúmina32. En consecuencia, se decidió reducir la calidad de la evidencia en un grado adicional debido a imprecisión.
Sesgo de publicaciónEn el metaanálisis de Delaney et al.5 no encontramos indicios gráficos ni estadísticos de sesgo de publicación. Sin embargo, con posterioridad a su publicación se han conocido los resultados de 3nuevos estudios aleatorizados.
Maitland et al.33 han publicado los resultados del estudio FEAST, un ensayo aleatorizado de mayor calidad metodológica que los estudios previos de su grupo, que compara la administración de bolos de albúmina (n=1.050) contra cristaloides (n=1.047) en niños con malaria con fiebre alta e hipoperfusión. La mortalidad a las 48h fue prácticamente idéntica (10,6% en el grupo de albúmina y 10,5% en el grupo de cristaloides), lo que apoya la hipótesis de que la llamativa OR observada en los estudios pediátricos era atribuible a un efecto de estudios pequeños.
En 2011 se presentaron los resultados (todavía no publicados en el momento de redactar este manuscrito) del estudio Early Albumin Resuscitation during Septic Shock (EARSS)6,34, un estudio aleatorizado multicéntrico abierto cuyo objetivo era investigar la eficacia y la seguridad de la administración precoz de albúmina hiperconcótica (n=399) frente a suero salino (n=393) en pacientes con shock séptico. No hubo diferencias entre los grupos en cuanto a mortalidad (24,1% frente al 26,3%), incidencia de infecciones nosocomiales, duración de la estancia en la UCI o en el hospital, ni insuficiencia renal.
Finalmente, en 2012 se presentaron los resultados preliminares del ensayo ALBumin Italian Outcome Sepsis (ALBIOS)35 (todavía no publicados en el momento de redactar este manuscrito), en el que se comparaba la administración de albúmina frente a cristaloides en pacientes sépticos, y que incluyó alrededor de 1.800 pacientes. La mortalidad hospitalaria fue del 35,9% en el grupo tratado con albúmina y del 37,7% en el grupo tratado con cristaloides (p=0,43) (Voigt, comunicación personal)36. Los investigadores del estudio ALBIOS37 han sugerido en declaraciones posteriores que, a la espera de los resultados definitivos a los 90días, la albúmina podría ser efectiva en los pacientes más graves con shock séptico (un nuevo subgrupo no predefinido en el protocolo del ensayo).
El metaanálisis realizado tras la inclusión de los nuevos estudios (total de 20estudios, con 6.666 pacientes) muestra una I2 del 0% y una OR ponderada (efectos fijos) de 0,90 (IC95%: 0,80-1,01; p=0,07) (ver suplemento online). Por tanto, la inclusión de los nuevos estudios en el metaanálisis no cambió sustancialmente la valoración ya descontada de la imprecisión. En consecuencia, se decidió no reducir la calidad de la evidencia en un grado adicional debido a sesgo de publicación.
De acuerdo con esta valoración (tabla 2), la evidencia de que la inclusión de albúmina en la reanimación hemodinámica inicial de los pacientes con sepsis grave y shock séptico reduce la mortalidad es de baja calidad (gradoC). Esto significa que nuestra confianza en la estimación del efecto es limitada, y el efecto verdadero de la albúmina puede ser sustancialmente diferente del estimado por el metaanálisis (reducción de la mortalidad del 18%).
Fuerza de la recomendaciónLa fuerza de la recomendación depende básicamente de la relación riesgo-beneficio, de las preferencias y, ocasionalmente, de los costes de la intervención24,25. El sistema GRADE establece 2grados de recomendación (1: fuerte; 2: débil) a favor o en contra de la intervención. Una relación riesgo-beneficio claramente favorable debería acompañarse de una recomendación fuerte a favor, ya que la mayoría de los pacientes bien informados optarían por dicha alternativa. Cuando la relación riesgo-beneficio es menos clara (debido a la baja calidad de la evidencia o a la existencia de efectos adversos importantes), la fuerza de la recomendación es débil y obliga frecuentemente a considerar las preferencias del paciente y los costes de la intervención.
Dada la baja calidad de la evidencia sobre la efectividad de la albúmina en la sepsis, cualquier estimación de su coste-efectividad resulta elucubrativa. Sí podemos estimar, sin embargo, el coste unitario del tratamiento. El precio de venta de laboratorio (PVL) de 100cc de albúmina humana al 20% es de unos 57€, mientras que el PVL aproximado de 100cc de suero salino es de 1€. Con la pauta de tratamiento del estudio EARSS (100cc de albúmina al 20% cada 8h durante 3días) el coste unitario por tratamiento ascendería por tanto a unos 510€. Asumiendo una reducción del riesgo de mortalidad con albúmina del 2,9% (equivalente a la estimada tras excluir los estudios pediátricos), habría que tratar a 35pacientes con albúmina para evitar una muerte adicional. Por lo tanto, ello supondría un coste farmacológico de unos 17.850€ por caso evitado. Y si asumimos una reducción de la mortalidad del 0,5% (equivalente al umbral que nos habíamos fijado provisionalmente al discutir la imprecisión), el coste se elevaría a 102.000€ por caso evitado.
Esta información fue discutida por un grupo de expertos clínicos y metodólogos que propusieron mayoritariamente una recomendación débil en contra de la utilización de albúmina en adultos con sepsis grave y shock séptico (GRADE2C) (ver detalles en el suplemento online).
Esta conclusión contrasta con las últimas recomendaciones de las guías de la Surviving Sepsis Campaign, que sugieren la utilización de albúmina en la reanimación hemodinámica de pacientes con sepsis grave y shock séptico que requieren cantidades sustanciales de cristaloides (GRADE2C)7. Desgraciadamente, los autores de las guías no aportan el «perfil de evidencia» explícito en que basan sus conclusiones, por lo que solo podemos hacer unas consideraciones generales sobre estas discrepancias. En primer lugar, las recomendaciones finalmente publicadas suponen una rectificación de anteriores declaraciones de los portavoces de la Sepsis Campaign que anunciaban para la nuevas guías una recomendación GRADE2B a favor de la utilización de albúmina en los pacientes con sepsis grave y shock séptico con hipoalbuminemia confirmada o probable6,38. Esta rectificación supone un cambio en la población específica a la que se aplica la recomendación (pacientes con hipoalbuminemia frente a pacientes que requieren grandes cantidades de cristaloides) que resulta difícil de explicar si tenemos en cuenta que las nuevas guías no aportan ninguna evidencia específica para el grupo de pacientes con altos requerimientos de fluidos39. En segundo lugar, las nuevas guías ignoran una parte importante de la evidencia como el estudio FEAST (que desacredita los resultados de estudios en niños, cuyo efecto es determinante para las conclusiones del metaanálisis) o el estudio ALBIOS (cuyos resultados fueron presentados junto a los del EARSS en el XXV Congreso Europeo de la ESICM, pero que no es citado en el documento final). En tercer lugar, las nuevas recomendaciones ignoran el coste de la albúmina, un aspecto que resulta esencial en una situación como la actual en la que la relación riesgo-beneficio es incierta.
ConclusionesLa calidad de la evidencia sobre la efectividad de la albúmina en pacientes con sepsis grave y shock séptico es baja. A la espera de la publicación de los resultados definitivos de los estudios en marcha34,35, dado su elevado coste y la incertidumbre existente sobre la relación riesgo-beneficio de la albúmina se sugiere no utilizar soluciones de albúmina en pacientes con sepsis grave y shock séptico (GRADE2C).
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.
A los miembros del panel de expertos que participaron en la votación sobre la fuerza de la recomendación de la albúmina: Drs. Manuel Cervera Montes, José Ignacio Emparanza Knörr, Vicente Ruíz García, Eduardo López Briz, José Ignacio Pijoan Zubizarreta y Roberto Reig Valero (ver suplemento online). Al Dr. Ingo Voigt (Elisabeth Krankenhaus Essen) por facilitar los resultados provisionales del estudio ALBIOS.







![Metaanálisis de Delaney et al [5]: Diagrama de árbol por subgrupos de edad.](https://static.elsevier.es/multimedia/02105691/0000003700000006/v1_201307251510/S0210569113000715/v1_201307251510/es/main.assets/thumbnail/gr1.jpeg?xkr=1dZuESKpnCAWr3yCSGZ24A==)