Los pacientes con patología neuroquirúrgica requieren frecuentemente el ingreso en unidades de cuidados intensivos tanto para su manejo en el postoperatorio inmediato como para el control de las complicaciones que puedan presentar. La patología neuroquirúrgica es amplia y requiere profilaxis, tratamiento y monitorización específica. El tratamiento del paciente neuroquirúrgico se basa en asegurar una correcta perfusión tisular cerebral, es decir, mantener un flujo sanguíneo suficiente para aportar energía al parénquima cerebral. Con el objetivo de optimizar el tratamiento y el manejo de estos pacientes, en los últimos años se han desarrollado y perfeccionado diferentes sistemas para monitorizar variables como la presión intracraneal, la actividad eléctrica cerebral (electroencefalografía), el flujo cerebral, la oxigenación del parénquima (presión tisular de oxígeno) o el metabolismo locorregional (microdiálisis). Esta revisión sintetiza el manejo general del paciente neuroquirúrgico así como el de las principales complicaciones que puede desarrollar durante el postoperatorio. Asimismo, se propone un algoritmo de actuación para facilitar la decisión de los profesionales responsables que incluye la neuromonitorización multimodal.
Neurosurgical patients frequently require admission to intensive care units, either for postoperative management or for treating complications. Most neurosurgical diseases require specific monitoring and prophylaxis. The basic principle of neurosurgical patient management is to ensure correct brain tissue perfusion, i.e., maintaining a sufficient blood flow to supply energy and oxygen to the brain parenchyma. In the last few years, several systems have been developed and improved for monitoring variables such as intracranial pressure, cerebral electrical activity (electroencephalography), cerebral blood flow, parenchymal oxygenation (tissue oxygen pressure) or locoregional metabolism (microdialysis). The present study provides an overview of the general management of neurosurgical patients and the main complications that may occur during the postoperative period. An interventional algorithm is also proposed to facilitate physician decisions, with the inclusion of multimodal neuromonitoring.
Los pacientes con patología neuroquirúrgica representan un gran número de los ingresos en las unidades de cuidados intensivos (UCI), debido a que engloban los traumatismos craneoencefálicos (TCE), los hematomas espontáneos, los ictus isquémicos, las hemorragias subaracnoideas (HSA) o las cirugías electivas1. De forma global, el manejo del postoperatorio inmediato de estos pacientes se basa en intentar mantener una buena perfusión tisular cerebral, es decir, mantener una adecuada presión de perfusión cerebral (PPC) asegurando una correcta oxigenación cerebral2.
La indicación del ingreso en la UCI puede ser debida al ingreso postoperatorio de una intervención, a un estado alterado de conciencia que requiera monitorización clínica o multimodal, a que requiera ventilación mecánica (VM) para protección de la vía aérea, o debido a complicaciones médicas posquirúrgicas como crisis epilépticas, infecciones, embolias pulmonares, etc.3. Cabe destacar que aunque recientes estudios cuestionan el ingreso en la UCI de todos los pacientes neuroquirúrgicos4, el ingreso en las UCI especializadas ha demostrado mejores resultados finales5.
Las complicaciones neuroquirúrgicas pueden ser fatales, e incluyen infección de la herida quirúrgica/meningitis posquirúrgica, sangrado intraparenquimatoso y crisis epilépticas. Para intentar evitar el desarrollo de complicaciones tendremos que prestar especial atención a las particularidades referentes a las profilaxis antibióticas propias de la cirugía, sedoanalgesia, estrategia de VM así como la monitorización multimodal específica cuando la requieran.
Cuidados postoperatoriosMonitorización clínica y radiológicaSe realizará una exploración clínica detallada prestando especial atención al nivel de conciencia registrando la escala de coma de Glasgow (GCS), tamaño pupilar o la escala FOUR6.
Si el paciente presenta cambios abruptos y/o mantenidos en la exploración neurológica se debería valorar la necesidad de realizar una prueba de imagen, ya sea una tomografía o una resonancia magnética, en busca de complicaciones tratables7,8.
Monitorización respiratoria y necesidad de ventilación mecánicaLa disfunción neuronal es una de las causas más frecuentes de necesidad de VM9. El uso de VM en pacientes responde tanto a la necesidad de mantener la vía aérea permeable en pacientes con bajo nivel de consciencia, por el riesgo de aspiración secundario, como para evitar la hipoxemia y la hipercapnia.
Los pacientes neurológicos ventilados suelen requerir más días de ingreso en una UCI, tienen mayor ratio de traqueotomía y se les suele programar una menor PEEP10.
Clásicamente se ha tendido a mantener niveles bajos de PEEP (≤5cmH2O) para no incrementar la presión intracraneal (PIC), pero estudios recientes sugieren que es seguro utilizar niveles más altos de PEEP y que estos mejoran la oxigenación cerebral11. Por otro lado, actualmente no está recomendado mantener periodos largos de hiperventilación profiláctica para disminuir la pCO212, pudiéndose utilizar como medida temporal para disminuir la hipertensión intracraneal (HIC) documentada y monitorizada.
SedoanalgesiaLa necesidad de sedación profunda ha demostrado aumentar los días de VM, delirio y mortalidad en pacientes ingresados en la UCI13-15. Actualmente las guías de sedación en UCI recomiendan, en ausencia de contraindicación, el uso de una estrategia de sedación ligera poniendo énfasis en priorizar la analgesia y el uso de fármacos no benzodiacepínicos16.
En los pacientes neuroquirúrgicos es importante realizar una exploración neurológica óptima, y en este sentido es necesaria una sedoanalgesia que permita realizar ventanas neurológicas de forma frecuente, siendo la sedoanalgesia ligera segura en este subgrupo de pacientes17,18.
Fluidoterapia y alteraciones electrolíticasLa fluidoterapia se suele dividir entre cristaloides y coloides. Los cristaloides tienen moléculas pequeñas solubles y se subdividen en dos subgrupos: las soluciones salinas y las soluciones balanceadas, estas últimas para conseguir una osmolaridad isotónica; tienen diferentes iones según el tipo, pero todos ellos tienen menos cloro: el exceso de cloro exógeno se ha visto relacionado con un aumento de acidosis metabólica hiperclorémica, disfunción renal, disfunción gastrointestinal y secreción de citoquinas inflamatorias19. El lactato de Ringer tiene menos osmolaridad que el resto de cristaloides, por lo que grandes infusiones con este cristaloide puede aumentar el edema cerebral y la PIC20. Para la resucitación y mantenimiento del paciente neuroquirúrgico se deberían usar soluciones isotónicas, evitando siempre las hipotónicas21,22.
Los coloides poseen moléculas más grandes con menos capacidad para difundir por membranas semipermeables. Actualmente se tiende a utilizar cristaloides por encima de los coloides debido a que no se han visto diferencias significativas en la mortalidad en coloides respecto al uso de cristaloides23.
Las soluciones hipertónicas se usan para el tratamiento de la HIC, buscando disminuir el edema cerebral extrayendo agua del tejido nervioso mediante presión osmótica al intersticio. No hay diferencias entre soluciones sódicas hipertónicas y el manitol en el manejo de la HIC24.
La hiponatremia es la alteración electrolítica más frecuente en los pacientes neuroquirúrgicos. Las patologías más frecuentes que causan hiponatremia son la secreción inadecuada de hormona antidiurética y el síndrome denominado cerebro perdedor de sal (CPS). Ambas cursan con hiponatremia y natriuresis aumentada, siendo la principal diferencia el volumen extracelular (VEC), ya que el síndrome de secreción inadecuada de ADH (SIADH) cursa con VEC normal y el CPS con VEC disminuido, es decir, el principal factor diferenciante es la volemia. Ante la aparición de síntomas con hiponatremia severa se recomienda la infusión de suero salino hipertónico al 3%19,25,26.
También podemos encontrar alteraciones del sodio en forma de hipernatremia. La diabetes insípida se caracteriza por deshidratación con hipernatremia a raíz de la disminución de la hormona antidiurética. El tratamiento se basa en reposición hídrica y con análogos de la ADH como la desmopresina o la vasopresina20.
Profilaxis posquirúrgicaAntibióticaLa prevalencia de infección de herida quirúrgica oscila entre el 1 y el 11%27. Debido al riesgo que comporta una infección neuroquirúrgica, la profilaxis antibiótica en intervenciones neuroquirúrgicas está ampliamente aceptada28,29.
La elección del antibiótico buscará cubrir los gérmenes más frecuentemente aislados: Staphylococcus aureus y estafilococo plasmocoagulasa negativo. Son opciones para esta profilaxis el cotrimoxazol o la cefazolina. En las cirugías de base de cráneo con abordaje transnasal o/y transoral se recomienda la profilaxis antibiótica con amoxicilina-ácido clavulánico.
En los pacientes con TCE está indicada la profilaxis antibiótica en fracturas craneales abiertas. Se han postulado diferentes pautas: amoxicilina-ácido clavulánico o cefuroxima con metronidazol30-32.
En fracturas no abiertas de base de cráneo el uso de antibióticos parece no modificar la incidencia de infecciones del SNC. En caso de tener asociada fístula de LCR hay menor evidencia de si el uso de antibióticos tiene o no utilidad33-35.
En los sensores de neuromonitorización invasivos, como el sensor de PIC, el de presión tisular de oxígeno (PtiO2) y el de microdiálisis, no hay evidencia que apoye el uso de antibióticos durante el tiempo de inserción de estos dispositivos36-38.
En la colocación de un drenaje ventricular externo no está recomendado el tratamiento intravenoso durante el tiempo de inserción del drenaje por el riesgo de aumentar resistencias antibióticas, pero se recomienda una dosis previa a la inserción39.
En cirugía raquimedular la profilaxis quirúrgica antibiótica está indicada; debe valorarse el antibiótico en función de cada paciente, de las comorbilidades y de los factores de riesgo, aunque nuevamente la cefazolina suele ser el antibiótico de elección40.
Prevención de convulsionesEl uso de fármacos anticonvulsivantes profilácticos en procedimientos neuroquirúrgicos es controvertido en todas las patologías neuroquirúrgicas y existe poca evidencia al respecto.
Aunque hasta un 60% de los pacientes con tumor cerebral pueden presentar convulsiones en su evolución41, el uso de anticonvulsivantes no ha demostrado disminuir la aparición de crisis epilépticas en estos pacientes42 y no está recomendado su uso rutinario21,43.
En los pacientes con traumatismo craneal grave se recomienda el uso de fenitoína para disminuir la incidencia de crisis epilépticas postraumáticas tempranas. Aunque se ha propuesto el uso de levetiracetam, no hay suficiente evidencia actual para recomendarlo sobre la fenitoína en este subgrupo de pacientes12.
Pese a la alta incidencia de crisis epilépticas en los pacientes afectos de HSA (entre el 4 y el 26% en el momento de la hemorragia)44, no se recomienda el uso sistemático de anticonvulsivantes en la HSA. Recientes revisiones sistemáticas concluyen que no existen pruebas para apoyar o refutar el uso de fármacos antiepilépticos para la prevención primaria o secundaria de las convulsiones relacionadas con la HSA45,46.
Dada la disparidad de patología basal que condiciona la craneotomía, hay poca evidencia para poder recomendar o no el uso de fármacos anticonvulsivantes en craniotomías47.
En el accidente vascular las guías no recomiendan el uso profiláctico de antiepilépticos, pero sí su tratamiento en caso de aparición de convulsiones. Una revisión de la Cochrane48 concluye no haber efectos beneficiosos al comparar el ácido valproico con placebo para la prevención primaria de las convulsiones después de la hemorragia cerebral49.
Profilaxis antitrombóticaLa tromboprofilaxis debe individualizarse a cada enfermo teniendo en cuenta los factores de riesgo de tromboembolismo50,51, como las patologías subyacentes. Estudios recientes sugieren que el uso de profilaxis farmacológica no aumenta significativamente el sangrado craneal52.
Podemos diferenciar entre la tromboprofilaxis mecánica, con medias de compresión neumática intermitente, y la tromboprofilaxis farmacológica, con la heparina de bajo peso molecular subcutánea o heparina no fraccionada subcutánea50.
Si nos centramos en las patologías neuroquirúrgicas, las guías recomiendan el uso precoz de tromboprofilaxis mecánica y el paso a farmacológica cuando sea posible, asociándose ambas en caso de alto riesgo, como ictus isquémico y lesión raquimedular. En las hemorragias intracraneales no traumáticas se recomienda retrasar el uso de la tromboprofilaxis farmacológica hasta 48h del ingreso, tras normalizar la coagulación y si el hematoma permanece estable. En el TCE con hemorragia la recomendación es tromboprofilaxis mecánica hasta 24-48h, donde se valoraría el paso a farmacológica. En los pacientes con HSA también se recomienda iniciar profilaxis mecánica al ingreso en el hospital y el uso de profilaxis farmacológica tras haber asegurado el aneurisma. En los pacientes con craneotomías electivas se recomienda iniciar profilaxis farmacológica en las primeras 24h posteriores50,53.
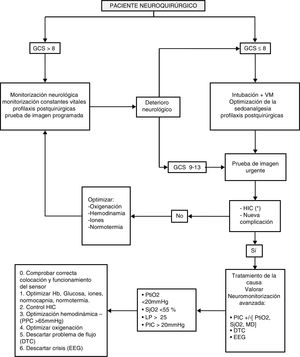
NeuromonitorizaciónCuando la exploración neurológica no es posible o esta no nos da suficiente información se valorará la neuromonitorización avanzada. El algoritmo de neuromonitorización se describe en la figura 1.
Manejo general del paciente neuroquirúrgico.
DTC: doppler transcraneal; EEG: electroencefalograma; GCS: Glasgow Coma Score; HIC: hipertensión intracraneal; LP: lactato-piruvato; MD: microdiálisis; PIC: presión intracraneal; PPC: presión de perfusión cerebral; PtiO2: presión tisular de oxígeno; SjO2: saturación yugular de oxígeno; VM: ventilación mecánica.
* Véase figura 2.
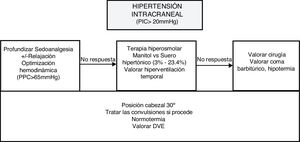
La monitorización de la PIC resulta fundamental en los cuidados de los pacientes con lesión cerebral difusa, habiéndose asociado incrementos de la PIC con un aumento de la mortalidad54-56. Los valores normales de PIC están entre 5 y 15mmHg57. Generalmente unas cifras >20-25mmHg se consideran indicación de tratamiento para el control de esta. Las recomendaciones de control de la HIC se recogen en la figura 2.
Se recomienda la medición de la PIC en pacientes con TCE con GCS inicial igual o inferior a 8 con TC anormal y en aquellos con TC normal pero >40años, hipotensión arterial (sistólica <90mmHg) o respuesta motora anormal al dolor58.
La monitorización de la PIC también está recomendada en pacientes en coma con contusiones, o con imposibilidad de exploración clínica, o en los que la suspensión de la sedación es peligrosa, y después de la craneotomía secundaria. Además debe ser considerada en los pacientes con hematoma agudo supratentorial con riesgo de HIC57,59.
Con la PIC podemos obtener la PPC, definida como presión arterial media−PIC60. El valor objetivo es mantener una PPC >60mmHg; niveles menores se han asociado a peor resultado final61.
También la monitorización de la PIC nos permite objetivar la autorregulación cerebral, es decir, la capacidad que tiene el cerebro de realizar vasoconstricción con aumento de la presión arterial. El índice de velocidad media basado en la PPC y el índice de autorregulación (ARI) predicen la mortalidad, y el resultado neurológico final en el TCE y el ARI, el resultado neurológico en la HSA62.
Flujo cerebralPodemos determinar el flujo cerebral mediante medidas invasivas como la flujometría de difusión térmica. El principal inconveniente de esta técnica es que es un sistema de medición regional que ofrece una información limitada a un área del parénquima63.
Más común es el uso de ultrasonografía con color y doppler transcraneal para la estimación del flujo de regiones cerebrales más amplias, que ha demostrado su utilidad sobre todo en la HSA para la monitorización semicontinua del déficit isquémico tardío y vasoespasmo45,64. Pese a esto, no todos los pacientes tienen una buena ventana acústica y la exactitud de la medida depende de la habilidad del operador57.
Oxigenación cerebralOtro de los pilares de la perfusión cerebral es la correcta oxigenación cerebral, y para esto nos podemos valer de la pulsioximetría para conocer la oxigenación sistémica, además del etCO2 para evitar la hiperventilación y la vasoconstricción cerebral secundaria57.
El sensor de PtiO2 nos ofrece una saturación local y continua del parénquima, con unos valores normales establecidos entre 20-35mmHg65. Existe una relación entre valores bajos de PtiO2 y morbimortalidad, siendo indicación de tratamiento valores inferiores a 20mmHg66. Un valor inferior a 20mmHg puede significar un compromiso en la oxigenación y debe considerarse un tratamiento para optimizar el aporte de oxígeno57.
La SjvO2 nos ofrece información global sobre el uso de oxígeno cerebral. Se mide mediante un catéter colocado en la vena yugular interna dominante con el extremo en el bulbo yugular67. Se consideran valores normales entre el 55 y el 75%. Valores inferiores al 55% son indicativos de riesgo de isquemia y por encima del 75% pueden significar hiperemia, disminución del metabolismo o muerte celular68-70.
La implementación de los sensores de PtiO2 y SjvO2 está recomendada en pacientes con riesgo de isquemia12,57,71.
Mediante el uso de la near infrared spectroscopy (NIRS) cerebral se puede estimar la saturación de oxígeno del tejido cerebral72. Su uso no está recomendado en las guías de neuromonitorización debido a la evidencia limitada y a las limitaciones de la técnica en adultos57,73.
Metabolismo cerebralUna mala perfusión tisular del parénquima cerebral alterará la homeostasis extracelular, la cual se puede medir mediante un catéter de microdiálisis74. Normalmente se suele medir lactato, piruvato, glucosa, glutamato y glicerol, que permiten determinar la existencia de una crisis metabólica74.
La glucosa es la principal fuente de energía del cerebro. Una disminución mantenida a nivel cerebral (<0,8mM) se ha asociado a peores resultados posterior a un TCE grave y HSA74.
La glucosa en condiciones normales se metaboliza a piruvato produciendo ATP en el ciclo de Krebs; en cambio, en situación de hipoxia o disfunción mitocondrial el piruvato es metabolizado a lactato. Un aumento de la ratio lactato/piruvato (LP) en el espacio extracelular traduce una situación de hipoxia o de disfunción neuronal. Un aumento de LP con disminución de piruvato es sugestivo de isquemia clásica; en cambio, un aumento de LP con piruvato normal sugiere una causa no isquémica, como disfunción mitocondrial75.
El glutamato se ha relacionado con el daño celular y la respuesta inflamatoria. Una elevación del glutamato puede traducir hipoxia y/o isquemia. El glicerol es un componente lipídico de las neuronas y un marcador de daño celular neuronal, por lo que una elevación del glicerol es un marcador de hipoxia y/o isquemia y de destrucción de la membrana neuronal75.
El uso de microdiálisis está recomendado en los pacientes con riesgo de isquemia cerebral, hipoxia y situaciones de déficit de glucosa64,76.
Actividad eléctrica cerebralEl electroencefalograma (EEG) registra la actividad eléctrica y es fundamental para detectar crisis epilépticas, sobre todo crisis no convulsivas. El EEG continuo (cEEG) tiene más posibilidades de detectar crisis no convulsivas que el EEG convencional77, pero la dificultad técnica y de interpretación, así como la disponibilidad de la misma, limitan la generalización de la técnica.
El cEEG está indicado en los pacientes con alteración del nivel de conciencia persistente o inexplicada57. El EEG es útil en el diagnóstico del estatus epiléptico no convulsivo, pero también para evaluar la respuesta al tratamiento. Así mismo, en pacientes con HSA de alto grado el cEEG puede poner en evidencia un déficit neuronal isquémico tardío de nueva aparición.
Conclusiones- –
El paciente neuroquirúrgico requiere un manejo postoperatorio integral, incluyendo una monitorización dinámica en función de su situación clínica.
- –
En pacientes conscientes se realizará una exploración neurológica completa y frecuente para detectar la aparición de déficits no presentes a su ingreso en la UCI.
- –
Los pacientes neurológicos precisan una estrategia ventilatoria y de analgosedación que favorezca la oxigenación cerebral y permita ventanas periódicas de sedación.
- –
En pacientes sedados donde la exploración clínica completa no es posible se considerará la monitorización multimodal, incluyendo los dispositivos de medición de PIC, PtiO2, EEG… que nos ayuden a optimizar el manejo y a detectar la aparición de complicaciones.
Los autores refieren no tener conflicto de intereses.