Editado por: Ana Ochagavía - Hospital Universitario de Bellvitge. L'Hospitalet de Llobregat. Barcelona. Spain.
Última actualización: Febrero 2024
Más datosLa evaluación integral mediante ecografía se ha convertido en una herramienta indispensable para facilitar el diagnóstico y el manejo terapéutico en los pacientes críticos con insuficiencia respiratoria aguda (IRA). Existe evidencia que apoya el uso de la ecografía para el diagnóstico de neumotórax, síndrome de distrés respiratorio agudo, edema pulmonar cardiogénico, neumonía, tromboembolismo pulmonar agudo y el paciente con COVID-19. Además, en los últimos años se ha desarrollado el uso de la ecografía para evaluar la respuesta a los tratamientos en los pacientes críticos con IRA, brindando una herramienta no invasiva para la titulación de la presión positiva al final de la espiración, monitorizar las maniobras de reclutamiento y la respuesta al prono, así como para facilitar la retirada de la ventilación mecánica. El objetivo de esta revisión es resumir los conceptos básicos sobre la utilidad de la ecografía en el diagnóstico y la monitorización de los pacientes críticos con IRA.
Comprehensive ultrasound assessment has become an essential tool to facilitate diagnosis and therapeutic management in critically ill patients with acute respiratory failure (ARF). There is evidence supporting the use of ultrasound for the diagnosis of pneumothorax, acute respiratory distress syndrome, cardiogenic pulmonary edema, pneumonia, acute pulmonary thromboembolism, and the patient with COVID-19. In addition, in recent years, the use of ultrasound to evaluate response to treatments in critically ill patients with ARF has been developed, providing a non-invasive tool for titrating positive end-expiratory pressure, monitoring recruitment maneuvers and response to prone, as well as to facilitate weaning from mechanical ventilation. The objective of this review is to summarize the basic concepts on the utility of ultrasound in the diagnosis and monitoring of critically ill patients with ARF.
La insuficiencia respiratoria aguda (IRA) es uno de los principales problemas a los que nos enfrentamos en las unidades de cuidados intensivos (UCI). En la IRA, uno de los elementos diagnósticos claves son las pruebas de imagen. En este sentido, la ecografía, que permite obtener imágenes en tiempo real, a pie de cama y de manera no invasiva, ha demostrado ser una herramienta con un rendimiento diagnóstico superior al de la radiografía de tórax para el diagnóstico de las principales entidades que afectan al paciente crítico, siendo una alternativa a la tomografía computarizada (TC)1.
Ecografía en el diagnóstico diferencial de la insuficiencia respiratoria en el paciente críticoProtocolo BLUEEl BLUE Protocol(Bedside Lung Ultrasound in Emergency Protocol) supone el primer algoritmo diagnóstico de la IRA mediante ultrasonidos2.
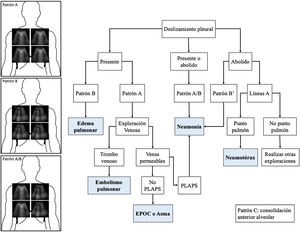
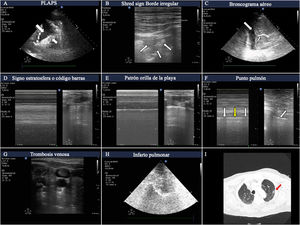
Tal y como se ha comentado en capítulos anteriores de esta serie, este protocolo genera patrones basados en la presencia en los campos pulmonares estudiados de líneasA, B y del deslizamiento pleural, así como la existencia del punto pulmón y la existencia de PLAPS (posterolateral alveolar and pleural síndrome). Basado en estos patrones, se propuso un algoritmo diagnóstico para la IRA (fig. 1). En conjunto, estos perfiles proporcionan un diagnóstico correcto en el 90,5% de los casos (tabla 1), siendo más difícil el diagnóstico de neumonía, que se realiza con mayor precisión ante la presencia de PLAPS (fig. 2).
BLUE Protocol. Se muestran los patrones más frecuentes: el patrónA, con líneasA en los cuatro puntos estudiados; el patrónB, con líneasB en los cuatro cuadrantes, y el patrón A/B, que muestra una distribución variable de líneasA yB. En función de los patrones ecográficos y del deslizamiento pulmonar se pueden establecer los diferentes diagnósticos en los pacientes con insuficiencia respiratoria aguda.PLAPS: posterolateral alveolar and pleural syndrome.
Patrones y patologías asociadas según el BLUE Protocol
| Patrón | Hallazgos | Patología asociada | Excluye | |
|---|---|---|---|---|
| Deslizamiento pleural presente | A | • Ecografía pulmonar:Sliding presenteLíneas A bilaterales• Ecocardiografía:VD dilatadoDisfunción VD• Ecografía venosa:Trombosis | EPOCAsmaTEPNeumonías posteriores | Edema pulmonarNeumonía anterior |
| B | • Ecografía pulmonar:Sliding presenteLíneas B bilaterales• Ecocardiografía:Disfunción VIPresiones de llenado• VExUS:Congestión grave | Edema pulmonarCardiogénicoSDRA | EPOC reagudizadoAsmaTEPNeumotórax | |
| A/B | • Ecografía pulmonar:Sliding presenteLíneas B en un ladoLíneas A en otro | Neumonía unilateral | EPOC reagudizadoAsma | |
| Deslizamiento pleural ausente | A’ | • Ecografía pulmonar:Sliding ausenteLíneas ASigno código barrasPunto pulmón | Neumotórax | Edema pulmonar |
| B’ | • Ecografía pulmonar:Sliding ausenteLíneas B | NeumoníaSDRA | Neumotórax | |
| C | • Consolidación alveolar encontrada en campos pulmonares anteriores | Neumonía |
EPOC: enfermedad pulmonar obstructiva crónica; SDRA: síndrome de distrés respiratorio agudo; TEP: tromboembolismo pulmonar; VD: ventrículo derecho; VExUS: valoración de la congestión venosa con ecografía; VI: ventrículo izuquierdo.
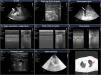
Hallazgos más frecuentes en pacientes con insuficiencia respiratoria aguda. A)Imágenes de PLAPS mostrando zonas hiperecoicas que delimitan un borde mal definido (flecha pequeña) y derrame pleural (flecha grande). B)Consolidación subpleural consistente en zona hipoecoica en contacto con la línea pleura, rodeada de borde hiperecoico irregular (shred sign). C)Imagen de broncograma aéreo mostrando líneas hiperecoicas (flecha pequeña) en el seno de un pulmón hepatizado rodeado de derrame pleural adyacente (flecha grande). D)Patrón en «código de barras», también denominado «de la estratosfera» en el modoM, correspondiente a un neumotórax. E)Patrón de «orilla de la playa» de un pulmón con un deslizamiento pleural preservado. F)ModoM colocado (izquierda) en la zona correspondiente al punto pulmón (flecha, imagen derecha); se puede observar cómo oscilan los patrones en orilla de la playa (flechas blancas) y en código de barras (flecha amarilla) en relación a las fases inspiratoria y espiratoria. G)Imagen de trombo en la vena yugular interna que aparece como hiperecoica, ocupando la mayor parte de la luz vascular. H)Infarto pulmonar: zona hipoecoica, con imagen hiperecoica en su interior (tomada con sonda de baja frecuencia) que se corresponde con árbol bronquial. I)Región de infarto pulmonar (flecha roja) en la tomografía computarizada pulmonar del mismo paciente.
La sensibilidad de los ultrasonidos para la detección del neumotórax es superior a la de la radiología convencional y similar a la de la TC3,4.
En la exploración ecográfica del neumotórax aparecen los siguientes hallazgos:
- •
Ausencia de deslizamiento pulmonar (lung sliding).
- •
Ausencia de líneas B (al no existir parénquima pulmonar inmediatamente por debajo de la línea pleural).
- •
Cambio del patrón normal en modoM, denominando patrón en «orilla de la playa» al patrón en «código de barras», también llamado «de la estratosfera». Este presenta una serie de líneas paralelas de distinto grosor (fig. 2). Este signo también puede aparecer al explorar grandes bullas, que pueden ser confundidas con neumotórax.
- •
Presencia de punto pulmón, hallazgo presente cuando el neumotórax no es masivo. Este signo consiste en la aparición de pulmón en la imagen 2D en inspiración, y su desaparición en la espiración, correspondiendo con el lugar en el que la pleura visceral y la parietal se despegan. También podemos encontrarlo como cambios en el modoM, consistentes en paso de patrón en «orilla de la playa» a «código de barras» en sucesivos ciclos respiratorios (fig. 2 y vídeo 1 del material electrónico suplementario). Su especificidad es del 100% para el diagnóstico de neumotórax.
Tanto el síndrome de distrés respiratorio agudo (SDRA) como el edema agudo de pulmón de origen cardiogénico producen una imagen ecográfica con patrónB bilateral del BLUE Protocol, en ambos casos denominado síndrome intersticial2. En el síndrome intersticial de causa no cardiogénica los campos pulmonares son habitualmente desiguales en su afectación, especialmente al inicio de la insuficiencia respiratoria, afectando a zonas dependientes de gravedad, a diferencia de cuando la causa es cardiaca, donde la distribución es hidrostática. Patologías previas pulmonares con destrucción de parénquima (enfisema) alteran la homogeneidad de los hallazgos en el edema agudo de pulmón.
Algunos datos adicionales, como el aumento del grosor y la irregularidad de la línea pleural, sugieren que el síndrome intersticial esté relacionado con algún proceso inflamatorio, ya sea neumonía u otro proceso inflamatorio pulmonar4. El hallazgo de condensaciones subpleurales también apunta a la existencia de neumonía como origen del síndrome intersticial.
No obstante, el estudio mediante ultrasonidos de la función cardiaca, tanto sistólica como diastólica, y del calibre de la vena cava inferior complementan la información para un diagnóstico más preciso.
NeumoníaPara el diagnóstico de neumonía mediante ultrasonidos identificaremos patronesB’, A/B yC. El hallazgo de PLAPS añade precisión diagnóstica. Es muy importante poder encontrar consolidaciones subpleurales en los campos anteriores, caracterizadas por zonas hipoecoicas en contacto con la línea pleural5. Estas zonas hipoecoicas tienen márgenes irregulares, lo que se denomina signo fragmentado o fractal (shred sign, fig. 2).
La aparición de broncograma aéreo móvil dirige al diagnóstico de neumonía. Consiste en imágenes hiperecoicas lineales, con apariencia ramificada en ocasiones, que se mueven con la respiración si la vía respiratoria correspondiente se encuentra permeable. La imagen es ocasionada por la entrada de gas en el árbol bronquial conteniendo secreciones (fig. 2 y vídeo 2 del material electrónico suplementario).
Tromboembolismo pulmonarEn el contexto de un paciente con insuficiencia respiratoria, el patrónA bilateral del BLUE Protocol tiene como posible diagnóstico el embolismo pulmonar2. Se complementa esta exploración con la vascular en la búsqueda de trombosis venosa (fig. 2), y con la exploración cardíaca en busca de signos de disfunción o dilatación del ventrículo derecho.
Otro posible hallazgo ecográfico relacionado con el embolismo pulmonar es la imagen de infarto pulmonar, caracterizada como una zona hipoecoica, triangular y subpleural6 (fig. 2).
EPOC descompensada y asmaLa presencia de patrón A bilateral y la ausencia de trombosis venosa y de PLAPS son datos que orientan a que la IRA se deba a enfermedad pulmonar obstructiva crónica (EPOC) o asma2.
La utilidad y la precisión de la exploración mediante ultrasonidos para estos diagnósticos, obviando la necesidad de trasladar al paciente al área de radiodiagnóstico, ha sido publicada en un reciente metaanálisis, con sensibilidad de 0,78 (IC95%: 0,67-0,86) y especificidad de 0,94 (IC95%: 0,89-0,97)7.
Ecografía en el paciente con COVID-19La ecografía pulmonar ha demostrado ser de utilidad en el paciente con COVID-198. La ecografía ofrece información sobre el diagnóstico y la extensión de la afectación pulmonar en la fase temprana o paucisintomática, con una mayor capacidad diagnóstica que la radiografía convencional9.
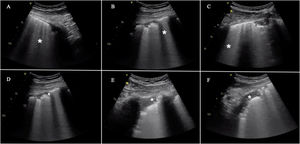
En general, los principales hallazgos ecográficos no difieren de aquellos que podemos observar en pacientes con SDRA de otra etiología y en otras patologías pulmonares, por lo que el hallazgo principal serán las líneasB, reflejando la afectación intersticial o alveolo-intersticial en la neumonía por SARS-CoV-2. No obstante, existen algunas particularidades10,11, como un artefacto característico que aparece en fases precoces (light beam), hiperecogénico, en forma de banda, que se extiende desde una línea pleural regular y un fondo de líneasA, y que aparece y desaparece con el deslizamiento pleural. El resto de los hallazgos se resumen en la figura 3.
Hallazgos frecuentes en pacientes con insuficiencia respiratoria aguda asociada a COVID-19. Incluye la presencia de líneasB en todas sus formas posibles, separadas o coalescentes, llegando incluso a formar una imagen de «pulmón blanco». Pueden partir de la línea pleural o de pequeñas consolidaciones periféricas. A)LíneasB separadas. B)LíneasB coalescentes. C)«Pulmón blanco». D)Línea pleural irregular y fragmentada. E y F)Consolidaciones subpleurales.
Aunque ninguno de estos signos es específico de la neumonía COVID-19, la distribución de estas alteraciones, en un entorno epidemiológico concreto, le otorga una gran especificidad. Es característica la afectación bilateral, en forma de grupos parcheados de líneasB que conviven con otras zonas pulmonares «libres»10,12. Las lesiones tienen una distribución periférica y predominan en campos posteroinferiores, extendiéndose a regiones laterales y anteriores a medida que progresa la enfermedad. Por el contrario, la aparición de derrames pleurales significativos o de grandes consolidaciones lobares obliga a tener en cuenta diagnósticos alternativos o complicaciones12.
La ecografía como herramienta para guiar el tratamiento de los pacientes con insuficiencia respiratoriaIntubaciónLa utilidad de la ecografía en la intubación incluye tanto la valoración de la vía aérea superior para predecir una vía aérea difícil13,14 como a modo de herramienta para comprobar la posición correcta del tubo endotraqueal (TET) tras la intubación15,16. Nos centraremos en este segundo caso, por ser la intubación emergente uno de los escenarios más frecuentes en el paciente crítico, no siendo posible en la mayoría de las ocasiones valorar una vía aérea antes de la intubar.
Comprobación de la intubaciónLa confirmación de una correcta posición del TET es fundamental, ya que se estima que el 3,3% de intubaciones emergentes son esofágicas17.
La ecografía traqueal ha mostrado tener el mismo valor que la capnografía para la exclusión de la intubación esofágica, con el 98,7% de sensibilidad y el 97,1% de especificidad, siendo incluso superior en pacientes con bajo gasto cardíaco en el contexto de una parada cardiaca18. Además, la ecografía traqueal presenta la ventaja de no precisar el inicio de las ventilaciones para la confirmación, lo que sí requiere la capnografía, disminuyendo el riesgo de distensión gástrica y de broncoaspiración.
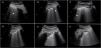
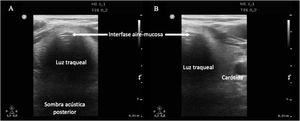
Para descartar la intubación esofágica es necesario utilizar un transductor lineal de alta frecuencia situado en la escotadura supraesternal, obteniendo una imagen transversal anterior del cuello y la vía aérea. En este plano, la tráquea se identifica como una línea hiperecogénica con forma de U invertida, generada por la interfase mucosa-vía aérea, con un artefacto con sombra acústica típica posterior (fig. 4). El esófago está colapsado y se encuentra en posición paratraqueal lateral izquierda. Una intubación esofágica se detectaría por la observación de una estructura circular anecoica adyacente a la tráquea (generalmente en el lado izquierdo de la tráquea), signo que se conoce como «doble tráquea» (fig. 4).
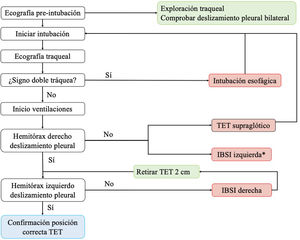
Se ha propuesto un protocolo16 que combina la ecografía traqueal y la torácica para evaluar la viabilidad de la ecografía en la confirmación de la posición correcta del TET en pacientes en UCI (algoritmo 1).
Algoritmo propuesto para la comprobación de la correcta posición del tubo endotraqueal16.
IBSI: intubación bronquial selectiva inadvertida. TET: tubo endotraqueal; *Poco frecuente.
En algunos casos dudosos, o para tener una confirmación adicional, se puede realizar una ecografía diafragmática para observar la excursión diafragmática durante las ventilaciones.
Respuesta a las maniobras de reclutamiento y el decúbito pronoLa ecografía ofrece la posibilidad de valorar, de una forma semicuantitativa, el grado y la distribución de la aireación pulmonar. Además, la posibilidad de repetir la exploración a pie de cama nos permite evaluar los cambios en respuesta a los tratamientos y maniobras que apliquemos en pacientes con IRA.
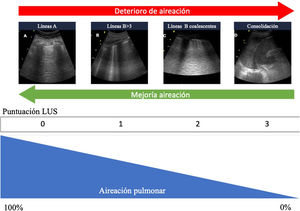
Cuantificación de la aireación pulmonarLos diferentes patrones ecográficos reflejan diferentes grados de aireación (fig. 5). Así, el patrónA corresponde a un parénquima pulmonar normalmente aireado. La presencia de tres o más líneasB en un espacio intercostal, separadas (B1), corresponde a una moderada pérdida de aireación, resultado de la afectación intersticial. Las líneasB coalescentes (B2) aparecen con una pérdida de aireación grave, como resultado de la afectación alveolar. Cuando la pérdida de aireación es completa, observaremos un patrón de consolidación (C)19.
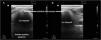
Patrones ecográficos de aireación pulmonar. A)Patrón de líneasA, aireación normal. B)B ≥3, líneasB separadas que indica moderada pérdida de aireación. C)Líneas B coalescentes, pérdida grave de aireación. C)Patrón tisular o de consolidación, pérdida completa de aireación. A cada patrón le corresponde una puntuación para generar el Lung Ultrasound Score (LUS).
Dividiendo cada hemitórax en regiones y otorgando un valor numérico a cada patrón, se puede obtener un valor global. La clasificación más extendida analiza doce regiones torácicas (seis por hemitórax: superior e inferior en los cuadrantes anteriores, laterales y posteriores)19. Cada región recibe una puntuación en función del patrón ecográfico (de 0 a 3 puntos). Siguiendo esta clasificación, la puntuación global (Global score o Lung Ultrasound Score [LUS]) variará entre 0 (pulmones aireados) y 36 (pulmones con pérdida total de la aireación). De este modo, se pueden utilizar variaciones de esta puntuación para expresar tanto la pérdida de aireación como la re-aireación en diferentes situaciones clínicas19,20.
Se han propuesto modificaciones sobre esta clasificación con el objetivo de mejorar la precisión en la valoración de la aireación pulmonar21. En este caso, seguiremos clasificando como normal un patrónA y como pérdida completa de aireación un patrónC. El grado de afectación entre estos dos extremos variará en función del compromiso de la línea pleural. Consideraremos que la pérdida de aireación es moderada cuando menos del 50% de la línea pleural esté afectada. Sin embargo, si encontramos artefactos (líneasB o consolidaciones subpleurales) en más del 50% de la línea pleural, consideraremos que existe una pérdida grave de aireación (tabla 2).
Clasificación de la aireación pulmonar
| Clásica | Modificada | |
|---|---|---|
| 0: aireación normal | Líneas A (< 3 líneas B) | Líneas A (< 3 líneas B) |
| 1: pérdida moderada | ≥ Líneas B1, separadas | Ocupación por artefactos ≤ 50% de la pleural |
| 2: pérdida grave | Líneas B2, coalescentes | Ocupación por artefactos > 50% de la pleural |
| 3: pérdida completa | Patrón tisular | Patrón tisular |
La ecografía permite evaluar la distribución de la pérdida de aireación22. Esta información resulta útil para diferenciar dos fenotipos de SDRA en función de su morfología. En los pacientes con SDRA focal predomina la afectación en regiones posteroinferiores, con una pérdida grave o completa de la aireación, mientras que los campos pulmonares anteriores están relativamente respetados. Estos pacientes responden mejor al prono23, mientras que niveles altos de presión positiva al final de la espiración (PEEP) pueden dar lugar a sobredistensión de las áreas con aireación conservada24. Por el contrario, los pacientes con SDRA de distribución difusa, en los que la pérdida de aireación afecta de forma parcheada a todas las regiones pulmonares, responden mejor a las maniobras de reclutamiento y niveles más elevados de PEEP24. Identificar los diferentes fenotipos de SDRA en función de su morfología es fundamental, ya que la elección de la estrategia ventilatoria en función de la clasificación puede repercutir sobre el pronóstico clínico25.
Utilizando los patrones ecográficos mencionados anteriormente (A, B1, B2 y C) calcularemos el LUS. Una puntuación ≥3 en regiones anteriores permite excluir con precisión la morfología focal26, en comparación con la TC. Se han descrito otros dos métodos que emplean el mismo sistema de puntuación y que complementan la información con el estudio de campos laterales y posteriores27.
Predicción de la respuesta al decúbito pronoVarios estudios han analizado la capacidad de la ecografía para predecir la respuesta al decúbito prono en pacientes con SDRA23,28,29. La presencia de un patrón ecográfico de aireación normal en campos anteriores en supino podría predecir la respuesta al prono, definida como una mejoría en la oxigenación23. Recientemente se han descrito resultados similares en pacientes con SDRA secundario a COVID-1929. No obstante, aunque la ecografía parece predecir la re-aireación de las zonas dorsales tras la maniobra de decúbito prono, no ha sido capaz de predecir la mejoría de la oxigenación en todos los estudios30, probablemente debido a los diferentes mecanismos implicados en la respuesta al prono y las limitaciones de la ecografía para cuantificar la aireación y la sobredistensión pulmonar31.
A raíz de la pandemia por SARS-CoV-2 ha crecido considerablemente el decúbito prono en pacientes con IRA hipoxémica que no reciben ventilación mecánica invasiva. En este tipo de pacientes también se ha propuesto que los cambios en los patrones de aireación pulmonar evaluados mediante ecografía podrían predecir la respuesta a prono32. Además, entre los pacientes con IRA hipoxémica que reciben oxigenoterapia de alto flujo, el éxito de la técnica parece relacionarse con una mayor disminución del LUS en las zonas dorsales en respuesta al prono33.
Respuesta a maniobras de reclutamiento y titulación de la PEEPBasándose en la alta sensibilidad y especificidad de la ecografía para la detección del colapso pulmonar34, así como la capacidad para monitorizar los cambios en la aireación pulmonar en tiempo real, se ha propuesto su potencial utilidad para guiar las maniobras de reclutamiento y titulación de la PEEP35. De hecho, se ha descrito una correlación entre el reclutamiento pulmonar inducido por la PEEP medido por las curvas de presión-volumen y la puntuación de re-aireación por ecografía19. Sin embargo, los cambios en la puntuación por ecografía no parecen asociarse con el reclutamiento evaluado mediante TC, considerado el gold standard36, seguramente debido a que los cambios en la puntuación ecográfica se deben a cualquier modificación en la aireación y no solo a la aireación de regiones consolidadas.
Mediante el estudio de la aireación pulmonar en los 12 cuadrantes mencionados, podremos detectar los cambios inducidos por un aumento de la PEEP al observar una disminución progresiva de líneasB o la aparición de estas en zonas previamente consolidadas en caso de reclutamiento19.
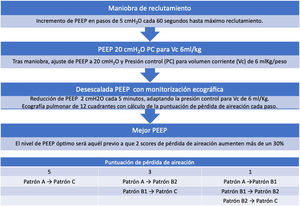
Aunque de forma experimental, se ha propuesto un enfoque para titular la PEEP con ecografía en pacientes con SDRA37 (algoritmo 2).
Algoritmo propuesto para la titulación de la presión al final de la espiración (PEEP) guiada por ecografía pulmonar. La puntuación de pérdida de aireación se calcula mediante la suma de los cambios observados en los patrones ecográficos en cada uno de los 12 cuadrantes estudiados. PatrónA: patrón de líneasA. PatrónB1: patrón de líneasB separadas. PatrónB2: patrón de líneasB coalescentes; PatrónC: patrón de condensación pulmonar.
No existen signos ecográficos específicos que nos permita detectar la sobredistensión pulmonar ocasionada por el aumento de las presiones intratorácicas; sin embargo, algunos signos indirectos nos pueden inducir a sospecharlo. La disminución considerable o incluso la desaparición del deslizamiento pleural puede asociarse a una significativa alteración en la ventilación relacionada con PEEP elevadas38, sobre todo si reaparece cuando se disminuye de nuevo la PEEP39. En cualquier caso, existe una limitada evidencia disponible en el uso de la ecografía pulmonar para la titulación de la PEEP y no debe ser el único método para realizarla, ya que no permite una evaluación precisa de la hiperinsuflación pulmonar inducida por PEEP.
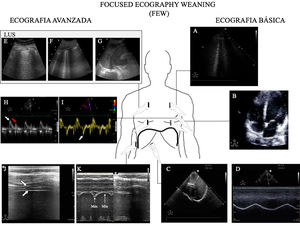
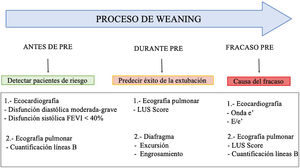
Utilidad de la ecografía en el weaning de la ventilación mecánicaEl fracaso del weaning o la reintubación precoz se asocian a una elevada morbimortalidad40, por lo que una evaluación dirigida al diagnóstico precoz de las causas que dificultan la desconexión de la ventilación mejorará el pronóstico de los pacientes. Las principales causas de fracaso del weaning pueden resumirse en tres grandes grupos: respiratorias, cardíacas y neuromusculares41. En ese sentido, el estudio mediante ecografía del corazón, los pulmones y la musculatura respiratoria puede ayudar a comprender el proceso fisiopatológico por el que un paciente fracasa en el proceso de weaning (fig. 6 y algoritmo 3).
Principales exploraciones ecográficas utilizadas para el diagnóstico de la causa del fracaso de la retirada de la ventilación mecánica. Se dividen en exploraciones que precisan un conocimiento básico de ecografía y exploraciones que precisan un grado avanzado de formación en ecografía. A)Ecografía pulmonar con detección de un aumento ≥6 líneasB durante la prueba de respiración espontánea para el diagnóstico de edema pulmonar inducido por el weaning (WIPO). B)Ecografía cardiaca, plano apical 4cámaras para estudio de la función sistólica del ventrículo izquierdo y el estudio de alteraciones estructurales del mismo (hipertrofia, dilatación, insuficiencia mitral grave). C)Estudio del diafragma mediante la excursión, en imagen en 2dimensiones (ver vídeo del material electrónico suplementario). D)Estudio del diafragma mediante la excursión, imagen en modoM; obsérvese la onda generada por el desplazamiento diafragmático con los movimientos respiratorios (una excursión <10mm se considera patológica). E-G)Imágenes utilizadas para el cálculo del Lung Ultrasound Score (LUS) tal y como se describe en el texto. H)Estudio de la función diastólica, imagen de Doppler pulsado del flujo transmitral mostrando las ondas de llenado temprano (E, flecha blanca) y tardío (A, flecha roja). I)Estudio de función diastólica, imagen de Doppler tisular del anillo mitral lateral mostrando la ondae’ (flecha blanca). J)Imagen en modo bidimensional del diafragma en la zona de aposición sobre el noveno espacio intercostal; el diafragma es la estructura localizada ente las dos líneas hiperecogénicas identificadas con la flechas (superior pleura, inferior diafragma, vídeo del material electrónico suplementario). K)Imagen en modoM para el estudio de la fracción de engrosamiento diafragmática identificando el grosor máximo en la inspiración y el mínimo en la espiración.
Durante la fase de weaning, el aumento de la precarga y la poscarga cardiacas causadas por el cambio de la presión intratorácica de positiva a negativa, el aumento de la secreción de catecolaminas y el trabajo respiratorio42 pueden inducir un edema pulmonar cardiogénico (weaning induced pulmonary oedema [WIPO]). Si bien la incidencia de WIPO no está bien establecida, se estima que puede estar involucrado en entre el 30% y el 87% de los fracasos43,44.
El estudio mediante ecocardiografía de los parámetros de función diastólica (llenado ventricular y relajación miocárdica) y presiones de llenado del ventrículo izquierdo juega un papel primordial en la evaluación del fracaso del weaning de la ventilación mecánica45. El estudio del flujo transmitral mediante Doppler pulsado y de la velocidad de desplazamiento del anillo mitral mediante Doppler tisular permite identificar las ondasE ye’, respectivamente (fig. 6). La relación entre las ondas E/e’ se ha sugerido como una medida para estimar la presión de llenado del ventrículo izquierdo46, si bien los resultados son contradictorios47.
El aumento del retorno venoso inducido por el paso a respiración espontánea se verá reflejado en la ecocardiografía con un aumento significativo de la ondaE48. En pacientes con disfunción diastólica y ventrículos poco compliantes (ondae’ <10cm/s) el aumento del retorno venoso puede provocar un aumento de la presión de llenado que se verá reflejado por aumento en la relación E/e’. Lamia et al. demostraron que una combinación de E/A >0,95 y E/e’ >8,5 detectaba aquellos pacientes en los que la prueba de respiración espontánea (PRE) inducía un aumento de la presión capilar49. Un metaanálisis publicado recientemente ha demostrado que los pacientes que fracasan en el weaning presentan velocidades de ondaE más elevadas y de ondae’ menores, con ratio E/e’ significativamente más elevada que los pacientes que completan la PRE con éxito50. Sin embargo, los estudios incluidos en el análisis muestran valores de las diferentes velocidades muy heterogéneos, por lo que no se puede establecer un punto de corte.
La función sistólica, estudiada mediante la fracción de eyección, no se ha asociado de forma significativa con el fracaso del weaning50. Sin embargo, como todos los resultados que hagan referencia a la fracción de eyección en pacientes críticos, deben interpretarse con cautela, ya que el parámetro depende en gran medida de las condiciones de carga. Otros parámetros, como la ondaS’ o el strain, podrían tener un papel importante en el contexto del weaning de la ventilación mecánica.
Ecografía pulmonarEn los pacientes sometidos a ventilación mecánica, el inicio de la respiración espontánea se asocia con cierta pérdida de aireación pulmonar51, ya sea por una ocupación de los alvéolos por edema pulmonar en el contexto de WIPO o por un desreclutamiento alveolar por la pérdida de la PEEP o asociada a una disfunción diafragmática. La utilización de la ecografía permite objetivar y monitorizar esta pérdida de aireación de forma objetiva mediante el LUS. El cálculo del LUS a los 60minutos del inicio de la PRE ha demostrado ser una herramienta precisa para predecir la aparición de insuficiencia respiratoria posterior a la extubación51. Los pacientes que presentarán insuficiencia respiratoria tras la extubación tienen puntuaciones mayores en el LUS, independientemente de la causa subyacente. El límite identificado para predecir un riesgo del 85% de fracaso posterior a la extubación es LUS>17, mientras que un valor <13 indica un riesgo insignificante de desarrollar un fracaso posterior a la extubación. Cabe decir que la puntuación LUS tal y como se define, en la práctica clínica, está limitada por su complejidad y por el tiempo necesario para su cálculo preciso.
La ecografía pulmonar también es útil para detectar el WIPO. En este caso, el estudio reducido a los 4 cuadrantes torácicos anteriores del BLUE Protocol, con la cuantificación de las líneasB de cada cuadrante antes y al final de la PRE, permite el diagnóstico de WIPO con una sensibilidad del 88% y una especificidad del 88% si la cantidad de líneas B aumenta en ≥6 durante la PRE52.
Ecografía diafragmáticaEl diafragma es el principal músculo respiratorio y tiene un papel vital en la ventilación. La evidencia acumulada sugiere que la mayoría de los pacientes críticos sometidos a ventilación mecánica desarrollan algún grado de disfunción diafragmática y juegan un importante papel en el fracaso del weaning de la ventilación mecánica53.
Si bien la medida de la presión transdiafragmática se considera el gold standard para el diagnóstico de disfunción diafragmática, la ecografía permite la visualización del diafragma y su variación durante los ciclos respiratorios de forma no invasiva. Se han descrito dos parámetros ultrasonográficos diferentes para evaluar la funcionalidad diafragmática (fig. 6 y vídeos 3 y 4 del material electrónico suplementario).
El primer parámetro es la medición de la excursión diafragmática54. La excursión se puede medir fácilmente con una sonda de 3 a 5MHz colocada en la línea medio-clavicular debajo del margen costal, orientada dorsalmente para visualizar la excursión de la cúpula diafragmática usando el hígado (o el bazo, en el lado izquierdo) como ventana acústica (fig. 6). Los pacientes con disfunción diafragmática, definida por un valor de excursión <10mm para cualquiera de los hemidiafragmas, tienen un mayor tiempo de weaning y una mayor frecuencia de reintubación55. Recientemente una revisión sistemática56 concluye que la excursión diafragmática puede predecir el fracaso del weaning con una odds ratio diagnóstica de 9,14 (IC95%: 4,74-17,64).
Algunos estudios han propuesto integrar la excursión diafragmática en un índice que la relaciona con la frecuencia respiratoria57. Este índice (frecuencia respiratoria/excursión diafragmática en milímetros) ha demostrado mejores resultados que la evaluación aislada de la excursión diafragmática.
El segundo parámetro describe el engrosamiento del músculo diafragmático durante la inspiración. Colocando una sonda de 10MHz sobre el noveno espacio intercostal, en la zona de aposición del diafragma, podemos medir el grosor diafragmático máximo (al final de la inspiración) y mínimo (al final de la espiración) calculando la fracción de engrosamiento ([grosor al final de la inspiración−grosor al final de la espiración]/grosor al final de la espiración)58. Una fracción de engrosamiento del 30%-36% se asocia con el éxito del weaning con una odds ratio diagnóstica de 42,6 (IC95%: 17,6-103,0)59,60.
En la práctica clínica, al seleccionar una u otra medida de evaluación diafragmática deberíamos tener en consideración la modalidad de la PRE. Se ha demostrado que en pacientes ventilados en presión soporte el engrosamiento diafragmático se correlaciona con parámetros invasivos de presión diafragmática, siendo un indicador fidedigno del esfuerzo respiratorio, mientras que la excursión no se correlaciona con el esfuerzo respiratorio, reflejando únicamente el desplazamiento pasivo del diafragma por la presión proporcionada por el ventilador, por lo que solo debería usarse en aquellos pacientes en que la PRE se realice en tubo enT61.
Limitaciones de la ecografía en el paciente con IRA y el weaning de la ventilación mecánicaEs importante tener en cuenta las limitaciones de la ecografía al interpretar los hallazgos. En primer lugar, la técnica es operador-dependiente y requiere un grado de formación que puede ser básico o avanzado62, mientras que en el estudio básico mediante el BLUE Protocol, la estimación visual de la función sistólica del ventrículo izquierdo o la excursión diafragmática requieren niveles básicos de formación, y la valoración cuantitativa de la aireación pulmonar, el estudio de la vía aérea, del engrosamiento diafragmático o de las presiones de llenado del ventrículo izquierdo necesitan un grado avanzado de formación63.
Además, la ecografía pulmonar permite visualizar las alteraciones y los artefactos que estén en contacto directo con la pleural, de manera que no es posible visualizar algunas lesiones profundas que no tengan traducción sobre la línea pleural. Por lo tanto, los hallazgos deben interpretarse con precaución y siempre teniendo en cuenta el contexto clínico64.
La exploración puede verse dificultada por las características anatómicas del paciente o por la presencia de dispositivos artificiales o de enfisema subcutáneo. Además, la visualización de la pleura está limitada por la amplitud del espacio intercostal.
Por último, una de las principales limitaciones de la ecografía, sobre todo al evaluar el reclutamiento, es la ausencia de signos específicos que nos permita detectar la sobredistensión pulmonar ocasionada por el aumento de las presiones intratorácicas19.
FinanciaciónNo se recibió financiación para este trabajo y su publicación.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.