INTRODUCCIÓN
Muchos pacientes ingresados en la unidad de cuidados intensivos (UCI) han sufrido la acción de una noxa concreta, una agresión cuantificable que, además de desencadenar fenómenos inflamatorios, puede alterar la coagulación o desarrollar síndrome de distrés respiratorio del adulto (SDRA). Éste es el caso de los pacientes politraumatizados y los sometidos a grandes cirugías (p. ej., cirugía cardíaca). En estos pacientes existen también características genéticas que determinan la respuesta y condicionan la aparición de complicaciones y, finalmente, el pronóstico.
El conocimiento que se está alcanzando de manera paulatina sobre la genética del paciente críticamente enfermo hace que comiencen a aparecer algunos estudios que apuntan la futura utilidad de la información genética en el tratamiento de nuestros pacientes. Evidentemente, son estudios preclínicos que no ofrecen datos relevantes para la práctica clínica diaria. Sin embargo, constituyen una invitación para que el médico intensivista obtenga otro punto de vista potencialmente desarrollable sobre el tratamiento del paciente crítico.
Por otro lado, la información obtenida de los estudios genéticos debe ser utilizada con suma cautela y regulada a través de comités éticos. La posibilidad, quizás no tan lejana, de predecir la respuesta ante la enfermedad de cada sujeto puede condicionar actitudes terapéuticas y de limitación del esfuerzo terapéutico que deben de estar basadas en una evidencia alcanzada a través del desarrollo de este campo de conocimiento.
El objetivo de esta segunda parte del manuscrito es demostrar que los polimorfismos genéticos (PG) implicados en la coagulación son de interés para el paciente crítico. Además, se trata de demostrar cómo traumatismos específicos (p. ej., el traumatismo craneoencefálico [TCE]) pueden ser determinados por otros PG que, quizá, pueden definirse como "específicamente neurológicos". El pronóstico de las grandes cirugías pueden estar determinado genéticamente. Se analiza también, desde el punto de vista del PG, una enfermedad clásica en las UCI, como el SDRA. Se abordará, además, la utilidad del conocimiento genético del paciente crítico desde una doble vertiente: la farmacogenética y la terapia génica. Finalmente, se destacarán algunas consideraciones generales y limitaciones del PG en relación con nuestros pacientes.
GENÉTICA Y COAGULACIÓN
Los PG que afecten a la coagulación y a la fibrinólisis pueden tener relevancia en el paciente crítico. Este concepto se analizará desde una doble vertiente: el paciente politraumatizado y la sepsis.
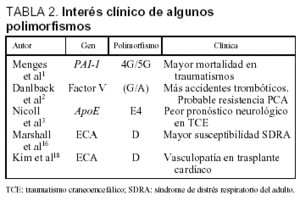
Inmediatamente después del traumatismo tiene lugar una elevación de las concentraciones del inhibidor del activador del plasminógeno (PAI-1), produciéndose un ambiente procoagulante. Menges et al1, en un estudio prospectivo, analizaron el PG consistente en la inserción/deleción (5G/4G) en la región promotora del gen del PAI-1 en pacientes politraumatizados, y su relación con el pronóstico. En este estudio observaron que las concentraciones plasmáticas del PAI-1 fueron significativamente mayores en el grupo con genotipo 4G/4G. El 84% de los pacientes homocigotos para esta mutación desarrollaron sepsis, y más de la mitad no sobrevivieron. Estos resultados sugieren que el genotipo 4G/4G puede poseer una peor capacidad fibrinolítica que empeore la microcirculación y predisponga a la disfunción multiorgánica.
La proteína C activada (PCA) es uno de los factores principales en la regulación de la coagulación. La PCA degrada al factor V en tres segmentos. Se han descrito pacientes resistentes a la PCA cuya base molecular reside en un cambio de G por A en la posición 1691 del cromosoma 1, donde está situado el gen del factor V2. Esta mutación condiciona, a su vez, un cambio en un aminoácido (Arg506Gln), lo que determina que el factor V no pueda ser degradado en sus 3 fragmentos y mantenga, de esta manera, su actividad procoagulante. La frecuencia de este polimorfismo puede alcanzar el 15%3. La importancia relativa de este PG no sólo radica en la mayor predisposición a presentar acontecimientos trombóticos, sino que estos pacientes podrían no responder adecuadamente si se administra PCA como tratamiento de la sepsis grave.
NEUROGENÉTICA DEL PACIENTE CRÍTICO
La relación entre el TCE y el desarrollo de demencia ha permitido asociar los factores genéticos con el pronóstico del TCE. Un estudio reciente ha demostrado que el 30% de los pacientes que fallecieron en la fase aguda del TCE presentaron depósitos de Abeta-PP (AP) en el córtex cerebral, revelando diferencias significativas respecto a los fallecidos por otra causa4. Se cree que el TCE puede estimular el depósito de proteína amiloide y facilitar un mayor deterioro neurológico. Se sabe que el alelo E4 de la apolipoproteína E constituye el mayor riesgo genético para el desarrollo de demencia tipo Alzheimer. Partiendo de esta base, se ha estudiado el PG de esta proteína en pacientes con TCE.
Nicoll et al5 demostraron que los pacientes con el alelo E4 que fallecieron a causa del TCE tuvieron depósitos de AP más frecuentemente que los pacientes sin este alelo. La frecuencia del alelo E4 en pacientes con AP fue del 0,52, mientras que en pacientes sin AP fue de 0,16 (p < 0,01). El TCE puede considerarse un desencadenante para el depósito de esta proteína en el córtex cerebral en pacientes susceptibles portadores del alelo E4. Además, la presencia de este alelo E4 no parece relacionarse sólo con la presencia de AP. Liaquat et al6 han medido los volúmenes de los hematomas mediante tomografía computarizada (TC) craneal en pacientes con TCE, y han observado que los portadores del alelo E4 presentan volúmenes significativamente mayores que los portadores de otros alelos (p < 0,01). La presencia de la isoforma E4 es considerada, junto con la localización extraaxial, como un predictor independiente del volumen del hematoma.
También se han realizado estudios en relación con el pronóstico. Sorbi et al7 observaron que, en pacientes con TCE y coma prolongado después del traumatismo, la frecuencia del alelo E4 era mayor que en aquellos que recuperaron la conciencia de manera más temprana. Teasdale et al8, en un estudio prospectivo realizado sobre 93 pacientes que sufrieron TCE, observaron que los pacientes con TCE y alelo E4 tuvieron un pronóstico significativamente más desfavorable (medido en términos de mortalidad, estado vegetativo o puntuaciones más bajas en la escala pronóstica de Glasgow) a los 6 meses del traumatismo respecto los pacientes sin este alelo (p < 0,01; tabla 1).
Se ha propuesto la hipótesis de que los individuos portadores del alelo E4 podrían desarrollar depósitos de AP a una edad más temprana que el resto de la población y que tendrían una mayor predisposición a fallecer a causa del TCE, motivo por el que podrían ser incluidos con más frecuencia en los estudios post mortem9. Sin embargo, en estudios animales se ha demostrado que la AP puede sintetizarse y depositarse en pocos días10.
Scheimeier et al11, en un estudio prospectivo donde se analizaron la supervivencia y el pronóstico neurológico de 80 pacientes después de sufrir una parada cardiorrespiratoria, observaron que los pacientes homocigotos para el alelo E3 tuvieron porcentajes de supervivencia significativamente mayores (64 frente a 33%; p < 0, 01) y un mejor pronóstico neurológico respecto a otros genotipos, por lo que se confirió a este genotipo un efecto neuroprotector. Sin embargo, todavía no se ha confirmado este hecho en pacientes con TCE.
GENÉTICA EN EL SÍNDROME DE DISTRÉS RESPIRATORIO
El paciente crítico desarrolla con mucha frecuencia una lesión pulmonar aguda que, en su máxima expresión, representa un síndrome de distrés respiratorio agudo (SDRA). Esta entidad es una causa importante de mortalidad en la UCI, para la cual no existe tratamiento específico.
El desarrollo del SDRA puede relacionarse con las concentraciones de citocinas en el lavado broncoalveolar (LBA). Se ha observado que los pacientes que desarrollan esta entidad presentan concentraciones de interleucina (IL) 10 significativamente menores respecto a los pacientes que sí lo desarrollan12. De esta manera, los PG que afecten a las concentraciones de esta interleucina pueden tener relevancia clínica.
Existen, no obstante, proteínas constitutivas del surfactante pulmonar que pueden ser de interés desde el punto de vista del PG. El surfactante está compuesto por un 90% de fosfolípidos y un 10% de proteínas (SP-A, SP-B, SP-C, SP-D). Estas proteínas contribuyen a disminuir la tensión superficial aire-líquido para evitar el colapso alveolar. Lin et al13 relacionaron variaciones polimórficas de la SP-B con el desarrollo de SDRA. En este estudio, la variación C/T en la posición 1580 dentro del codón 131 del gen puede determinar el desarrollo de esta entidad.
La activación del sistema renina-angiotensina en la circulación y en el parénquima pulmonar podría influir en el desarrollo del SDRA. El gen de la enzima conversiva de la angiotensina (ECA) es polimórfico. La deleción de un fragmento de 287 pb (alelo D) produce un aumento de la actividad de la ECA14. Por otro lado, los valores elevados de IL-6 se asocian con una mayor mortalidad en esta entidad. La presencia de citosina en la posición 174 del gen de la IL-6 (alelo C) se asocia con una actividad reducida del promotor y, por tanto, con unos valores plasmáticos más bajos15. Marshall et al16 analizaron la relación entre los alelos D del gen de la ECA y del alelo C del gen de la IL-6 con la susceptibilidad y el pronóstico del SDRA. La presencia del alelo D y del genotipo DD fue significativamente más frecuente en el grupo de pacientes que desarrollaron SDRA respecto a un grupo control y otro grupo en riesgo de desarrollar SDRA (p < 0,01). Además, el alelo D se asoció a una mortalidad significativamente más elevada (p < 0,02). Por otro lado, las frecuencias del alelo C y del genotipo CC fueron significativamente menores en el grupo que desarrolló SDRA (p < 0,02).
GENÉTICA EN LA CIRUGÍA CARDÍACA
La activación, a su vez, de los sistemas celulares y humorales que ocurren en el período postoperatorio crearán un ambiente proinflamatorio o procoagulante. En cualquier caso, los genes candidatos implicados en esta respuesta no sólo serán los responsables de procesos inflamatorios y procoagulantes, sino que podrán influir en el metabolismo lipídico, el funcionamiento de los canales iónicos y el mantenimiento de la integridad de la membrana17.
El gen de la ECA puede presentar inserciones/deleciones en el intrón 16. Los pacientes homocigotos para la deleción en esa posición (DD) desarrollan un mayor crecimiento e hipertrofia de las cavidades izquierdas si padecen hipertensión o cardiopatía, lo que no ocurre en sujetos sanos18. La presencia del alelo D se ha asociado, en el postoperatorio de cirugía cardíaca, con el desarrollo de vasculopatía grave en el trasplante cardíaco19,20.
Las variaciones genéticas en los genes que codifican los receptores de las glucoproteínas en la superficie plaquetaria puede ayudar a identificar también a pacientes con mayor riesgo isquémico. Mathew et al21 son los primeros autores que han relacionado el PG de la GPIIIA con un estado procoagulante y el desarrollo de ictus después de bypass coronario.
Existen pocos estudios que analicen el papel de las principales moléculas proinflamatorias en el pronóstico de la cirugía cardíaca. Martínez et al22 analizaron los PG del factor de necrosis tumoral beta (TNF-β) y de la IL-1ra en relación con la aparición del síndrome de bajo gasto tras la revascularización miocárdica con circulación extracorpórea no causado por infarto de miocardio. Existe significativamente más riesgo de desarrollar bajo gasto en los pacientes con algún alelo G en el primer intrón del TNF-βy los homocigotos A2 para el gen de la IL-1ra.
La IL-6 es sintetizada en respuesta a diferentes estímulos inflamatorios. Concentraciones elevadas de esta interleucina se han asociado con el desarrollo23, con la gravedad de la enfermedad coronaria24, con una mayor inestabilidad de la placa arteriosclerótica25 y, por tanto, con un peor pronóstico. Brull et al26 analizaron el genotipo del gen de la IL-6 en pacientes sometidos a bypass coronario y su relación con las concentraciones plasmáticas posquirúrgicas de esta citocina. Los pacientes con el PG consistente en una citosina en la posición 572 del gen presentaron valores significativamente superiores a los de otros genotipos analizados 6 h después de la intervención (tabla 2).
Por otro lado, el PG E469 del ICAM-1 se ha asociado con un efecto protector de vasculopatía en el trasplante cardíaco27.
Existen otros grupos de genes candidatos sobre los cuales sólo existen estudios preliminares. Alguno de ellos están implicados en la respuesta a las catecolaminas. Philip et al28 han observado que el PG G894T del gen que codifica para la sintetasa de óxido nítrico se asocia a una respuesta aumentada a la fenilefrina. El polimorfismo de la ApoE se ha relacionado con la evolución de la función renal y la función neurológica después de la cirugía cardíaca29,30.
FARMACOGENÉTICA
La farmacogenética se encarga del estudio de la variabilidad individual de respuesta a los fármacos en función de diferencias genéticas. De esta manera, el genotipo del paciente no sólo puede determinar la evolución y el pronóstico de la enfermedad, sino que también puede influir en la respuesta al tratamiento, la capacidad de metabolizar los fármacos administrados y, en cierto modo, prever la aparición de efectos adversos (fig. 1). No existe situación alguna en medicina el la que el clínico pueda predecir la respuesta individual al tratamiento. Es evidente que muchos factores determinan la respuesta a los fármacos (edad, sexo, etnia, enfermedades concomitantes y disfunción de los órganos secretores). No obstante, si estas variables se estandarizan, es evidente que persiste una respuesta individual.
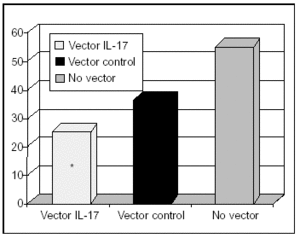
Figura 1. Importancia clínica de la transferencia del gen de IL-17: porcentajes de aclaramiento de K. pneumoniae en tejido pulmonar de monos.
Se ha evidenciado en los últimos años que factores genéticos modifican de manera significativa la absorción, disposición, metabolismo y excreción de fármacos31. Uno de los objetivos más importantes de la farmacogenética es la disminución de efectos secundarios. Cada fármaco interacciona con numerosas proteínas (transportadoras, enzimas, etc.). Un elevado número de enzimas son genéticamente variables32. El PG de los genes que codifican estas enzimas condiciona la aparición de 3 tipos de sujetos: normales, metabolizadores lentos (predispuestos a las reacciones adversas) y metabolizadores rápidos (sujetos que no responderán a las dosis habituales, dada la extremadamente rápida eliminación del fármaco). La mayoría de las enzimas implicadas en el metabolimo y la eliminación de fármacos son miembros de la familia del citocromo P-450, que incluye más de 30 isoformas33.
El reconocimiento temprano de una respuesta adecuada al tratamiento o la probabilidad elevada de desarrollar efectos secundarios significa que puede ayudar a desarrollar estrategias terapéuticas alternativas.
TERAPIA GÉNICA
La terapia génica constituye una nueva aproximación terapéutica consistente en transferir material genético al paciente. Este material puede ser administrado directamente a través de vectores, o indirectamente mediante la introducción de células modificadas genéticamente. Algunos de los problemas más importantes con los que se enfrenta este tipo de terapia son la eficacia de transmisión del material genético al paciente y el mantenimiento de un nivel de expresión de duración adecuada del gen transferido34.
Terapia génica en la neumonía
El interferón gamma (IFN-γ) es una de las moléculas fundamentales sobre la que gira la defensa ante multitud de patógenos respiratorios35. Algunos trabajos experimentales36 demuestran el aumento de INF-γ en el LBA después de la administración intratraqueal de adenovirus portadores de este gen. El incremento de esta molécula sólo se produjo localmente en el pulmón y no de forma sistémica. En este mismo estudio se ha observado que el INF-γ no se correlaciona con los valores pulmonares de TNF. No obstante, los animales expuestos al adenovirus respondieron con valores 5 veces superiores de TNF al administrarles endotoxina intratraquealmente. Además, en otro grupo de ratas a las que se expuso a Pseudomonas aeruginosa se demostró que el aclaramiento de la bacteria fue significativamente mayor en el grupo tratado con adenovirus, probablemente en relación con un mayor reclutamiento de neutró filos.
La IL-12 es una citocina con efectos pleiotrópicos. Se sabe que tiene importancia en la inmunidad celular contra el cáncer y las infecciones17. De manera específica, en la enfermedad pulmonar se ha relacionado con la infección por Klebsiella pneumoniae. Greenberger et al38 trataron a monos con adenovirus que contenían el gen de esta citocina antes de ser expuestos a K. pneumoniae. Los animales tratados con adenovirus presentaron porcentajes de supervivencia superiores que los controles.
A pesar de los conocidos efectos deletéreos del TNF, esta molécula participa en la defensa contra la infección pulmonar39. Algunos autores40 han demostrado que adenovirus portadores de este gen pueden ser beneficiosos en las neumonías por K. pneumoniae. Sin embargo, la aportación más importante de este estudio fue que dosis diferentes de adenovirus transgénicos portadores del gen de TNF tuvieron distintos resultados terapéuticos en cuanto a la capacidad para el aclaramiento bacteriano. Las dosis más elevadas resultaron ser más inefectivas.
La IL-17 tiene efectos granulopoyéticos41. Además, se sabe que participa en la liberación de otras citocinas proinflamatrias, como el TNF, IL-1β, IL-6 e IL-1242. Se ha observado36 en estudios experimentales que la administración intratraqueal de adenovirus recombinantes con el gen de esta citocina se traduce en un aumento de la expresión de la misma sólo en territorio pulmonar. A su vez, este mismo trabajo demuestra que esta forma de tratamiento aumenta el aclaramiento de K. pneumoniae en neumonías causadas por este microorganismo.
Terapia génica en la sepsis
Se conoce a través de modelos animales y en pacientes sépticos que el incremento de la apoptosis en órganos linfoides y las disminución del número de leucocitos en la sangre periférica se ha correlacionado con un peor pronóstico43,44. Estudios recientes en modelos animales de sepsis han demostrado que la inhibición de la apoptosis mejora el pronóstico. En este sentido, se ha demostrado en monos con peritonitis que la hiperproducción de la proteína Bcl-2 (inhibidora de la apoptosis) mejora la supervivencia. Oberholzer et al45 realizaron un estudio experimental con monos, a los que inyectaron en el timo adenovirus recombinantes capaces de expresar IL-10 humana, 24 h antes de provocar una peritonitis fecaliodea. La hiperexpresión de IL-10 en el timo incrementa la expresión de la proteína Bcl-2. In vitro, esta citocina reduce la apoptosis de las células T en parte mediada por esta proteína46. Los animales a los que se administró el adenovirus intratímico presentaron una mortalidad significativamente menor que los tratados con adenovirus intravenoso.
Terapia génica y hemodinámica
Los defectos de la contractilidad del miocardio constituyen una enfermedad frecuente en las UCI. Los receptores betaadrenérgicos presentan un descenso significativo en el bajo gasto miocárdico. Akhter et al47 han demostrado un aumento de la contractilidad después de la transmisión del gen humano β2-adrenérgico a través de adenovirus recombinantes en pacientes con bajo gasto.
PERSPECTIVAS Y LIMITACIONES
Aunque todavía se encuentra en un estadio muy temprano, la genética aplicada al paciente crítico transformará nuestra práctica clínica diaria en un futuro próximo. Las variaciones individuales que permiten una respuesta diferenciada ante una agresión se encuentran determinadas por el orden y la intensidad de la síntesis de mediadores de la inflamación y moléculas que permiten la comunicación inter e intracelular, todo ello condicionado por la activación de los genes implicados en la respuesta celular a la agresión.
El desarrollo de la biotecnología adecuada para identificar variaciones en el genoma que resulten determinantes está favoreciendo una perspectiva de trabajo donde será posible reconocer, por ejemplo, a aquellos pacientes con riesgo de desarrollar sepsis grave una vez diagnosticada una infección. También permitirá el desarrollo de nuevos biomarcadores que pueden ser utilizados para identificar a pacientes en los que se pueden aplicar terapéuticas específicas o que presentan un perfil de respuesta mejor o peor a los fármacos disponibles. Además, pronto será posible conocer, en un determinado momento y según un estímulo, cómo es la respuesta celular al estrés, utilizando la técnica basada en los "microarrays", que permite analizar en un instante el estado funcional de miles de genes. Esta técnica también permite medir el tipo de ARN expresado en diferentes tejidos48. No obstante, existen algunas limitaciones que es necesario tener presentes, y que describimos a continuación.
Limitaciones en los recursos humanos
Dado el gran auge de la genética en los últimos años, los clínicos no están familiarizados con este campo de conocimiento, por lo que sería necesario introducirlo dentro de nuestras habilidades. Evidentemente, el traslado de los conceptos genéticos del laboratorio hasta la cabecera del paciente será un reto apasionante en los próximos años.
Limitaciones científicas
Son necesarios estudios que confirmen los hallazgos obtenidos hasta el momento en otros grupos étnicos. En cualquier caso, se hace necesaria también la comunicación de los estudios de casos y controles que no demuestren asociaciones positivas, y la realización de estudios con un diseño adecuado y riguroso que pueda ser sometido a metaanálisis.
Limitaciones económicas
Evidentemente, el estudio del ADN es costoso en términos de tiempo y dinero. No obstante, la inversión en este campo del conocimiento podrá obtener beneficios que se deriven de la detección temprana, un mayor conocimiento de la fisiopatología de la enfermedad y un tratamiento más específico, traduciéndose en una menor estancia hospitalaria o en años de vida.
Limitaciones éticas y sociales
El conocimiento adquirido en este campo debe ser aplicable a todos los estratos de la población y a todas las etnias. De esta forma, el ámbito de investigación deberá recaer no sólo en los grupos étnicos favorecidos económicamente.
CONCLUSIONES
La genética aplicada al paciente crítico es un área de conocimiento con entidad propia que se encuentra al inicio de su camino, pero que progresa a gran velocidad. El PG puede explicar la variabilidad en la presentación clínica y evolución de los principales procesos patológicos diagnosticados y tratados en las UCI. La medicina intensiva tiene un nuevo campo de investigación que podrá dotar a la especialidad, en los próximos años, de un mayor conocimiento de los mecanismos moleculares que determinan la enfermedad crítica, unas armas diagnósticas, y quién sabe si terapéuticas, de enorme potencia.