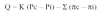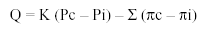INTRODUCCION
Las enfermedades respiratorias son, probablemente, las de mayor prevalencia en los pacientes críticos ingresados en los servicios de medicina intensiva. Diversos estudios realizados en nuestro país1-3 ponen de manifiesto el impacto asistencial y la importancia epidemiológica de estos procesos patológicos.
En los últimos años se han producido avances muy significativos en el conocimiento del movimiento transpulmonar de fluidos, tanto en situación normal como en situación de enfermedad. Estos avances han cambiado algunos conceptos clásicos, y consideramos que deben ser revisados desde la perspectiva de las investigaciones recientes. Clásicamente, se ha considerado que el movimiento de fluidos en el pulmón se regía por factores exclusivamente físicos4 y quedaban plasmados en la ecuación de Starling. Este planteamiento continúa siendo vigente, particularmente en lo que se refiere a la filtración de líquidos desde el espacio vascular. Sin embargo, en los últimos años se han producido numerosos avances en el conocimiento de otros mecanismos que intervienen sobre todo en la reabsorción de los fluidos intrapulmonares. En la actualidad sabemos que en la reabsorción influyen múltiples mecanismos, algunos no bien conocidos, pero que superan el concepto tradicional básicamente pasivo, que se regía por un balance entre las fuerzas hidrostáticas y osmóticas. Ahora sabemos que más allá de lo que podíamos esperar por la ecuación de Starling, existen mecanismos "activos" de transporte de agua, es decir, que su funcionamiento implica mecanismos oxidativos con consumo de energía; asimismo, también sabemos que existen canales independientes para el transporte de agua ligados a proteínas transportadoras que influyen en los movimientos de fluidos intrapulmonares. En la actualidad, el reto se encuentra en conocer tanto en qué proporción actúa cada uno de estos mecanismos como en la posibilidad de influir en ellos para encontrar aplicaciones clínicas.
Desde un punto de vista didáctico, esta revisión ha sido estructurada diferenciando tres bloques:
1. Movimiento de fluidos desde el espacio vascular al intersticial (filtración transcapilar).
2. Movimiento de fluidos entre los espacios alveolar e intersticial (filtración transalveolar).
3. Drenaje linfático.
MOVIMIENTO DE FLUIDOS DESDE EL ESPACIO VASCULAR AL INTERSTICIAL (FILTRACION TRANSCAPILAR)
El movimiento de fluidos desde el espacio vascular está condicionado, desde un punto de vista anatómico, por la presencia de "poros" en la barrera endotelial, y desde el punto de vista funcional está regido por la ecuación de Starling.
¿Por dónde se filtran los fluidos? (Condicionamientos anatómicos)
La barrera endotelial es el escollo anatómico que debe atravesar el fluido hacia el espacio intersticial, y está compuesta por la unión de células endoteliales. La unión entre éstas no es hermética, sino que existe un espacio virtual entre ellas que denominamos "poros endoteliales de pequeño tamaño" y que comunican de manera directa con el espacio intersticial. Este tipo de poros son extremadamente abundantes y permiten el libre paso de agua, electrólitos y solutos, como urea, glucosa, etc. Algunas proteínas (inmunoglobulinas y transferrina) pueden atravesar la barrera endotelial a través de otro tipo de poros de mayor tamaño, pero muy escasos y que se encuentran distribuidos en el árbol vascular5. El paso hacia el espacio alveolar está mucho más limitado, como veremos más adelante, lo que constituye un mecanismo protector frente a la posible inundación alveolar.
La presencia de los poros endoteliales permite el paso de fluidos al espacio intersticial, pero los vectores que rigen la intensidad de este proceso se encuentran determinados por la ecuación de Starling. Sin embargo, independientemente del balance de presiones hidrostáticas y coloidosmóticas, que describiremos en el apartado siguiente, los aumentos bruscos de presión de la arteria pulmonar originan un "estiramiento" de los poros endoteliales que los hace permeables a moléculas de mayor tamaño y, en definitiva, producen un aumento de la permeabilidad6.
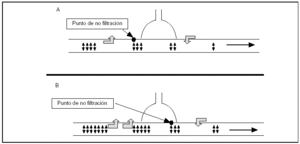
Aunque la presencia de este tipo de poros endoteliales está ampliamente distribuida por todo el espacio microvascular, la filtración de fluidos no se realiza de manera uniforme, fundamentalmente porque la presión hidrostática disminuye de forma progresiva a medida que se avanza en el lecho vascular, hasta llegar a lo que se denomina zona de no filtración (fig. 1), a partir de la cual el balance de presiones hidrostáticas y coloidosmóticas impide la filtración de fluidos. En situación de normalidad, se considera que la zona efectiva de filtración se reduce a la primera cuarta parte del lecho microvascular7, y en pulmones normales la trasudación de fluidos ocurre predominantemente en las arteriolas de un diámetro inferior a 100 μm y capilares de 10-12 μm de diámetro8,9. Un incremento en las presiones vasculares desplazarían el punto de "no filtración" hacia delante (fig. 1) y su efecto sería doble: por una parte, la propia presión hidrostática favorece una mayor filtración y, por otra, el desplazamiento del punto de no filtración aumenta la superficie vascular, que puede contribuir a incrementar el agua pulmonar extravascular, y si los mecanismos de reabsorción no aumentan paralelamente, el resultado será la aparición de un edema pulmonar.
Figura 1. Esquema que representa la filtración transcapilar de fluidos en el lecho microvascular pulmonar. La presión de arteria pulmonar disminuye progresivamente a lo largo de su trayecto y esto origina cambios en la relación entre las presiones hidrostática y oncótica. A: representa una situación "normal"; en la parte proximal de la arteriola, la presión de arteria pulmonar es superior a la coloidosmótica, originando la filtración de fluidos desde el espacio vascular al intersticial. El descenso progresivo de la presión arterial pulmonar hace que se alcance el punto de no filtración de forma relativamente temprana, y a partir de aquí la filtración iría en sentido contrario. B: se observa la situación originada en casos de hipertensión pulmonar. El punto de no filtración se desplazaría hacia delante, lo que puede tener dos efectos: en primer lugar, al ser la presión hidrostática más alta, la filtración desde el lecho vascular será mayor y, además, al desplazarse el punto de no filtración hacia delante, la superficie vascular susceptible de filtrar es mayor.
Pero la pared endotelial no ejerce un papel exclusivamente pasivo en el intercambio de fluidos, sino que se han identificado mecanismos activos que actuarían fundamentalmente sobre las proteínas y que explican que se encuentren concentraciones proteicas intersticiales que no se justifican por mecanismos de simple paso a través de poros del tamaño adecuado10. Éstos son aspectos relativamente nuevos y hoy día es difícil calibrar qué influencia cuantitativa o cualitativa pueden tener, tanto en pulmón sano como en pulmones edematosos.
¿Cómo se filtran los fluidos? (Condicionamientos funcionales)
La ecuación de Starling, descrita hace ya un siglo, plantea el balance entre las presiones opuestas hidrostática y coloidosmóticas, tanto intravasculares como intersticiales, y su funcionamiento ha permitido diferenciar dos grandes síndromes respiratorios: el edema pulmonar hidrostático o por aumento de las presiones vasculares y el edema pulmonar lesional o por aumento de la permeabilidad capilar.
La ecuación de Starling es la siguiente:
donde Q es el volumen de líquido trasudado; K, el coeficiente de filtración (volumen de fluido que atraviesa el endotelio por unidad de presión); Pc, la presión hidrostática capilar; Pi, la presión hidrostática intersticial; Σ , el coeficiente de reflexión osmótica (refleja la permeabilidad del endotelio a las proteínas, un valor de cero indica libre paso de proteínas, y un valor de uno indica nulo paso a través de la membrana); πc, la presión coloidosmótica capilar, y πi, la presión coloidosmótica intersticial.
La ecuación de Starling refleja uno de los conceptos fisiopatológicos más difundidos en fisiología, asumiendo que, en condiciones normales, la cantidad de fluido que se filtra en la zona arteriolar de los capilares pulmonares es similar a la que se reabsorbe en la zona venosa de los mismos. Posteriormente se ha comprobado que el proceso es más complicado y se han agregado factores que pueden afectar o completar la ecuación de Starling. Los más conocidos son la superficie pulmonar perfundida y la capacidad del drenaje linfático.
1. En condiciones normales, la superficie vascular perfundida tiene una clara trascendencia en las posibilidades de filtración de fluidos a través del endotelio vascular. Dada la capacidad de adaptación de la vasculatura pulmonar, un descenso en las presiones pulmonares como consecuencia de una situación de hipovolemia, o hipotensión de cualquier origen, reduce de forma drástica la superficie vascular perfundida11 y, por tanto, limita las posibilidades de filtración de fluidos al espacio intersticial. El efecto contrario puede también ocurrir, y la superficie vascular pulmonar aumenta y, por tanto, también la filtración transcapilar12 en casos de hipertensión arterial pulmonar, hipervolemia, etcétera.
2. El drenaje linfático es uno de los mecanismos de aclaramiento de fluidos y proteínas desde el espacio intersticial hacia el espacio vascular. Sospechamos que su papel en el mantenimiento del volumen de fluido intersticial puede ser importante, pero este aspecto no está definitivamente aclarado y algunos datos hacen dudar de su trascendencia; el hecho de que los pacientes con trasplante de pulmón puedan mantener un intercambio gaseoso y no desarrollen edema pulmonar sin el concurso del sistema linfático orienta en este sentido13. Éste y otros aspectos relacionados serán analizados en otro apartado más adelante.
MOVIMIENTO DE FLUIDOS ENTRE LOS ESPACIOS ALVEOLAR E INTERSTICIAL (FILTRACION TRANSALVEOLAR)
La barrera epitelial alveolar es una estructura comparativamente más resistente que la barrera endotelial capilar y, sobre todo, mucho más impermeable al paso de líquidos y solutos. Desde un punto de vista didáctico resulta conveniente diferenciar, por un lado, el paso de fluidos desde el intersticio al alvéolo y, por otro, el paso de líquidos desde el alvéolo al intersticio. Como veremos, los mecanismos que gobiernan el paso de fluidos desde el intersticio al alvéolo continúan teniendo muchos aspectos confusos y abiertos a la especulación. Sin embargo, los mecanismos de aclaramiento del edema alveolar son cada vez mejor conocidos, y en este campo se han producido importantes avances que han modificado nuestros conocimientos al respecto.
Paso de fluidos desde el intersticio al alvéolo
El mecanismo responsable del paso de fluidos desde el espacio intersticial al interior del alvéolo no es bien conocido. Probablemente sea diferente según el tipo de edema pulmonar.
En el caso del edema pulmonar lesional (síndrome de distrés respiratorio agudo), las propias lesiones en la membrana alveolar pueden ser responsables de la incompetencia de dicha membrana y permitirían el paso al alvéolo del abundante líquido proveniente de un lecho vascular muy permeable. De esta forma, puede explicarse la inundación del espacio alveolar con el característico líquido de aspecto hemorrágico y rico en proteínas. Las células epiteliales alveolares presentan, de forma muy temprana, lesiones muy heterogéneas, con zonas necróticas, denudación de la lámina basal, edematización citoplasmática y formación de membrana hialina14. El término que mejor define esta situación es el de "daño alveolar difuso".
En el caso del edema pulmonar hidrostático, la explicación sobre el modo en que se origina la inundación alveolar no es tan clara. En estas circunstancias, hay que tener en cuenta que no sólo pasa líquido al alvéolo, sino que éste se acompaña de una cantidad de proteínas similar a la existente en el espacio intersticial que, aunque es cuantitativamente menor que la del edema lesional, en cualquier caso se encuentran, en una proporción nada desdeñable. La hipótesis más aceptada es que el fluido atravesaría la vía aérea no a través del epitelio alveolar sino del epitelio bronquiolar, más débil y permeable15. El paso de proteínas al espacio alveolar requiere la presencia de poros suficientemente grandes y, por el momento, su localización no está precisada.
Algunos autores consideran que, incluso en casos de edema pulmonar hidrostático, pueden producirse lesiones significativas de la membrana alveolar que podrían ser responsables del paso de proteínas al espacio alveolar16, y esto justificaría el no infrecuente hallazgo de edemas pulmonares de origen hidrostático pero con un contenido proteico similar al del edema de origen lesional17.
Paso de fluidos desde el alvéolo al espacio intersticial. Mecanismos de resolución y aclaramiento del edema pulmonar
Transporte activo de iones transmembrana
Clásicamente se ha considerado que los únicos factores responsables de mantener libre de líquido el alvéolo eran la barrera de células epiteliales y la presión negativa del espacio intersticial subyacente18. Sin embargo, en 1982, Matthay19 apunta el concepto de que el aclaramiento del edema pulmonar es un proceso activo, que consume energía. Sólo así puede explicarse que la eliminación de agua sea más rápida que la eliminación de proteínas, y que el aclaramiento continúe a pesar del incremento de presión oncótica alveolar. El edema pulmonar hidrostático, y en mayor proporción el edema lesional, es un líquido rico en proteínas y, en pulmón normal, el aclaramiento de éstas se realiza a una velocidad de apenas un 2% cada hora. Por el contrario, la eliminación del agua alveolar puede cifrarse entre un 10 y un 25% cada hora20,21. Al aclararse más rápidamente el agua que las proteínas alveolares, la concentración de éstas aumenta con el tiempo y, por tanto, la presión oncótica alveolar; por tanto, con el esquema tradicional el alvéolo debería inundarse de líquido intersticial. La conclusión lógica ante este fenómeno es que el epitelio alveolar puede tener un papel activo en el aclaramiento del edema. Posteriormente se ha descrito la presencia de diferentes tipos de canales de Na ligados a las células alveolares tipo II22 que, de forma activa, bombean la sal, y el agua sigue pasivamente este fenómeno. Este tipo de canales puede estar presente también en las células alveolares tipo I23.
En diferentes especies animales y en estudios tanto in vitro como in vivo se ha demostrado que este mecanismo activo de aclaramiento de fluidos puede ser estimulado por diferentes sustancias, entre las que destacan los betaadrenérgicos (dopamina, dobutamina, isoproterenol)24,25 y su efecto puede ser frenado con la administración de bloqueadores beta, como el propanolol26. Así mismo, el empleo de betaadrenérgicos aerosolizados (salmeterol) en ovejas ha demostrado favorecer la resolución del edema pulmonar en estos animales27, así como en lóbulos pulmonares humanos in vitro28. Por el contrario, en determinadas circunstancias, como en la hipoxia grave, el flujo activo de sodio se encuentra sustancialmente disminuido29. En este sentido, nosotros hemos demostrado que un incremento del gasto cardíaco del 40% mediante el empleo de dopamina y dobutamina no produce aumentos del agua pulmonar30. Sin embargo, si el aumento del gasto cardíaco se produce por otros mecanismos y, en particular, en presencia de hipoxia grave, el edema pulmonar aumenta de manera significativa31.
Actualmente no conocemos el alcance práctico que estos hallazgos pueden tener aplicados a un paciente determinado, pero es evidente que se abre campo nuevo y apasionante para investigaciones futuras.
Canales específicos para el transporte de agua no ligado al transporte de iones
Además de este papel pasivo del agua, siguiendo a los iones Na que son bombeados de forma activa, existen mecanismos independientes específicos de transporte de agua. Estos mecanismos están ligados a proteínas transportadoras (aquaporinas) y, mediante su concurso, el agua puede atravesar la membrana epitelial del alvéolo sin necesidad de seguir o compensar variaciones osmóticas. Hasta el momento se han identificado 6 proteínas, de las que al menos 4 pueden estar presentes en la membrana epitelial de la vía aérea distal o proximal, aunque no son exclusivas de la vía aérea. De hecho, inicialmente se identificaron en la membrana celular de hematíes y en el epitelio de células renales32, pero su presencia está distribuida por la mayoría de los órganos y sistemas. El papel de estas proteínas no está completamente aclarado y se consideran de especial importancia en la reabsorción del líquido pulmonar fetal y la capacidad de transición hacia la primera respiración33. Como en el apartado anterior, estos hallazgos abren un amplio campo de posibilidades para nuevas investigaciones, tanto en aspectos fisiológicos como en intervención terapéutica.
DRENAJE LINFÁTICO
Ya hemos comentado que la filtración de líquido al espacio intersticial se produce fundamentalmente en la primera parte del lecho arteriolar y su reabsorción tiene lugar de manera parcial en la zona venosa del capilar pulmonar, donde la presión hidrostática es menor. Pero éste no es el único mecanismo de aclaramiento del agua intersticial, sino que hay otras vías, entre las que destaca el drenaje linfático y, en determinadas circunstancias, la acumulación en el espacio pleural puede contribuir a drenar al espacio intersticial34.
No se conoce la contribución exacta del drenaje linfático en el aclaramiento del agua pulmonar, tanto en circunstancias normales como en situación de edema pulmonar. Tradicionalmente se le ha otorgado un papel preponderante y se ha considerado que un desajuste entre el agua filtrada y el drenaje linfático desembocaba irremediablemente en edema pulmonar18. De esta forma, cualquier circunstancia que suponga una limitación al drenaje linfático originará un aumento del agua pulmonar extravascular y, de hecho, se ha comunicado que súbitos incrementos en la presión venosa central podrían limitar el flujo del conducto torácico y contribuir al incremento del agua pulmonar extravascular35. Asimismo, la aplicación de presión positiva espiratoria final (PEEP), al aumentar la presión intratorácica, podría suponer una barrera para el correcto funcionamiento del sistema linfático36.
Estas hipótesis no han sido confirmadas y, al menos en el caso de la aplicación de PEEP, nosotros hemos demostrado que el incremento de la presión intratorácica puede incluso ejercer un efecto de "estrujamiento" que estimula e incrementa el drenaje linfático37. Esto ha sido probado en el edema pulmonar hidrostático mediante la aplicación de PEEP de hasta 20 cmH2O por lo que, al menos en este aspecto, la actual tendencia a aplicar una PEEP elevada no tendría limitación por una posible interrupción del drenaje linfático.
Como hemos mencionado con anterioridad, no se conoce bien el papel que desempeña el drenaje linfático en el aclaramiento del edema pulmonar, y existen datos recientes que hacen sospechar que su trascendencia es menor de la que se le suponía. Así, en la actualidad se considera que no más de un 10-15% del agua intersticial es aclarada por el sistema linfático38,39; de hecho, en pacientes que sufren un trasplante pulmonar, el drenaje linfático no se restablece hasta pasadas al menos 2 semanas13, y se considera que esta circunstancia tiene más trascendencia por lo que supone de limitación de la respuesta inmunitaria ligada a los nódulos linfáticos40 que en el aclaramiento del agua intersticial.
IMPLICACIONES CLÍNICAS ACTUALES Y PERSPECTIVAS FUTURAS
Desde un punto de vista fisiopatológico, el tratamiento del edema pulmonar debe centrarse en dos aspectos: a) frenar la salida de líquido desde el capilar al espacio intersticial y alveolar, y b) aumentar la reabsorción del edema existente. El primer aspecto está orientado a evitar o disminuir la formación del edema, y las medidas terapéuticas se centran básicamente en la restricción de fluidos, aporte de diuréticos y descenso de las presiones vasculares. Como hemos comentado con anterioridad, en este sentido, la ecuación de Starling sigue estando plenamente vigente y, dependiendo de la etiología, el tratamiento sufrirá variaciones específicas que son bien conocidas.
El segundo aspecto es el auténticamente novedoso. La posibilidad de aumentar la reabsorción del edema pulmonar sería el paso trascendental y supondría un salto cualitativo de extraordinaria importancia. Hasta el momento, los datos de que disponíamos estaban basados en estudios experimentales, pero recientemente se ha publicado un estudio en humanos que confirma que la mayoría de los pacientes con lesión pulmonar aguda o síndrome de distrés respiratorio agudo tienen una afección aguda del aclaramiento del agua pulmonar41, y los pacientes con menos aclaramiento tienen peor pronóstico. Esto permite avanzar la hipótesis de que, mejorando el aclaramiento del agua pulmonar extravascular, podríamos mejorar el pronóstico de los pacientes. Por el momento nos movemos en el terreno de la especulación, pero el camino está trazado y sabemos la dirección en que hay que avanzar. Conocemos que la reabsorción del edema pulmonar obedece a mecanismos activos de transporte de Na a través de la membrana alveolar, y que el agua sigue de forma pasiva los cambios osmóticos originados por este "bombeo de sodio". Múltiples estudios experimentales han demostrado que la administración de catecolaminas (isoproterenol, dopamina, dobutamina y otras) aumenta significativamente el aclaramiento alveolar, pero esto no ha podido reproducirse en clínica humana, y no se ha encontrado relación entre los valores de adrenalina plasmática o la administración de catecolaminas y el grado de aclaramiento del edema pulmonar41. Se ha especulado que la administración aerosolizada de catecolaminas podría tener efectos favorables sobre el edema pulmonar, pero no existe confirmación clínica de esta hipótesis. Asimismo, al tratarse de un mecanismo oxidativo con consumo de energía, cualquier actuación que origine un descenso metabólico, como es el caso de la hipotermia, podría enlentecer la reabsorción del edema pulmonar.
En resumen, existen múltiples hipótesis que probablemente se aclaren en un futuro más o menos próximo, aunque a nuestro juicio hay una barrera importante que impide avanzar al ritmo deseado: actualmente no disponemos de herramientas realmente fiables para cuantificar la reabsorción del edema pulmonar en la clínica humana. Éste es, sin duda, otro campo a desarollar y da idea del camino que queda por recorrer. Es evidente, por tanto, que en estos momentos no pueden establecerse recomendaciones clínicas concretas.