El progreso de la medicina intensiva ha mejorado el pronóstico de muchos de los enfermos ingresados en las Unidades de Cuidados Intensivos (UCI), aunque por el contrario ha hecho que aparezcan nuevas enfermedades en estos pacientes, especialmente en los que permanecen mucho tiempo ingresados en estas unidades. Entre ellas están las diversas complicaciones neurológicas que afectan al sistema nervioso periférico. De todas estas enfermedades, la polineuropatía del paciente crítico (PPC) es la más precisamente definida y de la que conocemos mejor sus características clínicas y diagnóstico, si bien aún quedan muchas incógnitas en cuanto a su etiopatogenia, tratamiento y pronóstico. Las alteraciones de la placa neuromuscular, y sobre todo la miopatía, son las otras complicaciones del sistema nervioso periférico que desarrollan los pacientes críticos.
La PPC es una degeneración axonal primaria de las fibras motoras y sensitivas que se acompaña de degeneración de las fibras musculares como resultado de la denervación aguda que sufren. La PPC ocurre en pacientes críticos, especialmente en los que desarrollan sepsis grave con síndrome de disfunción multiorgánica (SDMO)1.
Se han realizado diversas clasificaciones histológicas de la miopatía aguda en el paciente crítico. Recientemente, Hund2 propuso la clasificación de miopatía del paciente crítico, miopatía de filamento grueso y miopatía necrotizante basada en los cambios histológicos presentes y que ha sido ampliamente aceptada.
De todas maneras, hay que señalar que en los últimos años se acuñaron diversos términos, como polineuromiopatía del paciente crítico (PNMPC), enfermedad neuromuscular adquirida en la UCI o paresia adquirida en la UCI. Esto se debe a: a) las manifestaciones clínicas son idénticas en ambas entidades, b) es muy frecuente la presencia de la PPC junto con la miopatía, c) algunos de los cambios neurofisiológicos propios de la neuropatía aguda pueden observarse también en la miopatía, y d) es difícil el diagnóstico neurofisiológico de la miopatía primaria dado que se requiere la colaboración del paciente para que realice una contracción voluntaria.
Por ello, aunque en pacientes críticos es evidente que hay una asociación casi constante de la miopatía con la PPC, en especial cuando existe SDMO, creemos que el término PPC sigue teniendo valor ya que muchas investigaciones se han centrado en evaluar la etiopatogenia y el pronóstico de esta neuropatía aguda. Aunque debemos reconocer que hay cierta confusión terminológica y que la denominación de PNMPC se está extendiendo en los últimos años, y con una encendida polémica3,4.
Recientemente, se han publicado varios trabajos que intentan aclarar 2 aspectos que creemos fundamentales en relación con esta complicación adquirida en la UCI: qué factores la desencadenan y qué impacto tiene el desarrollo de una PPC en el pronóstico de un paciente crítico.
ETIOPATOGENIA
En cuanto a la primera pregunta, diremos que la etiopatogenia precisa de la PPC o la PNMPC sigue siendo desconocida. Desde el trabajo de Zochodne et al5, realizado en 19 pacientes con PPC, se conoce que no se debe a un déficit específico vitamínico o nutricional. No obstante, en los últimos años se ha avanzado de forma considerable en el conocimiento de diversos factores asociados con el desarrollo de la PPC.
Cuando se estudia a un grupo heterogéneo de 98 pacientes críticos, se comprueba que la presencia de síndrome de respuesta inflamatoria sistémica y la mayor gravedad de los enfermos al ingreso (medida por el APACHE III) son los factores independientemente relacionados con la aparición de la PNMPC (terminología empleada por estos autores) y no otras variables analizadas, como el empleo de relajantes musculares, corticoides o midazolam6.
Sin embargo, al analizar a un grupo de pacientes con sepsis grave se observa que no todos ellos presentan esta complicación neurológica. Por ello, se ha intentado determinar qué factores están relacionados con su aparición. Witt et al7 mostraron que la presencia de PPC se correlacionaba directamente con la hiperglucemia e inversamente con la hipoalbuminemia, aunque se ha considerado que estos parámetros serían marcadores de gravedad más que verdaderos agentes etiológicos. No obstante, otros 2 estudios posteriores han corroborado la posible asociación entre trastornos metabólicos y el desarrollo de la PPC.
En una cohorte de 73 pacientes críticos con sepsis grave y ventilación mecánica durante más de 10 días, evaluamos los factores de riesgo asociados a la PPC. Mediante un análisis multivariante, los factores independientes para el desarrollo de PPC fueron la hiperosmolaridad, el empleo de nutrición parenteral, el uso de relajantes musculares y el fallo neurológico (definido como una puntuación en la escala de coma de Glasgow [GCS] < 10), mientras que el empleo de técnicas de depuración extrarrenal era un factor protector8. Antes que nuestro trabajo, varios autores habían postulado la posible asociación entre la PPC y el empleo de nutrición por vía parenteral9,10, así como la asociación entre la PPC y el coma7,11.
Posteriormente, un estudio prospectivo, aleatorizado y controlado con placebo, diseñado para evaluar la acción del tratamiento insulínico intensivo para mantener una glucemia entre 80-110 mg/dl en pacientes críticos quirúrgicos, demostró una reducción significativa en la aparición de PPC en el grupo de estudio frente al grupo de tratamiento convencional (51,9 frente a 28,7%; p < 0,001)12. En un análisis multivariante se hallaron como factores independientes asociados al desarrollo de PPC: el tratamiento convencional con insulina, el empleo de aminas vasopresoras por más de 3 días, la bacteriemia y el empleo de terapia de reemplazo renal. Esta disminución en la incidencia de la PPC se observó incluso cuando se comparó el grupo de pacientes con glucemia entre 80-110 mg/dl con aquellos en que las cifras se mantuvieron entre 110-150 mg/dl: esta reducción estuvo en relación con los valores de glucemia y no con la dosis de insulina aportada13. Hay que señalar que el grupo de pacientes incluidos en este ensayo difiere sustancialmente de nuestro grupo de estudio, ya que son pacientes posquirúrgicos, especialmente tras cirugía cardíaca, en la que sólo presentaron sepsis 93 (6%) de los 1.548 pacientes incluidos.
Un agente tóxico de bajo peso molecular no bien identificado ha sido detectado en la sangre de los pacientes que presentan PPC y se sugiere que participa en el daño neuronal que sufren estos enfermos14. Si ello se confirmara, habría que estudiar específicamente si el aclaramiento de este agente se produce por las técnicas de depuración extrarrenal, y con ello se explicaría el hallazgo de que el empleo de estas técnicas es un factor protector, aunque la corrección de los trastornos hidroelectrolíticos también puede contribuir a este hecho.
Por otro lado, Thiele et al15 realizaron un estudio retrospectivo en pacientes tras cirugía cardíaca, en el que en el análisis univariante la PPC se asociaba a la presencia de sepsis, al empleo de aminas vasopresoras y al empleo de depuración extrarrenal. Posteriormente, este mismo grupo ha publicado un estudio prospectivo, también en enfermos tras cirugía car-díaca, en el que el desarrollo de PPC se asoció de forma significativa a la presencia de sepsis y al empleo de aminas vasopresoras, pero no a la utilización de técnicas de remplazo renal16.
A finales de 2002, De Jonghe et al17 publicaron un estudio multicéntrico que incluyó a 95 pacientes críticos tras al menos 7 días de ventilación mecánica y que estaban conscientes para iniciar la desconexión del respirador. En este estudio se realizó primero una evaluación clínica y sólo en los pacientes con debilidad muscular se practicó un estudio neurofisiológico que, por otro lado, en todos los casos fue concordante con PPC (neuropatía axonal sensitivomotora). Además, en 10 casos que permanecían con paresia 2 semanas después de iniciar el estudio se practicó biopsia muscular y en todos ellos se observaron cambios compatibles con miopatía primaria y con atrofia muscular neurogénica. Este estudio, además de corroborar la frecuente asociación entre la PPC y la miopatía del paciente crítico, analizó los factores independientes para desarrollar una paresia adquirida en la UCI (terminología usada por los autores): el sexo femenino, el número de días con disfunción de 2 o más órganos, la duración previa de la ventilación mecánica y la administración de corticoides. Llama la atención, en sus resultados, la predisposición del sexo femenino (con una odds ratio cercana a 5), que no encontraron investigadores previos, y que ni la infección ni el shock séptico sean factores de riesgo y que sí lo sea el tratamiento con esteroides que tienen un efecto nocivo en el músculo estriado, pero no en el nervio periférico, y produce diversas formas histológicas de miopatía2.
En conclusión, como hemos visto, los factores de riesgo identificados difieren entre los diversos estudios, lo cual puede explicarse por las diferentes poblaciones incluidas y la diferencia en los criterios diagnósticos. Sin duda, cuando se analiza a un grupo heterogéneo de pacientes críticos, la sepsis grave es el principal factor desencadenante de esta complicación neurológica, en cuyo desarrollo también parecen influir alteraciones metabólicas como la hiperglucemia o la hiperosmolaridad. Es posible, como postula Bolton18, que en el contexto de una sepsis grave y SDMO que cursa con trastornos de la microcirculación, pérdida de la autorregulación y aumento de la permeabilidad vascular sea posible que ciertas sustancias como los relajantes musculares, sustancias con acción neurotóxica o mediadores de la inflamación salgan al espacio extravascular y causen lesión en los nervios periféricos.
IMPACTO SOBRE EL PRONÓSTICO
En este apartado, nos ocuparemos de 3 aspectos: impacto en el tiempo de ventilación mecánica, en el pronóstico vital y las secuelas a largo plazo.
Tiempo de ventilación mecánica
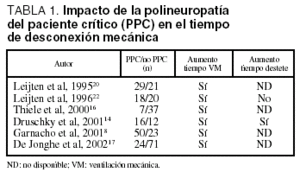
La PPC se describió como una entidad que dificulta la desconexión de la ventilación mecánica y se ha comprobado que al estudiar a un grupo de pacientes con desconexión dificultosa, la PPC es la enfermedad neuromuscular subyacente más frecuente: afecta al 62,5% de los pacientes19. No obstante, cuando se evalúa la repercusión de la PPC en la retirada de la ventilación mecánica se obtienen resultados contradictorios (tabla 1). Diversos estudios confirman que el tiempo total de ventilación mecánica es superior en pacientes con PPC que en el grupo que no la desarrolla8,14,16,17,20, si bien este hallazgo no es confirmado por otros autores21,22. Así, en un estudio prospectivo, al analizar sólo a los pacientes extubados, la duración de la ventilación mecánica fue similar en los pacientes con y sin PPC y el tiempo de desconexión del ventilador no fue diferente entre los dos grupos. Además, en un grupo de enfermos con PPC la gravedad de los cambios neurofisiológicos no se correlacionaba con el tiempo de ventilación mecánica11.
En síntesis, los datos de que disponemos nos sugieren que la PPC es una entidad que prolonga el tiempo de ventilación mecánica. No obstante, no podemos olvidar que el número de días con disfunción de 2 o más órganos y la duración previa de la ventilación mecánica son factores de riesgo para el desarrollo de esta axonopatía, lo cual puede explicar que el tiempo total de ventilación mecánica sea superior en los pacientes con PPC. Hasta la fecha no hay datos concluyentes en cuanto a la repercusión sobre el tiempo de desconexión del soporte ventilatorio. Además, los estudios disponibles no han evaluado la existencia de otros factores que pueden dificultar la desconexión del respirador tales como enfermedades subyacentes (enfermedad pulmonar obstructiva crónica o insuficiencia cardíaca), el estado nutricional previo o la sedación recibida en la UCI.
Repercusión sobre la mortalidad
Otro aspecto más controvertido aún es la repercusión de la PPC en la mortalidad (tabla 2). Así, Leijten et al20 encontraron una mortalidad más alta en la UCI de los pacientes con PPC, si bien este dato podría explicarse por la mayor gravedad al ingreso de estos pacientes más que por la contribución específica de la complicación neurológica. Esta diferencia de mortalidad no persistía tras un año de seguimiento.
En nuestra serie hallamos que la estancia hospitalaria de los pacientes dados de alta en la UCI es muy superior en los sujetos con axonopatía aguda y que la PPC es un factor independiente de mortalidad hospitalaria a pesar que la gravedad al ingreso en la UCI fue similar en los pacientes con y sin PPC. De Jonghe et al17, en su reciente artículo, no hallan una mayor mortalidad en los pacientes con paresia adquirida en la UCI respecto al grupo que no la desarrolló.
En conclusión, la PPC ensombrece el pronóstico vital de los pacientes críticos en especial cuando se trata de pacientes con SDMO. Además, ocasiona una dificultad de desconexión del respirador que junto al incremento de la estancia hospitalaria pueden favorecer la aparición de complicaciones intercurrentes graves con el consiguiente aumento de la mortalidad.
Secuelas a largo plazo
En los casos de polineuropatía leve la recuperación es favorable en semanas. En los casos de afección grave, el pronóstico funcional no es bueno y a los 2 años persisten una limitación importante de la movilidad y una calidad de vida muy deteriorada en casi todos los pacientes evaluados. En estos casos, persiste el patrón neurofisiológico de neuropatía axonal grave23. Sobre la base de los datos neurofisiológicos, la coexistencia de una neuropatía axonal con enlentecimiento de la velocidad de conducción se asocia a una peor recuperación20. Una estancia prolongada en la UCI, la mayor duración de la sepsis y la pérdida de peso son los tres parámetros que se asocian a una peor recuperación, según un estudio que siguió la evolución de 19 pacientes con PPC24 durante 2 años.
En 2003, 2 estudios han confirmado no sólo la persistencia de la afección neurológica periférica durante años, sino que este hecho es muy frecuente en pacientes críticos después del alta de la UCI.
Herridge et al25 estudiaron a 109 supervivientes de un síndrome de distrés respiratorio agudo a los 12 meses del alta de la UCI. Estos pacientes presentaron SDMO y a los 12 meses padecían una grave debilidad muscular, lo que se puso de manifiesto por el test de la distancia caminada en 6 min. En este estudio no se realizó una evaluación neurofisiológica y el hecho de que la ausencia de tratamiento esteroideo fuera un factor de mejor pronóstico funcional nos lleva a pensar que posiblemente la miopatía podía ser la causa de esta debilidad en un porcentaje importante de casos. De cualquier modo, destacan la gravedad y persistencia de las complicaciones neuromusculares, que superan incluso las secuelas en la función pulmonar.
Por su parte, Fletcher et al26 evaluaron a 22 pacientes que habían permanecido más de 28 días ingresados en la UCI. Este estudio se realizó una mediana de 42,5 meses tras el alta (rango 12-57 meses) y los pacientes habían permanecido en ventilación mecánica por una mediana de 37 días (rango 7-104 días). Los hallazgos más destacados de este trabajo fueron que el 100% de los enfermos continuaba con clínica de debilidad importante y que en el estudio neurofisiológico había datos indicativos de neuropatía axonal (PPC) en 21 de los 22 enfermos, y los datos de miopatía fueron inusuales.
CONCLUSIÓN
La PPC o PNMPC, según la terminología que se emplee, es una complicación que no sólo tiene impacto sobre la mortalidad, sino que causa una importante morbilidad que se extiende por un período de años y que puede condicionar de forma importante la calidad de vida de los pacientes. Hoy nuestros esfuerzos deben dirigirse a evitar los factores conocidos que favorecen su desarrollo. Es igualmente importante la identificación precoz de esta complicación que nos puede llevar a instaurar de forma temprana un programa de rehabilitación que pueda contribuir a mejorar la capacidad funcional de los pacientes afectados, lo cual no ha sido aún demostrado en estudios clínicos prospectivos27. Por tanto, aunque se han producido avances en los últimos años, este y otros muchos aspectos, incluidos los mecanismos moleculares neuronales, quedan aún sin resolver en la polineuropatía y miopatía del paciente crítico porque, como le gustaba repetir a Don Santiago Ramón y Cajal, "el Tajo es inagotable".