Disponer de escalas pronósticas en la insuficiencia cardiaca crónica agudizada para detectar la mortalidad precoz es fundamental. El objetivo de este estudio es crear una escala pronóstica (escala EAHFE-3D) que estratifique el riesgo de muerte a muy corto plazo.
Pacientes y métodoSe utilizó el registro EAHFE, multipropósito y multicéntrico, con seguimiento prospectivo que incluye 6.597 pacientes con insuficiencia cardiaca crónica agudizada atendidos en 34 servicios de urgencias españoles entre 2007 y 2014. Se recogieron variables demográficas, antecedentes personales, datos del episodio agudo, destino final y mortalidad a los 3 días. La cohorte de derivación incluye pacientes seleccionados entre 2009 y 2011 en el registro EAHFE (n=3.640). La variable a estudio fue la mortalidad a los 3 días. Se creó una escala pronóstica (escala EAHFE-3D) con los resultados del estudio multivariante en función del peso de la OR. La escala fue validada utilizando una cohorte de pacientes incluidos en 2014 (n=2.957).
ResultadosSe analizaron 3.640 pacientes (102 muertos a los 3 días, 2,8%) en la cohorte de derivación. La escala final contiene las siguientes variables (máximo 165 puntos): edad≥75 años (30 puntos), NYHA basal iii-iv (15 puntos), presión arterial sistólica<110mmHg (20 puntos), saturación de O2<90% (30 puntos), hiponatremia (20 puntos), tratamiento inotropo o vasopresor (30 puntos) y necesidad de ventilación mecánica no invasiva (20 puntos), con un área bajo la curva ROC de 0,80 (IC 95% 0,76-0,84; p<0,001). La cohorte de validación incluye 2.957 pacientes (66 muertos a los 3 días, 2,2%) y la escala obtiene un área bajo la curva ROC de 0,76 (IC 95% 0,70-0,82; p<0,001). Los grupos fueron: muy bajo riesgo (0-20 puntos), bajo riesgo (21-40 puntos), riesgo intermedio (41-60 puntos), alto riesgo (61-80 puntos) y muy alto riesgo (>80 puntos), con una mortalidad (cohorte de derivación/validación) de 0/0,5, 0,8/1,0%, 2,9/2,8, 5,5/5,8 y 12,7/22,4%, respectivamente.
ConclusionesLa escala EAHFE-3D puede ser de ayuda para estratificar el pronóstico a muy corto plazo de los pacientes con insuficiencia cardiaca crónica agudizada en 5 grupos de riesgo.
Prognostic scales are needed in acute exacerbation of chronic heart failure to detect early mortality. The objective of this study is to create a prognostic scale (scale EAHFE-3D) to stratify the risk of death the very short term.
Patients and methodWe used the EAHFE database, a multipurpose, multicenter registry with prospective follow-up currently including 6,597 patients with acute heart failure attended at 34 Spanish Emergency Departments from 2007 to 2014. The following variables were collected: demographic, personal history, data of acute episode and 3-day mortality. The derivation cohort included patients recruited during 2009 and 2011 EAHFE registry spots (n=3,640). The classifying variable was all-cause 3-day mortality. A prognostic scale (3D-EAHFE scale) with the results of the multivariate analysis based on the weight of the OR was created. The 3D-EAHFE scale was validated using the cohort of patients included in 2014 spot (n=2,957).
ResultsA total of 3,640 patients were used in the derivation cohort and 102 (2.8%) died at 3 days. The final scale contained the following variables (maximum 165 points): age≥75 years (30 points), baseline NYHA III-IV (15 points), systolic blood pressure<110mmHg (20 points), room-air oxygen saturation<90% (30 points), hyponatremia (20 points), inotropic or vasopressor treatment (30 points) and need for noninvasive mechanical ventilation (20 points); with a ROC curve of 0.80 (95% CI 0.76-0.84; P<.001). The validation cohort included 2,957 patients (66 died at 3 days, 2.2%), and the scale obtained a ROC curve of 0.76 (95% CI 0.70-0.82; P<.001). The risk groups consisted of very low risk (0-20 points), low risk (21-40 points), intermediate risk (41-60 points), high risk (61-80 points) and very high risk (>80 points), with a mortality (derivation/validation cohorts) of 0/0.5, 0.8/1.0, 2.9/2.8, 5.5/5.8 and 12.7/22.4%, respectively.
ConclusionsEAHFE-3D scale may help to predict the very short term prognosis of patients with acute heart failure in 5 risk groups.
La insuficiencia cardiaca crónica agudizada (ICCA) es un motivo frecuente de consulta en los servicios de urgencias hospitalarios (SUH) y su prevalencia aumenta conforme avanza la edad1. Se asocia a una elevada mortalidad hospitalaria y a los 30 días, que alcanza cifras del 5 y 10%, respectivamente. Los repetidos episodios de ICCA se relacionan con una progresiva pérdida funcional y un incremento de la mortalidad por cualquier causa2.
La ICCA es un síndrome con un amplio espectro de gravedad. Por un lado se encuentra aquel grupo de pacientes que consultan en los SUH con ICCA de bajo riesgo y que pueden no precisar de un ingreso hospitalario. De hecho, un 24% de los pacientes atendidos por un episodio de ICCA en los SUH españoles son dados de alta directamente desde Urgencias3. Es un objetivo prioritario en la gestión de este proceso reconocer a estos pacientes, ya que no hacerlo puede conllevar un aumento de ingresos inadecuados, con la consecuente pérdida de eficiencia de los recursos disponibles4–6. En el otro extremo existe un grupo de pacientes de muy alto riesgo, con una elevada mortalidad a muy corto plazo, y que si fueran identificados se podrían beneficiar de un manejo más individualizado, así como de una información más adecuada a los familiares y/o cuidadores. Además, y siempre teniendo en cuenta la situación basal y las expectativas de vida del paciente, nos ayudaría en la toma de decisiones, a decidir un manejo más agresivo desde el momento inicial, así como a una mejor selección de las camas de monitorización o de ingreso en las unidades de cuidados intensivos7. En este caso, la falta de identificación de estos pacientes puede condicionar retrasos en el tratamiento inmediato y en procedimientos diagnósticos, falta de monitorización continua, altas inadecuadas desde Urgencias o ingreso en salas no adecuadas, con un incremento del riesgo de acontecimientos adversos.
Hasta la fecha, la mayoría de los estudios que se han desarrollado para crear escalas de estratificación del riesgo en los pacientes atendidos por un episodio de ICCA se han centrado en la mortalidad hospitalaria, sin especificar en cuánto tiempo tiene lugar la muerte, o bien en la mortalidad a medio (30 o 60 días, generalmente) o largo plazo (hasta 5 años)8–14, y, por lo general, solo incluyen pacientes ingresados en plantas de hospitalización. Según nuestro conocimiento, los estudios de mortalidad precoz son realmente inhabituales15, a pesar de su importancia a la hora de tomar decisiones en Urgencias respecto a la intensidad y precocidad terapéuticas, el destino del paciente en una unidad de cuidados intensivos y establecer una primera valoración pronóstica para informar al paciente y la familia.
El trabajo de Kawase et al. encuentra que los niveles elevados de lactato (>3,2mmol/l) se relacionan con una mayor mortalidad precoz, siendo la estancia en unidades de cuidados intensivos más prolongada si sobreviven16. Lancellotti et al. describen una mayor mortalidad en los pacientes con ICCA y frecuencia cardiaca elevada en las primeras 24-36h, y demuestran que su control puede mejorar la mortalidad precoz17. La Sociedad Europea de Cardiología recomienda e insiste en la necesidad de un manejo precoz e intensivo18.
Teniendo en cuenta lo expuesto se ha determinado el periodo de estudio en 3 días, en el que las medidas inmediatas en las unidades de cuidados intensivos pueden ser más eficaces, siendo su intervención la que impacta de manera más importante; sin embargo, no existe evidencia científica en este corto periodo de tiempo. El objetivo de este trabajo fue identificar factores asociados a mortalidad a los 3 días, disponibles de manera rápida en los SUH, con el fin de crear una escala pronóstica de estratificación de riesgo de muerte muy precoz en los pacientes atendidos por un episodio de ICCA en los SUH.
Pacientes y métodosEl estudio EAHFE-3D es un análisis secundario de los datos del registro Epidemiology of Acute Heart Failure in Emergency Departments (EAHFE)3. Es un estudio de cohorte multipropósito, de carácter analítico no intervencionista y multicéntrico, con un seguimiento prospectivo que incluyó de forma consecutiva a todos los pacientes atendidos por ICCA en los 34 SUH españoles. El criterio de inclusión de los pacientes fue que cumpliesen los criterios diagnósticos de ICA, basados en la presencia de síntomas (disnea, ortopnea, disnea paroxística nocturna) y signos (tercer ruido, crepitantes pulmonares, presión venosa yugular>4cm, taquicardia sinusal en reposo, edemas, hepatomegalia, reflujo hepatoyugular) y datos radiológicos de congestión pulmonar, que precisaran tratamiento inmediato para su estabilización. Únicamente se han excluido de este estudio los pacientes con síndrome coronario agudo con elevación del segmento ST. El estudio EAHFE ha tenido 4 fases inclusivas de pacientes. Para generar la escala pronóstica se utilizaron los datos recogidos en EAHFE-1 (del 15 de abril al 15 de mayo de 2007, 1.107 pacientes), EAHFE-2 (del 1 al 30 de junio de 2009, 1.483 pacientes) y EAHFE-3 (del 7 de noviembre de 2011 al 7 de enero de 2012, 3.255 pacientes), con un total de 5.845 pacientes recogidos en 29 SUH. Para el presente estudio post hoc se incluyeron aquellos pacientes de los que se disponía de todos los valores necesarios para la realización del análisis propuesto y del seguimiento a 3 días. Para la validación de la escala se utilizaron los datos del EAHFE-4 (del 1 de enero al 28 de febrero de 2014, 2.957 pacientes recogidos en 34 SUH). La metodología de la recogida de datos ha sido la misma en los 4 periodos y en todos los centros, siendo previamente publicada3,19. El estudio fue aprobado por los comités de ética e investigación clínica de los hospitales participantes y se obtuvo el consentimiento informado de los pacientes incluidos en el estudio.
Se recogieron datos referentes a las características basales de los pacientes (edad, sexo, antecedentes patológicos, tratamiento previo de la insuficiencia cardiaca, grado de dependencia funcional según el índice de Barthel, clase funcional según la New York Heart Association –NYHA–) y datos del episodio agudo de ICCA tanto clínicos (presencia de disnea, ortopnea, disnea paroxística nocturna, hepatomegalia, reflujo hepatoyugular, edemas, frecuencia cardiaca, presión arterial sistólica) como de exploraciones complementarias (sodio, creatinina, filtrado glomerular calculado mediante la fórmula MDRD20) y del tratamiento administrado en Urgencias. Todas las variables se dicotomizaron en función del punto de corte que se consideró clínicamente más razonable. La variable dependiente a estudio fue la mortalidad a los 3 días. Esta se determinó a través de contacto telefónico tras el alta y mediante el seguimiento clínico de los pacientes hospitalizados.
Para la descripción de las variables cualitativas se utilizaron frecuencias absolutas y relativas, y para las cuantitativas, la media con desviación estándar. Para las comparaciones se utilizó la prueba de la ji al cuadrado para las primeras (o en las tablas 2×2 el test exacto de Fisher cuando los efectivos esperados eran inferiores a 5) y la prueba de la t de Student para medidas independientes para las segundas. Las variables que en el estudio univariante presentaron diferencias significativas, las cuales se expresaron como odds ratio (OR), se introdujeron en un modelo de regresión logística. Con las variables que mantuvieron la significación en el estudio multivariable se construyó una escala ponderando cada una de estas variables según su peso en el modelo final. Se valoró la capacidad de discriminación del modelo con el área bajo la curva (ABC) receiver operating characteristic (ROC). Posteriormente, se analizó la curva de distribución de las puntuaciones de la escala EAHFE-3D en función de la mortalidad y se definieron arbitrariamente 5 grupos de riesgo en función de los puntos de corte de manera que tuviesen sentido clínico, y estos puntos de corte determinaron de forma ascendente las categorías de muy bajo, bajo, intermedio, alto y muy alto riesgo, respectivamente. Se consideró que las diferencias eran estadísticamente significativas cuando el valor de p era inferior a 0,05 o cuando el intervalo de confianza (IC) del 95% de la OR excluía el valor 1 o el ABC excluía el valor 0,5. Se realizó la validación con la cohorte EAHFE-4 y se calculó su ABC. La comparación del ABC se realizó con la metodología de DeLong. El programa estadístico utilizado fue el SPSS® 19.0, y para la comparación del ABC se utilizó el programa STATA® 12.0.
ResultadosDe los 5.845 episodios incluidos en el registro EAHFE, se seleccionaron 3.640, en los que se disponía del 100% de los datos, para la cohorte de derivación. De ellos, 102 (2,8%) pacientes fallecieron durante los 3 días siguientes a su consulta al SUH.
Las características de la cohorte de derivación, de ambos grupos y de la de validación están descritas en las tablas 1 y 2. En la cohorte de derivación, de los 102 pacientes que fallecieron a los 3 días, se dio de alta a domicilio a un 16,7% (n=17), de los cuales el 70,6% (n=12) reconsultó en Urgencias, por lo que finalmente el 95,1% (n=97) falleció en el hospital. Respecto al destino de los pacientes fallecidos, el 8,9% (n=9) ingresaron en unidades de cuidados intensivos por ser considerados candidatos a un manejo intensivo; destaca que hasta un 66% (n=57) de los pacientes se ingresan en unidades dependientes de Medicina Interna. Los predictores de mortalidad precoz en el estudio univariante fueron: la edad≥75 años, la presencia de insuficiencia renal crónica, la dependencia funcional (índice de Barthel<60 puntos) y una situación basal de la NYHA de iii o iv. En el tratamiento de base no hubo diferencias entre ambos grupos. En la presentación clínica fueron predictores de mortalidad precoz unas cifras de PAS<110mmHg, una saturación de O2<90%, la hiponatremia (sodio<135mmol/l) y un FGe<60ml/min. Finalmente, respecto al tratamiento administrado en Urgencias, el inotropo o vasopresor y la ventilación no invasiva (VNI) se relacionaron con una mayor mortalidad.
Estudio univariante de las características basales de la cohorte de derivación
| Cohorte de derivación n=3.640 | Vivo 3 días n=3.538 | Muerto 3 días n=102 | p | Cohorte de validación n=2.957 | |
|---|---|---|---|---|---|
| Datos basales | |||||
| Edad≥75 años | 2.731 (75) | 2.638 (74,6) | 93 (91,2) | <0,001 | 2.249 (76,1) |
| Sexo femenino | 2.068 (56,8) | 2.003 (56,6) | 65 (63,7) | 0,153 | 1.620 (55,1) |
| HTA | 3.063 (84,1) | 2.976 (84,1) | 87 (85,3) | 0,748 | 2.533 (85,7) |
| Diabetes mellitus | 1.537 (42,2) | 1.495 (42,3) | 42 (41,2) | 0,824 | 1.259 (42,6) |
| Dislipidemia | 1.452 (39,9) | 1.418 (40,1) | 34 (33,3) | 0,169 | 1.400 (47,4) |
| Cardiopatía isquémica | 1.072 (29,5) | 1.048 (29,6) | 24 (23,5) | 0,182 | 895 (30,3) |
| IRC | 903 (24,8) | 868 (24,5) | 35 (34,3) | <0,05 | 742 (25,1) |
| AVC | 501 (13,8) | 486 (13,7) | 15 (14,7) | 0,779 | 383 (13) |
| Fibrilación auricular | 1.802 (49,5) | 1.759 (49,7) | 43 (42,2) | 0,131 | 1.422 (48,1) |
| Enfermedad arterial | 291 (8) | 283 (8) | 8 (7,8) | 0,954 | 275 (9,3) |
| Enfermedad valvular | 1.018 (28) | 992 (28) | 26 (25,5) | 0,571 | 838 (28,4) |
| EPOC | 941 (25,9) | 913 (25,9) | 28 (28) | 0,631 | 771 (26,1) |
| IC previa | 2.304 (65,2) | 2.230 (65) | 74 (72,5) | 0,114 | 1.666 (56,5) |
| Índice de Barthel<60 p | 655 (18) | 618 (17,5) | 37 (36,3) | <0,001 | 355 (14,3) |
| NYHA basal iii-iv | 900 (24.7) | 856 (24.2) | 44 (43.1) | <0,001 | 601 (46,8) |
| Tratamiento basal | |||||
| Diuréticosa | 2.703 (75,4) | 2.626 (75,3) | 77 (77) | 0,699 | 2.045 (77,6) |
| Inhibidores mineralocorticoides | 589 (16,4) | 577 (16,5) | 12 (12) | 0,227 | 542 (20,6) |
| IECA o ARA-II | 2.108 (58,8) | 2.047 (58,7) | 61 (61) | 0,646 | 1.418 (53,8) |
| Antagonistas del calcio | 924 (25,8) | 899 (25,8) | 25 (25) | 0,860 | 556 (21,1) |
| Betabloqueantes | 1.263 (35,2) | 1.230 (35,3) | 33 (33) | 0,639 | 1.135 (43,1) |
| Digoxina | 696 (19,4) | 676 (19,4) | 20 (20,2) | 0,841 | 378 (14,3) |
| Amiodarona | 234 (6,5) | 227 (6,5) | 7 (7) | 0,845 | 152 (5,8) |
| Nitratos | 756 (21,1) | 735 (21,1) | 21 (21) | 0,984 | 440 (16,7) |
ARA-II: antagonistas de la renina-aldosterona; AVC: accidente vascular cerebral; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima convertidora de angiotensina-aldosterona; IRC: insuficiencia renal crónica definida por creatinina>2mg/dl; NYHA: New York Heart Association.
Estudio univariante de las características basales de la cohorte de derivación
| Cohorte de derivación n=3.640 | Vivo 3 días n=3.538 | Muerto 3 días n=102 | p | Cohorte de validación n=2.957 | |
|---|---|---|---|---|---|
| Episodio agudo | |||||
| PAS<110 | 372 (10,2) | 346 (9,8) | 26 (25,5) | <0,001 | 257 (8,7) |
| Taquicardia en reposoa | 677 (18,6) | 654 (18,5) | 23 (22,5) | 0,298 | 415 (14) |
| Saturación de O2≤90% | 1.125 (30,9) | 1.060 (30) | 65 (63,7) | <0,001 | 798 (27,9) |
| Disnea | 3.227 (88,7) | 3.138 (88,7) | 89 (87,3) | 0,651 | 2.687 (90,8) |
| Ortopnea | 2.203 (60,6) | 2.136 (60,4) | 67 (66,3) | 0,229 | 1.595 (54) |
| DPN | 1.157 (31,8) | 1.119 (31,6) | 38 (37,3) | 0,230 | 764 (25,9) |
| Edemas | 2.533 (69,8) | 2.465 (69,9) | 68 (67,3) | 0,583 | 2.029 (68,7) |
| Hiponatremiab | 784 (21,5) | 748 (21,1) | 36 (35,3) | 0,001 | 578 (19,5) |
| FGe<60ml/min | 2.106 (57,9) | 2.030 (57,4) | 76 (74,5) | 0,001 | 1.688 (57,1) |
| Tratamiento Urgencias | |||||
| Diuréticos intravenososc | 3.232 (96) | 3.145 (96) | 87 (95,6) | 0,861 | 2.258 (94,1) |
| Nitratos intravenosos | 833 (22,9) | 804 (22,7) | 29 (28,4) | 0,177 | 440 (15,1) |
| Soporte inotropo/vasopresord | 112 (3,1) | 96 (2,7) | 16 (15,7) | <0,001 | 44 (1,5) |
| Uso de VNI Urgencias | 285 (7,8) | 264 (7,5) | 21 (20,6) | <0,001 | 222 (7,6) |
DPN: disnea paroxística nocturna; FGe: filtrado glomerular estimado; PAS: presión arterial sistólica; VNI: ventilación no invasiva.
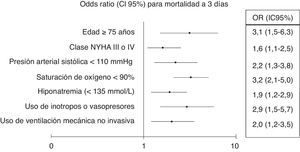
En el ajuste del modelo multivariante se mantuvieron estadísticamente significativas la edad≥75 años (OR 3,1; IC 95% 1,5-6,3; p<0,001), la NYHA basal iii-iv (OR 1,6; IC 95% 1,1-2,5; p=0,03), la presión arterial sistólica<110mmHg (OR 2,2; IC 95% 1,3-3,8; p=0,002), la saturación de O2<90% (OR 3,2; IC 95% 2,1-5; p<0,001), la hiponatremia (OR 1,9; IC 95% 1,2-2,9; p=0,005), el tratamiento inotropo o vasopresor (OR 2,9; IC 95% 1,5-5,7; p=0,002) y la necesidad de VNI (OR 2; IC 95% 1,2-3,5; p=0,01) (fig. 1).
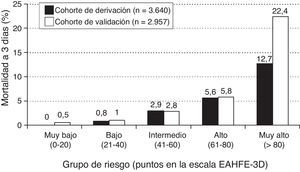
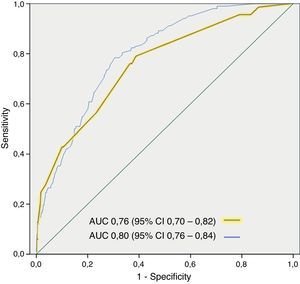
La puntuación de corte elegida para cada uno de los 5 grupos de riesgo de mortalidad precoz fue la siguiente: grupo de muy bajo riesgo de 0 a 20 puntos, grupo de bajo riesgo de 21 a 40 puntos, grupo de riesgo intermedio de 41 a 60 puntos, grupo de alto riesgo de 61 a 80 puntos y grupo de muy alto riesgo>80 puntos (fig. 2). El número de pacientes que incluyó cada categoría fue, respectivamente, de 432 (11,9%), 1.329 (36,5%), 1.080 (29,7%), 579 (15,9%) y 220 (6,0%), con una mortalidad observada para cada uno de ellos del 0, 0,8, 2,9, 5,5 y 12,7% (fig. 3). La capacidad discriminadora de este modelo fue buena, con un ABC de 0,80 (IC 95% 0,76-0,84; p<0,001) (fig. 4). En la cohorte de validación se incluyeron 2.957 pacientes, de los cuales fallecieron 66 (2,2%) a los 3 días; el ABC de este modelo es de 0,76 (IC 95% 0,70-0,82; p<0,001) (fig. 4), siendo la mortalidad por grupos de 0,5, 1,0, 2,8, 5,8 y 22,4, respectivamente (fig. 3). La diferencia entre las ABC fue de 0,04. El método no paramétrico de DeLong no mostró diferencias en la comparación de las ABC (p=0,47).
DiscusiónEl conocimiento de variables pronósticas a corto plazo en la ICCA es fundamental en los SUH para optimizar el manejo terapéutico, la monitorización, el destino de los pacientes, así como la información al enfermo y sus familiares. Existen una serie de variables que se relacionan con un aumento de la mortalidad a corto (mortalidad hospitalaria), medio (a 30 o 60 días) y largo plazo (un año o más) en la ICA. Solo el estudio de Lee et al. valora la mortalidad precoz a 7 días, y con los datos de dicho estudio crearon la escala EHMRG15. La escala EAHFE-3D se interesó en identificar una mortalidad más precoz, a 3 días, e independiente del destino del paciente (alta a domicilio o ingreso hospitalario), ya que uno de los objetivos fue detectar el riesgo inminente de muerte de manera que pueda permitir asignar tratamientos y recursos intensivos a aquellos pacientes candidatos a ellos, desde el momento inicial de la valoración en Urgencias. Así, la edad superior a 75 años, un estado basal en la categoría NYHA de iii o iv, una presión arterial sistólica inferior a 110mmHg, una saturación de oxígeno basal inferior a 90%, una hiponatremia y el uso de inotropos o vasopresores y de VNI en Urgencias fueron las variables independientes asociadas a un peor pronóstico a muy corto plazo.
El estudio EAHFE-3D quiso utilizar únicamente variables que se pueden obtener fácilmente en el momento de atender al paciente con ICCA en el SUH. Así, por un lado, se descartaron los péptidos natriuréticos, los cuales tienen un elevado valor pronóstico21, pero no están disponibles en todos los SUH y tienen en el paciente con diagnóstico fiable de ICCA un valor relativo con una baja especificidad, por lo que esta escala podría obviar el gasto en biomarcadores22,23.
Por otro lado, se descartó la troponina, ya que, aunque también cuenta con un elevado valor pronóstico, no se solicita de forma rutinaria y su determinación está ausente en casi el 50% de los casos de ICCA atendidos en Urgencias24. Sin duda, la generalización en los SUH de la disponibilidad del primero y de la solicitud del segundo quizá podría permitir mejoras en futuras aproximaciones a este modelo. Es de destacar que solo 3 de las 7 variables finalmente incluidas en la escala EAHFE-3D coinciden con 3 de las 10 variables incluidas en la escala EHMRG15: la edad, la presión arterial sistólica y la saturación arterial de O2; sin embargo, ambas escalas obtienen un ABC idéntico (0,80), lo que les confiere un buena capacidad discriminadora aplicadas en sus respectivos entornos. Estas ABC pueden parecer modestas, sin embargo, su significación estadística es correcta con una p<0,001 en ambos casos.
Entre las variables incluidas en la escala EAHFE-3D, la edad es un factor universal de mal pronóstico en los pacientes con ICA, independientemente del periodo de seguimiento contemplado25–28. El incremento de mortalidad en los pacientes con ICCA según avanza la edad se ha justificado con el grado de comorbilidad, la frecuencia de factores asociados a la fragilidad e incluso el distinto manejo inmediato condicionado por la presencia de enfermedades y la escasa evidencia publicada sobre los tratamientos aplicados29. El resto de las variables también han sido referidas en estudios previos. La hiponatremia se ha relacionado con el pronóstico en muchos estudios, pero, en general, son modelos para mortalidad a largo plazo (mortalidad entre uno y 5 años)30,31. Uno de los modelos que tiene en cuenta las variables del paciente con ICCA en el momento de su llegada a Urgencias es la escala EFFECT14, que se basa en el análisis de 4.031 pacientes que consultaron en Urgencias por ICCA y que valora la mortalidad a los 30 días y al año. En este modelo, la hiponatremia (sodio<136mmol/l) se asoció con la mortalidad a 30 días (hazard ratio 1,53; IC 95% 1,14-2,05) y al año (hazard ratio 1,46; IC 95% 1,19-1,80). En el registro OPTIMIZE-HF32, que incluyó 48.162 pacientes con ICA, un 19,7% presentó hiponatremia al ingreso que se asoció con un aumento en la estancia hospitalaria y con una mayor mortalidad (a los 60 y 90 días) tras el alta. En los pacientes con ICCA la perfusión microvascular está seriamente alterada33 y existen anomalías en la utilización del oxígeno microvascular cuando se comparan con pacientes estables34. Diferentes estudios han puesto de manifiesto la utilidad de la determinación basal de la saturación de O2 por pulsioximetría como herramienta complementaria para establecer la gravedad de la ICCA al evidenciar una estrecha correlación entre los defectos del intercambio de gases o las presiones pulmonares enclavadas y la gravedad de la ICA35.
El desarrollo de la escala EAHFE-3D permite identificar por encima de los 60 puntos a los pacientes de alto y muy alto riesgo (mortalidad a los 3 días del 5,5 y el 12,7%, respectivamente), que son los que deberían ser asumidos en las áreas de críticos para su manejo, donde por eficiencia y recomendación, si el paciente está en una situación de shock o necesita fármacos vasoactivos, se debería manejar hemodinámicamente con un ecocardiógrafo-doppler (inversión en equipo y una formación básica) según las últimas guías de manejo del shock36–38. Los pacientes con baja mortalidad se podrían beneficiar de un alta domiciliaria precoz. Además, nos puede ser de ayuda a la hora de decidir de forma individual la ubicación final en la unidad más adecuada39,40. Para ello es necesario el desarrollo de un protocolo de forma local y participativa por las diferentes especialidades implicadas en este proceso. Por tanto, estos pacientes deberían ser subsidiarios de ingreso en unidades con estricto control clínico, a no ser que otras consideraciones, esencialmente la de limitación del esfuerzo terapéutico, contraindiquen el mismo41,42.
El presente trabajo tiene ciertas limitaciones. En primer lugar, la población estudiada no incluye pacientes con síndrome coronario agudo con elevación del segmento ST, el cual se relaciona con un aumento de la mortalidad, si bien la proporción de esta asociación en el global de pacientes con ICCA atendidos en Urgencias es muy pequeña y su manejo terapéutico forma parte de otro escenario. En segundo lugar, como se ha mencionado anteriormente, el no tener en cuenta biomarcadores en la escala EAHFE-3D puede haber limitado su rendimiento, si bien, por otro lado, este hecho facilita su uso en todos los SUH, independientemente de la disponibilidad de los mismos. En tercer lugar, la aplicación de la VNI o la administración de vasopresores e inotrópicos puede ser heterogénea en los diferentes SUH, pues se realizan a criterio del médico responsable. A pesar de estas limitaciones, creemos que la escala 3D-EAHFE identifica fácilmente en Urgencias a los pacientes de alto riesgo de muerte muy precoz y puede contribuir a la mejora asistencial y a precisar el pronóstico de estos enfermos.
Conflicto de interesesEl grupo de investigación ICA-SEMES ha recibido ayudas sin restricciones y no directamente relacionadas con este estudio de los laboratorios Orion Pharma y Novartis.
Este trabajo ha sido posible en parte gracias a ayudas del Instituto de Salud Carlos III y FEDER (PI10/01918 y PI11/01021) y de la Generalitat de Catalunya (SGR 2009/1385).
Cristina Gil, Marta Fuentes (Hospital Universitario de Salamanca); Maria José Pérez-Durá, Eva Salvo, José Vallés (Hospital La Fe de Valencia); Rosa Escoda (Hospital Clínic de Barcelona); José Pavón, Ana Bella Álvarez (Hospital Dr. Negrín de Las Palmas de Gran Canaria); Antonio Noval (Hospital Insular de Las Palmas de Gran Canaria); José M. Torres (Hospital Reina Sofía de Córdoba); Maria Luisa López-Grima, Amparo Valero (Hospital Dr. Peset de Valencia); Alfons Aguirre, Maria Àngels Pedragosa (Hospital del Mar de Barcelona); Maria Isabel Alonso, Helena Sancho, Paco Ruiz (Hospital de Valme de Sevilla); Antonio Giménez, José Miguel Franco (Hospital Miguel Servet de Zaragoza); Sergio Pardo (Hospital San Juan de Alicante); Ana Belen Mecina (Hospital de Alcorcón); Josep Tost (Consorci Sanitari de Terrassa); Jordi Fabregat (Hospital Mútua de Terrassa); Susana Sánchez (Hospital Río Ortega de Valladolid); Pascual Piñera (Hospital Reina Sofía de Murcia); Raquel Torres Garate (Hospital Severo Ochoa de Madrid); Aitor Alquezar, Miguel Alberto Rizzi (Hospital Sant Pau de Barcelona); Fernando Richard (Hospital de Burgos); Javier Lucas (Hospital General de Albacete); Héctor Alonso (Hospital Marqués de Valdecilla de Santander); José Manuel Garrido (Hospital Virgen de la Macarena de Sevilla); Esther Rodríguez-Adrada (Hospital Clínico San Carlos de Madrid); Irene Cabello, Eva Lista, Ignasi Bardes (Hospital Universitari de Bellvitge de Barcelona).