La terapia con cánula nasal de alto flujo (CNAF) se ha introducido recientemente en el tratamiento del fallo respiratorio agudo (FRA), siendo una técnica segura, confortable y eficaz que logra revertir la hipoxemia en estos pacientes. Es necesario disponer de herramientas que nos permitan detectar precozmente el fallo de este tipo de tratamiento para evitar el incremento de la mortalidad que puede conllevar. El objetivo primario de este estudio ha sido analizar el impacto que la frecuencia respiratoria (FR), la saturación periférica de oxígeno (SpO2), la fracción inspirada de oxígeno (FiO2) y el índice ROX (IROX=[SpO2/FiO2]/FR) tienen sobre el éxito de la CNAF en los pacientes con FRA hipoxémico. Los objetivos secundarios han sido analizar la estancia y la mortalidad en la UCI y la necesidad de ventilación mecánica (VM).
Material y métodosSe trata de un estudio retrospectivo efectuado en una UCI polivalente del Hospital Comarcal de Montilla (Córdoba). Se incluyeron los pacientes tratados con CNAF por FRA hipoxémico desde enero de 2016 hasta enero de 2018.
ResultadosDesde enero de 2016 hasta enero de 2018 se trataron 27 pacientes con FRA, de los cuales 19 (70,37%) presentaban FRA hipoxémico. De estos, 15 (78,95%) respondieron bien al tratamiento y 4 (21,05%) fracasaron. A las 2h de tratamiento la FR demostró ser el mejor predictor (área bajo la curva ROC [AUROC] 0,858; IC95%: 0,63-1,05; p=0,035). La FiO2 y el IROX fueron buenos predictores a las 8h de tratamiento (FiO2: AUROC 0,95; IC95%: 0,85-1,04; p=0,007, e IROX: AUROC 0,967; IC95%: 0,886-1,047; p=0,005). El mejor punto de corte de la FR a la segunda hora fue de 29 respiraciones/min (sensibilidad 75%, especificidad 87%). El mejor punto de corte de la FiO2 a las 8h de tratamiento fue de 0,59 (75% sensibilidad, 93% especificidad). El mejor punto de corte para IROX a las 8h de tratamiento fue de 5,98 (sensibilidad 100%, especificidad 75%). En el modelo de regresión de Cox, una FR<29 respiraciones/min a la segunda hora de tratamiento y una FiO2<0,59 e IROX >5,98 a las 8h de tratamiento se asociaron a un menor riesgo de VM (FR: HR 0,103; IC95%: 0,11-0,99; p=0,05; FiO2: HR 0,053; IC95%: 0,005-0,52; p=0,012, e IROX: HR 0,077; IC95%: 0,008-0,755; p=0,028), respectivamente.
ConclusionesLa FR a la segunda hora de tratamiento y la FiO2 e IROX a las 8h de tratamiento fueron los mejores predictores de éxito del CNAF. Una FR<29 respiraciones/min (2.ª hora), una FiO2<0,59 y un IROX>5,98 (8.ª hora) se asociaron a un menor riego de VM.
High-flow nasal cannula (HFNC) therapy is used in the treatment of acute respiratory failure (ARF) and is both safe and effective in reversing hypoxemia. In order to minimize mortality and clinical complications associated to this practice, a series of tools must be developed to allow early detection of failure. The present study was carried out to: (i)examine the impact of respiratory rate (RR), peripheral oxygen saturation (SpO2), ROX index (ROXI=[SpO2/FiO2]/RR) and oxygen inspired fraction (FiO2) on the success of HFNC in patients with hypoxemic ARF; and (ii)analyze the length of stay and mortality in the ICU, and the need for mechanical ventilation (MV).
MethodsA retrospective study was carried out in the medical-surgical ICU of Hospital de Montilla (Córdoba, Spain). Patients diagnosed with hypoxemic ARF and treated with HFNC from January 2016 to January 2018 were included.
ResultsOut of 27 patients diagnosed with ARF, 19 (70.37%) had hypoxemic ARF. Fifteen of them (78.95%) responded satisfactorily to HFNC, while four (21.05%) failed. After two hours of treatment, RR proved to be the best predictor of success (area under the ROC curve [AUROC] 0.858; 95%CI: 0.63-1.05; P=.035). For this parameter, the optimal cutoff point was 29rpm (sensitivity 75%, specificity 87%). After 8hours of treatment, FiO2 and ROXI were reliable predictors of success (FiO2: AUROC 0.95; 95%CI: 0.85-1.04; P=.007 and ROXI: AUROC 0.967; 95%CI: 0.886-1.047; P=.005). In the case of FiO2 the optimal cutoff point was 0.59 (sensitivity 75%, specificity 93%), while the best cutoff point for ROXI was 5.98 (sensitivity 100%, specificity 75%). Using a Cox regression model, we found RR<29rpm after two hours of treatment, and FiO2<0.59 and ROXI>5.98 after 8hours of treatment, to be associated with a lesser risk of MV (RR: HR 0.103; 95%CI: 0.11-0.99; P=.05; FiO2: HR 0.053; 95%CI: 0.005-0.52; P=.012; and ROXI: HR 0.077; 95%CI: 0.008-0.755; P=.028, respectively).
ConclusionsRR after two hours of treatment, and FiO2 and ROXI after 8hours of treatment, were the best predictors of success of HFNC. RR<29rpm, FiO2<0.59 and ROXI>5.98 were associated with a lesser risk of MV.
La oxigenoterapia es la primera línea de tratamiento de la hipoxemia en el fallo respiratorio agudo (FRA). Puede hacerse con dispositivos de bajo flujo, cánula nasal, máscara facial simple o máscara con bolsa reservorio, o con sistemas de alto flujo, como la máscara Venturi. Con los dispositivos de bajo flujo la fracción inspirada de oxígeno (FiO2) no es predecible y depende de varios factores: patrón respiratorio del paciente, pico de flujo y sistema utilizado. Con la máscara Venturi la FiO2 es más predecible, siempre y cuando el flujo aportado supere la demanda de flujo del paciente. Recientemente se ha incorporado la cánula nasal de alto flujo (CNAF), sistema que utiliza una mezcla de aire y oxígeno, humidificado y calentado, con una tasa de flujo que puede llegar a los 60l/min. Para entregar esta mezcla de gases se pueden utilizar cánulas nasales de diferentes tamaños o conectores para cánulas de traqueotomía1-3.
La CNAF proporciona un flujo elevado, como se ha comentado, de hasta 60l/min, con FiO2 que oscilan entre 0,21 y 1. El gas se calienta, se humedece y se entrega al paciente a través de cánulas nasales. Los efectos favorables descritos son: lavado del espacio muerto orofaríngeo, presión positiva espiratoria (efecto PEEP), mejoría del patrón respiratorio, con disminución de la frecuencia respiratoria (FR), disminución del esfuerzo inspiratorio, mejor tolerancia y confort, incremento del cociente presión de oxígeno arterial [PaO2]/FiO2, efecto hemodinámico favorable en la insuficiencia cardiaca y entrega de una elevada tasa de flujo que hace que la FiO2 sea más predecible1-6. Además, se ha podido comprobar que disminuye la presión de insuflación pulmonar (driving pressure), lo que conlleva un menor daño pulmonar autoinfligido7,8.
Si bien en otras técnicas de soporte respiratorio están bien establecidos los criterios de éxito o fracaso9-13, con CNAF no existen muchos estudios centrados en este aspecto. Frat et al.14 condujeron un estudio observacional prospectivo en el que trataron secuencialmente con CNAF y ventilación mecánica no invasiva (VMNI) a 28 pacientes con FRA hipoxémico. En este estudio, una FR>30respiraciones/min en la primera hora de tratamiento se asoció a fracaso de este. Roca et al.15, en un estudio de cohorte en el que incluyeron 191 pacientes con neumonía, proponen el índice ROX (IROX) como predictor de éxito de CNAF a las 2, 6 y 12h de tratamiento15.
Es importante disponer de herramientas que nos permitan detectar precozmente el fracaso de la técnica, ya que un retraso en la intubación puede provocar un aumento de la mortalidad16.
El objetivo primario de nuestro estudio ha sido analizar el valor de las diferentes variables respiratorias (FR, saturación periférica de oxígeno [SpO2], FiO2 e IROX) como predictores de éxito del tratamiento con CNAF en el FRA hipoxémico. Los objetivos secundarios han sido analizar la estancia y la mortalidad en la UCI y la necesidad de ventilación mecánica (VM).
Material y métodosSe trata de un análisis retrospectivo efectuado en una UCI polivalente del Hospital de Montilla, Córdoba. Utilizamos una base de datos médica que incluía los pacientes mayores de 18años tratados con CNAF por FRA desde enero de 2016 a enero de 2018. Se incluyeron en el estudio los pacientes tratados con CNAF por FRA hipoxémico. Se indicó CNAF si el paciente tenía una SpO2<94% respirando con un sistema Venturi con FiO2 de 0,5 y presentaba una FR>25 respiraciones/min. Se excluyeron los enfermos con antecedentes de enfermedad pulmonar obstructiva crónica (EPOC) o cualquier patología con fallo respiratorio hipercápnico diferente a EPOC. Se excluyeron también todos los pacientes con una PaCO2>45mmHg. A todos los enfermos se les determinaba basalmente la SpO2, la FR y la FiO2, y se analizaba a las 2 y a las 8h de tratamiento. Con estos tres parámetros calculamos el IROX a las 2 y 8h de tratamiento.
Se definió fallo del tratamiento con CNAF como la necesidad de intubación y soporte con VM. Las indicaciones fueron la falta de mejoría de los signos de trabajo respiratorio, del intercambio de gases o la aparición de deterioro hemodinámico o del nivel de conciencia.
Para administrar CNAF se utilizaron dos tipos de dispositivos: AIRVO2 (Fisher & Paykel Healthcare, Auckland, Nueva Zelanda) y Optiflow (MR850 calentador y humidificador, con tubo RT202 y cánula nasal RT050/051, Fisher & Paykel Healthcare, Auckland, Nueva Zelanda). A todos los pacientes se les administró un flujo de 60l/min, humidificado y calentado a 37°C, y FiO2 para mantener una SpO2 del 94-98%.
El estudio fue evaluado y aprobado por el Comité de Ética Provincial de Córdoba (acta n° 282, ref. 4082).
Análisis estadísticoLas variables cuantitativas se muestran como medianas con rango intercuartílico o medias ±desviación estándar. Las variables cualitativas se muestran como frecuencias y porcentajes. Para el análisis de contraste de las variables continuas utilizamos la prueba t de Student para variables independientes y apareadas o Mann-Whitney, según el resultado del análisis de distribución de la normalidad con el test de Shapiro-Wilk. Las variables cualitativas se compararon con la prueba chi cuadrado o exacta de Fisher, según conveniencia. Para valorar la capacidad predictiva de las diferentes variables respiratorias, FR, SpO2, FiO2 e IROX, sobre el éxito del CNAF, se efectuó un análisis con la curva ROC (característica receptiva del operador) de cada una de ellas, con el fin de hallar el punto de corte asociado al éxito de la técnica. Se calculó el área bajo la curva ROC (AUROC) para determinar la probabilidad de asociación del punto de corte escogido asociado al éxito de la CNAF. Se dio el análisis como válido si AUROC ≥0,75. Se escogió el valor de corte con mejor relación sensibilidad/especificidad. Se calculó el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN). La posible asociación del punto de corte de la variable respiratoria, dado en el análisis de la curva ROC, con la necesidad de VM a las 96h de tratamiento, se analizó mediante un modelo de regresión de Cox. El resultado obtenido en este modelo se volvió a analizar ajustándolo por otras covariables que pudieran inducir confusión o interacción. Previo a esta medida de asociación, se procedió a un análisis univariante de cada una de las covariables, siendo incluidas en el modelo si la p<0,2. Se analizó la asociación de ambos puntos de corte, mediante una regresión de Cox, con la supervivencia a las 96h de tratamiento. Se consideró una diferencia estadísticamente significativa si p≤0,05.
Para el análisis estadístico utilizamos el software SPSS 15,0 para Windows.
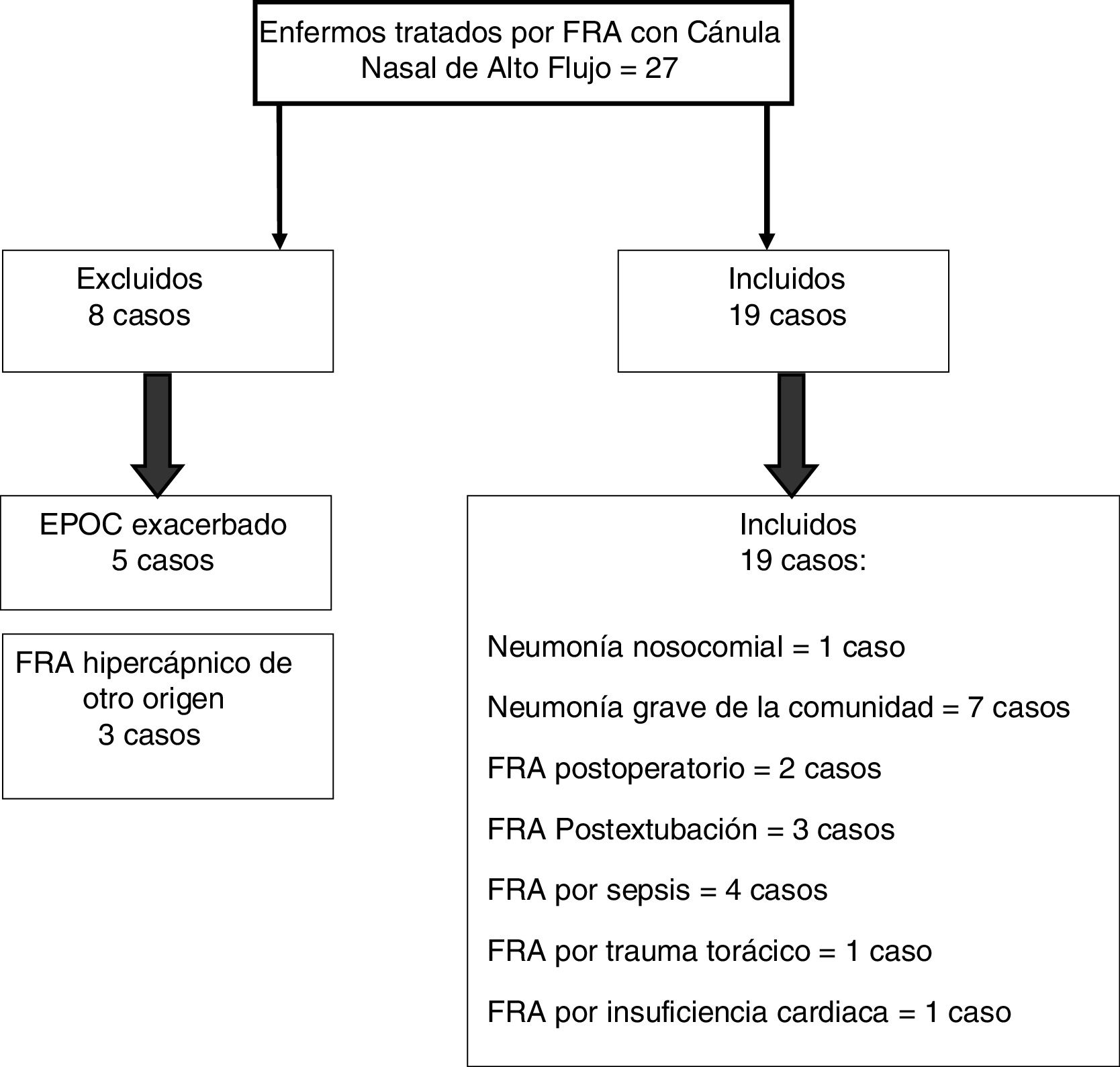
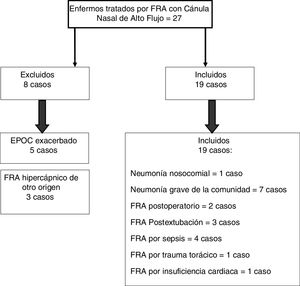
ResultadosDesde enero de 2016 a enero de 2018 se trataron con CNAF 27 enfermos por FRA, de los cuales 19 (70,37%) presentaban FRA hipoxémico (fig. 1).
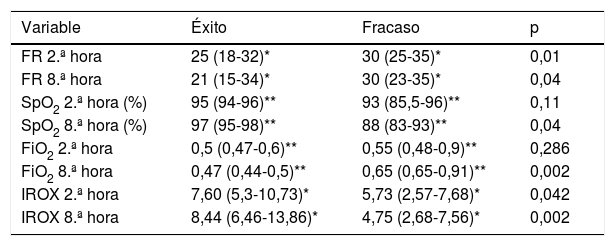
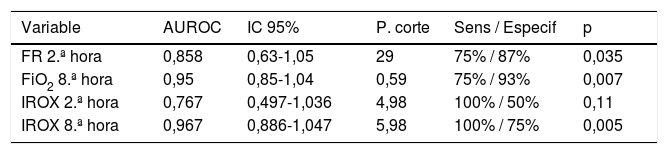
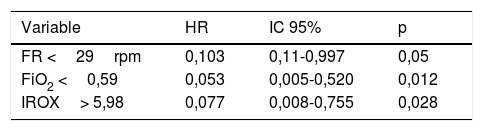
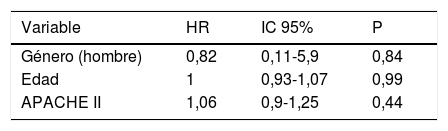
De los 19 pacientes tratados con CNAF, 4 (21,05%) fracasaron y tuvieron que ser intubados y conectados a un ventilador mecánico (3 pacientes con neumonía [75%] y uno con sepsis [25%]). El resto de los pacientes, 15 (78,95%), respondieron bien al tratamiento. No se encontraron diferencias estadísticamente significativas en edad, en género ni en los valores basales de FR, SpO2 y APACHEII entre los pacientes que respondieron favorablemente y en los que fracasó el tratamiento con CNAF (tabla 1). En términos generales, y sin distinguir entre éxito y fracaso, el soporte con CNAF produjo una disminución significativa de la FR a la segunda hora de tratamiento (FR basal 30 [28-35]; FR 2.ª hora 25 [24-30]; IC95%: 3,51-7,96; p<0,001), y aumento de la SpO2 (SpO2 basal 89% [85-91]; SpO2 2.ª hora 95% [93-96]; IC95%: −8,79 a −2,89; p=0,001). En la tabla 2 se muestran los resultados de FR, SpO2, FiO2 e IROX a la 2.ª y a la 8.ª hora de tratamiento en los pacientes con éxito y con fracaso. Los pacientes que tenían una SpO2 igual o superior al 94% (objetivo de SpO2 en nuestro estudio) a las 8h tuvieron una menor probabilidad de fracasar que los que presentaban una SpO2 inferior a 94% (OR: 0,024; IC95%: 0,001-0,497; p=0,016). Analizamos los resultados de la curva ROC para las diferentes variables respiratorias si el AUROC ≥0,75. El mejor predictor a la 2.ª hora de tratamiento fue la FR (AUROC 0,85; IC95%: 0,63-1,05; p=0,035). La FiO2 y el IROX fueron buenos predictores a las 8h (FiO2: AUROC 0,95; IC95% 0,85-1,04; p=0,007, y IROX: AUROC 0,967; IC95%: 0,886-1,047; p=0,005) (tabla 3). El análisis de la curva ROC de la FR a la segunda hora de tratamiento con CNAF nos dio un punto de corte de 29 respiraciones/min, mientras que los obtenidos con la FiO2 e IROX a las 8h fueron de 0,59 y 5,98, respectivamente (tabla 3). El VPP y el VPN para la FR fue del 60 y del 93%, respectivamente. El VPP para la FiO2 fue del 75%, mientras que el VPN fue del 93%. El VPP para IROX fue del 93% y el VPN, del 75%. Se analizó la asociación de riesgo entre los puntos de corte obtenidos de FR, FiO2 e IROX con la necesidad de VM, mediante un modelo de regresión de Cox (tabla 4). Los pacientes con una FR<29respiraciones/min a la 2.ª hora presentaron un riesgo significativamente inferior de tratamiento con VM (HR 0,103; IC95%: 0,11-0,997; p=0,05). Lo mismo se observó en los pacientes que necesitaron una FiO2<0,59 a las 8h (HR 0,053; IC95%: 0,005-0,520; p=0,012) y con los que tenían un IROX>5,98 a las 8h (HR 0,077; IC95%: 0,008-0,755; p=0,028). El análisis univariante de las posibles covariables inductoras de confusión y/o interacción (género-hombre, edad y APACHEII) dio una p>0,2 en cada una de ellas, por lo que no fueron incluidas en el modelo de regresión (tabla 5). La estancia media fue significativamente inferior en los pacientes con éxito de tratamiento (éxito 4,6±2,32días; fracaso 10,75±4,5días; IC95%: −9,51 a −2,78; p=0,001). El riesgo de mortalidad fue significativamente superior en los pacientes que fracasaron (OR 8,5; IC95%: 2,31-31,24; p=0,035) (tabla 6).
Valores de FR, SpO2, FiO2 e IROX a la 2.ª y a la 8.ª hora de tratamiento
| Variable | Éxito | Fracaso | p |
|---|---|---|---|
| FR 2.ª hora | 25 (18-32)* | 30 (25-35)* | 0,01 |
| FR 8.ª hora | 21 (15-34)* | 30 (23-35)* | 0,04 |
| SpO2 2.ª hora (%) | 95 (94-96)** | 93 (85,5-96)** | 0,11 |
| SpO2 8.ª hora (%) | 97 (95-98)** | 88 (83-93)** | 0,04 |
| FiO2 2.ª hora | 0,5 (0,47-0,6)** | 0,55 (0,48-0,9)** | 0,286 |
| FiO2 8.ª hora | 0,47 (0,44-0,5)** | 0,65 (0,65-0,91)** | 0,002 |
| IROX 2.ª hora | 7,60 (5,3-10,73)* | 5,73 (2,57-7,68)* | 0,042 |
| IROX 8.ª hora | 8,44 (6,46-13,86)* | 4,75 (2,68-7,56)* | 0,002 |
Curvas ROC de FR (2.ª hora), FiO2 (8.ª hora) e IROX (2.ª y 8.ª horas)
| Variable | AUROC | IC 95% | P. corte | Sens / Especif | p |
|---|---|---|---|---|---|
| FR 2.ª hora | 0,858 | 0,63-1,05 | 29 | 75% / 87% | 0,035 |
| FiO2 8.ª hora | 0,95 | 0,85-1,04 | 0,59 | 75% / 93% | 0,007 |
| IROX 2.ª hora | 0,767 | 0,497-1,036 | 4,98 | 100% / 50% | 0,11 |
| IROX 8.ª hora | 0,967 | 0,886-1,047 | 5,98 | 100% / 75% | 0,005 |
Estancia media y mortalidad en UCI de los pacientes con éxito y fracaso
| Resultado (n) | Estancia media (días) | IC 95% | p |
|---|---|---|---|
| Éxito (15) | 4,6±2,3210,75±4,5 | (-9,51)-(-2,78) | 0,001 |
| Fracaso (4) |
| Mortalidad de los pacientes con éxito y fracaso | ||||
|---|---|---|---|---|
| Resultado (n) | Muertes, n (%) | OR | IC 95% | p |
| Éxito (15) | 0 (0) | 8,5 | 2,31-31,24 | 0,035 |
| Fracaso (4) | 2 (50) | |||
En nuestro estudio, una FR inferior a 29 respiraciones/min a las 2h de tratamiento con CNAF o una FiO2 inferior a 0,59 y un IROX superior a 5,98 a las 8h se asociaron con éxito de la técnica y menor necesidad de VM. Es importante disponer de herramientas que nos permitan predecir el éxito o el fracaso de este tipo de soporte respiratorio, ya que un retraso en la intubación y en la VM pueden conllevar un incremento de la mortalidad, como se puso de manifiesto en el estudio de Kang et al.16. Estos autores demostraron que los pacientes que fracasaron con CNAF y que se intubaron más precozmente (en las primeras 48h en su estudio) tuvieron una menor mortalidad que los que tardaron más en intubarse (después de 48h de iniciado el tratamiento con CNAF). Uno de los efectos observados del tratamiento con CNAF en el FRA es la disminución de la FR7,17. Roca et al.15 observaron una reducción significativa de la FR en los pacientes con éxito de CNAF a las 2h de tratamiento (FR 25 [22-28]) comparados con los que fracasaron (FR 28 [22-32], p=0,023). En nuestro estudio la FR a las 2h fue significativamente inferior en los pacientes con éxito, 25 (18-32), al compararla con la FR de los pacientes que fracasaron, 30 (23-35), p=0,01. Similares resultados obtuvieron Frat et al.14 en el estudio que efectuaron en 28 pacientes con FRA hipoxémico, de los cuales 23 presentaban criterios de síndrome de distrés respiratorio agudo (SDRA). Todos los pacientes fueron tratados secuencialmente con CNAF y VMNI. Tras una hora de tratamiento con CNAF, los enfermos que presentaban una FR>30 respiraciones/min tenían una mayor probabilidad de fracasar y ser intubados (sensibilidad 94,1%, especificidad 87,5%). Maggiore et al.18, en un grupo de pacientes intubados y ventilados durante un periodo de tiempo superior a 24h y extubados con un cociente PaO2/FiO2≤300, compararon CNAF con oxigenoterapia con sistema Venturi, observando una reducción significativa de la FR a la primera hora en los pacientes tratados con CNAF (p<0,01).
A las 8h, los pacientes que recibieron una FiO2<0,59 tuvieron más probabilidades de éxito que los que fueron tratados con una FiO2>0,59. La norma general en todos los estudios es comenzar aplicando una FiO2 elevada, de 1, para conseguir un objetivo de saturación, reduciéndola posteriormente según la respuesta del paciente. Nosotros iniciamos el tratamiento con una FiO2 suficiente para alcanzar una SpO2 del 94-98%, siguiendo las recomendaciones de las guías británicas sobre oxigenoterapia. Debido al descenso gradual de la PaO2 con la edad, la cifra ideal de PaO2 se puede calcular restando a 100mmHg el producto de la edad por 0,3 (PaO2 ideal=100mmHg −0,3 ×edad). En términos de SpO2 esto se podría extrapolar a unos valores del 94-98% en la mayoría de las situaciones. El límite superior propuesto en estas guías, 98%, se establece con la idea de evitar los efectos deletéreos de la hiperoxemia, mientras que el límite inferior, 94%, cerca del límite inferior de la normalidad, asegura que la SpO2 permanezca por encima del 90% ante pequeños descensos de la SpO219. La CNAF consigue una FiO2 más estable y predecible que la oxigenoterapia convencional al aportar un flujo elevado, por encima de la tasa de flujo del paciente, lo que evita la dilución con aire ambiente y un mayor grado de mejoría de la oxigenación. Otro factor que influye en esta es el efecto PEEP conseguido con CNAF, proporcional a la tasa de flujo empleada17,20. Algunos autores observan una mejoría de la PaO2, pero no del cociente PaO2/FiO2, lo que atribuyen a un incremento de la FiO2 más que al efecto PEEP de la CNAF14. Otros autores sí objetivan mejoría del cociente PaO2/FiO2 a las 24h de tratamiento con CNAF18. Este incremento conjunto de la PaO2 y del cociente PaO2/FiO2 se puede atribuir a un efecto de reclutamiento alveolar inducido por la PEEP21. La respuesta de la PaO2 al aumento de la FiO2 depende del mecanismo responsable de hipoxemia. Si esta se debe principalmente a cocientes ventilación/perfusión bajos, la hipoxemia mejorará al incrementar la FiO2. Por otra parte, si el mecanismo responsable es el shunt, la respuesta será mínima22. Esto puede explicar la ausencia de mejoría del cociente PaO2/FiO2 en el trabajo de Frat et al.14, en el que había una considerable proporción de pacientes con SDRA. En nuestro estudio los pacientes que fracasaron, 4, necesitaron FiO2 más elevadas y presentaron SpO2 más bajas, a las 2 y a las 8h, que los pacientes que respondieron bien al tratamiento (FiO2 éxito 8.ª h: 0,47 [0,44-0,5]; FiO2 fracaso 8.ª h: 0,65 [0,65-0,91]; p=0,002; SpO2 éxito 8.ª h: 97% [95-98], SpO2 fracaso 8.ª h: 88% [83-93]; p=0,04). Tres de los 4 enfermos (75%) presentaban neumonía grave de la comunidad, una patología que puede cursar con un considerable porcentaje de shunt. Reske et al.22 relacionaron en un estudio el cociente PaO2/FiO2 con el porcentaje de shunt. Con un cociente PaO2/FiO2=200 el shunt mínimo fue del 21,3%, pudiendo llegar al 48,4%. Con un cociente PaO2/FiO2 de 100mmHg el shunt osciló entre el 36 y el 66,3%. Se sabe que cuando la fracción de shunt supera el 30% la respuesta de la PaO2 a los incrementos de la FiO2 es mínima. Además, el aporte de una FiO2 alta podría aumentar aún más el grado de desigualdad ventilación/perfusión, lo que contribuiría al empeoramiento de la oxigenación23,24. Es obvio que los 4 pacientes que fracasaron en nuestro estudio debían tener porcentajes de shunt elevados, dada la mayor necesidad de FiO2 y SpO2 más bajas, lo que podría justificar la falta de respuesta al tratamiento con CNAF.
La SpO2 mejoró significativamente con la CNAF, siendo esta respuesta evidente a las 2h. No se encontraron en ese momento diferencias significativas entre los pacientes con éxito y fracaso, pero a las 8h sí las hubo. Además, los pacientes que a las 8h mantuvieron una SpO2 igual o superior al 94% (objetivo de saturación en nuestro estudio) tuvieron una menor probabilidad de fracaso. Roca et al.15 encontraron una SpO2 significativamente más alta en los pacientes con éxito desde la segunda hora de tratamiento (97% [95-99] frente al 96% [94-98] en los pacientes con fracaso, p=0,032). Calculamos el IROX a la 2.ª y 8.ª hora, siendo significativamente más elevado, en ambas, en los pacientes con éxito (2.ª hora: 7,60 [6,58-10], frente a 5,73 [3,09-7,46], p=0,042; 8.ª hora: 8,44 [7,92-11,38] frente a 4,75 [3,01-7,04], p=0,002). Roca et al.15 encontraron una diferencia estadísticamente significativa entre los pacientes con éxito y fracaso desde la 2.ª hora de tratamiento, siendo muy significativa a las 6, a las 12 y a las 24h (p<0,001). El punto de corte calculado con la curva ROC a las 8h (5,98), en nuestra serie, se asoció con una menor necesidad de tratamiento con VM en el modelo de regresión de COX (HR 0,077; IC95%: 0,008-0,755; p=0,028). Roca et al.15 encontraron también una menor asociación de riesgo de VM en los pacientes con un IROX ≥4,88 desde la segunda hora de tratamiento. En este mismo estudio los autores calcularon el IROX asociado a fracaso de CNAF a las 2, a las 6 y a las 12h, que fue de 2,85, 3,47 y 3,85, respectivamente. ¿Cómo interpretar estos resultados? La mayoría de los pacientes se intuban a partir de las 12h de tratamiento. Por lo tanto, si un enfermo tiene un IROX a las 12h>4,88, la probabilidad es menor que si presenta un IROX <3,85. ¿Qué ocurre entre estos dos valores, 3,85 y 4,88? Es lo que los autores denominan zona gris. Los pacientes que se encuentran en esta zona deben ser manejados con sumo cuidado y controlarlos con más frecuencia. Si la tendencia del IROX es a subir, la probabilidad de éxito es mayor, pero si ocurre lo contrario, la probabilidad de intubarlos es elevada. Los valores de IROX calculados en nuestros enfermos difieren con los de Roca et al.15. Pensamos que puede ser debido al menor número de pacientes incluidos, a los diferentes tiempos de control y a las diferentes patologías tratadas en nuestra serie. La evolución del FRA en un postoperado puede diferir de la presentada en un FRA debido a una neumonía grave. Podríamos, por tanto, plantear la posibilidad de la existencia de diferentes valores de IROX según la causa del FRA. La definición de Berlín del SDRA valora la gravedad de este con el cociente PaO2/FiO2, calculado con una PEEP mínima de 5cmH2O, siendo grave si PaO2/FiO2 <100mmHg, moderado si está entre 100-200mmHg y leve si PaO2/FiO2 es de 200-300mmHg25. La PEEP alcanzada con la CNAF, a 50l/min, llega a ser de 3,81±1,33mmHg con la boca cerrada20, muy cercano a la PEEP de 5cmH2O utilizada como criterio de definición de SDRA. En nuestro estudio se incluyeron 4 pacientes con FRA hipoxémico con infiltrados pulmonares bilaterales secundarios a sepsis (fig. 1), de los cuales 3 (75%) respondieron bien al tratamiento y uno (25%) fracasó y tuvo que ser intubado por deterioro hemodinámico a las 4h. El cociente SpO2/FiO2 de los 3 pacientes que respondieron bien al tratamiento con CNAF era superior a 188, mientras que el SpO2/FiO2 del que fracasó era de 133,84 en el momento de ser intubado. Este enfermo sobrevivió y fue finalmente dado de alta del hospital. Se podía haber diagnosticado de SDRA a estos pacientes, ya que dichos infiltrados no se debían a fallo cardiaco o a sobrecarga de volumen26, pero no podemos asegurarlo al no conocer con precisión la PEEP que tenían. El SDRA, incluido en el FRA hipoxémico de novo en unas recientes guías, es una de las patologías en las que la evidencia no recomienda el uso de soporte respiratorio no invasivo27. Recientemente se ha podido demostrar que la CNAF disminuye la presión de insuflación pulmonar (driving pressure), lo que sugiere que este tipo de soporte puede reducir el estiramiento y la tensión pulmonares y el daño pulmonar autoinfligido7,28. En pacientes con SDRA ventilados mecánicamente se ha comprobado que la presión de insuflación (driving pressure) es un fuerte predictor de supervivencia, recomendando los autores mantenerla ≤13cmH2O29,30. Messika et al.31, en un estudio observacional, trataron con CNAF 45 pacientes diagnosticados de SDRA, de los cuales 18 (40%) requirieron intubación y VM. De estos, 9 (50%) fallecieron en la UCI. Observaron que el cociente PaO2/FiO2 de los pacientes que fracasaron y fueron intubados era más bajo, desde el inicio del tratamiento, que los que no precisaron VM (115,3 [84-177,1] frente a 145,3 [97,5-223,5]; p=0,26). A las 12h los pacientes que fracasaron tenían un cociente PaO2/FiO2 significativamente más bajo que los que no se intubaron (91,5 [64-129,5] frente a 124 [93-217]; p=0,02). Los autores asumieron que las presiones generadas por la CNAF a 60l/min cumplían con los criterios exigidos para diagnosticar y valorar la gravedad del SDRA según la definición de Berlín. Antonelli et al.32 observaron que los pacientes tratados con VMNI por FRA hipoxémico con un cociente PaO2/FiO2 ≤146mmHg, después de una hora de tratamiento, tenían más probabilidades de fracasar. Llama la atención que los pacientes de Messika que fueron intubados tenían cocientes PaO2/FiO2, a las 12h de tratamiento, más bajos que el valor propuesto, como indicador de fracaso, por Antonelli a la hora de tratamiento. El estudio de Messika fue comentado por Medina y Alapont33. Estos autores afirman en su escrito que la mortalidad del SDRA varía entre un 20 y un 60%, existiendo una relación entre el nivel de PEEP, el cociente PaO2/FiO2 y la mortalidad. Así, en pacientes intubados y ventilados con una PEEP>10cmH2O, si el cociente PaO2/FiO2 <150, la mortalidad es del 60,3%. Muchos intensivistas no están de acuerdo con continuar con VMNI en pacientes con SDRA si el cociente PaO2/FiO2 después de una hora de tratamiento es inferior a 175. Estos autores no comparten la idea de tratar pacientes diagnosticados de SDRA con un cociente PaO2/FiO2 <200, es decir, SDRA moderado-severo, con CNAF. Ellos opinan que si un paciente con SDRA se trata con VMNI y no se consigue, en una hora, un cociente PaO2/FiO2>175, debe ser intubado. El cociente PaO2/FiO2 valora solamente la oxigenación. El IROX propuesto por Roca et al.15 combina oxigenación (SpO2/FiO2) y trabajo respiratorio (FR). Pensamos que este índice puede ser más útil para decidir si un paciente debe ser intubado y tratado con VM.
Limitaciones del estudioEncontramos dos limitaciones en nuestro estudio. La primera es el escaso tamaño de la muestra y el haber sido efectuado en un solo centro. El análisis de asociación de riesgo entre los pacientes con una FR <29 respiraciones/min a la 2.ª hora de tratamiento, FiO2 <0,59 e IROX >5,98 a las 8h de tratamiento con la necesidad de VM, nos da un HR de 0,103 en el caso de la FR, de 0,053 en el caso de la FiO2 y 0,077 para IROX. Sin embargo, el intervalo entre el valor mínimo y máximo del IC95% es amplio. Este aspecto del análisis estadístico nos indica poca precisión de la prueba, debiéndose al reducido tamaño muestral.
Una segunda limitación la constituyen los diferentes tipos de patologías incluidos en nuestro estudio. Roca et al.15 incluyeron solo pacientes con neumonía y concluyeron que un índice ROX>4,88 a partir de las 2h de tratamiento con CNAF se asoció a éxito de la técnica. El diseño diferente de nuestro trabajo podría explicar la disparidad de resultados entre uno y otro estudio.
ConclusionesUna FR inferior a 29 respiraciones/min a la segunda hora de tratamiento y una FiO2 inferior a 0,59 e IROX superior a 5,98 a las 8h se asociaron a éxito de la CNAF en el FRA hipoxémico.
El fracaso de la técnica conlleva una mayor estancia y mortalidad en la UCI y una mayor necesidad de VM.
Hacen falta estudios prospectivos con una muestra más amplia para confirmar estos resultados.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este estudio.
AutoríaRafael Artacho Ruiz: coordinador del estudio, revisión base de datos, búsqueda bibliográfica, análisis estadístico.
Belén Artacho Jurado: búsqueda bibliográfica, elaboración del manuscrito, análisis estadístico.
Francisco Caballero Güeto: búsqueda bibliográfica, elaboración del manuscrito, revisión base de datos.
Ángela Cano Yuste: análisis estadístico.
Ignacio Durbán García: búsqueda bibliográfica, elaboración del manuscrito, revisión base de datos.
Francisco García Delgado: búsqueda bibliográfica, elaboración del manuscrito, revisión base de datos.
José Antonio Guzmán Pérez: búsqueda bibliográfica, elaboración del manuscrito, revisión base de datos.
Manuel López Obispo: búsqueda bibliográfica, elaboración del manuscrito.
Isabel Quero del Río: búsqueda bibliográfica, elaboración del manuscrito.
Francisco Rivera Espinar: búsqueda bibliográfica, elaboración del manuscrito, revisión base de datos, análisis estadístico.
Emilio del Campo Molina: búsqueda bibliográfica, elaboración del manuscrito, revisión base de datos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses para la realización de este estudio.
Queremos expresar nuestro agradecimiento al Dr. José María Guzmán Jiménez, UW School of Aquatic and Fishery Sciences, University of Washington, EE.UU., por su ayuda en la redacción del texto en inglés.