PREVALENCIA DE LA ANEMIA DEL PACIENTE CRÍTICO
La presencia de anemia es la anomalía hematológica y analítica más frecuente entre los pacientes médicos y quirúrgicos ingresados en las Unidades de Cuidados Intensivos (UCI). Según algunos estudios recientes el nivel medio de hemoglobina del paciente crítico a su ingreso en la UCI es de unos 11 g/dl, con una prevalencia de anemia del 65% (hasta un 30% con hemoglobina [Hb] <10 g/dl), que aumenta hasta casi el 90% al alta1-4.
Generalmente, la presencia de anemia y su gravedad se definen mediante la determinación de la hemoglobina o el hematocrito. Sin embargo, en el paciente crítico existen muchos factores que pueden hacer cambiar rápidamente el valor de estos parámetros, de tal forma que la presencia de anemia debe interpretarse en relación con la fisiopatología y terapéutica concurrentes. Así, unas veces la aparición de la anemia del paciente crítico (APC) es anterior al ingreso en la UCI y otras es un síntoma o comorbilidad de la patología médica o quirúrgica que ha provocado el ingreso, y su evolución dependerá en gran medida de la patología subyacente, pero la mayoría de las veces ésta es de origen multifactorial. En cualquier caso, la anemia, junto con las alteraciones de la funcionalidad de los eritrocitos circulantes5, puede alterar la eficiencia del aporte de oxígeno, siendo una de las principales causas de morbilidad y mortalidad en estos pacientes, no sólo al ingreso, sino particularmente durante su estancia en la UCI6. Por ello es necesario conocer su etiopatogenia para su prevención, la realización de un diagnóstico correcto y la implementación de un tratamiento adecuado para evitar o reducir sus efectos deletéreos.
ERITROPOYESIS
Para una mejor comprensión de la etiopatogenia y el tratamiento de la APC revisaremos brevemente algunos aspectos de la eritropoyesis. La «eritrona», definida como la totalidad de elementos eritroides en todos los estadios madurativos de desarrollo, constituye un ejemplo de división dinámica. La célula madre pluripotencial (CFU-S) se diferencia en una parte a células precursoras eritroides formadoras de colonias (BFU-E) y éstas a unidades formadoras de colonias eritroides (CFU-E), por medio de divisiones que van de 7 a 14 días, y después por medio de tres divisiones se suceden los proeritroblastos, eritroblastos y reticulocitos, que posteriormente ya en el torrente circulatorio se diferencian en eritrocitos maduros7. Para que este proceso ocurra a la velocidad adecuada (cada segundo se renuevan unos 2-3 millones de eritrocitos) es necesario el estímulo de la eritropoyetina y de algunas citocinas, así como el aporte de materiales plásticos (hierro, vitaminas B6 y B12, ácido fólico, etc.).
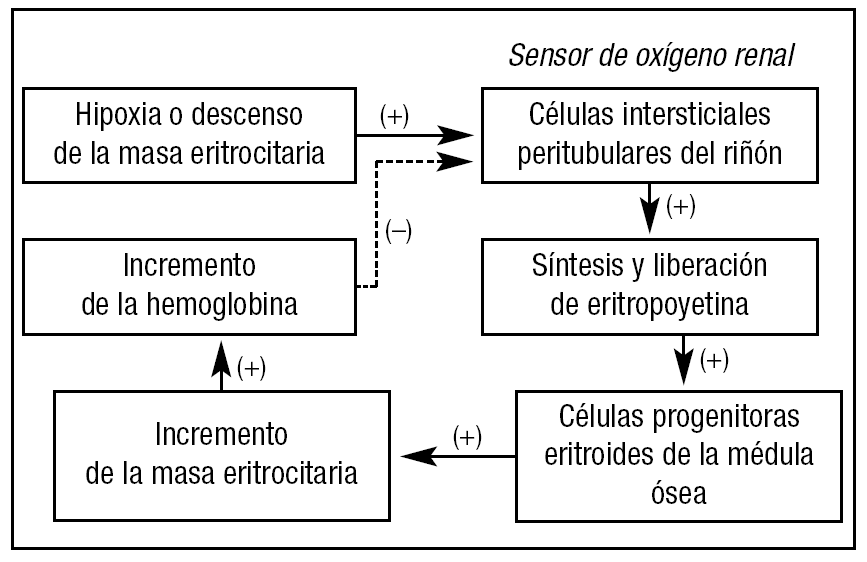
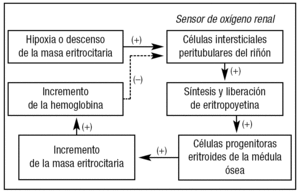
La eritropoyetina (EPO) es una glucoproteína producida fundamentalmente (90%) por las células peritubulares intersticiales del riñón. El hígado produce una pequeña cantidad que no es suficiente para suplir el déficit de EPO endógena que se produce cuando cesa la producción renal en el caso de insuficiencia renal. La EPO es un factor de crecimiento eritropoyético, con unos niveles normales que oscilan entre 5 y 30 mU/ml. Su producción endógena está regulada por la hipoxia tisular y, a su vez, ésta depende de factores tan variados como la presión parcial de oxígeno en el aire, el estado cardiocirculatorio del paciente o la capacidad de disociación del oxígeno de la hemoglobina. Es decir, la producción de EPO endógena va a depender de todos aquellos factores que influyen sobre la disponibilidad de oxígeno por los tejidos periféricos8,9 (fig. 1).
Figura 1. Regulación de la síntesis y liberación de eritropoyetina endógena. (+): estimulación; (-): inhibición.
La EPO ejerce sus efectos mediante la interacción con receptores específicos localizados en la membrana citoplasmática de los progenitores eritroides manteniendo su viabilidad y evitando la apoptosis, lo que promueve su supervivencia, proliferación y diferenciación y, por tanto, el aumento de la masa eritrocitaria. El aumento de eritrocitos circulantes, a su vez, incrementa la capacidad transportadora de oxígeno de la sangre y disminuye el estímulo hipóxico, lo que induce un decremento de la síntesis y secreción de eritropoyetina endógena10-12. Es decir, se establece un circuito completo de retroalimentación que regula la expresión génica de la eritropoyetina endógena y la producción de hematíes (fig. 1).
En lo que respecta al aporte de materiales plásticos o nutrientes, quizás es el hierro (Fe) el que presenta un mecanismo de utilización más complejo, al que dedicaremos los siguientes párrafos. El Fe, procedente de la dieta o administrado por vía oral, se absorbe en el duodeno en forma de hierro heme y no heme a través de la membrana apical del enterocito. Esta absorción se produce en cantidad de 1-2 mg/día que vienen a cubrir las pérdidas diarias, salvo en mujeres en edad fértil en las que las necesidades son de 3 mg/día, y está regulada por las necesidades de Fe del organismo, la eritropoyesis y la hipoxia. El Fe en el enterocito puede seguir dos caminos. Una pequeña parte se almacena unida a la ferritina y el resto atraviesa la membrana basolateral del enterocito con el concurso de la ferroportina 1 para alcanzar la circulación y unirse a la transferrina (Tf)13. El destino natural del complejo Tf-Fe es ser captado por las células eritroides inmaduras, a través de los receptores de Tf localizados en su membrana plasmática, donde se aprovecha en su mayor parte para la síntesis de la Hb y formación de nuevos eritrocitos, y una pequeña cantidad se almacena en la proteína ferritina.
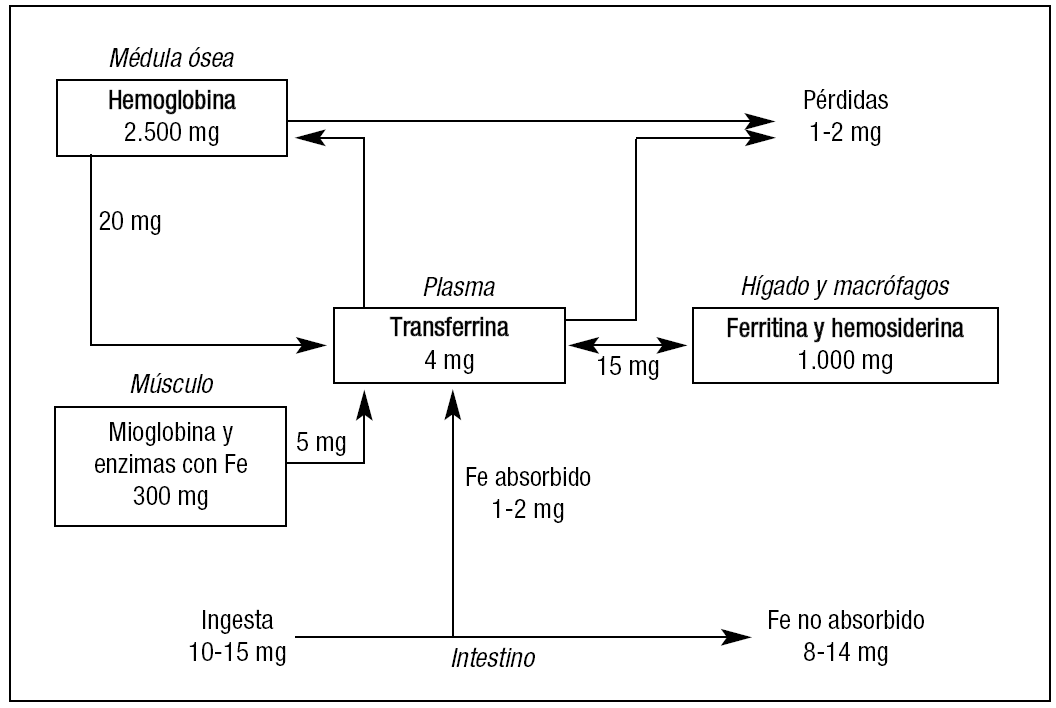
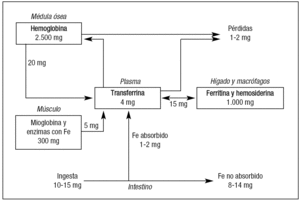
A los 120 días de su entrada en circulación los eritrocitos son inexorablemente fagocitados por los macrófagos del bazo, hígado o médula ósea, donde se cataboliza el heme y libera Fe que se almacena en la ferritina. Desde este depósito y también mediante el concurso de la ferroportina 1, atraviesa la membrana del macrófago y se incorpora a la Tf, que lo lleva nuevamente a la médula ósea. Esta vía de reciclaje del Fe es indispensable, ya que los requerimientos diarios de la eritrona son de unos 20-30 mg de Fe, mientras que la absorción intestinal del mismo es tan sólo de 1-2 mg/día, como ya se ha indicado13. Vemos pues que la vía interna del recambio del Fe es un flujo unidireccional desde la transferrina del plasma a la eritrona, de ésta al macrófago y regreso a la transferrina y que, aunque la cantidad de Fe unido a Tf es muy pequeña (3-4 mg), ésta representa el pool dinámico más importante del metabolismo férrico (fig. 2).
Figura 2. Principales rutas de distribución y almacenamiento del hierro en humanos. Modificada de Muñoz et al3. Fe: hierro.
ETIOPATOGENIA DE LA ANEMIA DEL PACIENTE CRÍTICO
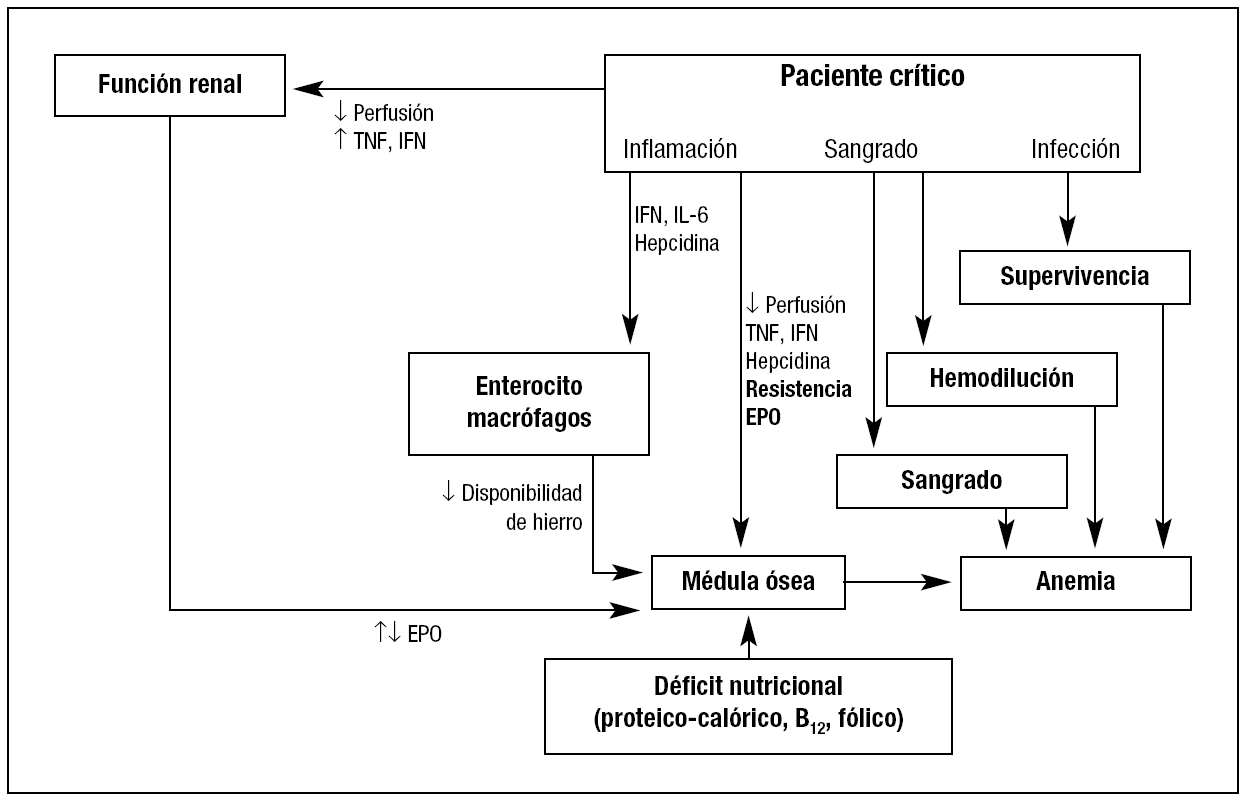
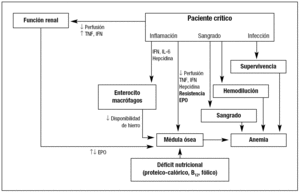
Como se ha indicado arriba, habitualmente la APC presenta una etiología multifactorial (fig. 3), en la que pueden intervenir la pérdida de sangre por traumatismos, cirugía o hemorragia gastrointestinal, sin olvidar las hemorragias intramusculares, pleurales y peritoneales, las cuales pueden ocurrir con motivo de la colocación de un catéter central o la práctica de una punción biópsica. La hemorragia puede ocasionar una disminución de la perfusión renal (alteración de la producción de EPO) y de la médula ósea (alteración de la proliferación). Apartado especial ocupan las pérdidas debidas a extracciones sanguíneas repetidas para determinaciones analíticas diversas, y cuya trascendencia es frecuentemente mal valorada («vampirismo»). Smoller y Kruskall14 comprobaron que la extracción de sangre para análisis en los pacientes de UCI es superior a 40 ml/día, frente a los 12 ml/día que se extraían en los pacientes de planta. Posteriormente, Corwin et al15 relacionaron directamente con las flebotomías para análisis el 30% de todas las transfusiones en UCI. La situación no parece haber cambiado mucho, puesto que en el estudio ABC, Vincent et al1 comprueban que en las UCI europeas la extracción diaria de sangre con fines diagnósticos se sitúa en 40-70 ml; esto es, se extrae el equivalente a un concentrado de hematíes cada 7-10 días. No obstante, la mayor extracción de sangre se produce durante las primeras 24-48 horas del ingreso en UCI y desciende progresivamente en los pacientes que requieren de una estancia prolongada en la Unidad1,16.
Figura 3. Etiopatogenia de la anemia en el paciente crítico. EPO: eritropoyetina; IL-6: interleucina 6.
La hemólisis, aparece tanto por causas inmunológicas (generalmente secundaria a reacciones adversas transfusionales, especialmente en el paciente politransfundido) o no inmunológicas que aumenten la destrucción de hematíes, como la sepsis que induce a un acortamiento de la vida media por diseritropoyesis y alteraciones de la membrana eritrocitaria, la presencia de hipertensión portal o el hiperesplenismo, la existencia de válvulas cardíacas con un defecto funcional o protésicas, el uso de circuitos extracorpóreos o la inyección rápida de soluciones hipotónicas17.
Dados los profundos cambios hemodinámicos e hidroelectrolíticos que pueden sufrir los pacientes críticos, la APC puede ser relativa a un fenómeno de hemodilución, frecuente en el fallo renal agudo, la insuficiencia cardíaca congestiva o tras la simple elevación de la volemia por excesiva administración de fluidos (cristaloides y/o coloides), especialmente durante la reposición de pérdidas hemáticas o durante la anestesia. Anemia más hemodilución pueden acontecer paralelamente, agravándose entonces el defecto celular17.
Los pacientes críticos presentan defectos en la secreción y/o mala utilización de EPO. Por ello, aunque debe evitarse la hipoxia, no se aconseja la oxigenación excesiva mantenida, ya que ésta frenaría la producción y liberación de EPO, tal como lo hace la propia transfusión sanguínea. De otra parte, existen una serie de citocinas proinflamatorias con efecto inhibitorio sobre la eritropoyesis entre las que se encuentran el factor de necrosis tumoral, el interferón gamma y la interleucina-1, que al ser liberados durante la sepsis, pancreatitis, traumatismos y cirugía, inducen un descenso en la producción de EPO; esto es, se produce una secreción de EPO inapropiada para el grado de anemia16,18,19. Recientemente, Elliot et al20 han descrito la presencia de niveles elevados de EPO e interleucina-6 durante la fase aguda de la enfermedad crítica (3 primeros días) en pacientes con fracaso renal agudo (FRA). Sin embargo, los niveles de EPO descendieron rápidamente y durante la fase crónica no fueron diferentes de los observados en pacientes sin fracaso renal. Por el contrario, durante todo el período de estudio, los niveles de interleucina-6 fueron más altos en los pacientes con FRA que en los pacientes sin FRA. Estos resultados sugieren que, al menos durante la fase aguda, en el paciente crítico con FRA, más que la producción, disminuye la acción de la EPO sobre los progenitores eritroides y que la administración de dosis farmacológicas de eritropoyetina recombinante (rHuEPO) debería realizarse en la fase crónica de la enfermedad.
Tanto la inflamación como la sepsis van a provocar una disminución de la disponibilidad de hierro al inhibir la absorción intestinal del mismo (inhibición de la ferroportina-1), aumentar su captación y almacenamiento por los macrófagos (aumento de ferritina) e inhibir su liberación desde el macrófago y el hígado a la transferrina (inhibición de la ferroportina-1). La inhibición de la ferroportina 1 es causada por la hepcidina, una proteína de fase aguda producida por el hígado en respuesta a la IL-613. Además, algunas citocinas modulan los niveles de ferritina, por una vía no Fe-dependiente, ocasionado un aumento de la síntesis de ferritina en caso de inflamación21, mientras que durante la sepsis se produce una rápida disminución del contenido en ácido sálico de la transferrrina, que disminuye tanto su estabilidad como su funcionalidad22. Es decir, el Fe se quedaría acantonado en estas células y no estaría disponible para la eritropoyesis.
El déficit de folatos y vitamina B12 también puede estar presente, al igual que el de cobre y zinc, aunque con menor frecuencia23,24. Habría que indicar también que su déficit es frecuente en pacientes programados para cirugía, aumenta con la edad, se agrava tras cirugía gástrica, hepática o intestinal, y se asocia al uso fármacos como la metformina, septrim o antimetabolitos y con el consumo de alcohol.
Finalmente, dado el papel específico del óxido nítrico como mediador de la función hematopoyética, su empleo como gas anestésico o su liberación masiva en la sepsis favorecería un viraje megaloblástico de la médula ósea por bloqueo de la síntesis de ADN17. Algunos fármacos, como los inhibidores de la enzima de conversión de la angiotensina (IECA), también han sido implicados en el desarrollo de anemia al reducir la liberación de EPO25.
En resumen, aunque todos los mecanismos etiopatogénicos son posibles en la APC, las pérdidas de sangre y la disminución de la eritropoyesis, por mecanismos prácticamente superponibles a los de la anemia de trastorno crónico, son los más frecuentes.
TRATAMIENTO DE LA ANEMIA DEL PACIENTE CRÍTICO
A diferencia de otros profesionales médicos, el intensivista corrige su punto de mira ante la anemia del paciente crítico correctamente controlado, donde una cifra reducida de hematíes al disminuir la viscosidad sanguínea induce cambios reológicos que en el ámbito de la microcirculación favorecen la oxigenación celular. A estos cambios reológicos, habría que añadir el efecto estimulador del descenso de la masa eritrocitaria sobre la producción de eritropoyetina17. De hecho, cuando se analiza la evolución de los pacientes críticos, se observa que a medida que aumenta su tiempo de estancia en UCI, la mayor parte de los que sobreviven presentan una anemia con niveles de hemoglobina en torno a los 10 g/dl1. Pero, por otra parte, se ha descrito alteración en los eritrocitos circulantes de los pacientes críticos que afectan a su estructura (por ejemplo, disminución del contenido de ácido sálico y de glucoforina de la membrana, tendencia a la esfericidad y disminución de la deformabilidad), funcionalidad (por ejemplo, cambios en la concentración de 2,3-difosfoglicerato) y supervivencia (reducción de 120 a 90 días), que pueden alterar el transporte de oxígeno5. Por ello, frente al aparente efecto favorable de la APC moderada, se debe tener siempre presente que la APC grave ocasiona defectos en la oxigenación tisular, que desempeñan un papel importante en la patogenia del fallo multiorgánico como causa de muerte en el paciente crítico, y por tanto debe evitarse y/o tratarse17,26.
Para evitar el desarrollo y/o agravamiento de la APC, además de la resolución más rápida posible del problema que originó el ingreso del paciente en la UCI, muy posiblemente una de las medidas más eficaces sea la de reducir las pérdidas sanguíneas (por ejemplo, limitando las extracciones de sangre con fines diagnósticos, disminuyendo las pérdidas por sangrado quirúrgico mediante un tratamiento agresivo de las alteraciones de la hemostasia, reduciendo las pérdidas gastrointestinales por úlceras de estrés o gastritis erosiva, etc.). En cuanto al tratamiento de la APC, además de la administración de transfusión de sangre alogénica (TSA), debe considerarse el tratamiento farmacológico con hierro intravenoso y eritropoyetina humana recombinante (rHuEPO).
Transfusión de sangre alogénica
Para evitar los efectos deletéreos de la APC, un 40% de estos pacientes suelen ser transfundidos, elevándose esta cifra al 70% si la estancia en UCI supera los 7 días1,2,4,27. La TSA suele prescribirse cuando la concentración de hemoglobina desciende de un cierto nivel (umbral transfusional), a menudo fijado entre 7 y 10 g/dl, según se aplique una política transfusional liberal o restrictiva o en función de la presencia o no de disfunción orgánica.
El razonamiento teórico sobre el que se asienta la política transfusional liberal es bastante directo: el incremento de las concentraciones de hemoglobina mejoraría el aporte de oxígeno a los tejidos y así optimizaría la función de los órganos1. Sin embargo, a partir de los resultados del trabajo de Hébert et al28 parece concluirse que una estrategia transfusional restrictiva (empleo de un umbral transfusional de 7 g/dl de hemoglobina con mantenimiento de una hemoglobinemia de 7-9 g/dl) resultaría al menos tan efectiva, si no superior, a una liberal (umbral transfusional 10 g/dl, con rango de mantenimiento entre 10-12 g/dl de Hb) en los pacientes críticos en normovolemia. La posible excepción serían los pacientes con procesos isquémicos agudos (umbral de transfusión: Hb < 9 g/dl), como se ha demostrado en un posterior análisis de los datos del subgrupo de pacientes cardíacos de este estudio29, y los pacientes en la fase inicial de la sepsis grave (umbral de transfusión: Hb <10 g/dl, si saturación venosa central de oxígeno < 70%)30.
Por ello, pese a las posibles ventajas teóricas de un criterio liberal de la transfusión sanguínea, parece que son más los beneficios de la aplicación de un criterio restrictivo (hemoglobina tolerable)28. Además, los datos de diversos estudios en pacientes ingresados en UCI parecen indicar que la morbilidad y mortalidad son aún menores en los pacientes no transfundidos1,2,31-33. En un estudio realizado en las UCI europeas se constató que, con un umbral de transfusión de 8,5 g/dl de Hb, el 37% de los pacientes son transfundidos, y en éstos se produjo una recuperación más lenta de la funcionalidad de los órganos, una estancia más larga y una mayor mortalidad. Así, la tasa de mortalidad fue del 30% en los pacientes no transfundidos frente al 50% en los transfundidos1. Por otra parte, en un estudio norteamericano no sólo se observó un aumento de mortalidad en los pacientes transfundidos, sino que este efecto era además dosis-dependiente (odds ratio: 1,48 para 1-2 unidades de TSA, 2,62 para 3-4 unidades, 4,01 para más de 4 unidades)2.
Los mecanismos por los que la TSA puede aumentar la morbimortalidad de los pacientes críticos son diversos, pero destacaríamos el efecto inmunomodulador (TRIM), la producción de daño pulmonar agudo (transfusion-related acute lung injury [TRALI]), la sobrecarga circulatoria (transfusion-associated circulatory overload [TACO]) y las alteraciones de la microcirculación, aunque no siempre es posible individualizar la contribución de cada uno de ellos34. Respecto al efecto TRIM (transfusion-related immunomodulation), los resultados de tres estudios incluyendo más de 1.700 pacientes sometidos a cirugía cardíaca muestran que la TSA se asocia con una mayor incidencia de neumonía nosocomial, mediastinitis y sepsis, que este efecto es dependiente del número de unidades de concentrado de hematíes transfundidas y del tiempo de almacenamiento de las mismas, y que también pueden estar implicados otros componentes sanguíneos31-33. Igual parece ocurrir en pacientes sometidos a cirugía oncológica, en los que, además, la TSA se asocia con un aumento de la recurrencia del tumor35,36.
El TRALI es un efecto adverso grave, bien caracterizado clínicamente, aunque aún se discute su etiología (anticuerpos del donante, lípidos y citocinas presentes en el producto transfundido, estado inmunológico del receptor, etc.) y uno de los principales responsables de mortalidad por transfusión37. De acuerdo con los estudios epidemiológicos realizados su incidencia es 1:4.000 unidades de concentrado de hematíes, 1:8.000-19.000 unidades de plasma y 1:400-1.200 unidades de plaquetas38,39. Sin embargo, probablemente sea una reacción transfusional infradiagnosticada ya que, en pacientes sin daño pulmonar agudo previo a la transfusión, el diagnóstico de TRALI requiere de:
1. La aparición de daño pulmonar caracterizado por un comienzo agudo, hipoxemia e infiltrado pulmonar bilateral, sin evidencia de sobrecarga circulatoria.
2. Que se produzca durante la transfusión o en las 6 horas siguientes a la finalización de la misma.
3. Que no existan otros factores de riesgo de daño pulmonar agudo37.
En relación con el pronóstico existen dos claras diferencias entre TRALI y el daño pulmonar agudo de otra etiología: el TRALI es generalmente transitorio, recuperándose los niveles pretransfusionales de presión arterial de oxígeno a las 48-96 horas del inicio del episodio, y la mortalidad en los casos de TRALI diagnosticados se sitúa en torno al 5-10%, claramente inferior al 40% observado en el daño pulmonar agudo de otra etiología37,40.
La TACO es una complicación de la TSA asociada a sobrecarga de volumen y, por lo tanto, tiene su causa en la alteración del gradiente hidrostático a nivel circulatorio/alveolar y su presentación es común a otras causas de edema hidrostático pulmonar. Tiene una incidencia < 1% en los estudios de hemovigilancia, pero aumenta hasta el 8% en pacientes ancianos sometidos a cirugía y hasta el 11% en pacientes críticos. Las manifestaciones clínicas y radiológicas de TRALI y TACO son similares. La ecocardiografía y la determinación del péptido natriurético atrial (BNP) pueden ayudar en el diagnóstico diferencial, pero a veces es necesaria la realización de pruebas invasivas, tales como la cateterización del ventrículo derecho o la determinación de proteínas en el fluido alveolar. Además, en el paciente crítico, la distinción entre TRALI y TACO es difícil, en parte porque ambas entidades pueden coexistir. Excluido el TRALI (edema por aumento de la permeabilidad capilar), habrá que realizar el diagnóstico diferencial con el edema pulmonar hidrostático de origen cardíaco (cambios en el electrocardiograma y niveles de troponina)41.
Por tanto, la administración de TSA a pacientes críticos debe restringirse, o mejor evitarse, pero instaurando un tratamiento farmacológico de la APC para no exponer a los pacientes a los riesgos de la anemia grave, a la vez que se promueve una más rápida recuperación y rehabilitación funcional42.
Estimulación de la eritropoyesis
Eritropoyetina humana recombinante
Como ya se ha comentado, la eritropoyesis se encuentra disminuida en el posoperatorio de los pacientes quirúrgicos, en los pacientes críticos y en los politraumatizados19,43,44. Sin embargo, la médula ósea de estos pacientes puede responder a la rHuEPO, por lo que se ha evaluado la efectividad de su administración como alternativa a la TSA y sus complicaciones.
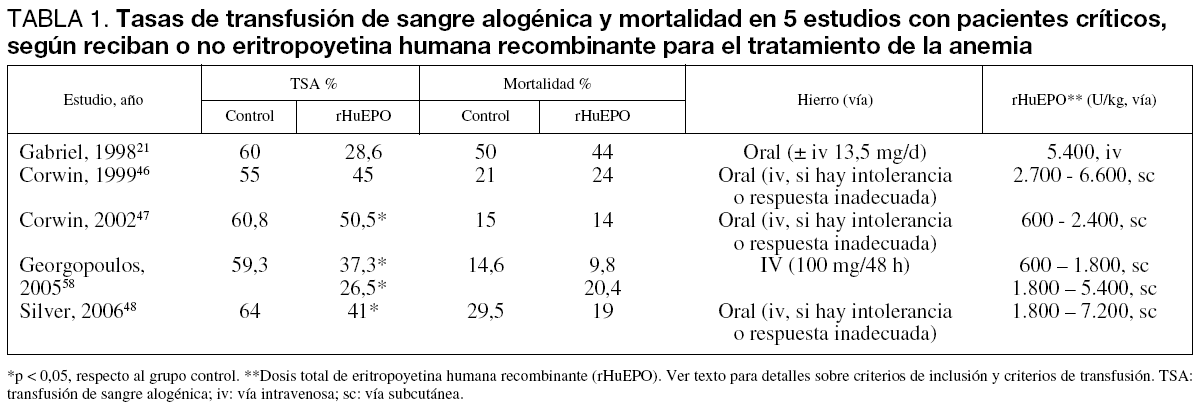
Un estudio no controlado analizó el papel de la rHuEPO en el tratamiento de la anemia posoperatoria grave (hematocrito < 25%) en 20 pacientes Testigos de Jehovah ingresados en UCI45. Veinte de ellos, con un hematocrito medio del 15,8%, recibieron 3 dosis de rHuEPO (300 UI/kg) intravenosas durante la primera semana, seguidas de otras 3 dosis de 150 UI/kg durante las dos semanas siguientes (n = 13), o 6 dosis de 100 UI/kg en las dos primeras semanas (n = 7). Un grupo histórico de 20 pacientes con un hematocrito medio del 12,5% y que no habían recibido rHuEPO sirvió de grupo control. Se observó que en el grupo de pacientes gravemente anémicos sin tratamiento los valores del hematocrito no se modificaron durante la primera semana y subían hasta el 17,8% en la segunda, mientras que en el grupo tratado con rHuEPO éstos se elevaban hasta el 19,3% en la primera semana y hasta el 22,5% en la segunda. La tasa de mortalidad fue inferior en el grupo tratado (15%) que en el grupo control (40%), aunque el reducido número de pacientes no permitió extraer conclusiones a este respecto45.
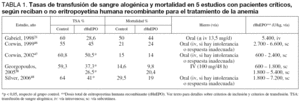
El primer estudio aleatorizado y controlado se realizó sobre 19 pacientes críticos con disfunción multiorgánica que recibieron rHuEPO (3 x 600 UI/kg/ semana) (n = 9) o placebo (n = 10), más hierro, ácido fólico y vitamina B12 durante tres semanas19. Los pacientes recibían TSA para mantener una hemoglobina > 10 g/dl. El tratamiento con rHuEPO produjo una estimulación de la eritropoyesis, objetivada por un recuento de reticulocitos significativamente aumentado (1,9% frente a 4,0%, para placebo y rHuEPO, respectivamente; p < 0,05), así como una disminución de la tasa de transfusión y de la duración de la estancia hospitalaria (54 ± 33 frente a 24 ± 11 días, respectivamente), aunque estas diferencias no fueron significativas (tabla 1).
Posteriormente se han realizado varios ensayos clínicos aleatorizados y controlados más amplios. En el primero, Corwin et al46 incluyeron 160 pacientes que fueron divididos en dos grupos de 80 y que recibieron placebo o EPO (300 UI/kg/día), diariamente desde el día 3 hasta el día 7 y después en días alternos. El objetivo del tratamiento era alcanzar un hematocrito del 38% y, para ello, éste se mantuvo como mínimo hasta el día 15 o el alta, si ésta se producía antes, y como máximo hasta las 6 semanas. La administración de TSA dependía únicamente del criterio del médico. En relación con el grupo placebo, en el grupo tratado un 22% menos de pacientes recibió TSA (55% frente a 45%), y un 84% menos de unidades de concentrado de hematíes (305 frente a 166 U) y alcanzó un hematocrito más alto (35 ± 5% frente a 31 ± 4), aunque no hubo diferencias en la mortalidad entre ambos grupos (21 frente a 24%) (tabla 1).
Muchos de estos autores participaron en un subsiguiente ensayo clínico aleatorizado incluyendo 1.302 pacientes, divididos en dos grupos: EPO 40.000 UI/ semana, con un máximo de tres dosis (n = 650) o placebo (n = 652), y el criterio de transfusión fue una hemoglobina < 9 g/dl con o sin sintomatología clínica47. Los resultados de este estudio apuntan en la misma dirección: un aumento de la hemoglobina y un descenso del número de pacientes transfundidos y del número de unidades, pero sin cambios en la morbimortalidad (tabla 1). Sin embargo, un análisis por subgrupos reveló que el tratamiento con rHuEPO redujo la mortalidad en aquellos pacientes con APACHE II ≤ 20 (OR 0,57; IC 95% 0,38-0,89), en los ingresados por traumatismo (OR 0,43; IC 95% 0,23-0,81) y hubo una tendencia a una menor mortalidad en los menores de 55 años (OR 0,80; IC 95% 0,50-1,29)47. No obstante, estos resultados no son superiores a los obtenidos por Hébert et al28 en este mismo tipo de pacientes utilizando un criterio restrictivo de transfusión (Hb < 7 g/dl). Además, un somero análisis de costes muestra que, sin evaluar otros posibles beneficios, el gasto ocasionado por la administración de 3 dosis de rHuEPO (1.200 dólares) sólo revertiría en el ahorro de una unidad de sangre alogénica (300-400 dólares). En nuestro medio sería necesario realizar estudios de coste-efectividad en nuestra práctica clínica habitual, teniendo en cuenta los costes derivados del uso de las diversas alternativas, así como el de las complicaciones que se producen con cada una de ellas.
Un último trabajo de este grupo realizado en pacientes críticos de larga estancia en UCI, y en el que se prolongó el tratamiento con rHuEPO (40.000 UI/ semana) hasta 12 semanas, obtuvo resultados similares; esto es, la disminución del porcentaje de pacientes transfundidos, pero no de la morbilidad o mortalidad48 (tabla 1). Estos resultados parecen indicar que, probablemente, sea necesario realizar una selección de los pacientes, delimitar los objetivos a alcanzar y racionalizar los tratamientos coadyuvantes si queremos que el incremento de costes que supone la administración de rHuEPO redunde en una reducción de la morbimortalidad de éstos. Además, el tratamiento con rHuEPO no tiene indicación aprobada para el paciente crítico y no es totalmente inocuo, ya que se han descrito casos de aplasia de células rojas por anticuerpos anti-EPO en pacientes tratados con rHuEPO49.
Utilización de hierro intravenoso
Todas las preparaciones de hierro intravenoso tienen en común el poseer un núcleo central de hierro elemental recubierto por una capa de carbohidratos. La velocidad de degradación de estos complejos guarda una relación inversa con el peso molecular de los mismos, de modo que hierro dextrano (90-265 kDa) < hierro sacarato (43 kDa) < hierro gluconato (37 kDa). Es este un aspecto importante, ya que va a determinar la dosis a administrar13. Si se administra una dosis excesiva de hierro intravenoso existe el peligro de que el hierro pueda liberarse del complejo con demasiada rapidez y sobrepase la capacidad de la Tf para unirlo (sobresaturación). Esto puede dar lugar a reacciones por «hierro libre» de naturaleza anafilactoide. Aunque los signos y síntomas de estas reacciones son muy similares, no deben confundirse con las reacciones anafilácticas, mucho más graves y con riesgo de muerte, que se producen en una pequeña proporción de pacientes tratados con hierro dextrano. Esta última complicación es específica del hierro dextrano y es debida a una reacción del sistema inmune mediada por anticuerpos anti-dextrano50,51. Por el contrario, el hierro gluconato y el hierro sacarato presentan un excelente perfil de seguridad, pudiendo este último administrarse a dosis de hasta 300 mg en dos horas50,51.
Es bien conocido que en los pacientes críticos (quirúrgicos o médicos) se produce un estado de disponibilidad reducida de hierro, que aumenta con el tratamiento con EPO y que es difícilmente corregible mediante ferroterapia oral13,52,53. En un estudio realizado sobre 131 pacientes médicos y quirúrgicos de la UCI y Recuperación del Hospital Clínico Universitario Virgen de la Victoria, encontramos que hasta un 76% de los pacientes presentaban anemia (33% con Hb < 10 g/dl), hierro sérico < 45 µg/dl en el 69%, saturación de Tf < 20% en el 53%, receptor soluble de transferrina (sTfR) > 1,9 en el 18%, ferritina < 100 ng/ml en el 23% y proteína C reactiva (PCR) > 0,5 mg/dl en el 88%. Esto es, un 50% de los pacientes ingresados en la UCI presenta una anemia que se cataloga como anemia de trastorno crónico (Fe bajo, volumen corpuscular medio normal, ferritina normal o alta). Una parte de ellos (13%) presentaban además una ferropenia evidente (sTfR > 2,3), con o sin inflamación3. Esto es, al menos la mitad de los pacientes podrían beneficiarse de la terapia con hierro intravenoso, especialmente si van a recibir rHuEPO3. En este sentido, MacDougall50 afirmaba no hace mucho que «todavía no existe una prueba de laboratorio para determinar la deficiencia de hierro que sea absolutamente fiable; la utilidad del hierro oral es limitada; y es necesario administrar hierro intravenoso de forma regular y frecuente a la mayor parte de los pacientes tratados con rHuEPO».
Los argumentos teóricos contra la administración de hierro intravenoso en pacientes críticos, especialmente en los sépticos, se han elaborado a partir de los resultados de estudios in vitro que sugerían que la acumulación de hierro en las células del sistema inmune podría disminuir las defensas del huésped. La relevancia clínica de esta hipótesis es incierta, pero tampoco conocemos la relación riesgo-beneficio de la administración de hierro intravenoso en estos pacientes.
Van Iperen et al54 compararon la eficacia de la administración de hierro sacarato intravenoso (30 mg/día), solo (n = 12) o en combinación con EPO (n = 12), en el tratamiento de la anemia en pacientes críticos. Los resultados de este trabajo muestran que, en comparación con el grupo control que sólo recibió ácido fólico (n = 12), ambos tratamientos muestran una tendencia a la reducción de los requerimientos transfusionales de estos pacientes. Sin embargo, aunque la respuesta eritropoyética fue mejor en el grupo tratado con fólico + hierro + EPO, como se desprende de la elevación del recuento de reticulocitos y de los niveles de receptor soluble de Tf, en comparación con el grupo tratado con fólico + hierro, no hubo diferencias significativas en cuanto a la reducción de las necesidades transfusionales ni en los valores de Hb al alta (día 21). Esta aparente contradicción puede ser debida a que el hierro se administró durante 14 días (20 mg/día) y la EPO sólo en días alternos durante 9 días (5 dosis de 300 UI/kg), con lo que las diferencias en la estimulación de la eritropoyesis sólo se mantienen hasta el día 15 del estudio.
Por otra parte, el déficit funcional de hierro que presentan muchos de los pacientes ingresados en UCI puede condicionar no sólo una disminución de la eritropoyesis, sino también una respuesta inmunológica inapropiada55,56. De hecho, los episodios de síndrome de respuesta inflamatoria sistémica presentan una mayor duración en los pacientes con déficit funcional de hierro, lo que condiciona una estancia más larga en la UCI y una mayor morbilidad57. Por ello, es posible que la corrección de dicho déficit mediante la administración de hierro intravenoso no sólo contribuya a una mejora de los valores hematimétricos y a un descenso de los requerimientos transfusionales, sino que mejore la respuesta inmune y, probablemente, disminuya la morbimortalidad y la duración de la estancia en UCI de estos pacientes. Así, en el estudio de Van Iperen et al54 en el grupo tratado con hierro intravenoso se observó una disminución de la respuesta inflamatoria del paciente, cuantificada por el descenso de los niveles de PCR y el aumento de los de transferrina, así como una menor mortalidad. Sin embargo, en el grupo tratado con hierro iv y EPO estos efectos no fueron tan evidentes, posiblemente debido a la persistencia del déficit funcional de hierro a causa de la estimulación de la eritropoyesis inducida por la EPO. De estos datos se desprende la necesidad de asegurar un suministro adecuado de hierro a los pacientes que estén recibiendo tratamiento con EPO; suministro que sólo puede garantizarse mediante la administración parenteral de hierro.
Recientemente, Georgopopulos et al58 compararon la eficacia de la administración de hierro sacarato intravenoso (100 mg/3 x semana), solo (n = 48) o en combinación con rHuEPO (40.000 UI) administrada una vez (n = 51) o tres veces por semana (n = 49), para aumentar los niveles de hemoglobina y disminuir los requerimientos transfusionales. Los pacientes incluidos tenían una Hb < 12 g/dl, no presentaban evidencias de déficit de hierro, estaban sometidos a ventilación mecánica y se esperaba que permanecieran en la UCI al menos 7 días. Los resultados de este trabajo muestran que, en comparación con el grupo control que sólo recibió hierro intravenoso, ambas dosificaciones de rHuEPO redujeron el porcentaje de pacientes transfundidos (59, 39 y 23%, respectivamente; p < 0,05) (tabla 1) y el número de unidades transfundidas (138, 33 y 23 unidades respectivamente; p < 0,05) y mejoraron los niveles de Hb al día 28 (9,9, 10,7 y 11,6 g/dl, respectivamente; p < 0,05). Sin embargo, al igual que en estudios anteriores no se modificó la estancia en UCI (22, 21 y 20 días, respectivamente) ni la mortalidad (14,6%, 9,8% y 20,4%, respectivamente) (tabla 1). Ahora bien, a diferencia de lo observado en el estudio de Corwin et al47 hubo una tendencia a una menor mortalidad en el grupo tratado con 40.000 UI/semana de rHuEPO (9,8 frente a 17%) (tabla 1), lo que nuevamente sugiere un posible beneficio de la administración sistemática de hierro sacarato en el tratamiento de la baja disponibilidad de hierro y la respuesta inflamatoria sistémica en estos pacientes54,57.
¿Cuál sería la dosis de hierro intravenoso a administrar? El déficit de hierro de un paciente no sangrante ingresado en la UCI puede calcularse de acuerdo con la siguiente expresión: déficit de hierro (mg) = (Hb deseada - Hb real) (g/dl) x peso corporal (kg) x 0,24. A la cifra resultante habría que añadir otros 500 mg para rellenar los depósitos si el paciente presenta ferropenia (microcitosis, ferritina baja, receptor de transferrina elevado, etc.), más 150-200 mg/semana para compensar las pérdidas provocadas por las extracciones sanguíneas. Una vez calculada la dosis total de hierro a administrar, ésta debe fraccionarse y administrarse diariamente. Posiblemente, en pacientes no estimulados con rHuEPO, una dosis de 50 mg/ día podría ser suficiente para cubrir las necesidades de la eritropoyesis, al tiempo que se evitaría la presencia de hierro libre. En pacientes sangrantes y/o estimulados con rHuEPO, la dosis podría ser de hasta 100 mg/día (máximo 600 mg/semana para hierro sacarato).
Otros antianémicos
La vitamina B12 y el ácido fólico son constituyentes de la dieta humana esenciales para la síntesis de ADN y la proliferación celular. La deficiencia de vitamina B12 y ácido fólico afecta principalmente a los tejidos con recambio celular rápido, especialmente la médula ósea y el tracto gastrointestinal. La principal manifestación de este déficit es la hematopoyesis megaloblástica en la que existe un marcado trastorno de la proliferación eritroblástica (pronormoblástica) y una eritropoyesis defectuosa. La anemia suele ir acompañada de un cierto grado de leucopenia y trombocitopenia. El déficit de folatos y vitamina B12, al igual que el de cobre y zinc, ha sido identificado en algunos pacientes críticos, aunque su tratamiento no suele ofrecer problemas23,24. Finalmente, es necesario recordar la necesidad de un adecuado aporte proteico-calórico en los pacientes críticos, por vía enteral siempre que sea posible. A este respecto, la inmunonutrición por vía enteral ha demostrado disminuir significativamente la tasa de infecciones y la estancia hospitalaria, pero no la mortalidad59, por lo que se plantea la cuestión de si esto es debido a la heterogeneidad de los pacientes críticos o a la ausencia o la absorción deficitaria de un nutriente específico en la mezcla administrada (por ejemplo, hierro), a pesar de cubrir sus requerimientos energéticos y plásticos.
CUESTIONES PENDIENTES
La evidencia proporcionada por los estudios publicados en la segunda mitad de los noventa sugería que la anemia incrementaba el riesgo de muerte en pacientes quirúrgicos y en pacientes críticos con enfermedad coronaria60,61. El estudio europeo ABC documentó que un nivel bajo de hemoglobina se asociaba a mayor disfunción orgánica, estancia más larga en la UCI y mayor tasa de mortalidad1, mientras que el estudio americano TRIC señalaba una Hb nadir < 9 g/dl también se asociaba con una mayor mortalidad2.
Por otra parte, la TSA no parece ser la mejor opción terapéutica para el tratamiento de la APC, puesto que también incrementa la disfunción orgánica, la estancia en la UCI y la mortalidad1,2, mientras que la administración de rHuEPO con o sin hierro intravenoso estimula la eritropoyesis, mejora los niveles de hemoglobina, reduce el porcentaje de pacientes con TSA y el volumen de la misma, pero no ha demostrado mejorar el pronóstico de estos pacientes21,46,47,54,58. Por ello, además de cuestionarse la relación coste-efectividad del tratamiento con rHuEPO62, surgen preguntas como ¿estaremos haciendo lo apropiado con la APC?, ¿habremos equivocado el enfoque del problema?, ¿habrá otro tipo de estrategia de tratamiento de la APC más eficaz? Para intentar dar respuesta a estas preguntas, podríamos empezar por hacer una recapitulación de lo hasta ahora expuesto:
1. La TSA se administra al 40% de los pacientes ingresados en UCI, aumentando esta cifra hasta el 70% si la estancia supera los 7 días, y se asocia de forma dosis-dependiente con un mayor riesgo de mortalidad a los 30 días1,2.
2. El uso de una estrategia transfusional restrictiva es al menos tan efectivo como el de una liberal en los pacientes críticos en términos de supervivencia a 30 días (82% frente a 77%; p = 0,10), reduce el porcentaje de pacientes con TSA (67% frente a 100%, p < 0,01) y el volumen de la misma (2,6 frente a 5,6 U/ paciente, p < 0,01). Además, la supervivencia a 30 días es mayor en los pacientes más jóvenes (< 55 años; 95% frente a 87%, p < 0,05) y en los menos graves (APACHE II < 20; 93% frente a 84%, p < 0,05) cuando se aplica un criterio restrictivo que cuando se aplica un criterio liberal28.
3. El tratamiento con rHuEPO con o sin hierro intravenoso reduce el porcentaje de pacientes con TSA y el volumen de la misma, pero no ha demostrado mejorar la supervivencia a 30 días de estos pacientes con respecto a aquellos en los que se aplicó un criterio restrictivo de transfusión (76% frente a 82%)28,46. Sin embargo, al igual que el estudio de Hébert et al28, la administración de una dosis semanal de rHuEPO (40.000 UI) disminuyó la mortalidad en los pacientes ingresados por traumatismo (OR: 0,43) y en los pacientes con APACHE II ≤ 20 (OR: 0,57) y hubo una tendencia a una menor mortalidad en los menores de 55 años (OR: 0,80)47.
4. La adición de hierro intravenoso (100 mg/3 x semana) al tratamiento con rHuEPO (40.000 UI/semana) parece mejorar la supervivencia con respecto a uso de rHuEPO con hierro oral (91,2% frente a 83%)47,58.
5. Finalmente, la hemoglobina media al ingreso se sitúa en unos 11 g/dl, mientras que los pacientes que sobreviven tras 4 semanas de estancia en UCI presentan un nivel de hemoglobina en torno a los 10 g/dl1.
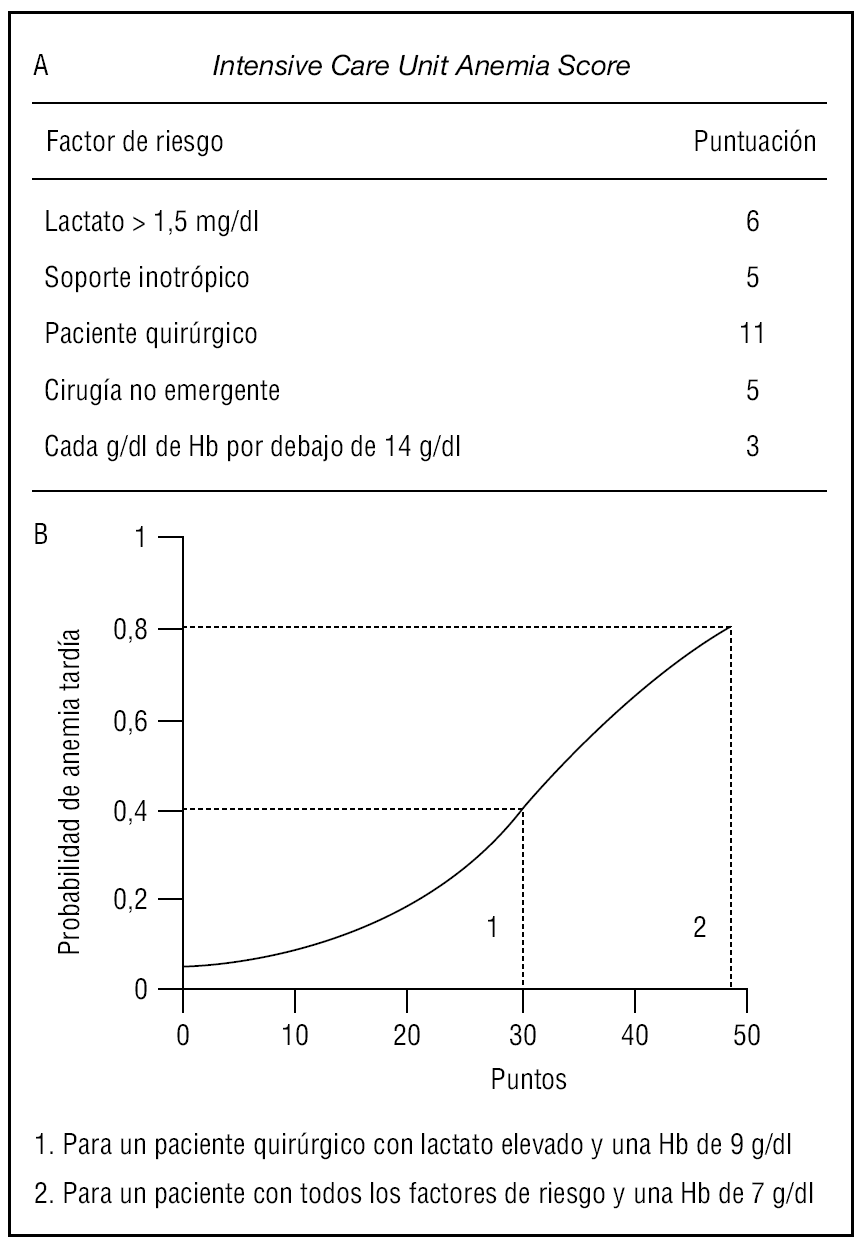
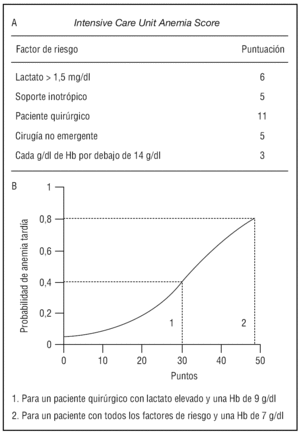
Teniendo en cuenta todos estos datos, en próximos estudios quizás pueda ser importante administrar sistemáticamente hierro intravenoso (50 mg/ día) y ajustar la dosis de rHuEPO, no para elevar los niveles de hemoglobina por encima de 12 g/ dl46,47,58, sino para mantener una hemoglobina > 7 g/dl o > 9 g/dl, según los pacientes presenten o no disfunción orgánica. Para ello, sería de suma utilidad disponer de alguna herramienta, como el Intensive Care Unit Anemia Score (ICUAS)63, que nos permita «predecir» qué pacientes podrían beneficiarse de este tratamiento. El ICUAS se construye a partir de una serie de datos recogidos en las primeras 6 horas de estancia en la UCI, incluyendo niveles de lactato y hemoglobina, necesidad de inotrópicos, ingreso posquirúrgico y cirugía no urgente, a los que se otorga una puntuación (fig. 4 A). La puntuación total del ICUAS predice, con un buen nivel de discriminación (área bajo la curva ROC: 0,74), la probabilidad de que el paciente tenga un nivel de hemoglobina menor de 7 g/dl (umbral para el criterio de transfusión restrictivo) a los 7 días del ingreso63 (fig. 4 B). Por ello, sería interesante desarrollar también una escala similar para predecir qué pacientes tendrán una hemoglobina < 9 g/dl a los 7 del ingreso (umbral de transfusión en pacientes con disfunción orgánica), ya que permitiría la instauración precoz del tratamiento adecuado en cada caso.
Figura 4. Valoración de los parámetros incluidos en el Intensive Care Unit Anemia Score (A) y aplicación de la puntuación obtenida en el modelo predictivo (B). Modificada de Milbrandt et al63. Hb: hemoglobina.
AGRADECIMIENTOS
El contenido de esta Revisión corresponde, en parte, a las ponencias «Tratamiento de la anemia del paciente crítico: hierro parenteral y eritropoyetina» y «Riesgos y complicaciones de la transfusión de hemoderivados» presentadas en el XLI Congreso Nacional de la SEMICYUC (Pamplona, 25-28 de junio de 2006).
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Correspondencia: Prof. M. Muñoz.
Medicina Transfusional.
Facultad de Medicina.
29071 Málaga. España.
Correo electrónico: mmunoz@uma.es
Manuscrito aceptado el 19-IX-2006.