INTRODUCCIÓN
Los Servicios de Urgencias y de Medicina Intensiva acuerdan abordar un proyecto dirigido a la plantilla de Urgencias, con trabajo asistencial en las áreas de observación de los hospitales con el objetivo común de mejorar el conocimiento diagnóstico terapéutico de la sepsis grave en pacientes adultos en dichas áreas, y que se fundamenta esencialmente en la redacción de un Documento de Consenso (DC) de este proceso, que contemple diferentes aspectos de la sepsis, entre los que se incluyen definiciones, herramientas diagnósticas, medidas terapéuticas básicas en la sepsis grave y shock séptico, con especial referencia a la aplicación de la antibioterapia adecuada y precoz seleccionada en función de las diferentes variables estudiadas. Este DC pretende tener la máxima difusión entre el personal de los Servicios de Urgencias.
A pesar de los avances en el tratamiento antibiótico y las medidas para modular la respuesta inmunitaria, la sepsis continúa teniendo una elevada mortalidad, que alcanza más del 40% en las formas de sepsis grave o shock séptico, y su incidencia va en aumento. Existe en la actualidad suficiente evidencia científica para afirmar que la aplicación precoz y dirigida de una serie de medidas diagnóstico-terapéuticas, entre las que se incluyen el tratamiento antibiótico y el soporte hemodinámico adecuado, mejoran de manera significativa la supervivencia. También existe el conocimiento de que el seguimiento de estas medidas tiene un cumplimiento escaso en todos los entornos hospitalarios. La sepsis requiere una identificación rápida y un tratamiento inmediato, pasando de esta forma a engrosar el grupo de enfermedades tiempo-dependientes, entendiendo como tales aquellas en las que el retraso diagnóstico o terapéutico influye negativamente en la evolución del proceso, y por tanto son entidades de especial interés para las áreas de Urgencias, donde una actuación adecuada puede modificar sustancialmente el pronóstico de los pacientes. La información epidemiológica disponible nos dice que el 30-40% de las sepsis que recibe una Unidad de Cuidados Intensivos (UCI) procede de Urgencias, aunque la verdadera incidencia de la sepsis en los Servicios de Urgencias es aún desconocida por la clara infraestimación y la inapropiada definición de los pacientes. Las Sociedades Científicas conscientes de esta situación han lanzado una campaña en el año 2002 que lleva por lema Surviving Sepsis Campaign, campaña liderada por las áreas de Cuidados Intensivos de ambos lados del Atlántico con la participación de la European Society of Intensive Care Medicine, el International Sepsis Forum y la Society of Critical Care Medicine, centradas en el manejo de la sepsis en los centros asistenciales, fundamentalmente en el ámbito de la Unidades de Cuidados Intensivos.
La Sociedad Española de Medicina de Urgencias y Emergencias (SEMES), junto con la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC), conscientes de esta problemática, han desarrollado de manera conjunta este DC con el objetivo de desarrollar, entre ambas Sociedades, una guía de actuación que facilite la identificación y manejo de pacientes sépticos.
Entre las especificaciones establecidas para la guía está su aplicabilidad en el entorno de las Urgencias, con una ventana temporal limitada a las «seis» primeras horas de manejo del paciente séptico, y el tratar de contemplar en las recomendaciones niveles de máxima exigencia asistencial.
Este DC hace especial referencia a los siguientes conceptos:
1. La sepsis es un proceso de elevada mortalidad.
2. El diagnóstico de la sepsis grave es difícil y, por tanto, es uno de los escollos para iniciar un tratamiento precoz, por lo que es necesario elevar el índice de sospecha y utilizar herramientas que la puedan definir.
3. La categorización de la gravedad de los pacientes sépticos es la base para la toma de decisiones diagnóstico-terapéuticas.
4. Los retrasos en la administración de antibióticos o en la estabilización hemodinámica, en los casos en que esté indicada, son piezas fundamentales donde habría que hacer una especial hincapié.
5. El manejo de las formas de sepsis grave debe realizarse mediante consenso de un grupo multidisciplinar, donde el médico de urgencias y el de intensivos constituyan el núcleo básico.
6. La integración de la sepsis en un proceso asistencial definido permitiría la evaluación y seguimiento de indicadores de calidad asistencial.
Las recomendaciones que nazcan de un grupo de trabajo, estructuradas en forma de vía clínica, sin duda aportarán una herramienta de alto valor para facilitar el manejo, al tiempo que impulsarán los modelos asistenciales con integración de profesionales de distinta formación, que se han mostrado eficaces en otras patologías, aunque no exentos de dificultad de implantación. La orientación actual del manejo del paciente séptico pone a las áreas de Urgencias en una posición de máxima responsabilidad y las vías consensuadas nos aportarán un documento que necesariamente requerirá una adecuación a las características locales de cada centro, pero que sin duda facilitará cualquier plan de mejora.
EPIDEMIOLOGÍA: LA SEPSIS GRAVE EN ESPAÑA
La sepsis grave es un complejo síndrome difícil de definir, diagnosticar y tratar, inducido por un proceso infeccioso con evidencia de alteraciones en la perfusión tisular y disfunción orgánica. Desencadenada por la entrada de microorganismos o sus toxinas en el torrente circulatorio, la sepsis provoca una respuesta inflamatoria por parte del huésped con pérdida de la autorregulación de los mecanismos de defensa, con tendencia a la hiperproducción de sustancias proinflamatorias o mediadores, activadores de la coagulación y fibrinólisis, que interrelacionan, suscitando el control de la infección o su evolución a sepsis grave o shock séptico.
El 10,4% de los pacientes que acuden a los Servicios de Urgencias hospitalarios (SUH) son diagnosticados de un proceso infeccioso (el más frecuente de origen respiratorio), de éstos el 20,6% requerirán ingreso hospitalario1. De los pacientes con proceso infeccioso ingresan en el hospital entre el 5-17%, dependiendo de las fuentes de información2,3. La gravedad de estos procesos es muy distinta, desde banales, la mayoría, hasta situaciones de sepsis grave y shock séptico. Aunque inicialmente se estimó que sólo el 5,3% de los pacientes con infección se ajustaban a la definición de sepsis1,4, en realidad entre el 5-10% cumplen los «criterios diagnósticos de sepsis»5, lo que supone alrededor de unos 50.000-100.000 casos/año en nuestro país, y de éstos, extrapolando, alrededor del 30% evolucionarán a cuadros de sepsis grave o shock séptico. La incidencia de estos procesos infecciosos está aumentando a un ritmo del 7-9% anual6-8 por diversos factores, como son el aumento de la expectativa de vida, que deriva en un mayor número de procesos crónicos en la población, incremento de realización de técnicas invasivas, estados de inmunodepresión por fármacos, enfermos tratados con quimioterapia, etc.
La sepsis representa hoy la enfermedad más prevalente en las UCI con una tasa de mortalidad muy elevada, estimándose en unos 97 casos/100.000 habitantes/año de sepsis grave (aunque los casos de sepsis representan unos 333 casos/100.000 habitantes/año)9. El 29% de las sepsis se transformarán en «graves» y el 9% en «shock séptico». Más de la mitad de los casos diagnosticados de sepsis grave se atienden fuera de las UCI2,9. Así, de forma global
se pueden estimar unos 45.000 casos de sepsis grave al año en España de los que fallecen unos 13.0008. En el mundo se producen unos 18.000.000 casos/ año con 1.400 muertos/día. La mortalidad de la sepsis grave se cifra en el 28%, teniendo en cuenta los pacientes que también proceden de otras áreas del hospital incluyendo los SUH9,10 y en el 35-54% si lo centramos en estudios en las UCI10,11. Según datos del estudio EDU-SEPSIS, en España, de octubre a diciembre 2005, la sepsis grave presentó una mortalidad del 47%, y los casos de shock séptico alcanzaron el 84%. Estas cifras de mortalidad son muy superiores a las de enfermedades como el infarto agudo de miocardio (IAM) o el ictus. De hecho, comparativamente mueren más personas de sepsis que de cáncer de mama o de colon o como complicación de un IAM. El coste económico por episodio de sepsis se ha estimado en unos 10.000 euros, siendo muy superior al coste del IAM12.
Desde que se produce la invasión por un microorganismo de un territorio, tejido, sangre u otros fluidos corporales, se desencadena en el huésped una compleja secuencia de acontecimientos destinados a resolver dicha agresión (lo que no siempre se logra), y que, en ocasiones, conducirá a un empeoramiento de la situación clínica con el consiguiente agravamiento del pronóstico e incremento de la morbilidad y mortalidad de este proceso infeccioso. La evolución de los acontecimientos clínicos nos llevaría desde un síndrome de respuesta inflamatoria sistémica (SRIS) a situaciones de sepsis, «sepsis grave», «hipotensión por sepsis», «shock séptico»... y al «síndrome de disfunción multiorgánica», como punto final de este proceso con distintos estadios de gravedad. Por lo tanto, el concepto de sepsis y sus secuelas (disfunción y fallo de órganos) debe ser entendido como un proceso dinámico y continuo de «estadios de la sepsis» que de ir evolucionando incrementarán la morbimortalidad del paciente13,14, por lo que actuar a tiempo de forma precoz y adecuada será fundamental para reducirla «evitando la progresión de la sepsis». En este sentido en los SUH se debe hacer un esfuerzo para conseguir un diagnóstico precoz, tratamiento inmediato y realizar una correcta toma de muestras microbiológicas en las primeras horas para contribuir a minimizar la mortalidad, evitando en la medida de lo posible que los pacientes lleguen a situaciones de sepsis grave y shock séptico. Desde el momento en que el paciente llega al SUH, comienza «la carrera para detener y revertir el proceso» que en ciertos casos tendrá éxito, y en otros continuará en la UCI. Por ello, la rapidez con la que afrontemos el problema y consigamos un diagnóstico de sospecha o confirmación lo más precoz posible y la aplicación de las medidas de tratamiento iniciales de «resucitación» serán determinantes para el pronóstico inmediato y posterior del paciente séptico15,16. Es un hecho conocido en la sepsis grave/shock séptico la influencia del retraso en la administración de antimicrobianos en la mortalidad; según la terapia antimicrobiana adecuada sea administrada en los primeros 30 minutos después del diagnóstico o entre las primeras 9-12 horas, la mortalidad varía entre un 17% y un 74%, respectivamente16.
Aunque la mortalidad relativa de la sepsis ha disminuido el aumento de su incidencia, ha hecho que el número absoluto de muertes por sepsis se incremente, por lo que representa un importante problema sanitario en todo el mundo. Para concienciarnos de este problema y así adoptar medidas específicas, desarrollar pautas de actuación y facilitar su puesta en práctica nació la Surviving Sepsis Campaign o «Campaña para sobrevivir a la sepsis» (CSS) en el año 2002, que con la participación de la European Society of Intensive Care Medicine, el International Sepsis Forum, la Society of Critical Care Medicine y el American College of Emergency Physicians, se fijó como principal objetivo conseguir una reducción de la mortalidad de la sepsis grave en un 25% en 5 años (2005-2009), lo que para España supondría «salvar» más de 3.000 personas/año. Para ello se establecieron unas pautas de actuación clínica17 a desarrollar de manera conjunta en forma de «dos paquetes de actuación básicos». El paquete de «resucitación inicial» se debe completar en las primeras 6 horas desde la sospecha de sepsis grave en los SUH, lo que implica iniciar lo antes posible y en el propio SUH las medidas indicadas en el mismo para conseguir «los objetivos de la resucitación»18. Con la identificación del paciente se activaría en el SUH el «código de sepsis grave» (CSG) con el comienzo de la fluidoterapia, realización de analítica con lactato, toma de hemocultivos, administración de la primera dosis de antibiótico adecuado y aviso a UCI.
El «segundo paquete» lo constituyen las medidas a tomar en las primeras 24 horas. Todas ellas se podrían agrupar en17-20:
1. Resucitación inicial.
2. Tratamiento de la infección (incluyendo diagnóstico de localización y aislamiento del microorganismo, así como administración del antimicrobiano y medidas de erradicación del foco con cirugía, si está indicada).
3. Tratamiento de la sepsis (corticoides y proteína C activada).
4. Tratamiento de soporte.
Desgraciadamente, con la recogida de datos del «estudio EDU-SEPSIS-SURVIVING» en España, sabemos que todavía no hay una correcta cumplimentación de las medidas en las primeras 24 horas, y que las medidas de resucitación se realizan en menos de la mitad de los casos, lo que resulta muy llamativo y hace necesario un esfuerzo de concienciación para que todos las llevemos a cabo, ya que «está en juego la vida del enfermo»21. En un reciente estudio16 se comprobó que sólo el 50% de los pacientes recibieron tratamiento antimicrobiano adecuado en las primeras 6 horas del inicio de la hipotensión, con una relación muy establecida entre el retraso del inicio de tratamiento antibiótico y la mortalidad.
DETECCIÓN E IDENTIFICACIÓN DEL PACIENTE SÉPTICO GRAVE. ASPECTOS LOGÍSTICOS
Elementos básicos en la identificación de la sepsis: definiciones
Desarrollo de la definición de sepsis
En 1991, el ACCP (American College of Chest Physicians) y la SCCM (Society of Critical Care Medicine)4 convocaron una conferencia de acuerdo general para desarrollar una amplia serie de definiciones que podrían mejorar la capacidad de los médicos de diagnosticar, supervisar y tratar la sepsis y otros aspectos relacionados con ésta. Las definiciones generales elaboradas en aquella conferencia han sido extensamente usadas en la práctica y en los ensayos clínicos de intervenciones terapéuticas.
El establecimiento de definiciones para un síndrome es intrínsecamente un proceso imperfecto, que requiere la puesta al día periódica sobre la base de nuevas ideas en fisiopatología o nuevas pruebas diagnósticas. En el año 2001 un grupo de expertos consideraron la necesidad de examinar de nuevo las definiciones de la sepsis a la luz de los nuevos avances. La SCCM, ACCP y varias otras Sociedades Científicas de Cuidados Intensivos norteamericanas y europeas patrocinaron la Conferencia Internacional de Definiciones de la Sepsis 20015. Los expertos asistentes formaron subgrupos para evaluar la rentabilidad diagnóstica de signos y síntomas de sepsis, marcadores celulares, citoquinas, datos microbiológicos y parámetros de coagulación.
El informe definitivo de la conferencia no encontró ninguna prueba que apoyara un cambio de las definiciones de sepsis, pero halló que los signos y síntomas son más variados que los criterios iniciales establecidos en 1991, dando mayor importancia al uso de los biomarcadores para el diagnóstico precoz de sepsis. Una lista de estos signos y síntomas para el diagnóstico de sepsis está representada en la tabla 1. A pesar de las definiciones perfiladas aquí, los términos no tienen una caracterización exacta de pacientes con sepsis. El futuro está en el desarrollo de un sistema que caracterizará la progresión de sepsis (sistema PIRO), que estratifica a pacientes sobre la base de sus condiciones de predisposición (comorbilidad, factores genéticos, etc.), insulto de la infección (patógenos y foco, etc.), la respuesta del sistema (SRIS, shock, proteína C reactiva [PCR], interleucina [IL], factor de necrosis tumoral [TNF], procalcitonina [PCT], etc.) y el grado de disfunción orgánica (SOFA, apoptosis, etc.) que identifique estadios de progresión en los pacientes sépticos.
El concepto de sepsis comprende desde el SRIS del huésped a la infección grave sospechada o documentada. La sepsis grave se caracteriza o bien por la alteración aguda de la función de uno o mas órganos (función hemodinámica, renal, respiratoria, hepática, hematológica o neurológica), o bien por mala perfusión tisular (hiperlactacidemia) o hipotensión arterial (transitoria o persistente). El shock séptico es definido por la presencia de hipotensión arterial que no responde a expansión del volumen intravascular y requiere perfusión de aminas para su tratamiento.
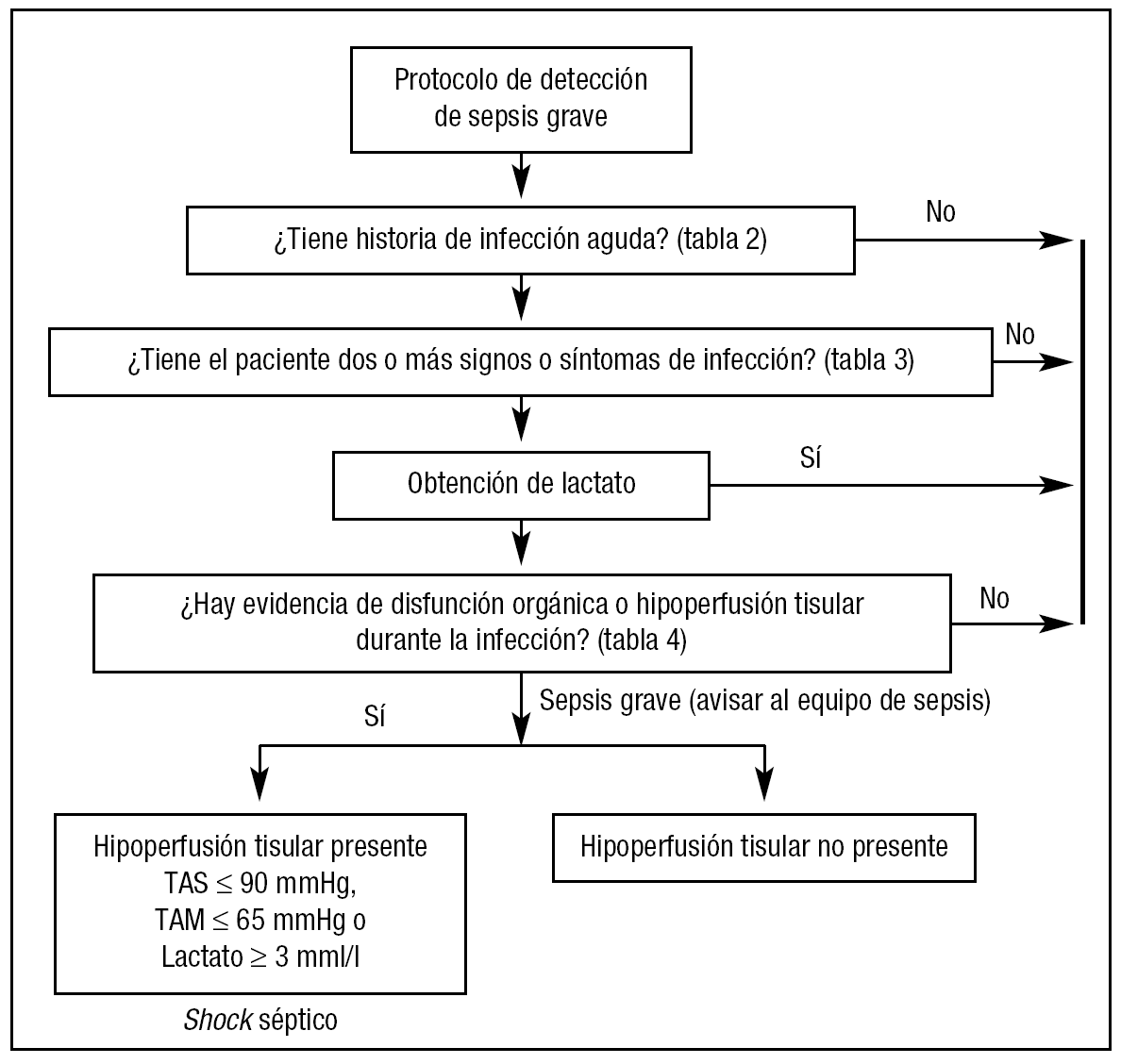
Algoritmo de detección precoz y estratificación de la sepsis
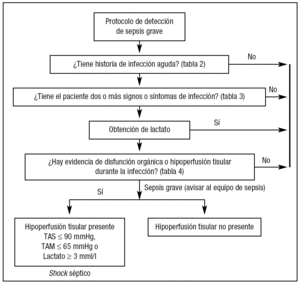
Proponemos el siguiente protocolo de detección precoz, extraído de las guías de manejo de sepsis grave y shock séptico de la campaña Sobrevivir a la Sepsis (fig. 1)17,19.
Figura 1. Protocolo de detección precoz y estratificación de pacientes con sepsis. TAS: tensión arterial sistólica; TAM: tensión arterial media.
DIAGNÓSTICO Y CONTROL DEL FOCO. TOMAS MICROBIOLÓGICAS. ANTIMICROBIANOS, CUÁL/ES, CUÁNDO...
Diagnóstico clínico y microbiológico
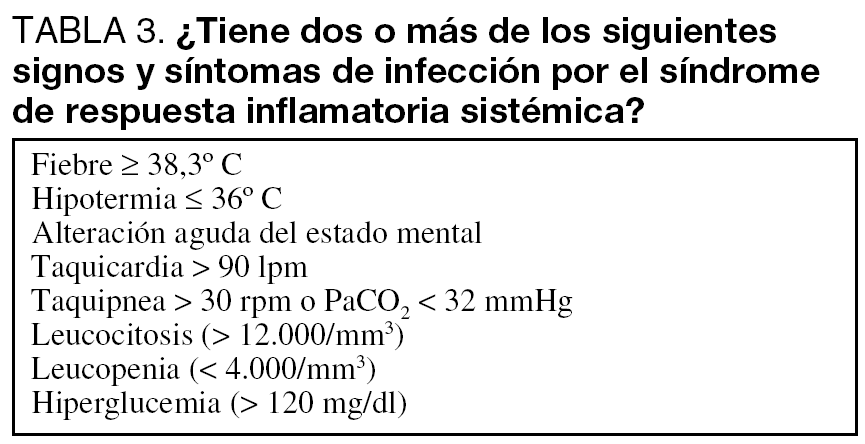
En los SUH es crucial la orientación sindrómica inicial para la identificación del foco (tabla 2) en los pacientes con sospecha de sepsis (tabla 3), la adecuada recogida de muestras microbiológicas y la elección de tratamiento antimicrobiano empírico. El conocimiento del perfil clínico del paciente y sus antecedentes (inmunosupresión, cirugía reciente, diálisis, etc.) resultarán de utilidad en la búsqueda del foco y la etiología de la sepsis.
Entre los estudios complementarios realizados con el objetivo de orientar el grado de afectación del paciente y descubrir su origen se recomiendan un hemograma (recuento y fórmula leucocitaria), un estudio de coagulación (plaquetas, dímero D y fibrinógeno), una bioquímica básica (con glucosa, iones, calcio, urea, creatinina, aspartato aminotransferasa [AST], alanina aminotransferasa [ALT], bilirrubina y lactato), una gasometría arterial o venosa, un sedimento de orina, una radiografía de tórax y un electrocardiograma (ECG). En algunos centros se incluye de rutina la realización de la PCR y la PCT (anexo 1).
El diagnóstico microbiológico se basa en la demostración del patógeno o de su huella en el sistema inmune del huésped en un contexto clínico determinado22. La confirmación etiológica en el laboratorio se hace necesaria para dirigir el tratamiento antimicrobiano y epidemiológicamente para conocer el nicho ecológico.
La información que se puede obtener del laboratorio dependerá de la calidad de la muestra remitida. La obtención de la muestra debe ser precoz (antes del tratamiento antibiótico), adecuada (en condiciones de asepsia, evitando la exposición de la muestra a desinfectantes, dando prioridad a los productos frescos, líquidos y biopsias frente a las torundas y preferentemente de los bordes de la herida) y suficiente (la viabilidad bacteriana en algunas muestras es escasa por factores fisicoquímicos, otras veces, como en el caso del líquido cefalorraquídeo [LCR], se solicitan muchos estudios para una muestra escasa). Las muestras serológicas requerirán de un posterior control para estudiar la seroconversión o los cambios en la titulación de los anticuerpos22,23.
Para el diagnóstico microbiológico24 se tomarán muestras microbiológicas de cuantas localizaciones pudieran constituir sindrómicamente el foco inicial (esputo, LCR, líquidos corporales, etc.). El hemocultivo es de excepcional interés en el diagnóstico etiológico, pues resulta positivo en el 50% de los pacientes con sepsis y se ha de practicar siempre independientemente del foco infeccioso (las recomendaciones sobre la técnica de extracción se exponen en el anexo 1). Otros cultivos de utilidad por su facilidad de obtención y rentabilidad son los urocultivos, que además constituyen el foco más frecuente de sepsis en los pacientes mayores de 65 años (las muestras y técnicas recomendadas para el diagnóstico de los focos sépticos más frecuentes se exponen en el anexo 1).
Tratamiento empírico
La antibioterapia debe instaurarse de manera precoz (si es posible en la primera hora16,25 desde el conocimiento del cuadro) y efectiva (tratamientos inadecuados o diferidos se correlacionan con una mayor morbimortalidad). El conocimiento del foco y del perfil de resistencias de la flora local facilita la elección del antimicrobiano efectivo.
Como norma general, y salvo clara identificación del foco séptico (las recomendaciones terapéuticas según el foco séptico se exponen en el anexo 2), la recomendación es emplear antimicrobianos de amplio espectro, desescalando en función del resultado de los cultivos17,24-26. Las cefalosporinas de tercera generación (ceftriaxona, cefotaxima y ceftazidima) y cuarta generación (cefepima), los carbapenémicos (imipenem y meropenem) y las penicilinas con penicilinasas (piperacilina-tazobactam) son los antibióticos más empleados. En ocasiones se pueden establecer combinaciones de antimicrobianos con objeto de ampliar el espectro (en infecciones polimicrobianas), de conseguir sinergismo (en infecciones en inmunodeprimidos) o de disminuir la selección de cepas resistentes (en infecciones por patógenos multirresistentes). En este sentido habría que considerar que la terapia antimicrobiana debe incluir antimicrobianos que cubran esta posibilidad en pacientes con los siguientes factores de riesgo: haber recibido 4 o más ciclos de antimicrobianos en el último año, colonización previa por patógeno multirresistente (esputo, úlcera, etc), flujo espiratorio máximo (VEMS) < 30% en la enfermedad pulmonar obstructiva crónica (EPOC), hospitalización reciente por un período ≥ a 5 días, alta prevalencia local de microorganismos resistentes, tratamiento o enfermedad inmunosupresora, procedencia de residencia asistida, tratamiento antibiótico IV, manipulaciones urológicas y/o cura de úlceras domiciliaria y diálisis en los últimos 30 días27,28, pudiendo estar justificado el uso empírico de glucopépticos (vancomicina y teicoplanina), estreptograminas (quinupristina/dalfopristina) u oxazolidinonas (linezolid)17,24-26.
Control del foco
En todo paciente con sepsis grave se debe evaluar la presencia de un foco de infección susceptible de ser erradicado mediante maniobras de control del foco.
Una vez localizado se iniciarán las maniobras destinadas al control del mismo para conseguir la erradicación microbiológica y, de esta manera, el control clínico29. Estas maniobras incluyen el drenaje de los abscesos y colecciones (toracocentesis en empiemas, descompresión y drenaje de las obstrucciones urológicas, drenaje percutáneo con control de eco-tomografía axial computarizada [TAC] de colecciones intraabdominales, etc.), el desbridamiento quirúrgico de los tejidos desvitalizados (fasciotomías en fascitis necrotizante, cirugía de abscesos tuboováricos, nefrectomía en pielonefritis enfisematosas, limpieza quirúrgica de úlceras por presión, etc.) y la retirada de dispositivos infectados (catéteres, prótesis, etc.). Las recomendaciones sobre las técnicas de control del foco infeccioso se exponen en el anexo 3.
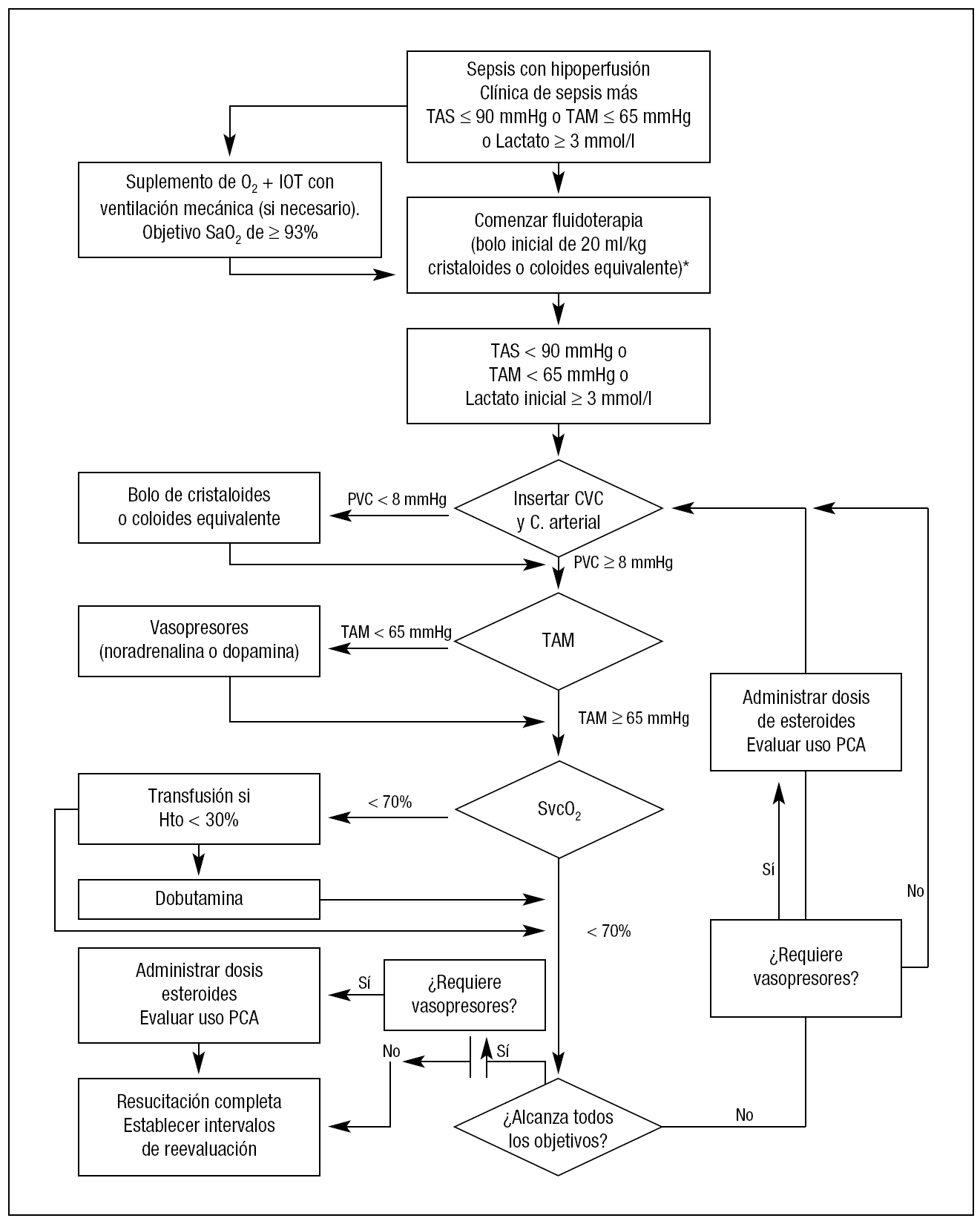
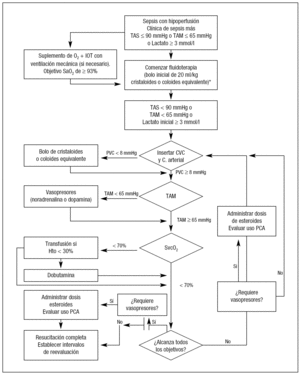
SOPORTE HEMODINÁMICO Y OTRAS MEDIDAS (fig. 2)
Figura 2. Algoritmo/secuencia de actuaciones para el manejo hemodinámico en la sepsis grave y el shock séptico. *En situaciones donde la tensión arterial media (TAM) se considere críticamente baja, los vasopresores pueden ser utilizados en cualquier punto de este algoritmo. IOT: intubación orotraqueal; SaO2: saturación arterial de oxígeno; TAS: tensión arterial sistólica; CVC: catéter venoso central; PCA: proteína C activada; ScvO2: saturación venosa central de oxígeno; Hto: hematocrito.
Objetivo
El objetivo de las medidas de soporte hemodinámico es mejorar el transporte de oxígeno para corregir y evitar la hipoxia celular. La sepsis grave y el shock séptico deben ser considerados situaciones de emergencia, por lo que este objetivo debe alcanzarse lo antes posible30. La variable diagnóstica principal y de alarma es la hipotensión arterial, aunque su ausencia no descarta la presencia de sepsis grave ni la existencia de hipoperfusión (tabla 4). Recientemente se ha demostrado la utilidad clínica de la saturación de oxígeno de la sangre venosa central (ScvO2) como «variable guía» para la corrección de la hipoxia tisular30. Por lo tanto, los objetivos hemodinámicos de pacientes con sepsis grave y shock séptico son el reestablecimiento de la tensión arterial y la normalización de la SVO2 mediante la administración de volumen, aminas vasoactivas y dobutamina.
Tratamiento de la inestabilidad hemodinámica
Conviene en primer lugar descartar razonablemente situaciones de pérdidas líquidas o hemorragias que causan hipotensión por mecanismos distintos a la infección grave. En presencia de hipotensión arterial se administran 500-1000 ml (20 ml/kg) de cristaloides o 300-500 ml de coloides en 15 minutos. Se puede repetir la carga de volumen en función de la respuesta y la estimación de la volemia, así como de la reserva cardíaca y del riesgo de desarrollo de síndrome de distrés respiratorio agudo. No existen datos para recomendar utilizar preferentemente cristaloides o coloides. No se recomienda la utilización de soluciones de albúmina humana.
Es recomendable establecer un acceso venoso central en el momento de confirmarse la presencia de sepsis grave o shock séptico. La colocación de un catéter arterial para la monitorización de la presión y gasometría arteriales es de gran utilidad, pero esta medida depende de la disponibilidad de equipamiento y personal.
Determinaciones iniciales
Determinación de iones, urea, creatinina, glucosa, bilirrubina, lactato y gasometría arteriales y SvcO2. Recuento de leucocitos y plaquetas, hemoglobina y hematocrito. Muestras para diagnóstico microbiológico: hemocultivos y otros cultivos pertinentes (LCR, muestras respiratorias, exudados, etc.).
Estabilización hemodinámica
El objetivo hemodinámico inicial es una tensión arterial sistólica (TAS) ≥ 90 mmHg o una tensión arterial media (TAM) ≥ 65 mmHg17,30-32. Si tras la administración de 2 a 3 litros de cristaloides o de 1 a 1,5 litros de coloides la presión venosa central (PVC) es > 8 mmHg y persiste la TAM < 65 mmHg, deben asociarse vasopresores. Se recomienda preferentemente el uso de noradrenalina a una dosis inicial de alrededor de 0,04 µg/kg/min (8 mg de noradrenalina en 250 ml a 5 ml/h) con incrementos de 5 ml/h cada 5 a 10 minutos en función de la respuesta hemodinámica. Se desaconseja la administración de adrenalina en infusión continua. En caso de hipotensión grave (TAS < 70 mmHg o TAM < 50 mmHg) puede iniciarse la perfusión de noradrenalina en fases precoces de la expansión de volumen, cuando la PVC es aún < 8 mmHg. Una vez conseguida una TAS > 90 o TAM > 65 mmHg, se podrá considerar incrementar la dosis de infusión de la noradrenalina si la persistencia del lactato sérico elevado o la oliguria sugieren una mala perfusión tisular.
Se ha indicado que las determinaciones «estáticas» de la volemia, como la PVC, la presión capilar pulmonar u otros indicadores de precarga ventricular, son peores predictores de la respuesta hemodinámica a la expansión de volumen que parámetros «dinámicos»33.
Una vez conseguida una PVC > 8 mmHg y TAM ≥ 65 mmHg, si la SvcO2 < 70%, o el lactato sérico > 3 mmol/l o persisten otros signos de hipoperfusión tisular, podrá considerarse iniciar la perfusión de dobutamina asociada a las aminas vasopresoras17,32.
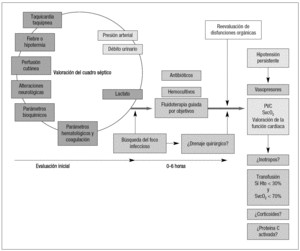
La transfusión de concentrados de hematíes se recomienda únicamente con Hb < 7 g/dl, excepto en pacientes con enfermedad coronaria, en presencia de hemorragia activa o ante determinaciones de lactato sérico persistentemente > 3 mmol/l (tablas 5 y 6) (fig. 3).
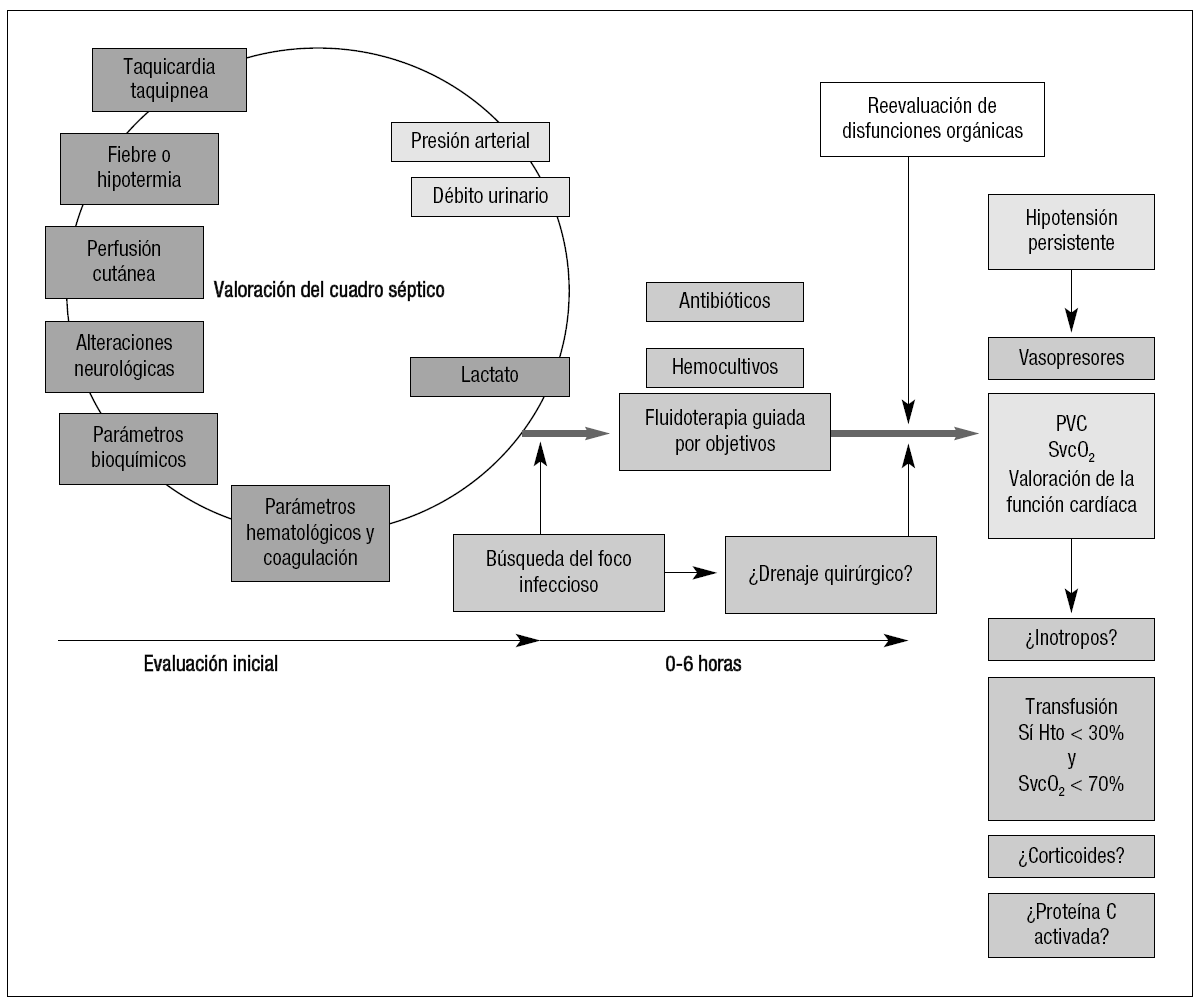
Figura 3. Diagnóstico y tratamiento inicial de la sepsis grave.SG: sepsis grave; PVC: presión venosa central; SvcO2: saturación de oxígeno de la hemoglobina en sangre venosa central; Hto: hematocrito. Tomada de la cita 19.
Otras medidas
1. Oxigenación. Se recomienda proporcionar aporte suplementario de oxígeno para mantener saturaciones por pulsioximetría superiores al 92%. La decisión de proceder a la intubación endotraqueal y conexión a ventilación mecánica en pacientes con sepsis grave o shock séptico no debe demorarse en caso de que exista taquipnea > 30/minuto, empleo de la musculatura respiratoria accesoria, desaturación < 90% o encefalopatía o descenso del nivel de conciencia.
2. Bicarbonato. De dudosa indicación, puede considerarse en pacientes con pH en sangre arterial ≤ 7,15.
3. Glucocorticoides. En pacientes con tratamiento esteroideo sistémico crónico es obligatorio administrar hidrocortisona intravenosa. Puede considerarse la administración de glucocorticoides en pacientes con hipotensión refractaria a la expansión de volumen e infusión de aminas a dosis altas. La hidrocortisona (50 mg intravenosa en bolo cada 6 horas o 100 mg intravenosos cada 8 horas) desplaza la curva de dosis-respuesta de la noradrenalina, aumentando la TA, aunque no puede considerarse probado que su administración reduzca la mortalidad de pacientes en shock séptico.
4. Primeras 24 horas. Se han recomendado otras medidas en este período de tiempo, entre las que se incluyen: corticoides a dosis bajas, proteína C activada en ausencia de contraindicaciones y bajo protocolo y mantener la glucemia < 150 mg/dl, que deben ser consideradas en función de la situación clínica del paciente.
CONSIDERACIONES FINALES PARA EL MANEJO DE LA SEPSIS GRAVE EN LOS SERVICIOS DE URGENCIAS HOSPITALARIOS
La sepsis continúa siendo una de las causas fundamentales de muerte; las secuelas de morbilidad ocasionan una importante carga asistencial, sin que ambas hayan sido sustancialmente reducidas a pesar de los avances en la terapéutica antibiótica.
La mortalidad y morbilidad de la sepsis puede ser reducida con «paquetes de acciones» realizadas en las fases precoces del proceso. La sepsis ha pasado a constituir un proceso tiempo-dependiente, (al igual que el IAM o el ictus agudo) y por tanto su identificación y manejo en Urgencias adquiere una importancia trascendental.
En este sentido, se recomienda:
1. La identificación precoz de la sepsis es el paso fundamental para iniciar las medidas terapéuticas, el mantener un alto índice de sospecha en los pacientes infecciosos junto con el uso de instrumentos para clasificar la gravedad de la sepsis son los dos pilares para la identificación y el manejo estructurado precoz. Los paquetes de medidas para las primeras 6 horas en el hospital van dirigidos a dos objetivos básicos: control del agente infeccioso y mantenimiento de la perfusión tisular.
2. El uso de tratamiento antibiótico en las dos primeras horas en los pacientes con sepsis debe ser un objetivo terapéutico absolutamente prioritario.
3. Los pacientes sépticos con hipotensión o signos de hipoperfusión tisular (lactato elevado, ScvO2 < 70%, diuresis reducida) deben recibir sobrecargas de volumen y se ha de comprobar su eficacia mediante monitorización de la respuesta. Los pacientes con falta de respuesta al volumen deben ser tratados con agentes vasoactivos.
4. Los pacientes con sepsis grave/shock séptico deben estar ubicados en áreas donde sea factible su correcto planteamiento diagnóstico y monitorización compleja (UCI); no obstante, esta ubicación final no puede ser un condicionante para no iniciar los paquetes de medidas, ya sea en las áreas de Urgencias o en las plantas de hospitalización convencional. El manejo coordinado de estos pacientes con los profesionales de las áreas referidas, en colaboración con los intensivistas, aporta mejora al resultado final, mediante una aproximación multiprofesional al complejo proceso del paciente séptico.
5. Es fundamental pues que, desde que se inicie la atención al paciente séptico a su llegada al SUH, se aplique la máxima prioridad a estos enfermos y una atención consensuada y continuada entre los servicios de Urgencias y UCI, actuando con los mismos protocolos para minimizar el tiempo de actuación («tiempo es vida») y la correcta y conjunta toma de decisiones, lo que ayudará sin duda a conseguir los objetivos de la CSS. La carrera contra la sepsis se ganará en equipo con las medidas propuestas, y utilizando, al igual que en otros procesos, el código sepsis de activación de manera rápida y precoz de equipos multidisciplinarios hospitalarios42.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Documento realizado con el soporte logístico de Lilly S.A.
De acuerdo con los autores y los editores, este artículo se publica simultáneamente y de forma íntegra en la siguiente publicación: emergencias (2007;19:151-63)
*Sociedades participantes
Sociedad Española de Medicina de Urgencias y Emergencias (SEMES),
Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC)
(Grupo de Trabajo de Enfermedades Infecciosas)
Coordinación
L. García-Castrillo Riesgo y C. León Gil
Revisión
A. Artigas Raventós y M. Moya Mir
Miembros del Grupo de Expertos
M. Borges Sa, F.J. Candel González, M. Chanovas Borrás, R. Ferrer Roca, A.J. Jiménez. A. Loza Vázquez y M. Sánchez García
Correspondencia: Dr. C. León.
Hospital Universitario de Valme.
Ctra. de Cádiz, s/n.
41014 Sevilla. España.
Correo electrónico: cleong@telefonica.net
Correo electrónico: cristobal.leon.sspa@juntadeandalucia.es
Manuscrito aceptado el 13-IV-2007.