INTRODUCCIÓN
Desde el primer marcapasos, implantado el 8 de octubre de 1958 al paciente Arne Larson por el Dr. Ake Senning1, millones de pacientes se han beneficiado de esta terapéutica, y se calcula que en el año 2002 se han implantado 600.000 unidades2 en el mundo. En España, con una población estimada de 40.000.000 de habitantes, se implantan aproximadamente 15.000 unidades/año3 (375 marcapasos por 100.000 habitantes).
Entre las complicaciones descritas en la bibliografía destaca la trombosis venosa profunda de las venas que alojan al electrodo del marcapasos. Aunque se han publicado porcentajes que varían desde el 5,5 al 45%4-10 utilizando métodos diagnósticos objetivos, todos los autores resaltan la baja incidencia de pacientes con síntomas.
La presencia de esta disparidad en los estudios de prevalencia junto con la ausencia de datos referentes a los electrodos actuales, nos indujeron a llevar a cabo este ensayo clínico con el objetivo primario de conocer la prevalencia de trombosis sintomáticas o asintomáticas. Por otra parte, y basándonos en publicaciones11,12 que sugerían que bajas dosis de anticoagulación oral podrían prevenir trombosis en pacientes con catéteres intravenosos y en aquellos sometidos a cirugía mayor, sin inducción de hemorragias, nos propusimos analizar la eficacia preventiva de bajas dosis de anticoagulación oral (acenocumarol, 1 mg/día), manteniendo el tiempo de protrombina < 1,5 (INR). Decidimos seleccionar este tratamiento por la facilidad de dosificación individual, la comodidad de administración y la ausencia de efectos secundarios a las dosis prescritas.
MÉTODOS
Diseño
Ensayo clínico aleatorizado y comparativo. Los pacientes se aleatorizaron en dos grupos: control y tratamiento (acenocumarol, 1 mg/día). La inclusión de pacientes en cada grupo se realizó por la técnica de asignación equilibrada por bloques (n = 6). El médico radiólogo que realizaba el diagnóstico por ecografía-Doppler desconocía el grupo en el que estaba incluido el paciente.
Sujetos de estudio
Todo paciente mayor de 18 años al que se implantó por primera vez un marcapasos definitivo, uni o bicameral, y que no cumplía un criterio de exclusión: imposibilidad para seguir el tratamiento correctamente; hemorragia activa; antecedentes de hemorragia subaracnoidea, aneurisma o tumor en el sistema nervioso central, u otras lesiones potencialmente sangrantes conocidas; diátesis hemorrágica grave o alteraciones de la hemostasia conocidas (INR > 1,5, plaquetas < 50.000/μl); cirugía mayor en los 5 días previos a la inserción; pericarditis con derrame; embarazo en curso; insuficiencia renal que requiera diálisis; tratamiento con ticlodipina o triflusal; anticoagulado previamente por cualquier motivo.
Número de pacientes
Para una hipótesis unilateral (el tratamiento disminuye la frecuencia de trombosis de un 40 a un 20%) y asumiendo un riesgo alfa del 5% y un riesgo beta del 20% (potencia = 1 beta 80%) el tamaño de la muestra se estableció en 64 pacientes por grupo; por tanto, 128 pacientes.
Electrodos empleados
St Jude Medical: 1450 T, 1470 T, 1358 AV plus y Tendril DX 1388T. Medtronic: Capsure 5024 y 5038. Guidant-CPI: 4285. Biotronik: Synox SX 60 BP. ELA Medical: Stela BT 46. Todos son bipolares, conexión IS-1, fijación pasiva (excepto Tendril DX 1388T), con una longitud de 58-60 cm, liberadores de corticoides en la punta (excepto Synox SX 60 BP y Stela BT 46), y emplean el MP35N como conductor eléctrico y silicona como aislante. Sus diámetros varían entre 2 y 2,6 mm (tabla 1).
Período de inclusión
Iniciamos la inclusión de pacientes el día 1 de abril de 1998 y la concluimos en octubre de 1999. Todos los pacientes han sido evaluados clínica y ecográficamente durante un año.
Ámbito del estudio
Hospital Donostia, ámbito terciario, población de referencia: 675.000 habitantes.
Variables independientes
Se han analizado las siguientes variables independientes: sexo; edad en años; antecedentes relacionados con enfermedad tromboembólica; medicación previa; diámetros (mm) de las venas subclavias derechas e izquierdas (medidas por técnica ultrasonografica en cada exploración); tipo de marcapasos; técnica y vía de implantación; tipo de material aislante y diámetro (mm) del electrodo; bioquímica sanguínea en el momento del implante: glucosa (mg/dl), urea (mg/dl), creatinina (mg/dl), cloro (mEq/l), sodio (mEq/l), potasio (mEq/l), GPT (U/l), hematíes (106/ml), hemoglobina (g/dl), leucocitos (103/ml), plaquetas (103/ml), tiempo de protrombina (INR) y tiempo tromboplastina parcial activado (s); complicaciones postimplantación, y efectos secundarios de la anticoagulación: dosis dependiente o independiente.
En el grupo de tratamiento, los estudios de coagulación (INR) se han realizado a la semana y al mes de la implantación, con muestras de sangre venosa extraídas al paciente, recogidas en tubos con citrato al 3,8%, centrifugadas a 3.000 rpm durante 15 min y procesadas en un coagulómetro ACL Futura (Instrumentation Laboratory). La tromboplastina utilizada fue tromboplastina IL TestTM PT-Fibrinogen HS (isi 1,30) (Instrumentation Laboratory). Si en alguno de los controles previstos, el INR superó 1,5, la dosis se redujo un 50%, y se efectuó un nuevo control a la semana.
Variables dependientes
Las variables dependientes para el diagnóstico de trombosis se recogieron en el ingreso, a las 24 h, al primer mes, al tercero, al sexto, y al año postimplante, comparando ambos lados, y fueron:
Clínicas: dolor, tumefacción, rubefacción, aumento de la temperatura e impotencia funcional de la extremidad ipsilateral al electrodo.
Ecográficas: a) visualización directa del trombo (T); b) ausencia de compresión de vena (C), y c) desarrollo de circulación colateral (V).
Doppler: a) ausencia de flujo espontáneo (S), y b) ausencia de cambios fásicos con la respiración o perturbación del flujo con relación al lado contralateral o a un examen previo (P).
Criterios diagnósticos
La exploración fue considerada normal cuando las variables estudiadas eran similares en el lado invadido y en el no invadido. Se consideró criterio clínico de trombosis la presencia de al menos 2 síntomas o signos en el brazo ipsilateral al electrodo de marcapasos y criterio ecosonográfico la presencia ipsilateral al electrodo de marcapasos de: T + P, P + S y T + P + S.
Los estudios ecográficos y Doppler de venas superiores se han llevado a cabo con un equipo Doppler color Sonolayer SSA-270A de Toshiba, un transductor lineal de 3,75 Mhz y un transductor sectorial de 7,5 Mhz. Éstos se han realizado de forma bilateral en venas axilares y subclavias con el paciente en decúbito supino y los brazos en abducción de 90°. Las imágenes ecográficas y de Doppler se han hecho en cortes transversales y longitudinales, así como en respiración basal y en inspiración profunda.
Análisis de datos
Las variables cuantitativas se midieron con la media (desviación estándar [DE]) y las variables cualitativas mediante distribución de frecuencias. Las diferencias entre proporciones fueron analizadas por el test de la χ2 o con el test exacto de Fisher para muestras pequeñas. Para la comparación de medias se utilizó la prueba de la t de Student. La igualdad de varianzas se comprobó con el test de Levene. La significación estadística se definió como un valor de p < 0,05. El análisis se realizó con el programa SPSS 10.0 para Windows.
El ensayo clínico ha sido aprobado por el Comité de Ensayos Clínicos del Hospital Donostia. Todos los pacientes fueron informados sobre éste y firmaron el consentimiento elaborado a tal fin.
El ensayo ha sido financiado parcialmente por el Fondo de Investigación Sanitaria del Instituto Carlos III, Ministerio de Sanidad y Consumo Español y ha obtenido el primer Premio St Jude Medical España, otorgado por la SEMICYUC (Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias).
RESULTADOS
El número de pacientes incluidos en el estudio fue de 130, asignándose 62 al grupo de tratamiento y 68 al de control. Concluyeron el estudio completamente 124 (95,38%). Se excluyó a 6 pacientes, 3 por fallecimiento (2,3%) y 3 por otras causas (2,3%). Las causas de fallecimiento fueron: linfoma, cáncer de pulmón y muerte no relacionada con el marcapasos. Las otras causas de exclusión fueron: sospecha de tromboembolia pulmonar (pertenecía al grupo de tratamiento y se descartó trombosis en venas superiores), cáncer de pulmón y ACVA no hemorrágico.
La edad media (DE) fue de 71,9 (10,8) años en el grupo de tratamiento y 71,91 (12,4) años en el grupo de control; no se apreciaron diferencias estadísticamente significativas (p = NS).
La relación varones:mujeres fue de 43:19 en el grupo de tratamiento y de 40:28 en el grupo de control, sin que las diferencias fueran estadísticamente significativas (p = NS).
Los datos bioquímicos hemáticos realizados en el momento del implante no mostraron diferencias estadísticamente significativas (p = NS) entre el grupo de control y el grupo de tratamiento.
Diámetros de las venas subclavia derecha e izquierda (tabla 2)
No se hallaron diferencias estadísticamente significativas entre los diámetros de las venas que alojan el electrodo comparadas con su lado contralateral (p = NS).
Antecedentes relacionados con enfermedad tromboembólica
Se encontraron en 4 pacientes (3,1%): 3 en el grupo de tratamiento (4,9%) y uno en el grupo de control (1,5%), no siendo la diferencia estadísticamente significativa (p = NS). Todos los antecedentes consistieron en flebitis de extremidades superiores o inferiores, y ninguno de los pacientes presentó trombosis clínica ni ecográficamente.
Medicación previa
Antes de la implantación del marcapasos tomaban medicación 47 pacientes (70,1%) en el grupo de tratamiento frente a 35 (57,4%) en el grupo de control: antagonistas del calcio (el 10,4 frente al 11,4%), inhibidores de la enzima de conversión de la angiotensina (IECA) (el 25,4 frente al 19,7%), diuréticos (el 17,9 frente al 9,8%), ácido acetilsalicílico (el 14,9 frente al 21,3%) y antiarrítmicos (el 10,4 frente al 9,8%), diferencias que no fueron estadísticamente significativas (p = NS).
Modo de estimulación
El modo indicado fue DDD-R 25 (19,2%), VDD-R 53 (40,8%), AAI-R 4 (3,1%) y VVI-R 48 (36,9%). La distribución entre los grupos de control y de tratamiento no mostró diferencias estadísticamente significativas (p = NS) (fig. 1).
Figura 1. Modo de estimulación indicado.
Técnica y vía de implantación
En 129 pacientes (99,2%) se empleó la técnica de punción o doble punción de la vena subclavia para introducir el/los electrodo/s, y en un paciente se empleó la disección de la vena cefálica.
El total de electrodos empleados durante el estudio fue de 155; St Jude Medical 52 (33,5%), Medtronic 81 (52,2%), Guidant 2 (1,3%), Biotronik 8 (5,1%) y ELA 12 (7,7%). La distribución entre los grupos de control y de tratamiento no evidenció diferencias estadísticamente significativas (p = NS) (fig. 2).
Figura 2. Electrodos empledados. St. Jude Medical: 1450T, 1470T, 1388T y 1358 AV Plus. Medtronic: 5024 y 5038. Guidant: 4285. Biotronik: Synox SX60BP. ELA: Stelabt 46.
Dosificación del acenocumarol
En todos los pacientes se indicó una dosis de 1 mg cada 24 h. En 6 casos (9,6%) se requirió disminuir la dosis y realizar un nuevo control a la semana para confirmar que el INR estaba por debajo de 1,5. En un paciente, y ante la presencia de pericarditis aguda, su médico de familia le suspendió el tratamiento. No se relató ninguna complicación referente al tratamiento.
Complicaciones de la implantación del marcapasos
Detectamos complicaciones en 8 pacientes (6,1%): 5 (8%) en el grupo de tratamiento y 3 (4,4%) en el grupo de control, sin apreciarse diferencias significativas (p = NS). Las complicaciones halladas a las 24 h fueron 6 (4,6%): 4 en el grupo de tratamiento (3 precisaron nueva intervención quirúrgica estimulación del nervio frénico, dislocación del electrodo ventricular y mala implantación del electrodo ventricular y una por hematoma de bolsillo) y 2 en el grupo de control (dislocación del electrodo auricular y ventricular que requirieron intervenciones quirúrgicas en un caso se explantó el sistema, implantando un nuevo generador y un electrodo de fijación activa en el lado contralateral). En el primer mes un paciente del grupo de tratamiento presentó signos de pericarditis por lo que su médico de cabecera suspendió la administración de acenocumarol. Al tercer mes un paciente del grupo de control requirió intervención quirúrgica para recolocar un electrodo ventricular dislocado. Ninguno de estos pacientes ha desarrollado trombosis clínica ni ecográficamente.
El 98,5% de los pacientes a los que se implantó un marcapasos se ha mantenido asintomático respecto a trombosis de venas superiores durante el estudio. Asimismo, el 77% de los pacientes presentó una exploración ecográfica y Doppler normal a las 24 h del implante, el 70% al primer mes, el 73% al tercero, el 69% al sexto y el 70% al año.
Pacientes con trombosis (tabla 3)
Cuatro pacientes cumplieron criterios ecográficos (3,2%); 2 presentaron síntomas (1,5%; uno del grupo de control y otro del grupo de tratamiento) y 2 no lo hicieron (1,5%; uno del grupo de control y otro del grupo de tratamiento); 2 estaban en el grupo de control y 2 en el grupo de tratamiento (p = NS). Los síntomas o criterios ecográficos han aparecido entre el quinto y el sexto mes. En cada modo de estimulación se observó un paciente con trombosis (p = NS). Los 2 pacientes sintomáticos fueron tratados con anticoagulación a dosis terapéutica, y mejoraron clínica y ecográficamente (a los 12 meses no presentaban signos ecográficos de trombosis). Uno de los pacientes asintomáticos (AAI) presentaba persistencia de trombosis en la ecografía.
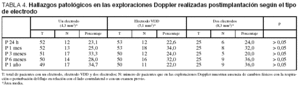
En las exploraciones realizadas con Doppler sobre las venas que alojaban los electrodos, detectamos un porcentaje importante de pacientes (tabla 3) que presentaba ausencia de cambios fásicos con la respiración con relación al lado contralateral o un examen previo. Sin embargo, debemos señalar que cuando comparamos a los pacientes (tabla 4) a quienes se había implantado un electrodo único con los que recibieron 2 electrodos o un electrodo tipo VDD (mayor grosor) no se apreciaron diferencias estadísticamente significativas (p = NS).
DISCUSIÓN
Al comparar los resultados obtenidos en el grupo de control y en el de tratamiento, en cuanto a edad, sexo, antecedentes tromboembólicos, medicación previa, analítica sanguínea, técnica, vía de implantación, diámetros de las venas subclavia derecha e izquierda, electrodos empleados, modo de estimulación seleccionado y número de complicaciones, observamos que no hay diferencias estadísticamente significativas, lo que nos permite asegurar que ambos grupos son homogéneos.
La edad media (71,9 años) de los enfermos incluidos en nuestro ensayo clínico es inferior a la observada en la Base de Datos Nacional3 (75,1); de igual forma, el modo de estimulación VDD-R (40,8%) y VVI-R (36,9%) no se ajusta a la distribución habitual de nuestro entorno: VDD-R (24%) y VVI-R (46,1%). Estos hechos se podrían explicar por el protocolo del ensayo, ya que se excluyó a los pacientes con tratamiento anticoagulante previo, siendo éstos, por lo general, personas de edad avanzada y en fibrilación auricular crónica, a quienes se les coloca fundamentalmente un marcapasos VVI-R. Es necesario destacar, por otro lado, que sólo se emplearon electrodos cuyo material aislante era silicona; por tanto, nuestros resultados quedan exclusivamente limitados a este material.
Encontramos trombosis en la vena que alojaba el electrodo del marcapasos en 4 pacientes, lo que representa una prevalencia del 3,2%6. El 50% de estas trombosis fueron asintomáticas. Antes del tercer mes postimplante ningún paciente desarrolló trombosis, y éstas aparecieron entre el quinto y el sexto mes. No se encontró ninguna variable con la que se pudiera relacionar la aparición de trombosis, habiéndose estudiado, edad, tratamiento preventivo, diámetro de la vena subclavia, implantación de uno o más electrodos, mayor número de complicaciones que requiriesen reintervenciones o antecedentes de enfermedad tromboembólica10.
En los estudios ecosonográficos hallamos ausencia de cambios fásicos con la respiración o perturbación del flujo, con relación al lado contralateral o a un examen previo, en el 23% de los pacientes a las 24 h de implantar el/los electrodo/s; este valor aumenta al 30% en el primer mes, y se mantiene en valores similares a los 3, 6 y 12 meses. No encontramos diferencias estadísticamente significativas entre el grupo de tratamiento y el de control, y tampoco entre los pacientes en cuyas venas se alojaban un electrodo simple, un electrodo VDD o dos electrodos8. Este hecho, que no tiene trascendencia clínica, en ningún caso puede interpretarse como trombosis. En nuestra opinión no hay una clara explicación, y barajamos la posibilidad de vasospasmo, pero no encontramos diferencias en el diámetro de la vena que aloja el electrodo y su lado contralateral. También hemos pensado en la posibilidad de una obstrucción mecánica al flujo sanguíneo secundaria a la presencia del electrodo en la luz vascular, pero esto se ha descartado, ya que una vez aparecida debería haberse mantenido en las siguientes exploraciones y en nuestro estudio este hecho no fue constante, ya que lo observamos aisladamente y consecutivamente o no en 2 o más exploraciones.
Nuestros resultados respecto la prevalencia de trombosis venosa (3,2%) y de exploraciones ecográficas y Doppler normales (70%) difieren sustancialmente de los publicados por otros autores, como Spitell y Hayes5 (30-45%), Antonelli et al4 (8%), Goto et al7 (23%), de Cock et al8 (15%), Zuber et al9 (11%) y Lin et al10 (5,5%), si bien con este último ha sido en menor medida. Aunque no podemos explicar cuál es la causa de esta discordancia podríamos sugerir y preguntarnos las siguientes cuestiones:
1. Al ser la mayoría estudios retrospectivos y no prospectivos, ¿es posible que en los resultados no estén englobados todos los pacientes?
2. Al contrario que en nuestro ensayo, en que se utilizó silicona como material aislante, se han utilizado otros materiales como el poliuretano. ¿Es posible que el poliuretano sea más trombogénico?
3. En estos estudios ha transcurrido más tiempo desde el implante al diagnóstico. ¿Es posible que con el paso del tiempo y por mecanismos desconocidos se produzcan más estenosis y secundariamente trombosis?
4. Diferentes métodos y definiciones en cuanto al diagnóstico de trombosis. Nosotros hemos utilizado un método diagnostico con una alta sensibilidad (94%) y especificidad (96-100%)13-15, pero ¿es posible que con venogramas hubiéramos detectado mas trombosis?
Respecto al objetivo secundario del estudio, podemos concluir que el tratamiento profiláctico con acenocumarol a dosis bajas no ha sido efectivo en cuanto a la prevención de la trombosis7, ni en cuanto a los trastornos hallados en el Doppler, en oposición al beneficio descrito en otras enfermedades con trombosis venosas11-12.