INTRODUCCION
La utilización de diferentes sistemas destinados a valorar la gravedad para establecer el pronóstico vital de los pacientes críticos es una práctica habitual en muchas unidades de cuidados intensivos (UCI). En estos momentos disponemos de diversos sistemas de valoración de la gravedad y predicción del pronóstico: APACHE, SAPS, MPM, con sus diferentes actualizaciones. Respecto al rendimiento de los modelos, se han encontrado grandes diferencias en la exactitud predictiva cuando se aplican a poblaciones diferentes de las incluidas en los estudios originales1. Entre las poblaciones en las que estos índices han demostrado una menor exactitud se encuentra la de los enfermos que precisan ventilación mecánica2-4, que constituye alrededor de un 30% de los pacientes ingresados en las UCI5.
Los objetivos de este estudio son conocer las variables que se asocian a la mortalidad de los enfermos que precisan ventilación mecánica durante más de 12 h, evaluar la capacidad de predicción de la mortalidad hospitalaria del SAPS II en enfermos en ventilación mecánica y determinar si algún modelo mejora esta capacidad predictiva.
PACIENTES Y MÉTODO
En 72 UCI se llevó a cabo un estudio de cohortes de todos los pacientes ingresados en la unidades participantes y que recibieron ventilación mecánica durante más de 12 h consecutivas entre el 1 y el 31 de marzo de 1998. El investigador designado en cada Unidad era el único que conocía el protocolo, con el fin de evitar cualquier influencia en el manejo habitual de los enfermos. A cada investigador se le proporcionó un manual que describía los datos a recoger y las definiciones.
Para el propósito de este trabajo se dividieron las variables recogidas en tres grupos:
1. Variables previas al inicio de la ventilación mecánica. Datos demográficos: sexo, edad, peso, fecha de ingreso en la Unidad, puntuación del Simplified Acute Physiology Score II (SAPS II) en el momento del ingreso, así como la fecha de inicio de la ventilación mecánica y la causa que motivó el inicio de la ventilación mecánica: a) enfermedad pulmonar obstructiva crónica (EPOC), incluyendo a los enfermos con reagudización de la enfermedad pulmonar crónica debido a infección, broncospasmo, insuficiencia cardíaca o cualquier otra causa de exacerbación; b) asma; c) coma, incluyendo a los pacientes que requirieron ventilación mecánica por una disminución del nivel de conciencia secundaria a causas orgánicas o metabólicas; d) enfermedad neuromuscular; e) enfermedad pulmonar crónica diferente de la EPOC, incluidos los enfermos con enfermedad pulmonar restrictiva que presentaron una reagudización; f) insuficiencia respiratoria aguda, donde se incluyó a los pacientes que, no teniendo una enfermedad pulmonar crónica, precisaron ventilación mecánica debido a una de las siguientes causas:
* Síndrome de distrés respiratorio agudo (SDRA) definido según la Conferencia de Consenso Americana-Europea6.
* Postoperatorio, incluidos los pacientes que precisaron una prolongación de la ventilación mecánica tras una intervención quirúrgica debido a la enfermedad de base, edad avanzada o cirugía de alto riesgo.
* Insuficiencia cardíaca/edema agudo de pulmón, pacientes con disnea, infiltrado alveolar bilateral, hipoxemia y evidencia de enfermedad cardíaca o pacientes con shock cardiogénico.
* Aspiración, definida como visualización de contenido gástrico en la vía aérea o en el aspirado traqueal.
* Neumonía, definida por la aparición de infiltrado alveolar persistente acompañado de fiebre/hipotermia y leucocitosis/leucopenia.
* Sepsis, definida según los criterios de la Conferencia de Consenso de la ACCP/SCCM7.
* Traumatismos: pacientes que requerían ventilación mecánica debido a lesiones de tórax, abdomen y/o cabeza producidas por un traumatismo.
* Parada cardiorrespiratoria: pacientes que requerían ventilación mecánica tras el cese súbito e inesperado de las funciones cardiopulmonares.
En el caso que un paciente tuviese más de una causa, el investigador registró la causa dominante.
2. Variables aparecidas durante la ventilación mecánica. En este grupo se han valorado las variables asociadas con el tratamiento del enfermo: parámetros ventilatorios volumen tidal, frecuencia respiratoria, PEEP, fracción inspirada de oxígeno, presión pico y presión plateau, la gasometría más cercana al registro de los parámetros ventilatorios y la utilización de relajantes musculares, sedantes (opiáceos, benzodiacepinas y propofol) y fármacos vasoactivos y las siguientes complicaciones aparecidas durante la ventilación mecánica: necesidad de intubación en pacientes en los que se inició ventilación no invasiva, síndrome de distrés respiratorio agudo, barotrauma, neumonía asociada a ventilación mecánica, sepsis, shock, fracaso renal agudo, fallo hepático, coagulopatía, acidosis metabólica y acidosis respiratoria (para considerar presente alguno de estos acontecimientos se requería que se mantuviese durante al menos 24 h). Dado que el SDRA, la sepsis y la neumonía podían ser motivo para el inicio de la ventilación mecánica, se consideraron complicaciones cuando aparecían con posterioridad a las primeras 48 h de inicio de la ventilación. Las definiciones de las complicaciones mencionadas se exponen en el apéndice.
El seguimiento de los pacientes se realizó hasta el alta del hospital, registrándose los días de ventilación mecánica, de weaning, los días de estancia en la UCI y la situación vital en el momento del alta.
Análisis estadístico
Los resultados se expresan como media y desviación estándar, mediana con percentiles 25 y 75 o proporciones con intervalo de confianza (IC) del 95%, según fuese más apropiado. El objetivo primario fue la mortalidad hospitalaria.
Las variables categóricas fueron codificadas como 0 (ausencia) o 1 (presencia). Algunas de las variables continuas edad, SAPS II, la peor relación PaO2/FiO2, la PEEP y el volumen tidal, fueron categorizadas utilizando como puntos de corte los que fueron clínicamente relevantes y codificadas como variables dummy, que comparan todas las categorías con la categoría que tiene la mortalidad más baja. El resto de las variables continuas presión pico y presión plateau fue dicotomizodo usando puntos de corte previamente publicados o considerados de relevancia clínica.
Para valorar la influencia de cada variable en la mortalidad hospitalaria se realizaron dos análisis de particiones recursivas8: el primero, con las variables presentes al inicio de la ventilación mecánica (excepto las variables que ya están incluidas en el cálculo del SAPS II: edad, tipo de problema y coma) y el segundo, añadiendo al primero las variables aparecidas durante la ventilación mecánica, los días totales de soporte respiratorio y los días de estancia en la UCI. En ambos modelos se utilizaron las variables que presentaron significación estadística en el análisis univariante. Con el análisis de particiones recursivas se construyó, inicialmente, un árbol de clasificación introduciendo las variables previamente mencionadas. Este método identifica el punto de corte o valor umbral, para cada variable, que proporciona la mejor separación entre los enfermos que sobreviven y los que fallecen. Para las variables continuas, el potencial valor umbral es cualquiera de los valores representados en los datos, mientras que en las variables dicotómicas, el punto de corte se establece entre la ausencia o la presencia de una categoría. Para las variables con varias categorías, el programa agrupa en las dos subcategorías que mejor clasifiquen a los enfermos. Las particiones empiezan tras evaluar la capacidad de cada variable para separar a los fallecidos de los supervivientes; así, la variable que da lugar a la mejor división se convierte en la primera rama del árbol. Este procedimiento se repite para cada uno de los dos subgrupos que han resultado de la primera división, hasta que no sea posible obtener más particiones por no haber diferencias significativas entre fallecimientos y supervivientes o haya menos de 25 enfermos en uno de los grupos resultantes. Este método, además de dibujar un árbol de clasificación, nos permite obtener subgrupos de enfermos con diferentes combinaciones de variables asociadas que conllevan distinto riesgo de mortalidad. Una vez identificados los subgrupos de riesgo, se realiza un modelo de regresión logística para estimar la odds ratio de cada subgrupo. Los subgrupos obtenidos se introducen en el modelo como una variable dummy, que compara cada subgrupo con el que tiene una menor mortalidad. Para la obtención del modelo se utilizaron dos terceras partes de la muestra total escogida aleatoriamente (grupo de desarrollo).
Con el objeto de validar la predicción de la mortalidad hospitalaria, se aplicaron los modelos obtenidos en este estudio y el SAPS II al tercio de los enfermos restante (grupo de validación). Para evaluar su capacidad predictiva se llevó a cabo una medida de calibración (exactitud de las predicciones de riesgo hechas por los modelos), con el método de Lemeshow y Hosmer (cuando la mortalidad predicha por un modelo difiere significativamente de la observada, se considera que el modelo no calibra bien y el estadístico χ2 tendrá una p < 0,05)9 y una medida de discriminación (capacidad de los modelos para separar entre pacientes que sobreviven y pacientes que fallecen), para lo cual se calculó el área bajo la curva ROC de cada modelo (se considera que un modelo discrimina bien cuando esta área es mayor de 0,80).
RESULTADOS
Durante el período de estudio 1.103 enfermos precisaron ventilación mecánica durante más de 12 h. Fueron excluidos del análisis 55 enfermos por desconocer su estado vital en el momento del alta hospitalaria. En la tabla 1 se exponen las características de los enfermos de los grupos de desarrollo y de validación.
La mortalidad hospitalaria observada en el grupo de desarrollo del modelo fue de un 43% (IC del 95%, 39-47) mientras que la mortalidad predicha por el SAPS II fue de un 36%.
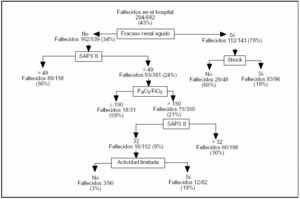
En el análisis de particiones recursivas que se observa en la figura 1 se identifican las variables asociadas a la mortalidad en el modelo que incluye todas las variables, ya que es el que mejor predice la mortalidad hospitalaria: desarrollo de fracaso renal agudo, shock e hipoxemia (definida como una relación PaO2/FiO2 < 150) durante la ventilación mecánica, gravedad estimada por el SAPS II en el ingreso en la UCI y una actividad basal limitada. La combinación de estas variables identifica a los subgrupos de riesgo que mejor discriminan a la población estudiada. En la tabla 2 se expone el resultado del análisis multivariante con los subgrupos de riesgo obtenidos. Los 7 subgrupos se pueden agrupar en 3 categorías basadas en su probabilidad de muerte; así, obtenemos una primera categoría, con una alta mortalidad (87%), constituida por los enfermos en los que se asocian factores de riesgo desarrollados durante la ventilación mecánica: fracaso renal y shock (OR = 198,6; IC del 95%, 54,3-725,5). La segunda categoría, con una mortalidad intermedia (30-60%), está constituida por enfermos que durante la ventilación mecánica presentan fracaso renal agudo, sin shock (OR = 43,8; IC del 95%, 12,1-158,1), o hipoxemia grave (OR = 39,7; IC del 95%, 10,3-153,3) o que presentan, en el momento de su ingreso en la UCI, una alta gravedad estimada por una puntuación SAPS II > 49 (OR = 37,0; IC del 95%, 11,3-121,5). Por último, existe una categoría, con una mortalidad inferior al 30%, que comprende a los enfermos cuyos factores de riesgo más importantes son: presentar en el momento del ingreso un nivel de gravedad intermedio, definido como una puntuación SAPS II entre 32 y 49 puntos (OR = 12,5; IC del 95%, 3,8-40,8), o una actividad limitada previamente al ingreso en la UCI (OR = 6,9; IC del 95%, 1,9-25,4).
Figura 1.
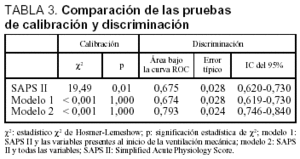
En la tabla 3 se expone la comparación cualitativa de los resultados numéricos de las pruebas de calibración y discriminación resultantes de la aplicación de los modelos obtenidos en este estudio y el SAPS II al grupo de validación.
DISCUSION
Los índices para la predicción de la mortalidad se utilizan habitualmente en las UCI con el objetivo de comparar la calidad en el cuidado de los pacientes entre diferentes unidades y poder establecer el pronóstico de un enfermo, lo cual podría ser útil en la toma de decisiones clínicas. Sin embargo, las diferentes características de los pacientes y los distintos tratamientos empleados, de acuerdo con el lugar y el tiempo, limitan el uso de estos índices a la hora de tomar decisiones10.
La principal limitación en el uso de estos modelos es el tipo de pacientes al que se aplica. Así, la evaluación del SAPS II, que fue el índice que escogió nuestro grupo para la evaluación de la gravedad de los enfermos incluidos en el estudio, presenta una exactitud predictiva muy diversa cuando se aplica a grupos homogéneos de enfermos. Martínez Alario et al11 observaron que el SAPS II tiene una buena calibración (χ2 = 5,16) pero una discutible discriminación (área bajo la curva ROC = 0,771) en la predicción de la mortalidad hospitalaria de una población de 456 pacientes tras una intervención quirúgica cardíaca. Del Bufalo et al12 tampoco encontaron una buena discriminación (área bajo la curva ROC = 0,735) cuando aplicaron el SAPS II a una cohorte de 306 enfermos ingresados en una unidad respiratoria de cuidados intensivos. Otros resultados son los que encuentra el estudio de Auriant et al13, que pone de manifiesto una buena calibración (χ2 = 2,4; p > 0,5) y una buena discriminación del SAPS II para la predicción de la mortalidad (área bajo la curva ROC = 0,85) en una serie de enfermos ingresados en una unidad de cuidados intermedios.
En lo que se refiere a la población objeto de nuestro estudio, los enfermos que precisan ventilación mecánica durante más de 12 h, tampoco el SAPS II ha demostrado una adecuada exactitud en la predicción de la mortalidad. Así, en el estudio de Portier et al14, realizado sobre 332 enfermos con enfermedad pulmonar crónica que precisaron ventilación mecánica durante más de 24 h, no fue posible establecer una relación entre mortalidad y SAPS.
En nuestro estudio observamos que la predicción de la mortalidad obtenida con el SAPS II medido en las primeras 24 h de ingreso en la UCI presenta una mala calibración (χ2 = 10,76; p < 0,05) y un escaso poder de discriminación (área bajo la curva ROC = 0,675). Considerando que alguno de los factores presentes en el momento de iniciarse la ventilación mecánica que se relacionan con la mortalidad (actividad limitada, motivo para iniciarse la ventilación mecánica) pudieran mejorar la exactitud predictiva, se determinó un nuevo modelo que mejoró significativamente la calibración, pero no la discriminación.
Una de las posibles explicaciones para la falta de precisión de estos sistemas de gravedad es su carácter estático. Es decir, el pronóstico se realiza a partir de los datos recogidos en las primeras 24 h de ingreso en la unidad, sin tomar en consideración la evolución del enfermo durante su estancia en la UCI. En los últimos años se han desarrollado los Mortality Probability Models (MPM), que establecen el pronóstico de forma dinámica a lo largo de la evolución clínica (MPMII-0, MPM II-24 y MPM II-48)15. En un estudio comparativo de estos modelos con los modelos tradicionales (APACHE y SAPS) medidos los días primero y segundo de estancia en la UCI, los MPM proporcionaron una mejor predicción de mortalidad16. En un sentido similar se sitúan los hallazgos de Rue et al17, quienes calcularon el MPM II en el momento del ingreso y durante los primeros 7 días de estancia en la UCI, concluyendo que para obtener una exacta predicción del pronóstico es necesario actualizar diariamente la medida de la gravedad. Basándonos en estas observaciones, desarrollamos un nuevo modelo añadiendo al SAPS II y a las variables presentes al inicio de la ventilación mecánica los factores presentes durante la ventilación mecánica, tanto los relacionados con el manejo del enfermo como las disfunciones orgánicas que aparecieron durante el soporte ventilatorio. Con este modelo se consigue una calibración similar al modelo con las variables al inicio de la ventilación mecánica, pero mejoró ligeramente la discriminación, llegando el área bajo la curva ROC casi al límite de lo que se considera una buena discriminación.
En conclusión, en una cohorte de enfermos ventilados mecánicamente durante más de 12 h, el SAPS II ha demostrado ser un predictor discutible de la mortalidad hospitalaria. La inclusión en el modelo de factores previos al inicio de la ventilación mecánica y de otros aparecidos durante el soporte ventilatorio, que en nuestro estudio se relacionan con la mortalidad hospitalaria, podrían mejorar la exactitud predictiva del SAPS II.
*El Grupo español del International Mechanical Ventilation Study Group ha estado constituido por:
J.M. Allegre (Hospital Nuestra Señora del Rosell, Cartagena); S. Alonso (Hospital Joan XXIII, Tarragona); A. Álvarez Ruiz (Hospital General Río Carrión, Palencia); B. Álvarez Sánchez (Hospital General, Alicante); M.T. Antuna (Hospital de Cabueñes, Gijón); J.M. Añón (Hospital Virgen de la Luz, Cuenca); P. Arribas (Hospital 12 de Octubre, Madrid); A. Ayensa (Hospital Virgen de la Salud, Toledo); A. Azcárate (Hospital Nuestra Señora de Aránzazu, Donostia); J. Blanco (Hospital del Río Hortega, Valladolid); L. Cabré (Hospital de Barcelona, Barcelona); F. Carrizosa (Hospital General, Jérez de la Frontera); J. Castañeda (Hospital Clínico, Valladolid); R. de Celis (Hospital de Galdakao, Galdakao); J.A. Conesa (Hospital Clínico Universitario San Carlos, Madrid); J. Diarte (Complejo Hospitalario, Ciudad Real); A. Díaz Lamas (Complejo Hospitalario Cristal Piñor, Orense); R. Fernández (Consorci Hospitalari del Parc Taulí, Sabadell); M. Ferrer (Hospital Clínic i Provincial, Barcelona); D. Fontaneda (Hospital Virgen Blanca, León); P. Galdós (Hospital General, Móstoles); A. García Jiménez (Hospital Arquitecto Marcide, El Ferrol); J. García Pardo (Hospital Juan Canalejo, La Coruña); G. González Díaz (Hospital Morales Meseguer, Murcia); C. Homs (Hospital General San Jorge, Huesca); J. Ibáñez (Hospital Son Dureta, Palma de Mallorca); M. León (Hospital Arnau de Vilanova, Lleida); A. Lloria (Complejo Hospitalario Rebullón, Pontevedra); J. López Díaz (Hospital La Paz, Madrid); M.R. Lorenzo (Complejo Hospitalario Materno-Insular, Las Palmas); S. Macías (Hospital General, Segovia); J.A. Maldonado (Hospital de la Serranía, Ronda); J. Maynar (Hospital Santiago Apostol, Vitoria); A. Moreno (Complejo Hospitalario de San Millán-San Pedro, Logroño); A. Mota (Hospital General Universitario, Elche); T. Mut (Hospital General, Castellón); M. Nolla (Hospital General de Cataluña, Sant Cugat del Vallés); F. Ortega (Hospital Universitario de Valme, Sevilla); E. Palazón (Hospital General Universitario, Murcia); V. Parra (Hospital de Sagunto, Sagunto); A. Peral (Hospital Gregorio Marañón, Madrid); J.C. Portela (Complejo Hospitalario Xeral-Calde, Lugo); A. Ramírez (Hospital Nuestra Señora de Sonsoles, Ávila); J.A. Ramos (Hospital de Poniente, El Ejido); M. Rey (Complejo Hospitalario, Santiago de Compostela); J.J. Rodrigo (Hospital Nuestra Señora del Pino, Las Palmas de Gran Canaria); J.C. Rodríguez Borregan (Hospital Marqués de Valdecilla, Santander); J.A. Rodríguez Sarria (Hospital General, Elda); A. Rubio (Hospital Ramón y Cajal, Madrid); S. Ruiz Navarro (Hospital General Ciudad de Jaén, Jaén); V. Sagredo (Hospital Virgen de la Vega, Salamanca); M.J. Serralta (Hospital Universitario de San Juan, Alicante); J.F. Solsona (Hospital del Mar, Barcelona); F. Suárez Sipmann (Fundación Jiménez Díaz, Madrid); F. Taboada (Hospital General de Asturias, Oviedo); S. Temprano (Hospital Severo Ochoa, Leganés); J.P. Tirapu (Hospital de Navarra, Pamplona); M.V. de la Torre (Hospital Universitario Virgen de la Victoria, Málaga); P. Ugarte (Hospital Marqués de Valdecilla, Santander); M. Valledor (Hospital de San Agustín, Avilés); C. Vaquerizo (Hospital 12 de Octubre, Madrid); A. Viñuales (Hospital Lluis Alcanyis, Xátiva).
GLOSARIO
Acidosis metabólica. Se definió como un pH menor de 7,30 con una PaCO2 menor de 45 mmHg.
Acidosis respiratoria. Se definió como un pH menor de 7,35 con una PaCO2 mayor de 55 mmHg.
Barotrauma. Presencia de al menos uno de los siguientes hallazgos: enfisema intersticial, neumotórax, neumomediastino, neumoperitoneo, enfisema subcutáneo.
Coagulopatía. Disminución de al menos un 25% en el recuento de plaquetas, con un aumento en el tiempo de protrombina de al menos dos veces el valor control.
Fallo hepático. Se definió como un aumento en la bilirrubina por encima de 2 mg/dl con incremento de las transaminasas y de la LDH dos veces por encima del límite superior de la normalidad.
Fracaso renal agudo. Se definió como un aumento agudo en la creatinina mayor de 2 mg/dl, o que se doblara el valor basal en un paciente con fracaso renal crónico y/o la necesidad de cualquier método de depuración renal.
Neumonía asociada a la ventilación mecánica. Fue definida de acuerdo con los criterios modificados de los CDC (CDC definitions for nosocomial infections, 1988. Am Rev Respir Dis 1989; 139:1058-9).
SDRA. Fue definido de acuerdo con los criterios de la conferencia de consenso Americano-Europea (Bernard GR, Artigas A, Brigham KL, et al. The American-European Consensus Conference on ARDS: definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med 1994;149: 818-24).
Sepsis y shock. Fueron definidos de acuerdo con los criterios de la conferencia de consenso ACCP-SSM (Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA. ACCP/SCCM Consensus Conference. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Chest 1992;101:1644-55).