INTRODUCCIÓN
En la población pediátrica, el traumatismo craneoencefálico (TCE) es la principal causa de muerte traumática y, además, es el responsable de secuelas tan graves como el retraso mental, la epilepsia infantil y la incapacidad física1-3.
La incidencia del TCE pediátrico en los países desarrollados es de aproximadamente 200 casos/100.000 niños/año, considerándose graves alrededor de un 7%, con una mortalidad próxima al 30% y una incidencia de secuelas de aproximadamente el 40%1,4-6.
La morbimortalidad del TCE se encuentra determinada por las lesiones primarias que se producen en el momento del traumatismo (relacionadas con el tipo de traumatismo y localización) y por las lesiones secundarias (hipoxia, isquemia, hipertensión endocraneal, etc.) cuyo efecto aparece tardíamente y sobre las que podemos actuar de forma preventiva mediante una resucitación y estabilización adecuadas4,7-8.
Los avances en el conocimiento fisiopatológico de los acontecimientos que se producen tras el TCE han permitido el desarrollo de nuevas medidas diagnósticas y terapéuticas. A pesar de ello, su morbimortalidad continúa siendo alta1,4-6,9. Por este motivo, se insiste en la búsqueda de sistemas de monitorización de la dinámica cerebral y de predicción pronóstica10-12.
Los objetivos del presente estudio han sido: a) conocer las características clínicas y evolutivas de los pacientes pediátricos con TCE grave (TCEG) ingresados en una unidad de medicina intensiva (UMI), y b) analizar los factores que influyen en la mortalidad.
PACIENTES Y MÉTODO
Durante el período comprendido entre agosto de 1983 y enero de 2001 ingresó en nuestra UMI un total de 262 pacientes pediátricos con TCE, de ellos 125 con TCEG. Sobre este último grupo se realizó el presente estudio.
Variables analizadas
1. Variables cuantitativas: edad, puntuación de la escala de Glasgow (GCS), tiempo de estancia en UMI.
2. Variables cualitativas: sexo, procedencia, causa del TCE, lesiones asociadas extracraneales, lesiones en la TAC craneal, secuelas objetivadas, existencia de hiperglucemia, anemia, shock o midriasis pupilar, necesidad de monitorización de la presión intracraneal (PIC) y saturación venosa yugular de oxígeno (SyO2), existencia de hipertensión intracraneal (HTC) y necesidad de ventilación mecánica.
Criterios utilizados
1. GCS: se utilizó el primer valor reflejado, una vez estabilizado el paciente, en la puntuación obtenida en la escala de Glasgow clásica13 o la modificada para pacientes pediátricos14. Esta última se diferencia de la primera únicamente en el apartado de respuesta verbal, que se puntúa de la siguiente manera: balbuceos (5 puntos), llanto irritable (4 puntos), llanto al dolor (3 puntos), queja o suspiro al dolor (2 puntos), ninguna respuesta (1 punto).
2. TCEG: puntuación GCS menor o igual a 8.
3. Paciente politraumatizado15-16: lesión grave en al menos 2 regiones corporales (cráneo/cerebro, tórax, abdomen, sistema musculoesquelético) o tres fracturas mayores. Lesión grave es aquella que se produce en: a) cráneo: inconsciencia o focalidad neurológica, rinorrea, otorrea o fractura facial; b) tórax: fracturas costales, fractura de esternón, neumotórax, hemotórax, contusión pulmonar, rotura aórtica, taponamiento cardíaco o rotura diafragmática; c) abdomen: laceración o contusión orgánica, y d) sistema musculoesquelético: fractura de cuerpo o arco vertebral, fractura de pelvis, fémur, tibia, húmero o amputación de miembros.
4. Lesión en la TAC: se utilizó la clasificación del Traumatic Coma Data Bank (TCDB)17, que se presenta en la tabla 1. Se consideró lesión encefálica difusa (LED) grave a la LED III y a la LED IV.
5. Shock: existencia de presión arterial sistólica menor de 55 mmHg en menores de un año y menor de 65 mmHg en mayores de un año, con repercusión orgánica y necesidad de administración de fluidoterapia (mayor o igual a 20 ml/kg) y/o catecolaminas para su control18.
6. Hiperglucemia: glucemia mayor a 250 mg/dl.
7. Ventilación mecánica: pacientes que precisaron ventilación con presión positiva intermitente en el momento del TCE o en relación con éste.
8. Anemia: hemoglobina menor de 8 g/dl o necesidad de transfusión de concentrados de hematíes en cantidad mayor o igual a 10 ml/kg.
9. Monitorizacion de PIC: se realizó con distintos sistemas de presión y en diferentes ubicaciones, según el caso clínico o la disponibilidad técnica.
10. HTC: PIC mayor de 20 mmHg de forma mantenida a pesar del control de todos los factores intra o extracraneales que pudiesen influir en su medida.
11. Midriasis: dilatación pupilar arreactiva uni o bilateral mayor de 4 mm.
12. SyO2: monitorización tras la canalización de la vena yugular interna de forma retrógrada con comprobación radiológica de la localización en el bulbo yugular. Las determinaciones se realizaron de forma intermitente.
13. Índice de extracción cerebral de oxígeno (IEO2)10: diferencia entre SaO2 y la SyO2. Se consideraron 3 posibilidades: a) hiperemia cerebral: IEO2 menor de 25%; b) isquemia cerebral: IEO2 mayor de 45%, y c) normal: IEO2 entre 25 y 45%.
14. Evolución clínica: se definió siguiendo la Glasgow Outcome Scale (GOS)19, que considera 4 categorías: 1 = alta sin secuelas: sin déficit neurológicos ni psicológicos; 2 = secuelas menores: no imposibilitan una actividad autónoma física, intelectual y de personalidad del paciente; 3 = secuelas mayores: estado vegetativo o necesidad de cuidados especiales; 4 = fallecimiento.
Análisis estadístico
Los datos obtenidos fueron procesados en el programa SPSS 10.0. Los resultados se expresan como media y desviación estándar (DE). Las variables cuantitativas se compararon mediante la prueba de la t de Student y las cualitativas mediante el test de la χ2. El análisis multivariante se realizó mediante regresión logística con el método paso a paso, es decir, la selección de variables por pasos hacia delante, con comprobación de entrada basada en la significación del estadístico de puntuación y comprobación de eliminación, basada en la probabilidad del estadístico de razón de verosimilitud (estimaciones de máxima verosimilitud parcial). Se permitió un valor de significación entre 0,05 y 0,1 para obtener así un mejor ajuste de posibles variables de confusión.
Se realizó, asimismo, un análisis de calibración mediante las pruebas de bondad de ajuste y medida del estadístico χ2 de Hosmer-Lemeshow, para valorar el ajuste del modelo.
RESULTADOS
Durante el período de estudio analizado, ingresó en nuestra UMI un total de 262 pacientes pediáticos con TCE. De ellos, 125 (48%) fueron TCEG, con predominio del sexo masculino (67%). La edad media de estos pacientes fue de 69,1 (41,5) meses. Un total de 14 pacientes (59%) ingresaron en la UMI procedentes del área de urgencias, y los 51 restantes (41%) fueron trasladados desde otros hospitales. Las causas del TCEG fueron los accidentes de tráfico en un 60% de las ocasiones, seguidos de las caídas (28%), otro tipo de accidentes (10%) y en último lugar las agresiones (2%).
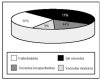
La estancia media en la UMI fue de 8,6 (8) días y la mortalidad de la población fue de 37 pacientes (29,6%). En la evolución clínica, cabe destacar que 46 pacientes (37%) presentaron situación de inestabilidad hemodinámica y shock, y que la existencia de anemia e hiperglucemia se constató en 78 (63%) y en 47 pacientes, (38%) respectivamente. El 93% de la población estudiada precisó ventilación mecánica y 32 pacientes (26%) presentaron secuelas de relevancia, que fueron graves en el 66% (fig. 1).
Figura 1. Evolución clínica de los pacientes pediátricos con traumatismo craneoencefálico grave (TCEG).
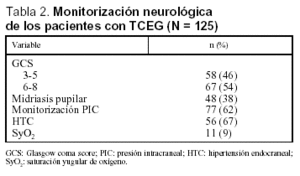
En la tabla 2 se exponen la variables de monitorización neurológica más importantes, destacando que la puntuación del GCS medio fue de 5,4 (1,8), presentando un 46% de los pacientes una puntuación de GCS menor o igual a 5. En 77 pacientes con TCEG se monitorizó la PIC, objetivándose HTC en un 75% de los mismos. De los 11 pacientes en los que se monitorizó la SyO2, en un 62% predominó la situación de baja extracción cerebral de oxígeno (hiperemia cerebral) respecto a la situación de alta extracción cerebral de oxígeno (isquemia cerebral) objetivada en un 23% de los pacientes.
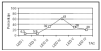
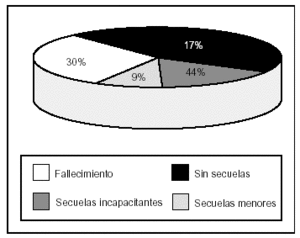
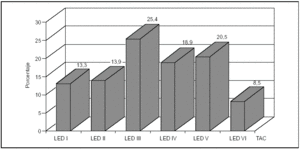
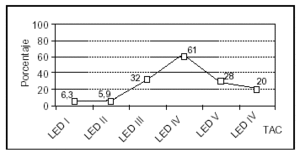
Los hallazgos obtenidos en la TAC se presentan en la figura 2, destacando las lesiones encefálicas difusas tipos III y IV (LED III y LED IV), con una incidencia del 25 y del 19%, respectivamente. Así mismo, en la figura 3 se expone la mortalidad asociada a cada una de las lesiones objetivadas en la TAC, predominando la asociada a la LED IV con un 61% y la LED III y la LEV con un 30% cada una.
Figura 2. Distribución porcentual de los hallazgos de la TAC, en los pacientes pediátricos con traumatismo craneoencefálico grave (TCEG).
Figura 3. Mortalidad asociada a la lesión observada en la TAC en los pacientes pediátricos con TCEP.
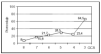
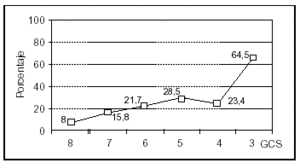
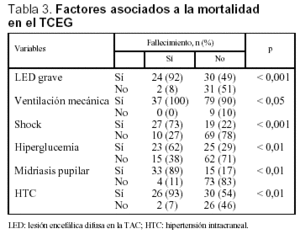
Se analizó una serie de variables clínicas clásicamente relacionadas con la mortalidad en el TCEP. Los pacientes con menor puntuación del GCS presentaron globalmente una mortalidad más alta. El rango osciló entre un 8% para los pacientes con GCS de 8 y un 64% de mortalidad para los pacientes con GCS de 3 (fig. 4). La mortalidad fue significativamente mayor en los pacientes con lesión encefálica difusa grave, en los pacientes que precisaron ventilación mecánica y en aquellos que presentaron shock. Asimismo, en los pacientes en que se constató hiperglucemia, HTC o midriasis pupilar, la mortalidad fue significativamente más elevada (tabla 3). No encontramos diferencias en relación con la mortalidad en los pacientes con politraumatismo asociado respecto a los que presentaron TCE puro (35 frente a 27%; NS), ni en los que presentaron fractura craneal respecto a aquellos pacientes en los que ésta no se objetivó (32 frente a 26%; NS). Los pacientes con anemia presentaron una mortalidad mayor que aquellos que no la manifestaron, siendo estas diferencias casi significativas (35 frente a 20%; p = 0,06).
Figura 4. Mortalidad asociada a la puntuación del GCS en los pacientes pediátricos con TCEP.
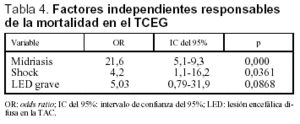
Se realizó un análisis multivariante para determinar los factores responsables de la mortalidad de los pacientes pediátricos con TCEG. Estos factores fueron la presencia de midriasis, shock y lesión encefálica difusa grave en la TAC. En la tabla 4 se presentan estos factores, junto al riesgo asociado a la mortalidad de cada uno de ellos.
Por último, se validó el ajuste del modelo mediante un análisis de calibración (bondad de ajuste y estadístico χ2 de Hosmer-Lemeshow), obteniéndose un valor de χ2 = 5,45 y un valor de p = 0,24.
DISCUSIÓN
El TCE constituye un grave problema de salud pública en los países desarrollados. En la población pediátrica es la principal causa de muerte traumática, con una mortalidad que puede alcanzar el 30% y unas secuelas graves de hasta un 40%19-20.
Clásicamente se ha considerado que existían importantes diferencias entre el TCE pediátrico y el del adulto, en relación con aspectos anatómicos, etiológicos y fisiopatológicos20-22. Sin embargo, muchos de estos conceptos actualmente están en revisión, y las diferencias se están reduciendo.
La importancia del estudio expuesto se basa en la amplia muestra de pacientes pediátricos analizados, el tratamiento estadístico realizado y, sobre todo, en la escasa bibliografía existente para poblaciones pediátricas amplias.
La mortalidad de nuestra población es de un 29%, porcentaje similar al de otras series publicadas, aunque la comparación es difícil porque las poblaciones pueden ser diferentes en aspectos como la edad, la puntuación media del GCS, las lesiones objetivadas en la TAC, etc. La mortalidad global del presente estudio (14,7%) es sensiblemente superior a la publicada recientemente por Fernández et al23, de un 10,9%, y a la referida por Reid et al9 de un 12,8%, para poblaciones con un 19 y un 36% de TCEG, respectivamente. Sin embargo, la incidencia de TCEG en nuestro trabajo fue de un 47,7%, destacando además que sólo se incluyó a pacientes con edad comprendida entre un mes y 14 años, respecto a los trabajos anteriormente mencionados, que limitan la edad máxima en 18 y 19 años, respectivamente. En el estudio de Ward24 se incluyeron 201 pacientes con TCEG (GCS menor o igual a 8), y la mortalidad tras 12 meses de seguimiento fue de un 24%, mientras que la reflejada por Feickert et al1 fue del 22%.
Asimismo, es importante destacar el valor de la puntuación del GCS, citado en múltiples trabajos como factor asociado o factor responsable de la mortalidad1,19,22,25-26. Sin embargo, la puntuación GCS puede presentar dificultad para su determinación debido a la utilización de sedoanalgesia o relajantes musculares, varibilidad evolutiva, información indirecta de la misma a través de los equipos de emergencia que atienden al niño con TCE, etcétera.
En nuestro trabajo, la puntuación del GCS no se incluyó entre los factores determinantes de mortalidad en el análisis multivariante, incluso cuando se introdujo en el modelo como variable cualitativa (datos no expuestos). Para algunos autores, el GCS no debería ser utilizado como único factor pronóstico, debido a su bajo valor predictivo22, aunque en el estudio de Feickert et al1 la puntuación del GCS considerada como variable categórica presentó un alto valor predictivo por sí misma.
A pesar de todos los inconvenientes anteriormente reflejados, la puntuación del GCS es un dato de innegable utilidad. En principio nos permitirá la clasificación en pacientes con TCE leve-moderado respecto al TCEG. Asimismo, su asociación con la mortalidad queda constatada en nuestro trabajo, ya que el 100% de los pacientes que fallecieron presentaban un GCS menor o igual que 8. Además, en pacientes con TCEG la mortalidad fue significativamente mayor en el grupo con GCS comprendido entre 3 y 5 respecto al grupo con GCS comprendido entre 6 y 8 (70,3 frente a 29,7%; p < 0,001). Además, otro dato pronóstico a tener en cuenta es la indicación de la monitorización de la PIC, si el GCS es menor o igual a 8. En el presente trabajo, en dos tercios de los pacientes con GCS menor o igual de 8 en los que se monitorizó la PIC se objetivó HTC.
Un segundo factor asociado a la mortalidad es la lesión objetivada en la TAC inicial, principalmente la existencia de edema cerebral12,27-28. Algunos autores consideran que el edema cerebral tiene un mejor pronóstico en los pacientes pediátricos respecto a los adultos29. Por el contrario, otras publicaciones consideran el edema cerebral, en los pacientes pediátricos, como el factor fisiopatológico más importante en la evolución desfavorable de éstos1,20, ya que se asocia a secuelas neurológicas de relevancia clínica hasta en un 39% de los casos. En nuestro estudio, la incidencia de edema cerebral, considerando las LED graves (grados III y IV), alcanzó un 40% y constatamos la asociación entre la mortalidad y un mayor grado de lesión objetivada en la TAC, según los criterios del TCDB17. Ahora bien, la importancia de la TAC en el TCEG debe entenderse como un elemento dinámico en el que pueden existir variaciones importantes entre la primera TAC y la segunda, realizadas en un período de 24 h23.
Marshall et al20 presentan una clasificación pronóstica en la que relacionan la lesión inicial en la TAC y la morbimortalidad de los pacientes adultos con TCE. Fernández et al23 demuestran esta asociación en el TCE pediátrico y, aunque analizaron tanto la primera TAC como la segunda realizada al paciente, sólo objetivaron una asociación lineal entre la TAC inicial y la evolución clínica.
En el resultado del análisis multivariante, la existencia de una lesión encefálica difusa grave fue incluida en el modelo final con un valor de p < 0,1, pero se amplió el valor de significación, dada la importancia del hallazgo y para evitar el posible efecto de variables de confusión.
Otro dato en relación con la incidencia de edema cerebral fue la constación de aumento del flujo sanguíneo cerebral, estimado a partir de un IEO2 disminuido en el 60% de los pacientes con HTC en los que se monitorizó la SyO2, aunque el número de pacientes fue muy reducido y, por ello, no se pueden extrapolar conclusiones fiables.
Una tercera variable a tener en cuenta es la afección hemodinámica y, en concreto, la existencia de hipotensión arterial, hipoperfusión cerebral y shock. Estos factores se han relacionado con una mayor mortalidad26,30-32. Así, Mansfield4 refleja un aumento de la mortalidad del 150% en pacientes con TCEG y shock, lo que supone un ascenso de la mortalidad del 22 al 66% en pacientes pediátricos con TCEG. En esta misma dirección, cabe destacar el reciente estudio de White et al33, en el que se concluye que valores de presión arterial elevados se asociaron a una mayor supervivencia. En nuestro trabajo, la existencia de shock incrementó el riesgo de mortalidad en 4 veces.
La existencia de midriasis uni o bilateral como reflejo de HIC y un acontecimiento previo a la herniación cerebral fue un determinante de mortalidad asociado a una alta odds ratio, hecho previamente descrito por otros autores1,25,31. La existencia de HTC se asoció de forma significativa a una mayor mortalidad (46 frente a 7%; p < 0,001).
Por último, analizamos otro grupo de factores de riesgo también relacionados habitualmente con la mortalidad del TCE6,34-36, como la edad, la existencia de politraumatismo asociado y la presencia de fractura craneal, hiperglucemia o anemia.
El mejor pronóstico del TCE pediátrico en relación con los pacientes adultos se constata en múltiples estudios4,6,34. Otros estudios globalmente no objetivan esta diferencia y, cuando estratifican la población en distintos rangos de edad, no demuestran diferencias de mortalidad debido al reducido número de pacientes incluidos en cada grupo37. Sin embargo, la tendencia observada es hacia una mayor mortalidad en las edades más bajas de la población pediátrica4,25, atribuida en parte a una mayor sensibilidad de su cerebro inmaduro a las excitotoxinas que se liberan tras el TCE. Los resultados obtenidos en nuestro trabajo siguen esta línea, y en los 125 pacientes estudiados con TCEG, no existió influencia de la edad en la mortalidad comparando los 3 rangos de edad en que dividimos a la población (menores de un año, entre uno y 3 años y mayores de 3 años), aunque sí es cierto que la mortalidad mayor la presentaron lo pacientes menores de un año (46,7 frente a 29,7 frente a 15,8%; NS).
Asimismo, no obtuvimos diferencias en la mortalidad entre pacientes con TCE puro o asociado a politraumatismo, coincidiendo con el trabajo de Feickert et al1. Sin embargo, en el estudio de Tepas et al6, la mortalidad asociada al TCE con lesiones extracraneales casi duplicaba la del TCE puro.
La existencia de fractura craneal, considerada por algunos autores como factor de implicación pronóstica34-35, en nuestro trabajo, al igual que en el de Feikert1, no se asoció una mayor mortalidad (32,4 frente a 26,1%; NS).
Otros factores clásicamente relacionados con una mayor mortalidad, como la hiperglucemia o la anemia, también fueron constatados en el presente estudio (p < 0,05 y p = 0,06, respectivamente). Sin embargo, estas variables no tuvieron trascendencia en el análisis multivariante.
En conclusión, y a pesar del inconveniente de tratarse de un estudio restrospectivo, podemos establecer la relevancia, en relación con la mortalidad, de la lesión neurológica grave (objetivada en la TAC craneal o por la existencia de arreactividad pupilar) y de la situación de shock como reflejo de una inestabilidad hemodinámica grave.