INTRODUCCIÓN
En los últimos estudios epidemiológicos relacionados con infecciones en pacientes hospitalizados, se han constatado dos hechos: el incremento del porcentaje de infecciones por cocos grampositivos (CGP)1 y el desarrollo de resistencias bacterianas a los antibióticos empleados. Este problema es más acuciante en lo pacientes ingresados en Unidades de Cuidados Intensivos (UCI)2,3, por lo que, en estos pacientes la elección del tratamiento antibiótico y su adaptación (ajuste o desescalada) a cada momento de la evolución deba ser una práctica basada en el conocimiento profundo de las posibilidades terapéuticas, así como de las peculiaridades farmacocinéticas que afectan a los pacientes críticos.
En las UCI se dispone de la posibilidad de administrar fármacos por diferentes vías de las habituales (perfusión continua, vía inhalatoria, intratecal, etc.), y una mayor facilidad para la monitorización de antimicrobianos, lo que hace que el tratamiento de enfermedades infecciosas en pacientes críticos tenga matices diferentes a los de los pacientes ingresados en plantas de hospitalización.
Dos grupos de trabajo dedicados al estudio de infecciones en el paciente crítico, y desde un punto de vista multidisciplinario, hemos abordado el problema del tratamiento antibiótico de las infecciones por CGP en el paciente crítico elaborando las recomendaciones que a continuación se exponen. Tanto el Grupo de Estudio de Infecciones en el Paciente Crítico de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (GEIPCSEIMC) como el Grupo de Trabajo de Enfermedades Infecciosas de la Sociedad Española de Medicina Intensiva, Crítica y de Unidades Coronarias (GTEISEMICYUC) designó unos expertos, que acometieron estas recomendaciones para presentarlas a sus respectivas Sociedades, centrándose en el tratamiento antimicrobiano de las infecciones más frecuentes en pacientes críticos con sospecha o confirmación de ser causadas por CGP.
METODOLOGÍA
Tanto el GEIPC-SEIMC como el GTEI-SEMICYUC nombraron entre sus miembros a un coordinador y 3 expertos. Además, cada Grupo de Trabajo designó un revisor que supervisaría las decisiones y grados de recomendación decididos por el panel. En total se seleccionó un grupo multidisciplinario de 10 participantes elegidos por su experiencia en el tratamiento de infecciones en el paciente crítico. El grupo incluye médicos intensivistas, un microbiólogo y un farmacólogo. Se decidió no abordar las infecciones en las que no intervengan los CGP, ni las que sean muy infrecuentes en pacientes críticos. Tampoco se han hecho consideraciones de índole económica, referencias a tratamientos secuenciales, ni a fármacos no comercializados actualmente en nuestro país, aunque estos aspectos también deben ser tenidos en cuenta a la hora de elegir el antibiótico más adecuado.
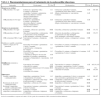
Las recomendaciones que se presentan se han desarrollado según estándares previamente aceptados4 y aplicando la normativa propuesta por la Infectious Diseases Society of America (IDSA)5. Se ha aplicado esta normativa (tabla 1) considerando independiente la fuerza de la recomendación del nivel de evidencia. Algunas de las recomendaciones, sobre todo las de los tratamientos alternativos, se hacen en ausencia de ensayos aleatorizados específicos, aunque el grado de la recomendación pueda ser alto en base a la experiencia clínica de los miembros del panel, a las recomendaciones de otras guías, a la ausencia de otras posibilidades o por la extrapolación de los datos obtenidos en otras poblaciones o de datos de laboratorio de microbiología. Para los ensayos clínicos aleatorizados, adecuadamente realizados, comparativos de la eficacia de dos tratamientos antibióticos en infecciones y referidos a poblaciones de pacientes críticos, y si la eficacia es equivalente, se ha considerado que ambos antibióticos cumplen el nivel de evidencia I (tabla 1).
Organización general
Se realizó una reunión entre los dos coordinadores el 11 de noviembre de 2005 decidiéndose la estructura del proyecto y los ponentes de cada uno de los temas. Se decidió limitar las recomendaciones al tratamiento empírico de las infecciones en pacientes críticos con datos microbiológicos de sospecha de infección por CGP (tinción de Gram, antigenuria de neumococo, etc.) así como el tratamiento dirigido de las mismas.
Posteriormente, se realizó una búsqueda sistemática de la literatura siguiendo fórmulas previamente recomendadas6. Se llevó a cabo una búsqueda computarizada en Medline y Current Contents en el período entre enero de 1975 y diciembre de 2005. Las palabras clave (Key words) fueron: Gram-positive, Staphylococcus, Streptococcus, pneumonia, bacteremia, peritonitis, soft-tissue infection, urinary infection, endocarditis, meningitis, guidelines, critically ill, intensive Care y treatment. Se revisaron manualmente los abstracts publicados en los últimos 5 años en los Congresos de la European Society of Intensive Care Medicine (ESICM), de la European Society of Clinical Microbiology and Infectious Diseases (ESCMID) y de la Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC).
Se realizó una reunión con la participación de todos los autores del presente manuscrito el día 11 de enero de 2006. En ella se presentaron las propuestas de tratamiento y se procedió a discutir las recomendaciones terapéuticas así como el nivel de evidencia de cada una de ellas. En caso de discrepancia se tomaron las decisiones por mayoría. Tras la evaluación de varios borradores, el 9 de junio de 2006 hubo otra reunión en la que se actualizaron las referencias bibliográficas y se acordaron los niveles de recomendación.
La celebración de estas reuniones ha sido patrocinada por Pfizer que no ha influido en ningún momento en el diseño, resoluciones y publicaciones de las recomendaciones. Todos los participantes han hecho una declaración de conflicto de intereses que se detalla al final del manuscrito.
CARACTERÍSTICAS DE LOS ANTIMICROBIANOS EMPLEADOS EN EL TRATAMIENTO DE INFECCIONES POR BACTERIAS GRAMPOSITIVAS EN EL PACIENTE CRÍTICO
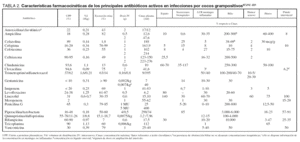
Desde el descubrimiento de la penicilina hasta la actualidad, se han desarrollado múltiples antibióticos con actividad frente a CGP. Sin embargo, la mayoría de ellos presentan un espectro de actividad que abarca tanto CGP como gramnegativos. Cloxacilina, vancomicina y, posteriormente, teicoplanina fueron desarrollados para combatir infecciones producidas, exclusivamente, por CGP. Recientemente se han diseñado una serie de moléculas que cubren las limitaciones de eficacia y/o seguridad de las que habían estado disponibles hasta la actualidad. En España se hallan comercializadas linezolid y quinupristina/dalfopristina, aunque la utilización en la clínica de este último fármaco es prácticamente nula. Las características farmacocinéticas más destacables de los antibióticos más utilizados en las infecciones producidas por CGP se resumen en la tabla 2.
Tradicionalmente se ha recomendado la monitorización de niveles plasmáticos de vancomicina, basándose en la relación existente entre las concentraciones plasmáticas de este antibiótico y su perfil de eficacia y toxicidad. Debe realizarse siempre que se emplee en pacientes críticos. Cuando se administran dosis múltiples, las determinaciones (a partir del segundo - tercer día) de los niveles valle deben realizarse entre 30 y 60 minutos antes de la próxima dosis.
La monitorización de niveles plasmáticos de vancomicina, puede tener un gran valor predictivo de la eficacia del tratamiento de infecciones graves. En base a la sobreestimación de la nefrotoxicidad se ha propuesto como concentraciones mínimas (Cmin) óptimas valores de 10 mg/l. En la actualidad se recomienda7 utilizar dosis suficientes para alcanzar Cmin entre 15-20 mg/l o incluso superiores en caso de infecciones del sistema nervioso central.
Una estrategia que se está extendiendo consiste en la administración de vancomicina en perfusión continua, que se ha relacionado con menor toxicidad y con mayor estabilidad y rapidez para alcanzar concentraciones terapéuticas8,9. La perfusión continua de vancomicina debe ir precedida de la administración de una dosis de carga. Un reciente estudio10 en pacientes con neumonía, demuestra una mayor supervivencia de los tratados con perfusión continua, aunque el estudio no fue diseñado para evaluar este efecto. En un metaanálisis, la administración de la misma dosis de antibióticos concentración-dependiente en régimen de dosis múltiples se relacionó con un mayor número de fallos terapéuticos que con el régimen de perfusión continua11. La administración de vancomicina en perfusión continua, alcanzando los niveles plasmáticos propuestos anteriormente, puede ser una estrategia más beneficiosa y costo-efectiva12 que la administración intermitente de este glucopéptido.
Al emplear teicoplanina, es importante administrar la dosis de carga (6 mg/kg/12 horas en las primeras tres dosis) para alcanzar con mayor rapidez los niveles terapéuticos, a pesar de lo cual no se logran hasta el tercer día13. Las dosis óptimas de teicoplanina deberían ajustarse mediante la monitorización de niveles plasmáticos13,14, lo que no es posible en la práctica clínica rutinaria y por tanto condiciona el empleo de este glucopéptido en ciertas situaciones. Por el contrario, se ha observado que el régimen de linezolid en dosis de 600 mg/12 horas, puede considerarse adecuado en pacientes críticos sin necesidad de medir niveles plasmáticos14.
Los pacientes críticos presentan frecuentes variaciones en el volumen de distribución que dificultan la interpretación de los niveles plasmáticos de los distintos antimicrobianos, por lo que se está investigando con mayor profundidad en una serie de relaciones farmacocinéticas/farmacodinámicas (PK/PD), que han demostrando tener relación con la eficacia terapéutica15. Se ha observado que la relación entre la concentración máxima (Cmax) y la concentración mínima inhibitoria (CMI) por encima de 12 y el cociente del área bajo la curva (AUC) y la CMI (AUC/ CMI) entre 30 y 40 horas son parámetros útiles para optimizar el tratamiento de las infecciones respiratorias por CGP tratadas con quinolonas y evitar la selección de flora resistente16.
En el caso de los glucopéptidos y linezolid, el parámetro que mejor predice la eficacia es el área bajo la curva superior a la CMI (AUIC). Valores de AUC24/ CMI o AUIC inferiores a 400 horas se asociaron con una menor erradicación microbiológica en pacientes con neumonía por Staphylococcus aureus resistente a meticilina (SARM) tratados con vancomicina17,18. En otro estudio, se demostró que valores de este indicador cercanos a 153 para vancomicina libre fueron excelentes para el tratamiento de infecciones respiratorias por S. aureus19, mientras que, valores de AUIC mayores que 125 se han considerado pronóstico de fallos terapéuticos en el tratamiento de infecciones por Enterococcus faecium20. Para linezolid valores de AUIC entre 50 y 100 se han considerado suficientes para garantizar buenos resultados terapéuticos21.
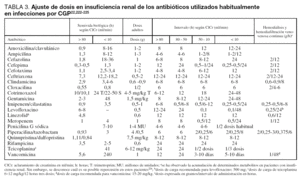
En la tabla 3 se muestran las dosis de los antimicrobianos con actividad frente a los CGP así como los ajustes de dosis en situación de insuficiencia renal22. A lo largo del documento, si no se especifica una pauta especial, las dosis a emplear son las recogidas en esta tabla. Sin embargo, hay dos entidades en las que es necesario el empleo de dosis máximas como son las infecciones del sistema nervioso central y las endocarditis, por lo que las dosis necesarias para el tratamiento de estas infecciones se recogen en la tabla 4. Con respecto a las infecciones del sistema nervioso central conviene hacer algunas consideraciones especiales sobre la farmacodinamia de algunos antibióticos.
Farmacodinámica de los antibióticos útiles en el tratamiento de las infecciones del sistema nervioso central por CGP
En el tratamiento de las infecciones del sistema nervioso central es especialmente importante la capacidad del antibiótico para atravesar la barrera hematoencefálica (BHE). Es imprescindible que la concentración del antibiótico en el líquido cefalorraquídeo (LCR) sea superior a la concentración mínima bactericida, es decir, que el llamado índice bactericida sea superior a 1, siendo óptimo23 un valor de 10. La inflamación meníngea incrementa hasta 10 veces la difusión de los antibióticos, fenómeno que decrece rápidamente en 24-48 horas de comenzado el tratamiento, si esta inflamación disminuye. Los antibióticos que durante la inflamación meníngea no alcanzan en LCR el 20% de la concentración en plasma (tabla 2), atraviesan escasamente la BHE cuando la inflamación meníngea disminuye, por lo que no son adecuados para el tratamiento de estas infecciones.
El objetivo del tratamiento es la rápida esterilización del LCR, por lo que deben utilizarse antibióticos con rápida actividad bactericida y a la dosificación más alta posible (tabla 4). La esterilización tardía del LCR se ha relacionado con una mayor incidencia de secuelas neurológicas24. Si no es posible lograr la concentración adecuada mediante la administración por vía sistémica, se puede recurrir a la instilación directa por vía intraventricular o intratecal.
Los betalactámicos difunden mal al LCR. Ceftriaxona y cefotaxima tienen similar capacidad para atravesar la BHE. La dosis máxima de ceftriaxona recomendada es de 4 g/día por la posibilidad de aparición de barro biliar. Esta dosis puede ser insuficiente para el tratamiento de cepas con CMI elevadas, por lo que en estos casos se recomienda administrar cefotaxima.
Entre los glucopéptidos, la teicoplanina prácticamente no difunde al LCR y la vancomicina lo hace de forma irregular (5-40% de las concentraciones plasmáticas) (tabla 2). Con frecuencia, estas concentraciones son infraterapéuticas (además la dexametasona puede disminuir la penetración de vancomicina en LCR) por lo que es imprescindible monitorizar las concentraciones plasmáticas en el valle, para mantener niveles de 20 a 30 mg/l. Se ha recomendado la administración de vancomicina en perfusión continua25 (5060 mg/kg/día previa administración de una dosis de carga de 15 mg/kg) con lo que se pueden mantener concentraciones plasmáticas entre 25-30 mg/l y concentraciones en LCR entre 6-19 mg/l, que son adecuadas para el tratamiento de patógenos sensibles.
Linezolid atraviesa muy bien la BHE, con concentraciones en LCR del 70% de las concentraciones plasmáticas y de hasta el 160% en meningitis, alcanzando cifras muy por encima de las CMI de los microorganismos sensibles26.
Efectos adversos e interacciones de antimicrobianos administrados en infecciones por CGP
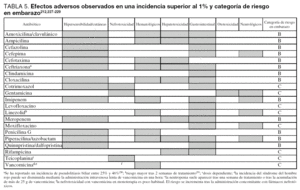
En la tabla 5 se describen los efectos adversos que se presentan en un porcentaje superior al 1% al utilizar este grupo de antibióticos. Quinupristina/ dalfopristina presenta una frecuencia elevada de efectos adversos en la zona de administración. Con linezolid se ha observado riesgo de trombocitopenia en pacientes críticos con trombocitopenia previa27 así como anemia y trombocitopenia en pacientes con insuficiencia renal grave28.
Se debe tener en cuenta las interacciones entre los antimicrobianos y otros fármacos administrados concomitantemente cuya descripción excede nuestro propósito29. Ya se ha comentado la posibilidad de fracaso renal asociando vancomicina a otros fármacos nefrotóxicos. Otros ejemplos de interacciones de interés son el excesivo efecto de relajantes musculares asociados a gentamicina o clindamicina, los efectos arritmógenos de quinolonas junto a algunos antiarrítmicos, el síndrome serotoninérgico combinando linezolid con inhibidores de la recaptación de serotonina o la acción sobre el metabolismo de algunos medicamentos que provoca rifampicina.
Nuevos antimicrobianos para el tratamiento de infecciones por CGP
En los últimos años han aparecido diversos fármacos con actividad específica frente a microorganismos grampositivos multiresistentes. Actualmente se hallan en fases avanzadas de investigación o comercialización. Después de la redacción de estas recomendaciones (finalizadas en septiembre de 2006) se ha aprobado en nuestro país el empleo de daptomicina y tigeciclina, para las indicaciones que a continuación se especifican, que seguramente serán ampliadas en los próximos meses, lo que debe tenerse en cuenta a la hora de plantear estrategias terapéuticas en el futuro. La experiencia con estos antibióticos en pacientes críticos es aún escasa. Daptomicina es un antibiótico lipopéptido aprobado para el tratamiento de infecciones de piel y tejidos blandos30. En un reciente estudio ha demostrado una eficacia similar a vancomicina en el tratamiento de las bacteriemias y endocarditis por CGP31, aunque aún no ha sido aprobado para esta indicación. Se ha descartado su uso en neumonía porque su efecto es inhibido por el surfactante pulmonar32. Recientemente se ha aprobado tigeciclina, una glicilciclina derivada de las tetraciclinas, para el tratamiento de infecciones de piel y tejidos blandos e infecciones abdominales33,34. Este antibiótico posee actividad, además, frente a varios microorganismos gramnegativos como Acinetobacter spp. y enterobacterias productoras de betalactamasas de espectro extendido (BLEE).
Dalbavancina, es un lipoglicopéptido que ha demostrado una eficacia similar a vancomicina en el tratamiento de las infecciones de piel y tejidos blandos35. Posee una farmacocinética muy interesante ya que el tratamiento completo incluye una dosis semanal durante dos semanas. Telavancina presenta una estructura similar a dalvabancina y ha demostrado una eficacia similar a los antibióticos antiestafilocócicos en el tratamiento de infecciones de piel y tejidos blandos36 y superior a vancomicina en el tratamiento de la bacteriemia relacionada con catéter37. Finalmente, ceftobiprole, es la primera cefalosporina con actividad frente al SARM incluso con sensibilidad reducida a vancomicina38, manteniendo la actividad de otras cefalosporinas frente a bacilos gramnegativos, incluyendo Pseudomonas aeruginosa, pero no frente a enterobacterias productoras de BLEE.
TRATAMIENTO DE LA NEUMONIA NOSOCOMIAL POR COCOS GRAMPOSITIVOS
La neumonía asociada a ventilación mecánica (NAV) es la forma más frecuente de neumonía nosocomial (NN) entre los pacientes críticos39. Según datos del ENVIN-UCI alrededor del 15-20% de los pacientes ventilados desarrolla NAV mientras que la densidad de incidencia oscila entre 17 y 23 por 1.000 días de ventilación mecánica40. La NN es la infección nosocomial que se asocia con las mayores tasas de mortalidad, aumento de las estancias y con un costo asociado muy elevado41. La adecuación del tratamiento empírico es fundamental en la evolución de los pacientes42-44.
En las NN adquiridas en UCI los aislamientos de CGP suponen entre el 20 y el 28% del total de microorganismos39. La presencia de CGP se ha incrementado considerablemente en la última década debido al aumento de aislamientos de S. aureus, que se ha convertido en el primer agente causante de NAV en nuestro medio. S. aureus sensible a meticilina (SASM) predomina en las NAV desarrolladas en los 5-7 primeros días de estancia en la UCI, mientras que en las NAV tardías, de más de 7 días de estancia en UCI, el 60% del total de S. aureus son SARM (datos del informe ENVIN-UCI de 2005). Los factores de riesgo para NAV por SARM incluyen el tratamiento antibiótico previo, la procedencia de centros de larga estancia, NAV de presentación tardía así como la presencia de brotes o la flora propia de cada UCI45.
Otros CGP a tener en cuenta son Streptococcus pneumoniae en las NAV tempranas, presente entre el 3-5% de los casos y E. faecalis, en menos del 2%. Aunque en estudios epidemiológicos y más raramente en trabajos de investigación se recoge la presencia de Staphylococcus epidermidis, el papel patogénico de este microorganismo queda por delimitar y no se incluye en estas recomendaciones.
Recomendaciones para el tratamiento de neumonía nosocomial por CGP
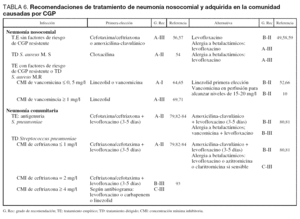
En la tabla 6 se recogen las principales recomendaciones para el tratamiento de la neumonía nosocomial con el grado de recomendación y las referencias bibliográficas en las que se sustenta. Disponemos de numerosos estudios que evalúan el tratamiento de la NN46-55. Sin embargo, el número de pacientes críticos con NN causadas por CGP en los ensayos aleatorizados es reducido, especialmente en los estudios más antiguos. En la tabla 6 se recogen las principales recomendaciones para el tratamiento de la neumonía nosocomial.
Tratamiento empírico de neumonía nosocomial sin factores de riesgo de CGP resistentes
No hay estudios específicamente diseñados para evaluar la eficacia de diferentes antibióticos en la neumonía nosocomial sin factores de riesgo de presencia de CGP multiresistentes (generalmente neumonía precoz asociada a ventilación mecánica). Las recomendaciones se basan en la sensibilidad de los microorganismos que se espera aislar, muy probablemente sensibles a betalactámicos y teóricamente sin diferencias entre los distintos betalactámicos propuestos (A-III)56,57. Como alternativa se propone levofloxacino (B-II) que ha sido estudiado para el tratamiento de NAV58,59. La posible asociación del uso de quinolonas con la selección de SARM60 o el posible desarrollo de resistencias hace que el panel de expertos se decante más por el empleo de betalactámicos que por levofloxacino. No hay estudios específicos en pacientes alérgicos a betalactámicos, pero el empleo de levofloxacino parece la opción más razonable (A-III).
Tratamiento dirigido de neumonía nosocomial por S. aureus sensible a meticilina
El tratamiento de elección debe ser oxacilina (A-I). Dada la elevada mortalidad de la neumonía bacteriémica por S. aureus sensible a meticilina tratada con vancomicina54, si se ha iniciado tratamiento con un glucopéptido es mandatorio cambiar a cloxacilina. No hay recomendaciones con respecto a otras alternativas.
Tratamiento empírico de neumonía con factores de riesgo para presentar CGP resistentes o tratamiento dirigido a SARM
En pacientes en los que se sospeche o se confirme el aislamiento de SARM como causante de la neumonía, el tratamiento clásico de elección ha sido la vancomicina (A-I). No obstante, este tratamiento ha sido considerado sub-óptimo por algunos autores, ya que vancomicina es un antibiótico de elevado peso molecular que no alcanza concentraciones altas a nivel pulmonar7 por lo que se recomienda monitorizar los niveles plasmáticos para obtener Cmin séricas de 20 mgll7,61. Con estos niveles, Combes et al62 no hallaron mortalidad atribuible en una cohorte de 74 pacientes con NAV por SARM. En un estudio retrospectivo reciente Rello et al10 demostraron que el tratamiento con vancomicina en perfusión continua fue un factor protector de mortalidad hospitalaria en una cohorte de 75 pacientes con NAV por SARM. Aunque no se trataba de un ensayo clínico diseñado para estudiar las diferencias en eficacia de esta forma de administración y que un estudio aleatorizado12, con reducido número de neumonías por SARM, no halló este beneficio (aunque sí fue costo-efectivo), el panel recomienda considerar la perfusión continua de vancomicina en los casos de NAV por SARM (B-II) siendo imprescindible la monitorización de los niveles plasmáticos hasta alcanzar los recomendados (15-20 mg/l).
La teicoplanina tiene las mismas limitaciones farmacocinéticas que la vancomicina y no es posible en la práctica clínica medir sus niveles séricos. Se ha demostrado63 la necesidad de administrar dosis muy elevadas durante los dos primeros días para alcanzar niveles séricos y en el fluido de epitelio intersticial adecuados. En ausencia de estudios clínicos que demuestren su eficacia, no recomendamos su uso en el tratamiento de NN por SARM. Tampoco quinupristina-dalfopristina ha demostrado superioridad a vancomicina en pacientes con neumonía por CGP, mientras que la tasa de efectos adversos y de suspensión de tratamiento fue algo mayor, por lo que el panel no recomienda emplear quinupristina-dalfopristina para el tratamiento de las NN por CGP53.
Se ha comparado la eficacia de linezolid con vancomicina en dos ensayos clínicos aleatorizados y doble ciego64,65, y posteriormente se han analizado de forma retrospectiva todos los pacientes de estos ensayos con neumonía confirmada por SARM y los casos de NAV52,66. La supervivencia fue mayor en el grupo tratado con linezolid en comparación con el grupo tratado con vancomicina en dosis discontinuas en el conjunto de pacientes con neumonía por SARM52 (80% frente a 63,5%; p = 0,03) y en aquellos con neumonía asociada a ventilación mecánica causada por SARM66 (84,1% frente a 61,7%; p = 0,02), lo cual fue confirmado mediante un análisis multivariante, en el que el tratamiento con linezolid fue un factor independiente de supervivencia hospitalaria (OR: 2,6; IC 95%: 1,3-5,1; p = 0,006). Según estos datos, el número de pacientes necesarios a tratar con linezolid respecto a vancomicina para salvar una vida es de 6.
Las limitaciones que presentan estos trabajos se basan en el hecho de que son análisis retrospectivos de dos ensayos clínicos diseñados para demostrar no-inferioridad, que el número de episodios con cultivos cuantitativos es limitado, que la dosificación de vancomicina (1 g iv/12 horas) no es la más adecuada y que los niveles valle requeridos de vancomicina (5-10 mg/l) son inferiores a los hoy recomendados. Por ello, se considera que la evidencia para su elección como primera opción sería B-II. Dada la excelente concentración que alcanza linezolid en tejido pulmonar, tanto en voluntarios sanos67 como en pacientes críticos68, hoy en día se considera que este fármaco o vancomicina (niveles plasmáticos 15-20 mg/l) constituyen el tratamiento de primera línea en la NN por SARM (A-I)69,70. En pacientes hemodinámicamente inestables y en los que existe un alto riesgo de padecer insuficiencia renal, el linezolid debe contemplarse como primera elección70.
El panel cree indispensable que los laboratorios de Microbiología determinen la CMI del SARM a vancomicina pues dependiendo de la misma debe elegirse la terapia dirigida tal y como se refleja en la tabla 6. Se ha demostrado la menor eficacia de vancomicina cuando la CMI era mayor o igual que 1 mg/l71 por lo que el panel recomienda en estos casos el empleo de linezolid (A-III). Hay que reconocer que, al menos hasta el año 2002, se ha comprobado en estudios de vigilancia realizados en España que el 100% de los aislamientos de SARM presentan CMI a vancomicina menor o igual que 1 mg/l72,73. Sin embargo, se han comunicado recientemente algunos casos de SARM con CMI a vancomicina más elevadas en algunos hospitales españoles74, lo que lleva a este panel, ante la posibilidad de que en un futuro próximo se incremente el número de cepas de SARM con susceptibilidad intermedia a vancomicina, como ya ocurre en algunos países europeos75, a proponer que se determine exactamente la CMI a vancomicina en los aislamientos significativos en pacientes críticos y por tanto, se realizan las recomendaciones terapéuticas en base a esta posibilidad (tabla 6).
La duración óptima de tratamiento se considera que debe ser de 8 días y/o hasta 48 horas después la defervescencia de los síntomas en las neumonías causadas por S. pneumoniae y S. aureus sensible a meticilina (A-I). Sin embargo, en las NN por SARM el panel recomienda 15 días, si bien 8 días podrían ser suficientes si el tratamiento empírico ha sido adecuado y hay resolución clínica76 (B-III).
TRATAMIENTO DE LA NEUMONÍA ADQUIRIDA EN LA COMUNIDAD POR CGP QUE REQUIEREN INGRESO EN UCI
La etiología más frecuente de la neumonía comunitaria es el S. pneumoniae, siendo S. aureus el otro microorganismo grampositivo más comúnmente implicado, si bien a gran distancia77. El tratamiento antibiótico de toda neumonía grave de la comunidad debe iniciarse precozmente ya que la demora en su inicio se asocia a mayor mortalidad y morbilidad78.
Recomendaciones para el tratamiento de la neumonía adquirida en la comunidad por CGP
En la tabla 6 se recogen las principales recomendaciones para el tratamiento de la neumonía adquirida en la comunidad.
Tratamiento empírico. Tinción de Gram o antigenuria positiva de neumococo
La antigenuria positiva de neumococo se considera diagnóstico de esta etiología en presencia de un cuadro clínico compatible y si no ha habido proximidad de otra infección neumocócica. Sin conocer el antibiograma o la existencia de bacteriemia concomitante, recomendamos el inicio del tratamiento con terapia combinada con cefotaxima o ceftriaxona junto a levofloxacino (A-II). Existe amplia experiencia clínica de tratamiento de neumonías comunitarias en pacientes ingresados en UCI con esta combinación79, aunque no hay ensayos aleatorizados. Una alternativa válida, sería el empleo de amoxicilina-clavulánico80,81 en vez de la cefalosporina, pero su empleo en pacientes críticos, para el tratamiento de esta infección es menos frecuente, por lo que la fuerza de recomendación es menor (B-II).
El empleo combinado de antibióticos para el tratamiento de la neumonía neumocócica es en la actualidad un tema de debate. Dos estudios retrospectivos82,83 y uno prospectivo observacional84 han hallado que, en pacientes con neumonía neumocócica bacteriémica, la terapia combinada se asocia a menor mortalidad que la monoterapia. Por el contrario, otro estudio retrospectivo85 no halló diferencias en la mortalidad de pacientes con sepsis neumocócica tratados con monoterapia o terapia combinada, si bien sus conclusiones pueden ser discutibles86. Recomendamos la terapia combinada de inicio ante la sospecha de neumonía neumocócica grave bacteriémica al menos durante 3 a 5 días (A-III).
Para la antibioterapia inicial, tenemos que elegir antimicrobianos que incluyan el espectro posible de la neumonía comunitaria y que tengan el menor porcentaje posible de resistencias dentro de área que se está considerando. En España, la tasa de resistencia de neumococo a macrólidos es elevada (entre el 30 y 50%)87. Por el contrario, menos del 1% de cepas de S. pneumoniae son resistentes a amoxicilina-clavulánico, cefalosporinas de tercera generación o levofloxacino88. Aunque estos datos harían decantarse claramente a favor de otras opciones que no incluyeran macrólidos, un estudio retrospectivo89 encuentra una mayor mortalidad en pacientes que han recibido quinolonas en vez de otras combinaciones, sugiriendo que el efecto inmunomodulador de los macrólidos, descrito por algunos autores, pueda jugar un papel importante en la curación. Estos resultados deben confirmarse y sopesar el posible efecto beneficioso frente a las resistencias, por lo que con los datos actuales se recomienda el empleo de levofloxacino (A-II) en vez de macrólidos (claritromicina o azitromicina). Se ha empleado levofloxacino en monoterapia en neumonías comunitarias en pacientes críticos, pero sin shock séptico90, por lo que el panel recomienda, en esta situación clínica, el empleo de levofloxacino siempre, al menos en los primeros días, en combinación con otro antibiótico.
En España, no existen prácticamente casos de SARM como causa de neumonía adquirida en la comunidad. Por tanto, el tratamiento empírico antes propuesto cubre la posibilidad de que el CGP implicado sea S. aureus. Una vez conocido el antibiograma y si es sensible a meticilina, podemos continuar con ceftriaxona o sustituir por cloxacilina.
Tratamiento dirigido. Streptococcus pneumoniae
Existe una amplia experiencia clínica positiva con el empleo de ceftriaxona o cefotaxima en neumonías graves sin que haya influido en la respuesta clínica el desarrollo de resistencias del neumococo detectado en algunas áreas91,92, por lo que sigue siendo tratamiento de primera línea79 (A-II). Elegir entre el mantenimiento de la cefalosporina o de levofloxacino, tras los días de terapia combinada, es una cuestión no resuelta. Con niveles de resistencia a ceftriaxona de 2 mg/l, el tratamiento con cefotaxima o ceftriaxona sigue siendo el recomendado (con la adición de levofloxacino como se ha comentado en el apartado anterior), aunque la experiencia clínica en neumonías causadas por cepas de S. pneumoniae con este nivel de resistencia es mucho más escasa, por lo que la recomendación es de menor consistencia (B-III). Es muy improbable que en infecciones pulmonares se encuentren cepas de S. pneumoniae con resistencia más elevada93, en cuyo caso el tratamiento debe adaptarse al antibiograma (C-III). Para casos de alergia a betalactámicos con sensibilidad conocida se debe emplear levofloxacino o macrólidos (claritromicina o azitromicina) según el antibiograma.
Cuando existe sospecha de aspiración, el tratamiento debe ampliarse a la cobertura de anaerobios por lo que se puede sustituir la ceftriaxona por amoxicilina-clavulánico o ertapenem (A-III). No existen estudios comparativos en estos casos, por lo que el nivel de evidencia es bajo. Por otro lado, dos antimicrobianos recientemente introducidos en la práctica clínica como linezolid y ertapenem han demostrado similar tasa de respuesta clínica y microbiológica al compararlos con ceftriaxona94,95, pero su uso queda restringido en la neumonía comunitaria a situaciones muy específicas.
La duración óptima del tratamiento antimicrobiano en la neumonía comunitaria no ha sido establecida. Se recomienda de 10 a 14 días en las formas graves, aceptándose cursos más cortos en neumonías no graves96 (C-III).
TRATAMIENTO DE LAS BACTERIEMIAS PRIMARIAS Y RELACIONADAS CON CATÉTERES POR CGP
Los sistemas de vigilancia de infección nosocomial en las UCI de Norteamérica dan unas tasas de bacteriemias primarias y relacionadas con catéter de 3,2 a 5,3 bacteriemias por mil días de catéter3,97. En España el sistema ENVIN-UCI recoge una tasa media nacional de 3,5 a 4,7 bacteriemias por mil días de catéter98. Los CGP son los gérmenes más frecuentemente aislados tanto en las bacteriemias primarias como en las relacionadas con catéter, representado el 50-60% de todos los gérmenes cultivados. Los Staphylococcus coagulasa negativo constituyen el 35-50% de los aislamientos, el S. aureus el 15-20% y el Enterococcus spp. el 5-10%.
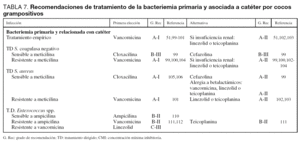
Recomendaciones para el tratamiento de la bacteriemia primaria y asociada a catéter por CGP
Tratamiento empírico
El tratamiento empírico en el caso de sospecha de bacteriemia relacionada por catéter es vancomicina (A-I)51,99-101 debido a que los microorganismos más frecuentemente implicados son el Staphylococcus coagulasa negativo (en un 60-80% resistentes a meticilina), SARM o Enterococcus spp. (tabla 7). La alternativa es teicoplanina o linezolid, aunque la experiencia de estos antimicrobianos empleados como tratamiento empírico es menor que con vancomicina (A-II)51,102,103. Ambos serían antibióticos de primera elección en pacientes con elevado riesgo de desarrollar fracaso renal. El tratamiento empírico debe completarse en algunas situaciones clínicas con un antibiótico para cobertura de bacilos gramnegativos, e incluso para el tratamiento de hongos, lo cual queda fuera del alcance de estas recomendaciones.
Tratamiento dirigido
Cuando el patógeno aislado es un Staphylococcus coagulasa negativo sensible a meticilina se debe utilizar cloxacilina o cefazolina, aunque por lo poco frecuente de este patrón de sensibilidad el nivel de evidencia es bajo (B-III). Lo habitual es la resistencia a meticilina, por lo que será necesario mantener el tratamiento empírico inicial con vancomicina (A-I)104.
Si el microorganismo aislado es un Staphylococcus aureus sensible a meticilina, se recomienda emplear una penicilina isoxazólica como cloxacilina (A-I), siendo las cefalosporinas de primera generación una alternativa igualmente válida (A-II). El tratamiento de bacteriemias por SASM con penicilinas antiestafilocócicas es más efectivo que con glucopéptidos105. Comenzar el tratamiento con vancomicina en vez de con un beta-lactámico se asocia con un mayor retraso en la negativización del hemocultivo en las bacteriemias por SASM106.
Para el tratamiento de bacteriemias por SARM se recomienda el empleo de vancomicina (A-I), con las mismas salvedades respecto a la nefrotoxicidad, que las referidas anteriormente y que apoyarían el empleo de linezolid o teicoplanina (A-II) (tabla 7). El exceso de mortalidad atribuida en pacientes críticos con bacteriemia por SARM (comparado con pacientes con bacteriemia por SASM), sugiere que el tratamiento con glucopéptidos es sub-óptimo para la atención de pacientes con esta infección107. Por ello, hay que enfatizar la necesidad de alcanzar niveles plasmáticos óptimos o plantear otras combinaciones como la adición de rifampicina108, ya que en España el 95% de los SARM son sensibles a este antibiótico72.
Linezolid no se ha demostrado superior a vancomicina al analizar los resultados de 5 ensayos clínicos que incluyeron 144 bacteriemias por SARM101. Sin embargo, linezolid ha resultado superior a teicoplanina para el tratamiento de la bacteriemia en pacientes hospitalizados103, y equivalente en pacientes críticos102, aunque en ambos estudios no se trataba exclusivamente de pacientes con SARM.
Si el S. aureus presenta CMI a vancomicina menor o igual que 0,5 mg/l, el panel recomienda monoterapia con vancomicina (A-I) siempre que los niveles terapéuticos se sitúen en 15-20 mg/l. En el caso de
S. aureus con CMI entre 1 y 4 mg/l, se puede emplear vancomicina en perfusión continua, manteniendo niveles terapéuticos de 20-30 mg/l61 asociado a rifampicina108 o bien, linezolid en monoterapia109. Si la CMI es mayor o igual que 8 mg/l debemos guiarnos por antibiograma, siendo muy posiblemente linezolid la opción más adecuada. Estas situaciones, de momento improbables en nuestro país, tienen niveles bajos de recomendación y evidencia (C-III).
En casos de bacteriemia por Enterococcus spp. sin endocarditis o meningitis, el tratamiento debe ser ampicilina si la cepa es susceptible (B-II) no considerando oportuno la adición de un aminoglucósido, pues la terapia combinada se ha demostrado que no modifica el pronóstico110. Recomendamos tratar la bacteriemia por Enterococcus spp resistente a ampicilina con vancomicina o teicoplanina (B-II)111,112. La bacteriemia por Enterococcus spp. resistente a vancomicina debe tratarse con linezolid (C-III). En esta situación no es recomendable el uso de teicoplanina. Los fenotipos Van A son resistentes a teicoplanina y los fenotipos Van B son sensibles, pero pueden hacerse resistentes con la exposición a dicho antibiótico113.
En la bacteriemia por S. coagulasa negativo la duración del tratamiento es de 5 a 7 días retirando el catéter y siempre que el paciente no sea portador de prótesis cardiaca o articular (B-III). Si no se retira el catéter o el paciente es portador de prótesis cardiaca o articular el tratamiento sistémico debe durar hasta 14 días (B-III). La retirada del catéter venoso es mandatario en el caso de bacteriemia por S. aureus y Enterococcus spp. Se ha demostrado que la no erradicación del foco es un factor independiente de mortalidad en bacteriemia por SASM y SARM114. En estos pacientes, se debe realizar un ecocardiograma transesofágico (ETE) para descartar endocarditis (B-III). La duración del tratamiento antibiótico se considera que debe ser de 14 días si el ETE es negativo (C-III).
TRATAMIENTO DE LAS INFECCIONES INTRAABDOMINALES CAUSADAS POR CGP
Los patógenos implicados en las peritonitis secundarias son bacilos gramnegativos, anaerobios y entre los CGP sólo tiene un papel relevante y a la vez discutido Enterococcus spp. En recientes ensayos clínicos realizados en infecciones abdominales115,116 la etiología por CGP oscila entre el 7 y el 15% de los aislamientos, especialmente y por orden de frecuencia a expensas de Streptococcus spp., Enterococcus spp. y en menor proporción S. aureus. En peritonitis postoperatorias se incrementa la proporción de Enterococcus spp.117,118 y SARM118, mientras que en peritonitis nosocomiales no postquirúrgicas esta proporción se mantiene similar a las comunitarias119. Las peritonitis terciarias suelen estar causadas por patógenos multirresistentes entre los que se encuentra Enterococcus spp. y SARM. Presentan una elevada mortalidad que se ve influenciada tanto por el retraso en la cirugía como por recibir tratamiento antibiótico empírico inadecuado, bien sea en la selección, momento de prescripción, dosificación o en la duración del mismo120-122.
Los factores de riesgo que se han descrito asociados al aislamiento de Enterococcus spp. son: shock en pacientes que recibieron previamente cefalosporinas, inmunodepresión, portadores de prótesis valvulares cardiacas, infección recurrente intraabdominal, larga estancia hospitalaria, APACHE II mayor que 15, infección nosocomial y determinadas localizaciones especialmente el foco colónico123-126. Algunos autores han encontrado mayores complicaciones y mortalidad en peritonitis postquirúrgicas en las que se ha aislado Enterococcus spp.123,124.
Recomendaciones para el tratamiento de las infecciones intraabdominales por CGP
El tratamiento de las infecciones intraabdominales debe basarse prioritariamente en el control quirúrgico del foco de la infección (A-I), dado que su retraso se asocia a una mayor mortalidad127. No se ha demostrado la superioridad de ninguna pauta antibiótica sobre otra128. No se considerará necesaria la cobertura antibiótica específica de Enterococcus spp. en peritonitis comunitarias (A-I)129, por el contrario, se deben considerar como factores de riesgo para ampliar cobertura antibiótica para CGP, el origen nosocomial (A-I) y las peritonitis terciarias (A-I).
En peritonitis nosocomial postoperatoria con riesgo de aparición de Enterococcus spp. como primera elección el panel recomienda el empleo de piperacilina-tazobactam o imipenem (B-II)115,116 o la combinación de cefepime más metronidazol y ampicilina (C-III)129,130. Sin embargo, cuando la resistencia local de enterococo a ampicilina es elevada debe usarse vancomicina. Asimismo, en Unidades con alta incidencia de SARM, se debe considerar la utilización de vancomicina o como alternativa, teicoplanina o linezolid. En alérgicos a penicilina, la pauta debe incluir aminoglucósidos (o quinolonas) con metronidazol y vancomicina, teicoplanina o linezolid (C-III).
En la peritonitis terciaria debe incluirse cobertura empírica de Enterococcus spp. y SARM por lo que a las pautas de tratamiento anteriores debe añadirse vancomicina o teicoplanina, siendo la alternativa linezolid (C-III)129,130 aunque debe ajustarse el tratamiento antibiótico según la sensibilidad (A-I).
El tratamiento antibiótico debe mantenerse hasta 48 horas después de la defervescencia de los síntomas, signos de sepsis y recuperación de la motilidad intestinal (C-III).
TRATAMIENTO DE LAS INFECCIONES URINARIAS CAUSADAS POR CGP
Alrededor del 8% de nuestros pacientes presentan una infección urinaria adquirida en UCI, siendo más frecuentes en mujeres y en enfermos médicos131. Datos del ENVIN muestran que las infecciones urinarias suponen entre el 20 y 25% de las infecciones adquiridas en UCI, con una densidad de incidencia de 5 a 7 episodios por 1.000 días de sondaje vesical y confirman al foco urinario como responsable de alrededor del 15% de las bacteriemias secundarias2.
La etiología por CGP en las infecciones urinarias adquiridas en UCI suponen entre el 20 y el 25% del total de aislamientos131,132 principalmente por E. faecalis98, y en menor medida SARM y Staphylococcus coagulasa negativo133. Las infecciones urinarias solamente suponen el 6,2% del total de infecciones causadas por SARM51. Son infecciones tardías que se presentan en enfermos de larga estancia, y en un importante porcentaje se asocian a bacteriemia134. El papel del Staphylococcus coagulasa negativo como patógeno urinario está por aclarar. Se deben considerar factores de riesgo para desarrollar infecciones urinarias por CGP multiresistentes las infecciones nosocomiales, las adquiridas en pacientes sometidos a manipulación urológica reciente y cuando el paciente ha recibido tratamiento antibiótico previo.
Recomendaciones para el tratamiento de las infecciones urinarias por CGP
No hay ensayos clínicos específicos en los que se hayan comparado distintas pautas antibióticas en pacientes críticos con infecciones urinarias, por lo que las recomendaciones solamente pueden ser hechas en base a la etiología, la sensibilidad y los efectos secundarios de los antimicrobianos a administrar.
En infecciones urinarias de la comunidad no se debe considerar la cobertura de CGP, salvo su presencia en la tinción de gram. Si aparecen CGP se deberá utilizar betalactámicos con actividad frente a E. faecalis (A-I). En infecciones adquiridas en UCI o tras manipulación instrumental o quirúrgica de la vía urinaria se debe plantear la asociación de vancomicina o linezolid en caso de presencia de CGP en racimos, en las UCI en que exista endemia de SARM (A-III).
Tiempo de tratamiento: siete días y/o hasta 48 horas después de la defervescencia de los síntomas y signos de sepsis debiendo conllevar la negativización de los cultivos. Si tras este tiempo de tratamiento no se aprecia mejoría se debe reevaluar al paciente (A-III).
TRATAMIENTO DE LAS INFECCIONES DEL SISTEMA NERVIOSO CENTRAL POR CGP EN EL PACIENTE CRITICO ADULTO
En este apartado consideraremos las infecciones del sistema nerviosos central (ISCN) que incluyen las meningitis bacterianas (MB) graves adquiridas en la comunidad, las nosocomiales, las cerebritis, los abscesos cerebrales y las ventriculitis. Los patógenos más frecuentemente aislados en la meningitis comunitaria son S. pneumoniae (39%), Neisseria meningitidis (15,6%) y S. aureus (6,2%)135. La mortalidad en las distintas series varía entre el 20 y 30%136. En la MB neumocócica un 10% de pacientes quedará con secuelas neurológicas permanentes.
La etiología de la MB nosocomial es diferente a la comunitaria, ya que predominan CGP como S. aureus, Staphylococcus coagulasa negativa, Enterococcus spp y en menor porcentaje los BGN.
Los abscesos cerebrales son polimicrobianos en alrededor del 45% de los casos. Los agentes causales más frecuentes son Streptococcus spp., tanto aerobios como anaerobios, y bacterias anaerobias estrictas formando parte de infecciones polimicrobianas. En los abscesos cerebrales postraumáticos, el microorganismo más frecuente es el S. aureus. Este microorganismo (poco frecuente como causa de meningitis comunitaria) es un patógeno frecuente en las meningitis de adquisición nosocomial y en las ventriculitis135,137.
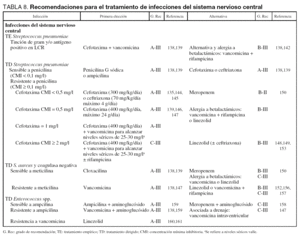
Recomendaciones de tratamiento de infecciones de sistema nervioso central por CGP
No hay ensayos aleatorizados y controlados realizados en pacientes adultos, con altos niveles de evidencia, por lo que los puntos clave del tratamiento son el diagnóstico precoz y tratamiento antibiótico (empírico o guiado por tinción de Gram o detección de antígeno en LCR) y el tratamiento coadyuvante. Las recomendaciones para el tratamiento de esta infección se resumen en la tabla 8, mientras que en la tabla 4 se han especificado las dosis de los antibióticos a emplear en las infecciones del sistema nervioso central.
Infecciones del sistema nervioso central causadas por Streptococcus pneumoniae
1. Tratamiento empírico (tinción de Gram y/o antígeno positivo en LCR). Para el tratamiento empírico de la meningitis bacteriana de la comunidad en que se debe cubrir S. pneumoniae, hay un amplio consenso de que el tratamiento de elección es la combinación de cefotaxima y vancomicina (A-III)138,139. Los niveles de la cefalosporina de tercera generación en LCR pueden ser insuficientes para el tratamiento de infecciones causadas por cepas con CMI elevadas por lo que debe asociarse vancomicina. No debe emplearse vancomicina en monoterapia porque las concentraciones en LCR pueden ser infraterapéuticas. Además, en modelos animales se ha demostrado una mayor eficacia de la combinación ceftriaxona más vancomicina que la monoterapia con ceftriaxona, vancomicina, rifampicina o meropenem140,141.
En pacientes alérgicos a penicilina se recomienda el tratamiento con vancomicina más rifampicina (B-III). Se ha demostrado en un modelo animal, que la rifampicina incrementa la penetración en el SNC de la vancomicina, contrarrestando el efecto negativo de la dexametasona sobre los niveles en LCR del antibiótico142. Otras guías recomiendan como alternativa moxifloxacino o gatifloxacino138,139, pero no existen formulaciones intravenosas en España de estas quinolonas. No consideramos a levofloxacino como alternativa de tratamiento debido al posible efecto epileptógeno en pacientes con alteraciones del sistema nervioso central143.
2. Tratamiento dirigido de infección por S. pneumoniae. La pauta antibiótica dependerá de la información que proporciona el antibiograma. Para neumococo sensibles a penicilina (CMI ≤ 0,1 mg/l) una opción válida es penicilina G sódica (A-III). Aunque es una pauta recomendada en las guías138,139, la práctica clínica habitual no es emplear este antibiótico, sino que se prefiere una cefalosporina de tercera generación (A-III). Si se había iniciado tratamiento empírico debe suspenderse vancomicina y continuar con cefotaxima o ceftriaxona con los que hay una amplia experiencia clínica positiva135,144,145.
Cuando la infección está causada por un neumococo resistente a penicilina (CMI ≥ 1 mg/l) se debe medir la CMI a cefalosporinas. En la tabla 8 se refleja las recomendaciones del panel según los niveles de CMI a cefotaxima. Aunque el nivel de evidencia es bajo (A-III), es recomendable un incremento en la dosis de cefotaxima y la adición de vancomicina y rifampicina para tratar neumococos con los niveles más altos de resistencia (C-III)139,146,147. La dosis de vancomicina deberá ajustarse para alcanzar Cmin plasmática de 25 -30 mg/l siendo recomendable la administración en perfusión continua25.
El papel del linezolid como alternativa en la meningitis por S. pneumoniae no está establecido. En un modelo animal de meningitis, linezolid fue menos efectivo que ceftriaxona en caso de S. pneumoniae sensible a penicilina, e inferior a la combinación ceftriaxona más vancomicina si la meningitis era causada por S. pneumoniae resistente a penicilina148. Recientemente, se ha comunicado una serie de 7 pacientes con meningitis por S. pneumoniae resistente a penicilina, tratados de forma exitosa con la combinación ceftriaxona más linezolid149, lo que apunta a que esta combinación de antibióticos podría ser una alternativa en estos casos. Se requieren más estudios que confirmen su utilidad.
El meropenem es una opción que se ha demostrado eficaz en un ensayo clínico150, pero en un modelo experimental de meningitis por S pneumoniae resistente a penicilina, meropenem se mostró inferior a ceftriaxona más vancomicina151. No obstante, el panel cree que al ser un carbapenem de amplio espectro, no debe emplearse en primera línea ya que existen otras opciones de espectro más reducido. En todos los supuestos anteriores, si hay alergia a betalactámicos se debe emplear vancomicina más rifampicina (B-III), o linezolid (C-III).
La duración del tratamiento de la meningitis neumocócica debe ser entre 10 y 14 días.
Infecciones del sistema nervioso central causadas por Staphylococcus aureus y coagulasa negativo
En el caso de meningitis por SASM se debe tratar con una penicilina isoxazólica (cloxacilina) y no con vancomicina en base a su mejor penetración en el SNC y su mayor poder bactericida (A-III) (tabla 8). Otra opción es meropenem (C-III) y para alérgicos a betalactámicos vancomicina o linezolid (A-III).
Para tratar las meningitis o ventriculitis por SARM, el tratamiento de elección ha sido vancomicina (A-III), debiendo considerar la adición de rifampicina por su excelente penetración en el SNC (C-III) o el empleo de linezolid (B-III). No hay en la literatura ensayos que hayan comparado vancomicina frente a linezolid en meningitis por SARM. Si la CMI es menor o igual que 0,5 mg/l puede emplearse vancomicina en perfusión continua pero manteniendo niveles séricos de 20-30 mg/l (A-III). En los pocos casos en que la CMI se encuentre entre 1 y 4 mg/l, la primera opción puede ser el empleo de vancomicina con rifampicina (C-III) o linezolid como alternativa, mientras que ésta será la única opción si la CMI es mayor o igual que 8 mg/l (C-III) lo que aún no se ha descrito en nuestro país72,75. Linezolid se ha demostrado eficaz en casos comunicados de tratamiento de meningitis o ventriculitis por SARM152,153, pero aún no hay evidencia para recomendarlo como de primera línea. No se recomienda el empleo de teicoplanina en ISNC debido a la mala difusión al LCR (tabla 2).
La administración intraventricular de vancomicina se reserva para los casos de ventriculitis asociada a drenaje con mala evolución clínica147 especialmente si no es posible sustituir dicho drenaje, medida que debe realizarse siempre que se pueda154. Además, este panel recomienda la adición intraventricular de vancomicina en caso de SARM con CMI de vancomicina mayor o igual que 1 mg/l (C-III). Un estudio de 10 pacientes con ventriculitis estafilocócica asociada a drenaje demostró que 2 g/día de vancomicina no lograba niveles terapéuticos en LCR lo cual se obtenía cuando se añadía tratamiento intraventricular con 10 mg/día de vancomicina155.
El tratamiento empírico o dirigido de ISNC por S. epidermidis debe ser igual al tratamiento para infecciones por S. aureus resistente a meticilina, es decir, es obligado el empleo de vancomicina (A-III) o linezolid (B-III)156,157. Debe considerarse la adición de rifampicina en los casos de mala evolución clínica. Se recomienda que la duración del tratamiento de todas las infecciones estafilocócicas sea entre 2 y 3 semanas.
Infecciones del sistema nervioso central causadas por Enterococcus spp.
La meningitis por Enterococcus spp. suele ser de adquisición nosocomial en el 90% de los casos si bien puede ser causa de meningitis comunitarias en pacientes con enfermedades debilitantes graves158. En las cepas sensibles a ampicilina, el panel recomienda el tratamiento con ampicilina y un aminoglucósido (gentamicina o estreptomicina) (A-III)159. Meropenem con gentamicina es una opción válida en estos casos (C-III)158. Para los aislamientos, resistentes a ampicilina, el tratamiento de elección es vancomicina asociada a gentamicina o estreptomicina (A-III)138,159. En caso de que la infección por Enterococcus spp. se asocie a la existencia de un drenaje ventricular, puede emplearse además de la terapia sistémica, vancomicina intraventricular, sobre todo en los casos de mala evolución clínica o si dicho drenaje no puede ser sustituido. Si se trata de una infección por Enterococcus spp. resistente a vancomicina, la única opción terapéutica es linezolid (A-III) lo cual se avala por diversas series de casos que demuestran su utilidad en esta indicación160,161. La duración del tratamiento debe ser entre 2 y 3 semanas (A-III).
TRATAMIENTO DE LA ENDOCARDITIS CAUSADA POR CGP EN EL PACIENTE CRÍTICO
Se define endocarditis infecciosa (EI) como la infección que produce vegetaciones en el endocardio (válvula, defecto septal o endocardio mural). La infección de los shunts arteriovenosos o de una coartación de aorta debe denominarse endarteritis, aunque tanto el síndrome clínico, como su manejo son similares a lo que se discute para la EI. Las EI se clasifican en: endocarditis sobre válvula natural, EI en adictos a drogas parenterales y endocarditis sobre válvula protésica. La información más esencial es sin duda la etiología, por lo que las recomendaciones terapéuticas (tabla 9) se basan en el conocimiento del microorganismo y su antibiograma. Las manifestaciones clínicas de la EI pueden ser muy variables, por ello se precisa una estrategia diagnóstica sensible y específica. En la actualidad se utilizan los criterios de Duke que clasifican las EI en 3 categorías: definitivas, posibles y probables162,163.
En un hospital general de gran dimensión se detectan unas 50 endocarditis al año, por lo que es difícil que un solo profesional tenga suficiente experiencia personal y es muy recomendable contar, siempre que sea posible, con la colaboración de expertos164. Aunque sólo un 5% de las EI requerirán ingreso en la UCI, es esencial su reconocimiento precoz y realizar un ecocardiograma transesofágico entre otras situaciones en bacteriemias persistentes causadas S. aureus, S. epidermidis, enterococo y Streptococcus viridans incluso cuando haya un origen documentado163.
En lo que respecta a la etiología de la EI, en los últimos años se han detectado cambios importantes. El 90% de los casos están causados por CGP, pero S. viridans es responsable ya de sólo un 10% de las EI, mientras que los estafilococos causan más del 60% de los casos164,165.
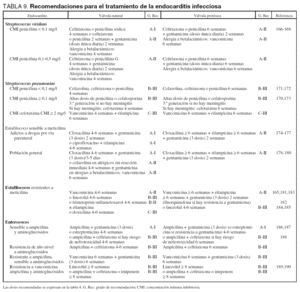
Recomendaciones de tratamiento de infecciones de endocarditis por CGP
La EI precisa de un tratamiento prolongado, por ello es extremadamente importante filiarla etiológicamente. En pacientes con hemocultivos negativos debido a que ya recibían antimicrobianos cuando aquellos se obtuvieron, la actitud recomendada, si la situación clínica lo permite, es suspender el tratamiento y repetir los hemocultivos a las 48-72 horas. Las dosis de los antibióticos que se deben emplear, se reflejan en la tabla 4.
En el caso de un paciente en situación tan crítica que no es posible esperar a conocer el resultado de los hemocultivos puede ser necesario instaurar tratamiento empírico. El tratamiento recomendado en caso de válvula nativa o de prótesis implantada hace más de un año será la combinación de ampicilina (o vancomicina si hay intolerancia) con gentamicina y ciprofloxacino durante 4-6 semanas (B-III). En caso de endocarditis sobre válvula protésica que lleva menos de un año de implantación, el tratamiento empírico recomendado será la combinación de vancomicina con cefepime, rifampicina (6 semanas) y gentamicina (2 semanas) (B-III)163.
En la tabla 9 se han resumido algunas de las pautas de tratamiento recomendadas en función del microorganismo aislado, su sensibilidad antimicrobiana y si la válvula afectada es natural o protésica. Se expresa además en ella el nivel de evidencia de la recomendación y algunas de las citas más importantes que la refrendan. Exceptuando las EI causadas por microorganismos más frecuentes, sobre las que se ha realizado algún ensayo clínico, y puede hacerse recomendaciones A-I, el resto de recomendaciones, sobre todo al referirse a patógenos con resistencias elevadas a algún antibiótico, se basa en estudios de cohortes, en general pequeños, que no han estudiado directamente el efecto del tratamiento, sino una descripción de la serie, por lo que no pasan de ser recomendaciones de menor nivel.
La resistencia a antimicrobianos es un problema creciente a la hora de instaurar el tratamiento. En la actualidad hemos de esperar que al menos el 50% de los S. viridans sean resistentes a penicilina por lo que será necesario ajustar el tratamiento antibiótico a dicha circunstancia (A-II)166-168. Igualmente, la resistencia a penicilina de neumococo es un problema creciente169, lo que condiciona a adoptar pautas con dosis elevadas de betalactámicos (B-III) o vancomicina con rifampicina (C-III)170-173.
Con respecto a S. aureus, cuando es sensible a meticilina, es necesario diferenciar el tratamiento antibiótico entre pacientes con endocarditis y adictos a drogas por vía parenteral174-177 de la población general con endocarditis178-180. Las posibilidades de tratamiento de endocarditis por SARM son varias165,181-185, como se refleja en la tabla 9.
Los aminoglucósidos (básicamente gentamicina) deberán administrarse en dosis única diaria para el tratamiento de EI causada por S. viridans, pero para el tratamiento de EI por Staphylococcus spp. o Enterococcus spp. es preferible un intervalo más reducido (3 dosis diarias) administradas lo más próximo posible a vancomicina o cloxacilina para potenciar el efecto sinérgico163.
En lo que respecta a los enterococos, cuando sean sensibles a ampicilina y aminoglucósidos, éste será el tratamiento de elección (A-I)186,187 o ampicilina con ceftriaxona si hay resistencia o riesgo de nefrotoxicidad por aminoglucósidos (B-III)188. Es muy frecuente en nuestro país la resistencia a ampicilina y la resistencia de alto nivel a aminoglucósidos, con lo que no existirá sinergia con los betalactámicos, debiendo administrar combinaciones con glucopéptidos (B-III) o linezolid (B-III)189,190. Afortunadamente la resistencia a vancomicina es rara, aunque se han descrito brotes en UCI191.
Es esencial recordar que la EI puede precisar tratamiento quirúrgico emergente o precoz, por tanto se recomienda notificar a los cirujanos cardiovasculares el diagnóstico de cada nuevo caso, incluso aunque no tenga aún indicación quirúrgica. Existen recomendaciones recientes sobre las indicaciones de cirugía tanto urgente como electiva en la endocarditis192. La cirugía no debe retrasarse innecesariamente, ya que esto afectará negativamente al pronóstico del paciente.
INFECCIONES DE PARTES BLANDAS CAUSADAS POR CGP
Se desconocen datos exactos sobre la epidemiología de las infecciones de piel y partes blandas (IPB) en pacientes críticos. Las infecciones de herida quirúrgica son frecuentes, y muchas veces no requieren tratamiento antibiótico, pero suelen ir englobadas y confundidas con infecciones más profundas que afectan a órganos y espacios193. Por otro lado, las IPB graves que afectan a fascias profundas y musculatura, son poco frecuentes y las series descritas nunca llegan a un centenar de casos.
Con respecto a la etiología, muchas de las IPB son polimicrobianas, sobre todo aquellas postquirúrgicas abdominales, por lo tanto, no se pueden hacer recomendaciones de tratamiento empírico dirigidas exclusivamente a CGP194. Por otro lado, cualquiera de los patógenos que produce infecciones banales o infrecuentes en pacientes críticos (pie diabético, ulceras varicosas, etc.) puede ser agente causal de infecciones profundas y graves (infecciones necrosantes) por lo que el conocimiento de la etiología no presupone la extensión de la infección, que debe guiarse por criterios clínicos y quirúrgicos, ya que la parte fundamental del tratamiento es la revisión quirúrgica de la profundidad de la lesión, y en ningún caso puede abordarse el tratamiento antibiótico de forma exclusiva194,195.
Por las razones antedichas en estas guías, y referido a IPB se proponen recomendaciones útiles para cuando se conoce la etiología de microorganismos grampositivos, sin excluir que deba añadirse otros tratamientos antibióticos que cubran otros posibles agentes. De hecho, las guías referidas a tratamiento de estas infecciones, suelen incluir un gran número de alternativas terapéuticas195.
Recomendaciones para el tratamiento de infecciones por partes blandas causadas por CGP
Hay pocos ensayos clínicos que hayan estudiado IPB en pacientes críticos, y los que hay, son heterogéneos en cuanto a definición de población a tratar, la gravedad de la infección y la actitud quirúrgica51,102. Por el contrario, existe un número considerable de estudios aleatorizados en los que no se aporta datos sobre la gravedad de los pacientes, y en los que se comparan distintas pautas antibióticas. En general, no se demuestra superioridad de un antibiótico en investigación sobre otro de utilización habitual (oxacilina, vancomicina, ceftriaxona, piperacilina-tazobactam, etc). De estos ensayos, algunos son multicéntricos, incluyen un número elevado de pacientes y estudian la eficacia clínica en el tratamiento de infecciones quirúrgicas superficiales o de partes blandas, como ertapenem196, quinupristina-dalfopristina197, teicoplanina198, linezolid199, daptomicina200 o tigeciclina33. Otros ensayos de menor nivel de evidencia han estudiado meropenem201, levofloxacino202, cefazolina con probenecid203, telavancina36 o dalbavancina35.
Infecciones causadas por Staphylococcus aureus
Para el tratamiento de IPB por SASM se recomienda cloxacilina (A-I)199,200, siendo alternativas válidas cefazolina o amoxicilina-clavulánico (A-II)197, debiendo emplear glucopéptidos o linezolid en caso de alergia a betalactámicos.
En un reciente ensayo clínico204 que compara el empleo de linezolid con vancomicina en infecciones de piel y partes blandas, se demuestra la superioridad de linezolid en el tratamiento de abscesos (pero no en celulitis o infecciones de herida quirúrgica) al tratar infecciones por SARM. No hubo diferencias en el tratamiento de otros patógenos. Los mismos autores habían publicado el año anterior205 un subanálisis de los pacientes con infecciones de herida quirúrgica. Solamente hubo diferencias significativas en la mejor erradicación microbiológica en los pacientes que habían recibido linezolid cuando la etiología era SARM.
En otro estudio en el que se comparó linezolid frente a teicoplanina103 en el tratamiento de infecciones por CGP no se encontraron diferencias en la eficacia clínica al tratar IPB, aunque el número de pacientes con infecciones por SARM era sorprendentemente bajo. Por otro lado, se ha constatado la necesidad de administrar dosis de teicoplanina de 6 mg/kg/día198 en vez de dosis menores para tratar infecciones IPB. En vista de estos estudios, el panel recomienda el empleo de linezolid para el tratamiento de IPB causadas por SARM (A-I), dejando como alternativa cualquiera de los glucopéptidos (B-I).
Infecciones causadas por Enterococcus spp.y Streptococcus spp.
Tampoco hay ensayos específicos sobre el tratamiento de IPB causadas por enterococos, por lo que las recomendaciones deben seguir el mismo criterio que el utilizado para infecciones enterocócicas de otras localizaciones, sean sensibles a ampicilina (A-II) o resistentes, empleando glucopéptidos o linezolid (B-III)98,111,206.
En el caso de las infecciones causadas exclusivamente por Streptococcus pyogenes (generalmente no quirúrgicas y de extremidades) el tratamiento de elección es penicilina y clindamicina (A-I)207,208. Otras alternativas como glucopéptidos o linezolid con clindamicina tienen menor grado de evidencia (C-III), aunque en teoría serían opciones válidas para pacientes con alergia a betalactámicos. La adición de clindamicina se basa en una mayor supresión de toxinas y mejor modulación de la producción de citoquinas que los betalactámicos, habiéndose demostrado en dos ensayos clínicos209,210 mayor eficacia clínica de clindamicina. Se debe combinar con penicilina por la posibilidad de resistencia a clindamicina211.
AGRADECIMIENTOS
El panel de expertos, quiere agradecer a Pfizer por facilitar y patrocinar el proceso de elaboración de estas recomendaciones. Igualmente, agradecemos al Dr. Miguel Ángel de la Cal por la orientación en la categorización de la evidencia científica y al Dr. Jordi Rello por la revisión crítica del manuscrito.
Declaración de conflicto de intereses
Este trabajo ha sido esponsorizado por Pfizer. Además, POA ha recibido honorarios por conferencias para Pfizer, MSD, Wyeth y Sanofi-Aventis. JGM ha recibido una beca de Lilly y honorarios por conferencias para Lilly, MSD, Gilead y Pfizer. SGC ha recibido honorarios por conferencias para Pfizer, MSD y Wyeth. ORC ha recibido honorarios por conferencias para Pfizer. MPM ha recibido honorarios por conferencias para Pfizer, Wyeth, Sanofi- Aventis y Astra-Zeneca. RZC ha recibido una beca de Pfizer y honorarios por conferencias para Pfizer, Wyeth, MSD y Elan. PMG ha recibido honorarios por conferencias para Pfizer, Gilead, Sanofi-Aventis, MSD, Wyeth y Elan. ECC no ha declarado conflicto de intereses. FAL ha recibido becas de Astra-Zeneca y Bristol Myers y honorarios por conferencias para Pfizer, MSD, Wyeth y Sanofi-Aventis.
Correspondencia: Dr. P.M. Olaechea Astigarraga.
Servicio de Medicina Intensiva. Hospital de Galdakao.
B.º de Labeaga, s/n.
48960 Galdakao. Vizcaya.
Correo electrónico: pedromaria.olaecheaastigarrag@osakidetza.net