Estudiar los resultados y las complicaciones del tratamiento endovascular (TEV) en pacientes con ictus isquémico agudo ingresados en una unidad de cuidados intensivos (UCI). Analizar los factores que podrían influir en la mortalidad y en el grado de discapacidad al alta y un año después del ictus.
DiseñoEstudio prospectivo observacional.
ÁmbitoUCI polivalente. Hospital de tercer nivel.
PacientesSesenta pacientes adultos. Muestra consecutiva.
IntervencionesNinguna.
Variables de interésDatos epidemiológicos, tiempo desde la clínica inicial hasta el TEV, resultado angiográfico, tiempo de estancia en UCI, días de ventilación mecánica, complicaciones neurológicas, National Institutes of Health Stroke Scale (NIHSS) al ingreso y al alta de UCI, escala de Rankin modificada (mRS) al año de evolución.
ResultadosEdad media 68,90±8,84años. Mediana de tiempo hasta el TEV: 180min. Mediana NIHSS al ingreso: 17,5; al alta: 3. Flujo distal en el 90% de los casos. Mediana estancia en UCI: 3días. Ventilación mecánica: 81,7%. Independencia funcional (mRS≤2) 50% al año del ictus. Fallecimientos: 22 (36,6%); 8 (13,3%) en la UCI y el resto durante el primer año.
ConclusionesLas variables asociadas a un peor estado funcional fueron la transformación hemorrágica sintomática, la ausencia de recanalización y las complicaciones durante el procedimiento. La transformación hemorrágica y la hidrocefalia se asociaron a mayor mortalidad. Se consiguió flujo distal en la mayoría de los casos, con una baja tasa de complicaciones. La mitad de los pacientes alcanza independencia funcional al año del ictus.
To study the results and complications of endovascular treatment (EVT) in acute ischemic stroke patients admitted to Intensive Care Unit (ICU). To analyse the possible factors related to mortality and level of disability at ICU discharge and one year after stroke.
DesignObservational prospective study.
SettingMixed ICU. Third level hospital.
PatientsSixty adult patients. Consecutive sample.
InterventionsNone.
Variables of interestEpidemiological data, time from symptom onset to EVT, angiographic result, length of stay, days on mechanical ventilation, neurological complications, National Institutes of Health Stroke Scale (NIHSS) at ICU admission and discharge, modified Rankin scale score (mRS) at one year.
ResultsMean age 68,90±8,84years. Median time from symptom onset to EVT: 180minutes. Median NIHSS at admission: 17,5; at discharge: 3. Distal flow was achieved in 90% of cases. Median ICU stay: 3 days. Mechanical ventilation: 81,7.%. Functional independence (mRS≤2) 50% at one year. Deaths: 22 (36,6%) of which 8 (13,3%) died during UCI stay and the rest during the first year.
ConclusionsThe factors relating to a worse functional outcome were symptomatic hemorrhage transformation, lack of recanalization and complications during EVT. The factors relating to mortality were symptomatic hemorrhage and hydrocephalus. Distal flow was achieve in most cases with a low complication rate. Half of the patients presented functional independence one year after the stroke.
En países desarrollados el ictus isquémico es una de las primeras causas de discapacidad y la segunda causa de muerte. La enfermedad tiene un efecto devastador sobre la calidad de vida de los pacientes, supone un elevadísimo gasto sanitario y representa un problema sanitario de gran magnitud1.
Más del 85% de los ictus son de tipo isquémico, principalmente de origen cardioembólico o aterotrombótico2. La oclusión arterial condiciona una disminución del flujo sanguíneo cerebral (FSC). Cuando es inferior a 10ml/100g/min se produce la muerte celular y el infarto. Entre la zona infartada y el parénquima cerebral con FSC normal (50ml/100g/min) hay una zona hipoperfundida de extensión variable en la que se distinguen dos áreas: la oligohémica, con un FSC superior a 22ml/100g/min, que raramente evoluciona a tejido infartado, y la penumbra isquémica, con FSC inferior a 22ml/100g/min, que progresa a infarto cerebral si no se restablece precozmente la perfusión. El objetivo principal en el tratamiento del ictus es recanalizar de forma urgente la arteria obstruida y conseguir la reperfusión precoz del tejido cerebral3. Este concepto se ha resumido en el eslogan «tiempo es cerebro». El manejo posterior en unidades de ictus o unidades de cuidados intensivos (UCI) es fundamental para obtener mejores resultados funcionales4,5.
La trombólisis con activador tisular del plasminógeno recombinante intravenoso (IVr-tPA) ha demostrado su eficacia y seguridad desde la publicación del ensayo clínico National Institute Neurological Disorders Stroke (NINDS)6. Tras los resultados del European Cooperative Acute Stroke Study (ECASS-3), su utilización se extendió a los ictus isquémicos de hasta 4,5h de evolución7. Las limitaciones del tratamiento son la pequeña ventana terapéutica, la menor eficacia en oclusiones de gran vaso y trombos superiores a 8mm8, y la contraindicación en pacientes con riesgo elevado de complicaciones hemorrágicas5.
Además del tratamiento con IV r-tPA, existen técnicas endovasculares de reperfusión que consiguen una mayor tasa de recanalización al actuar en el lugar de la lesión y que permiten tratar a un mayor número de pacientes al aumentar la ventana terapéutica9.
Recientemente se han publicado varios estudios que demuestran la superioridad de la trombectomía mecánica con respecto al tratamiento exclusivo con IVr-tPA en pacientes con oclusión de gran vaso y hasta 8h de evolución. El tratamiento endovascular (TEV) mejora los resultados funcionales sin incrementar la mortalidad10-14.
El objetivo del presente estudio es analizar los resultados y complicaciones del TEV asociado o no a IVr-tPA en pacientes con ictus isquémico agudo ingresados en UCI.
Pacientes y métodosDiseño del estudioEstudio observacional de tipo prospectivo. Hospital Universitario, centro de referencia para Neurocirugía y Neurorradiología intervencionista. Se incluyeron todos los pacientes con ictus isquémico agudo sometidos a trombectomía mecánica que ingresaron en la UCI entre junio de 2012 y febrero de 2014. La elección de su ingreso en la UCI fue a criterio del especialista en Neurología en función de la necesidad de soporte ventilatorio, mal estado neurológico tras el procedimiento y/o complicaciones relacionadas con el TEV. El estudio fue aprobado por el Comité de Ética de la Investigación del Principado de Asturias con el n.°148/15.
Variables de estudio:
- -
Demográficas: edad y sexo.
- -
Clínicas: antecedentes personales de riesgo cardiovascular e ictus previo, National Institutes of Health Stroke Scale (NIHSS) al ingreso hospitalario.
- -
Relacionadas con el procedimiento: tiempo hasta el inicio del TEV, localización de la obstrucción, indicación del tratamiento, utilización de IVr-tPA previa, técnicas endovasculares empleadas, recanalización y sus complicaciones.
- -
Complicaciones neurológicas durante la estancia en la UCI: transformación hemorrágica, hidrocefalia, crisis comiciales. Complicaciones sistémicas: respiratorias (neumonía, traqueobronquitis, atelectasias, edema agudo de pulmón), shock cardiogénico. Requerimientos en la UCI: soporte ventilatorio, necesidad de fármacos vasoactivos.
- -
Variables de resultado: valoración funcional y mortalidad al alta de la UCI, mortalidad durante el primer año de seguimiento y grado de discapacidad al año del evento isquémico.
Al ingreso todos los pacientes fueron evaluados por un especialista en Neurología. Se les realizó tomografía computarizada (TC) de cráneo, angiografía con TC (ATC), TC de perfusión para valorar la viabilidad del tejido cerebral, seleccionando a los pacientes que podrían tener mayor beneficio clínico, y arteriografía cerebral para localizar el lugar de la oclusión vascular y la existencia de colateralidad. La vía de acceso fue la arteria femoral. El TEV fue realizado por neurorradiólogos expertos bajo anestesia general o sedación, según el estado clínico del paciente y a criterio del especialista en Anestesiología. Pacientes con bajo nivel de consciencia y escasa o nula colaboración fueron sedoanalgesiados y conectados a ventilación mecánica. Después del procedimiento, los pacientes ingresaron en la UCI.
TratamientoDe los 207 pacientes con ictus isquémico agudo que recibieron TEV en nuestro centro, 60 casos (29%), los que cumplían criterios de gravedad, ingresaron en la UCI. Los criterios de inclusión para el TEV se especifican en la tabla 1. El cumplimiento de todos ellos se consideró condición imprescindible para su incorporación en el estudio. La indicación del tratamiento fibrinolítico intravenoso se realizó a criterio del médico especialista en Neurología.
Criterios de inclusión para tratamiento endovascular
| Edad > 18 años |
| Tiempo desde el inicio de los síntomas hasta la llegada al hospital: |
| < 6 h en circulación anterior |
| < 12 h en circulación posterior |
| NIHSS ≥ 7 |
| TC craneal sin hemorragia o infarto |
| ATC con oclusión de gran vaso o contraindicación/fracaso de fibrinólisis sistémica |
| TC de perfusión: viabilidad del tejido cerebral (discrepancia > 20%) |
ATC: angiografía con TC; NIHSS: National Institutes of Health Stroke Scale; TC: tomografía computarizada.
La extracción mecánica del trombo se realizó mediante un stent autoexpandible y extraíble Solitaire FR® (Covidien-ev3Inc, Irvine, CA, EE.UU.). La técnica consiste en avanzar una microguía (Concentric Medical Inc., CA, EE.UU) y sobre ella un microcatéter con balón Rapidtransit® (Codman & Shurtleff, Inc., MA, EE.UU.) hasta atravesar el punto de obstrucción. El dispositivo se despliega y comprime el trombo contra la pared del vaso consiguiendo su recanalización. Posteriormente, se infla el balón del catéter guía, se retira el stent con aspiración continua para evitar embolismos y se extrae el trombo simultáneamente con el stent. En los procedimientos de angioplastia transluminal percutánea se utilizaron balones UltraSoft® (Stryker Neurovascular, Fremont, CA, EE.UU.). Los stents colocados fueron el Wingspan® Stent System en posición intracraneal y el Wallstent® carotídeo, ambos de Boston Scientific, MA, EE.UU.
La recanalización arterial se valoró mediante la escala Arterial Occlusive Lesion (AOL): no recanalización: 0; recanalización parcial o incompleta de la oclusión sin flujo distal: 1; recanalización parcial o incompleta de la oclusión con flujo distal: 2; recanalización completa con flujo distal: 315. Consideramos fracaso del tratamiento un AOL 0-1 y eficacia un AOL 2-3.
Valoración de los resultadosSe definió hemorragia cerebral sintomática según criterios ECASS-II, como evidencia de hemorragia cerebral en cualquier parte del cerebro asociada a deterioro neurológico con un incremento de al menos 4 puntos en la escala NIHSS16.
Para la evaluación del efecto del tratamiento al alta de la UCI se documentó la escala NIHSS en todos los pacientes que sobrevivieron. Para la valoración funcional se empleó la escala de Rankin modificada (mRS)17, considerando buen estado funcional un mRS≤2. La evaluación funcional al año se realizó con datos obtenidos en la revisión clínica realizada por el servicio de Neurología y mediante conversación telefónica.
Análisis estadísticoEstadística descriptiva. Los resultados se analizaron mediante el programa SPSS 19.0 para Windows (SPSS Inc., Chicago, Illinois).
Las variables continuas se describen mediante la media y la desviación típica cuando siguen una distribución normal, lo que se ha verificado con la prueba de Kolmogorov-Smirnov y, en caso contrario, o bien cuando se trata de variables de tiempo o cuando el valor de la desviación típica supera al de la media, mediante la mediana y el rango intercuartílico. Las variables categóricas se describen mediante frecuencias absolutas y relativas.
La comparación de variables continuas, teniendo en cuenta que solo se han comparado dos muestras independientes, se ha realizado mediante la t de Student para muestras independientes cuando siguen una distribución normal y, en caso contrario, mediante el test no paramétrico U de Mann-Whitney.
El análisis de una variable en distintos momentos del tiempo se ha realizado mediante la t de Student para muestras relacionadas y, en caso de que las distribuciones de frecuencias no sigan una distribución normal, la prueba de rangos con signo de Wilconxon.
Para contrastar la independencia de variables categóricas se ha utilizado el test chi-cuadrado, y el estadístico exacto de Fisher cuando no se cumplen las condiciones necesarias para su aplicación.
Como medida de riesgo se ha utilizado la odds ratio de Maentel-Haenszel (ORMH), incluyendo sus respectivos intervalos de confianza (IC) al 95%.
Los valores de p<0,05 se consideraron estadísticamente significativos.
ResultadosCaracterísticas clínicasEdad media: 68,90±8,84años (hombres 67,12±8,26; mujeres 73,41±8,89). Varones: 43 (71,7%). No se encontró asociación estadísticamente significativa entre la edad y la mortalidad o el estado funcional tanto al alta como al año. Tampoco el sexo mostró diferencias en cuanto a los resultados clínicos.
El 83,3% de los pacientes tenía al menos un factor de riesgo cardiovascular: hipertensión arterial, 36 (60%); diabetes mellitus, 13 (21,7%); dislipemia, 23 (38,3%); tabaquismo activo, 11 (18,3%). Antecedentes de ictus previo, 6 (10%). La etiología del ictus puede verse en la tabla 2.
Etiología del ictus y localización de la lesión
| n (%) | |
|---|---|
| Etiología | |
| Cardioembólico | 26 (43,3) |
| Aterotrombótico | 18 (30) |
| Criptogenético | 11 (18,3) |
| Disección carotídea | 4 (6,7) |
| Síndrome de hipercoagulabilidad | 1 (1,7) |
| Arterias afectas | |
| Lesión única | 26 (43,3) |
| ACM | 18 (30) |
| Segmento M1 | 13 (21,6) |
| Segmento M2 | 5 (8,3) |
| ACI terminal | 6 (10) |
| VB | 1 (1,7) |
| ACP | 1 (1,7) |
| Lesión mixta | 34 (56,6) |
| Tándem ACI+ACM1 | 22 (36,6) |
| ACI+ACM2 | 7 (11,6) |
| ACI+ACP | 1 (1,7) |
| ACM+ACA | 1 (1,7) |
| VB+ACP | 3 (5) |
ACA: arteria cerebral anterior; ACI: arteria carótida interna; ACM: arteria cerebral media; ACM1: segmento M1 de la arteria cerebral media; ACM2: segmento M2 de la arteria cerebral media; ACP: arteria cerebral posterior; VB: vertebrobasilar.
La mediana de tiempo transcurrido desde la presentación clínica hasta el inicio del TEV fue de 180min (rango intercuartílico: 131,25-237,50). No se encontraron diferencias estadísticamente significativas en el estado funcional ni en la mortalidad en función del tiempo transcurrido hasta el tratamiento.
National Institutes of Health Stroke ScaleMediana al ingreso: 17,5 puntos (rango intercuartílico: 14-20). En dos pacientes en situación de coma profundo al ingreso no se pudo valorar la escala NIHSS. No existen diferencias estadísticamente significativas en el NIHSS al ingreso de los pacientes que fallecen y los que no; sin embargo, a mayor NIHSS al ingreso, el estado funcional al alta de la UCI y al año fue peor, p=0,027 y p=0,036, respectivamente. La mediana de NIHSS al ingreso de los pacientes que tuvieron buenos resultados al año del ictus fue de 16,5 puntos (rango intercuartílico: 13-19).
Valoración del efecto del tratamientoMediana de NIHSS en el momento del alta de la UCI: 3 puntos (rango intercuartílico: 1,25-11,50). Comparando NIHSS al ingreso y al alta, se han encontrado diferencias estadísticamente significativas en la escala en ambos momentos del tiempo, p<0,01. Mediana de reducción de NIHSS al alta: 11 puntos (rango intercuartílico: 6-15).
TratamientoLa indicación del TEV se realizó por fracaso de la fibrinólisis con IVr-tPA en 8 pacientes (13,3%), contraindicación del tratamiento fibrinolítico en 8 (13,3%) y basado en la localización de la obstrucción de gran vaso en 44 (73,3%); de estos, 7 pacientes (11,6%) recibieron tratamiento incompleto con alteplasa hasta disponer del procedimiento endovascular. Para esta última indicación se muestra una asociación entre el hecho de haber recibido IVr-tPA y el buen estado funcional al alta de la UCI, p=0,014, y también con la supervivencia al año, p=0,037.
Localización de la lesión, tratamiento endovascular y complicaciones de la técnicaLa localización de la oclusión arterial se refleja en la tabla 2. El 56,6% de los pacientes tenían dos o más arterias afectadas. No se encontró relación estadísticamente significativa entre ninguna de las localizaciones de la obstrucción y la mortalidad o el estado funcional. Las lesiones en tándem arteria carótida interna-arteria cerebral media (ACI-ACM) tampoco se relacionaron con un peor estado funcional ni mayor riesgo de muerte.
La técnica empleada, los resultados y las complicaciones se pueden ver en la tabla 3.
Técnicas endovasculares y sus complicaciones
| n (%) | Fallecimientos, n | mRS ≥ 3, n | |
|---|---|---|---|
| Técnica | |||
| Trombectomía mecánica | 60 (100) | ||
| Stent | |||
| Extracraneal | 15 (25) | ||
| +Angioplastia | 1 (1,7) | ||
| Intracraneal | 6 (10) | ||
| +Angioplastia | 2 (3,3) | ||
| Stent intracraneal+stent extracraneal+angioplastia | 1 (1,7) | ||
| Angioplastia | 1 (1,7) | ||
| Recanalización | |||
| Completa (AOL 3) | 41 (68,3) | 5 | 14 |
| Incompleta (AOL 2) | 13 (21,7) | 0 | 5 |
| Fallida (AOL 0 y 1) | 6 (10) | 3 | 6 |
| Complicaciones durante la técnica | |||
| Embolismo distal | 9 (15) | 1 | 4 |
| Disección arterial | 3 (5) | 0 | 1 |
| Rotura arterial | 1 (1,7) | 1 | 1 |
| Estenosis del stent | 1 (1,7) | 0 | 0 |
| Desprendimiento del dispositivo | 1 (1,7) | 1 | 1 |
AOL: Arterial Occlusive Lesion.
De los 54 pacientes que tuvieron un tratamiento recanalizador efectivo (AOL2 y 3), 35 (64,9%) presentaron un buen estado funcional al alta, en tanto que de los 6 pacientes en los que no fue efectivo (AOL0 y 1) ninguno lo presentó (p<0,01). Al año de evolución, 30 (55,6%) de los pacientes con tratamiento efectivo mantenían el buen estado funcional y el 100% del grupo de tratamiento fallido, la mala situación (p=0,024).
En un paciente se produjo perforación arterial durante el tratamiento y falleció en la UCI. Otras complicaciones graves fueron el desprendimiento del dispositivo extractor del trombo en un paciente fallecido también durante el ingreso y la estenosis del stent en un caso y que falleció a los 5meses. Los pacientes que sufrieron complicaciones durante el procedimiento tuvieron una probabilidad de buen estado funcional al año del evento 3,7 veces inferior al de los que no las han tenido (p=0,019; OR MH 0,27 [IC95%: 0,1-0,8]).
Estancia en la unidad de cuidados intensivosMediana de 3 días (rango intercuartílico: 2-5,75).
Complicaciones en unidad de cuidados intensivosLos requerimientos y las complicaciones en la UCI se resumen en la tabla 4
Complicaciones y requerimientos en la unidad de cuidados intensivos
| n (%) | Fallecimientos, n | mRS ≥ 3, n | |
|---|---|---|---|
| Complicaciones neurológicas | |||
| Transformación hemorrágica sintomática | 8 (13,3) | 3 | 8 |
| Hidrocefalia | 4 (6,7) | 3 | 4 |
| Crisis comiciales | 2 (3,3) | 0 | 1 |
| Complicaciones sistémicas | |||
| Neumonía | 5 (8,3) | 2 | 3 |
| Traqueobronquitis | 10 (16,7) | 2 | 8 |
| Atelectasias | 5 (8,3) | 1 | 3 |
| Shock cardiogénico | 1 (1,7) | 1 | 1 |
| Edema agudo de pulmón | 4 (6,7) | 2 | 2 |
| Otras | 5 (8,3) | 1 | 5 |
| Complicaciones en el lugar de punción | |||
| Pseudoaneurisma | 1 (1,7) | 0 | 0 |
| Hemorragia local | 2 (3,3) | 0 | 0 |
| Trombosis femoral | 1 (1,7) | 0 | 1 |
| Requerimientos UCI | |||
| Ventilación mecánica | 49 (81,7) | 8 | 24 |
| Fármacos vasoactivos | 23 (38,3) | 8 | 14 |
De los 8 pacientes con transformación hemorrágica sintomática fallecieron 3 (37,5%) en la UCI, mientras que de los 52 pacientes sin esta complicación fallecieron 5 (9,6%) (p=0,031). Al año habían fallecido 7 (87,5%) de los pacientes con transformación hemorrágica y 15 (28,8%) de los que no la tuvieron (p<0,01). Con la situación funcional al alta también se alcanzó una asociación estadísticamente significativa (p<0,01). Ninguno de los pacientes con transformación hemorrágica evolucionaron a un buen estado funcional al año en comparación con el 57,7% de los pacientes que no tuvieron esta complicación (p <0,01).
De los 4 pacientes con hidrocefalia, ninguno ha sobrevivido al primer año de evolución, en tanto que de los 56 pacientes que no la tuvieron sobrevivieron 38 (67,9%) (p=0,015). Uno de los pacientes precisó derivación ventricular externa de líquido cefalorraquídeo.
Complicaciones sistémicasDe los 40 pacientes con complicaciones sistémicas, 8 (20%) fallecieron en la UCI, mientras que sobrevivieron los 20 pacientes que no las tuvieron (p=0,043). Además, de los 40 pacientes, 21 (55%) presentaron una mala situación funcional al alta y, por contra, de los 20 que no las tuvieron, 4 (20%) evolucionaron a un mal estado funcional (p=0,016).
En cuanto a la traqueobronquitis, de los 10 pacientes que la desarrollaron, 8 (80%) presentaron mal estado funcional al alta, mientras que de los 50 que no la desarrollaron, 17 (34%) lo tuvieron (p=0,012). Al año, el mismo número de pacientes que habían presentado traqueobronquitis mantenían el mal estado funcional, y de los 50 restantes, 22 (44%) lo presentaban (p=0,038).
Otras complicaciones: insuficiencia renal aguda, infección del tracto urinario (2 casos), bacteriemia y hemorragia digestiva alta.
Tratamiento en la unidad de cuidados intensivosVentilación mecánica: mediana 7,5h (rango intercuartílico: 2-41). De los 49 pacientes que precisaron soporte ventilatorio invasivo, 24 (48%) tuvieron un mal estado funcional al alta, mientras que de los 11 que no la requirieron, uno (9,1%) presentó mal estado funcional (p=0,019).
De los 23 pacientes que necesitaron fármacos vasoactivos, 8 (34,8%) fallecieron durante su ingreso, mientras que de los 37 pacientes que no los recibieron, no falleció ninguno (p<0,01). Al alta de la UCI, de los pacientes con necesidad de fármacos vasoactivos, 14 (60,9%) tuvieron un mal estado funcional. Sin embargo, de los que no los recibieron, 11 (29,7%) evolucionaron mal (p=0,017).
Después del TEV, 39 pacientes (65%) recibieron tratamiento antiagregante y 9 (15%) tratamiento anticoagulante.
EvoluciónMortalidad: en la UCI fallecieron 8 pacientes (13,3%); en 2 casos, por causa ajena al ictus (shock cardiogénico y fracaso renal agudo con edema agudo de pulmón). Las causas de la muerte relacionadas con el ictus fueron: en 4 pacientes, síndrome de hipertensión intracraneal por infarto cerebral, asociado a transformación hemorrágica en 2 casos y limitación del esfuerzo terapéutico en 2 casos, debido a la ausencia de recuperación neurológica. Durante el año de seguimiento fallecieron otros 14 pacientes (23,3%), 5 de ellos por una causa diferente al ictus (infarto agudo de miocardio, neoplasia pancreática, dos por insuficiencia respiratoria y un paciente por complicaciones infecciosas).
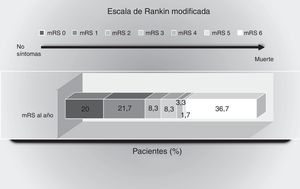
Estado funcional: durante el año de seguimiento 30 pacientes (50%) tuvieron una buena evolución, con mRS≤2. La distribución de la evolución funcional puede verse en la figura 1.
Puntuaciones en la escala de Rankin modificada al año del evento isquémico. Muestra el porcentaje de pacientes con puntuaciones entre 0 y 6 en la escala de Rankin modificada: 0, sin síntomas; 1, sin incapacidad importante: capaz de realizar sus actividades y obligaciones habituales; 2, incapacidad leve: incapaz de realizar alguna de sus actividades previas, pero capaz de velar por sus intereses y asuntos sin ayuda; 3, incapacidad moderada: síntomas que restringen significativamente su estilo de vida o impiden su subsistencia totalmente autónoma (necesita alguna ayuda); 4, incapacidad moderadamente grave: síntomas que impiden claramente su subsistencia independientemente, aunque sin necesidad de atención continua (incapaz de atender sus necesidades personales sin asistencia); 5, incapacidad grave: totalmente dependiente, necesitando asistencia constante día y noche; 6, muerte.
Nuestros resultados muestran que los factores asociados a un mayor grado de discapacidad son la ausencia de recanalización, las complicaciones durante el procedimiento endovascular y la transformación hemorrágica sintomática. La presencia de complicaciones sistémicas, la necesidad de fármacos vasoactivos, el soporte ventilatorio y el desarrollo de traqueobronquitis implican igualmente un peor resultado funcional al alta de la UCI, aunque probablemente esto se deba a la situación clínica y al nivel de complejidad de los pacientes de la UCI, ligados a un incremento de recursos con respecto a otro tipo de pacientes. Las variables ligadas a mortalidad son la transformación hemorrágica y la hidrocefalia. La tabla 5 resume las variables que se asocian a peores resultados funcionales y mortalidad. La tasa de hemorragia cerebral sintomática (13,3%) es superior a la de otros estudios debido, probablemente, tanto a la definición utilizada —los criterios SIST-MOST son mucho más restrictivos que los definidos en el ECASS-II— como a la mayor gravedad de los pacientes.
Resumen de las variables que se asocian a peores resultados funcionales y mortalidad
| Factores de comparación | ||||
|---|---|---|---|---|
| Variables | Fallecimiento al alta | Estado funcional al alta | Fallecimiento al año | Estado funcional al año |
| Ausencia de recanalización | p < 0,01 | p=0,024 | ||
| Complicaciones durante el procedimiento | p=0,019 | |||
| Transformación hemorrágica sintomática | p=0,031 | p < 0,01 | p < 0,01 | p < 0,01 |
| Hidrocefalia | p=0,015 | |||
| Complicaciones sistémicas | p=0,043 | p=0,016 | ||
| Traqueobronquitis | p=0,012 | p=0,038 | ||
| Necesidad de fármacos vasoactivos | p < 0,01 | p=0,017 | ||
| Necesidad de ventilación mecánica | p=0,019 | |||
En el manejo del ictus isquémico agudo se acepta como primera opción terapéutica el tratamiento con IVr-tPA, pero la escasa ventana terapéutica, los pobres resultados en casos de obstrucción de gran vaso y sus estrictos criterios de inclusión limitan su utilización. Por todo ello el TEV, asociado o no a tratamiento fibrinolítico endovenoso, es una gran alternativa, ya que ha mostrado buenos resultados en las 6 primeras horas desde el inicio de los síntomas10-14. El TEV consigue una rápida restauración del FSC, es seguro, se asocia a mejores resultados funcionales y muestra una tendencia global a la reducción de la mortalidad con respecto al tratamiento convencional18, siendo esta más importante a menor tiempo de evolución. Esto está llevando a algunos clínicos, en la práctica diaria, a obviar el tratamiento endovenoso o a limitar su dosis en un intento por acortar al mínimo los tiempos de tratamiento. Además, determinadas localizaciones, como la ACI terminal, la ACM proximal o lesiones en tándem (ACI-ACM), han mostrado peor tasa de recanalización con IVr-tPA19, y estas localizaciones son las más frecuentes en nuestro trabajo.
Los últimos ensayos clínicos10-14 estudian la recanalización en las 6 primeras horas (excepto REVASCAT, con un límite de 8h), en oclusión de gran vaso con el uso de stent-retrievers. Las principales diferencias de nuestro trabajo radican en el menor porcentaje de pacientes que reciben tratamiento previo con IVr-tPA, la mayor gravedad que evidencia un NIHSS más elevado y que se trata de pacientes que, por su inestabilidad clínica, no se consideran subsidiarios de ingreso en la unidad del ictus y, por último, la evaluación del grado funcional al año en lugar del seguimiento a los 90días del evento isquémico.
En nuestro estudio, el tiempo desde el inicio de los síntomas hasta el TEV (mediana 180min) es menor que los referidos en la literatura, que oscilan entre 185 y 269min10-14. No se evidenció diferencia estadísticamente significativa en la evolución clínica en función del tiempo. Es posible que, como en nuestra serie se realiza un tratamiento más temprano, no se reflejen las diferencias estadísticamente significativas que podrían aflorar si los tiempos fueran más largos. La necesidad de implementar de forma precoz un tratamiento que restaure el FSC justificaría la implementación de cualquier estrategia que se traduzca en una mayor rapidez de instauración del TEV, en nuestro caso, la eliminación o el tratamiento incompleto con IVr-tPA hasta la disponibilidad de la técnica endovascular. Por tanto, una de las diferencias de nuestro estudio es el bajo porcentaje de pacientes tratados previamente con IVr-tPA. En este sentido, una de nuestras limitaciones es que eliminamos los beneficios que se podrían conseguir con el uso de una terapia combinada.
En nuestra serie todos los procedimientos se realizaron con Solitaire FR® y se consiguió flujo distal en el 90% de los casos, tasa superior a las obtenidas en otros estudios (TICI 2b/3 de 59% en MRCLEAN, 72% en ESCAPE, 86% en EXTEND-IA, 88% en SWIFT PRIME y 66% en REVASCAT)18. Nuestros resultados confirman la relación entre recanalización y buen estado funcional. La baja tasa de complicaciones es muy similar a la de los ensayos clínicos reseñados.
La mayoría de los estudios valoran el estado funcional a los 90días; en nuestro análisis realizamos el seguimiento hasta un año después del ictus. Nuestra tasa de independencia funcional al año es del 50%, frente al 33% de MRCLEAN, el 44% de REVASCAT, el 53% de ESCAPE, el 60% de SWIFT-PRIME y el 71% de EXTEND-IA10-14 analizadas a los 90días.
El NIHSS sigue confirmándose como un buen medidor pronóstico. El beneficio clínico del tratamiento es independiente de la edad, y a pesar de ser elevada, se muestra una supervivencia al año del 63,3% de los pacientes. La tabla 6 muestra una comparativa entre los resultados de los principales ensayos clínicos y los de nuestra serie.
Datos demográficos y resultados de los recientes estudios aleatorizados y controlados de tratamiento endovascular. Comparativa con nuestros resultados
| Estudios | Edad media | NIHSS basal (mediana) | Tratamiento con IVr-tPA (%) | TICI 2b/3 (%) | Tiempo hasta la punción (mediana) | ACI cervical estenosis/oclusión | Anestesia general (%) | mRS 0-2 a los 90 días (%) |
|---|---|---|---|---|---|---|---|---|
| MR CLEAN | 65,8 | 17 | 87 | 59 | 260 | 13 (stent) | 38 | 33 |
| ESCAPE | 71 | 16 | 73 | 72 | 185 | 13 | 9 | 53 |
| EXTEND-IA | 68,6 | 17 | 100 | 86 | 210 | 0 | 36 | 71 |
| SWIFT PRIME | 65 | 17 | 100 | 88 | 224 | 0 | 37 | 60 |
| REVASCAT | 65,7 | 17 | 68 | 66 | 269 | 8,7 (stent) | 7 | 44 |
| Nuestros resultados | 68,9 | 17,5 | 25 | 90a | 180 | 15 (stent) | 81,7 | 50b |
ACI: arteria carótida interna; IV r-tPA: activador tisular de plasminógeno recombinante intravenoso; mRS: escala de Rankin modificada; NIHSS: National Institutes of Health Stroke Scale; TICI: Thrombolysis In Cerebral Infarction.
Las fortalezas posibles de nuestro trabajo consisten en su ámbito de estudio, la UCI, y en el seguimiento al año, un plazo más largo que el reportado hasta el momento en la literatura. Entre las limitaciones destacamos el sesgo en la selección de los pacientes, debido a la inclusión únicamente de aquellos que ingresan en la UCI —presumiblemente más graves—, el tamaño muestral reducido y la ausencia de un grupo control.
El TEV consigue restaurar el FSC en pacientes que no tienen la opción terapéutica del IVr-tPA o en aquellos en los que fracasa el tratamiento. La trombectomía mecánica con dispositivos stent-retriever obtiene buenos resultados con equipos multidisciplinares y en centros especializados20, aunque, a pesar de la evidencia disponible, existen algunos aspectos por definir. Es necesario establecer criterios que permitan predecir qué pacientes se pueden beneficiar del tratamiento, para minimizar los riesgos y el coste del proceso.
Entre sus limitaciones está la escasa disponibilidad, ya que requiere centros especializados, y su mayor complejidad técnica, sin olvidar que la recanalización y un buen resultado angiográfico no se asocian siempre a un mayor beneficio clínico, que depende de múltiples factores como la localización/tamaño del trombo, la severidad clínica y el tiempo transcurrido desde el inicio de los síntomas.
Todavía existe una cierta discriminación negativa en el tratamiento del ictus agudo, con clara desventaja en infraestructura y recursos humanos, cuando se compara con la patología coronaria. Considerando que el ictus constituye una de las primeras causas de mortalidad y discapacidad, su tratamiento supone un importante desafío para los sistemas sanitarios, siendo necesaria la implantación y una mayor disponibilidad de equipos neurointervencionistas. El alto precio en cuanto a mortalidad y calidad de vida de los pacientes lo convierten en una inexcusable obligación ética y profesional.
FinanciaciónNingún tipo de participación.
AutoríaLucía Viña Soria, Dolores Escudero Augusto y Lorena Martín Iglesias han concebido y diseñado el estudio.
Lucía Viña Soria, Dolores Escudero Augusto, Lorena Martín Iglesias, Lucía López Amor, Iván Astola Hidalgo, Lorena Forcelledo Espina, Raquel Rodríguez García, Sara de Cima Iglesias, José Antonio Gonzalo Guerra, Eduardo Murias Quintana, Pedro Vega Valdés y Sergio Calleja Puerta han contribuido en la adquisición de datos, análisis e interpretación de los datos y revisión crítica del manuscrito.
Todos los autores han aprobado la versión actual que se presenta.
Conflictos de interesesNinguno.
A Josefina Alonso Fernández, del Hospital Universitario Central de Asturias, por su aportación en el procesamiento de datos y análisis estadístico.