El traumatismo craneoencefálico moderado (TCEM), representa el 20% de los traumatismos craneales. Incluye a pacientes entre 9-13 puntos en la escala de coma de Glasgow. Su mortalidad es del 15%, quedando con secuelas cerca del 50%1,2. El TCEM es muy heterogéneo en cuanto a gravedad y variabilidad del curso clínico1,2. Afecta a adultos jóvenes y personas de edad avanzada, un tercio de los cuales presentan lesiones intracraneales1,2. En estos pacientes, la presencia de dolor y agitación es muy frecuente, debido a la lesión neurológica, trauma en otras regiones y al consumo de alcohol o drogas ilicitas1,2. Agitación puede magnificar la lesión cerebral por diferentes mecanismos: incremento del metabolismo y consumo de oxígeno; elevación de la presión intracraneal (PIC), descenso de la presión de perfusión cerebral (PPC); aumento del estrés cardiovascular y alteración de la ventilación y oxigenación3. Asimismo, la agitación dificulta el examen clínico y la realización de procedimientos diagnósticos y terapéuticos3. La sedoanalgesia adecuada es imprescindible, ya que tanto el exceso como la sub-sedación pueden contribuir al daño cerebral secundario4.
A diferencia del TCE grave donde diferentes guías clínicas establecen recomendaciones de sedoanalgesia5, el TCEM carece de las mismas, empleándose por similitud las del TCE grave, las que habitualmente aconsejan midazolam a dosis elevadas, remifentanilo, propofol; fármacos que alteran el nivel de conciencia, dificultan el examen neurológico y ocasionan el empleo de ventilación mecánica invasiva4,5. La dexmedetomidina (DEX), un agente sedante y analgésico que ejerce su acción a través de la estimulación de los receptores α2 adrenérgicos en el locus ceruleus y en la médula espinal, posibilita el empleo de la denominada «sedación cooperativa o consciente», definida como aquella que facilita que el individuo esté tranquilo y confortable, preservando respuesta apropiada e inmediata a los estímulos táctiles y verbales que permiten valorar el estado neurológico, manteniendo intactos los reflejos defensivos de la vía aérea y la ventilación espontánea con estabilidad hemodinámica sistémica6,7. El fármaco puede ocasionar hipotensión arterial y bradicardia debido a simpaticólisis, las cuales pueden evitarse anulando la dosis de carga, titulando dosis mientras se mantiene estricta normovolemia6,7. La DEX no altera la PIC ni la oxigenación cerebral, presentando propiedades neuroprotectoras6–10.
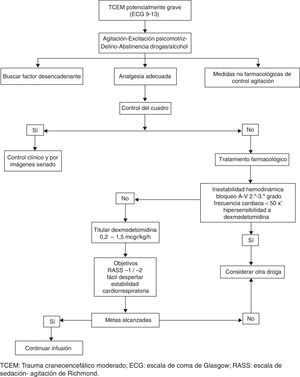
En la presente carta presentamos resultados preliminares con un protocolo de sedoanalgesia cooperativa (fig. 1) basado en el uso de la DEX, en pacientes con TCEM, sin lesiones asociadas y TC patológica que ingresaron a la Unidad de Terapia Intensiva del Hospital San Juan Bautista, Catamarca, Argentina en el periodo noviembre 2014-mayo 2015. Fue requerido consentimiento informado fue requerido al igual que la aprobación del comité de ética hospitalario.
Los pilares del protocolo asientan en la pesquisa del factor desencadenante (trauma, dolor, globo vesical); medidas básicas (contención verbal, sonda vesical, ambiente adecuado), analgesia y terapia farmacológica de la agitación. Control del dolor, el cual fue monitorizado siguiendo variables clínicas, comenzó con antinflamatorios no esteroides (diclofenaco, ketorolaco) intravenosos (IV). Si existe contraindicación (gastritis, úlceras gastroduodenales, disfunción renal, trastornos de coagulación); alergia; sangrado activo o se llegó a dosis máximas sin control, utilizamos opioides. De elección morfina IV (2-4mg/2-4h). Ante inestabilidad hemodinámica recurrimos al fentanilo intermitente a las dosis recomendadas4. En la tabla 1 se muestra los datos clínicos más relevantes.
Características demográficas y datos clínicos de la población estudiada
| Caso | Edad | Sexo | Mecanismo trauma | GCS | TC (Marshall) | ANA CO | Cirugía | RASS A/D | TAM (mmHg) A/D | FC (x’) A/D | FR (x’) A/D | paO2/FiO2 A/D | PIC A/D | Dosis máxima DEX (μg/kg/h) | Días DEX |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 34 | F | Motocicleta | 12 | II | DF | No | 3/−1 | 91/89 | 75/68 | 19/16 | 482/477 | — | 0,7 (1,8)a | 3 |
| 2b | 19 | M | Motocicleta | 9 | LOE NE | MOR | Sí | 4/−2 | 90/84 | 87/71 | 18/16 | 432/428 | — | 0,3 | 5 |
| 3 | 80 | M | Caída | 11 | II | DF | No | 3/−2 | 129/104 | 107/72 | 22/16 | 417/416 | — | 0,5 | 5 |
| 4b | 56 | M | Caída | 9 | LOE NE | MOR | Sí | 4/−2 | 145/107 | 121/86 | 24/17 | 454/452 | 3/7 | 0,2 | 6 |
| 5 | 46 | M | Motocicleta | 10 | II | MOR | No | 3/−1 | 88/84 | 107/89 | 22/17 | 381/378 | — | 0,3 | 4 |
| 6 | 47 | F | Caída | 9 | III | MOR | No | 3/0 | 92/88 | 112/82 | 18/18 | 418/419 | — | 0,5 | 4 |
| 7b | 21 | M | Motocicleta | 9 | III | MOR | Sí | 4/0 | 87/84 | 92/83 | 26/20 | 401/404 | 9/11 | 0,4 | 3 |
A: antes; ANA CO: analgesia coadyuvante; D: después de 24h de infusión; DEX: dexmedetomidina; DF: diclofenaco; F: femenino; FC: frecuencia cardiaca; FR: frecuencia respiratoria; GCS: escala de coma de Glasgow; h: hora; LOE NE: lesión ocupante de espacio no evacuada al momento de la evaluación; M: masculino; MOR: morfina; PIC: presión intracraneal; RASS: escala de agitación de Richmond; TAM: tensión arterial media; TC: clasificación tomográfica de Marshall inicial al ingreso; μg: microgramos.
1,8 dosis máxima, alcanzada por error. Violación del protocolo. Hipotensión arterial transitoria que se corrige reajustando la dosis e infundiendo 1.000ml salino normal.
Los pacientes 2 y 4 fueron intervenidos quirúrgicamente por las siguientes razones: P2 desarrolló hematoma epidural tardío; P4 presentó hematoma subdural inicialmente tratado de manera conservadora; mientras que P7 presentó inicialmente lesión axonal difusa tipo III (borramiento cisternal), conjuntamente con contusiones bifrontales< 25cc, que a posteriori requirió craniectomía descompresiva por hipertensión endocraneana refractaria.
No empleamos dosis de carga de la DEX debido a que la misma se asocia a hipotensión arterial, deletérea en estos pacientes5–7. La DEX inicia su acción a los 15-30min, alcanzando a la hora su concentración plasmática pico, por dicha razón inicialmente es necesario asociar fármacos que ayuden a controlar la agitación7. En nuestra población fueron empleadas dosis bajas de midazolam (2mg IV) o clorpromazina (25mg IM) en 3 y 4 pacientes, respectivamente.
A los 60min de iniciada la infusión de DEX, la totalidad de los pacientes descendieron 2 o más puntos en la escala RASS, mientras que el 71% alcanzó a los 120min, niveles de sedación y analgesia adecuados (RASS 0), que permitieron mantener a los pacientes tranquilos y colaboradores, en ventilación espontánea con la posibilidad de realización de examen neurológico seriado, inclusive en el periodo posoperatorio. La evolución temporal de la escala RASS puede visualizarse en la tabla 2. Para evitar confusiones no fueron utilizados otros fármacos sedantes, ni combinación de los mismos durante la infusión de la DEX, sobre todo aquellos que pudieran interferir con la evaluación neurológica y/o potencialmente depriman la ventilación. Analgésicos coadyuvantes fueron empleados en todos los casos a dosis convencionales (tabla 1). Por otra parte, no hemos observado efectos hemodinámicos o respiratorios adversos, que ocurrieron solo (una vez) cuando la DEX se empleó en dosis más altas, fuera de los rangos recomendados (violación del protocolo). Dicha complicación iatrogénica requirió corrección de dosificación e infusión de salino normal para su pronta resolución (tabla 1).
Evolución de la puntuación en la escala de agitación-sedación de Richmond
| Paciente | Antes DEX | Inicio | 1h | 2h | 6h | 12h | 24h | 36h | 48h | Sin DEX |
|---|---|---|---|---|---|---|---|---|---|---|
| P1 | 3 | 3 | 1 | 0 | 0 | 0 | −1 | −2 | −2 | 0 |
| P2 | 4 | 4 | 1 | 1 | 0 | 0 | −2 | −2 | −2 | 0 |
| P3 | 3 | 3 | 1 | 0 | 0 | −1 | −2 | −2 | −2 | 0 |
| P4 | 4 | 3 | 1 | 0 | 0 | −1 | −2 | −2 | −2 | 0 |
| P5 | 4 | 4 | 0 | 0 | 0 | 0 | −1 | 0 | 1 | 1 |
| P6 | 3 | 3 | 1 | 1 | 1 | −1 | 0 | 0 | 1 | 1 |
| P7 | 3 | 3 | 1 | 0 | 0 | −2 | −2 | −1 | 0 | 0 |
DEX: dexmedetomidina; h: hora.
No fue necesario el empleo de vasopresores o inotrópicos. Así mismo, en los casos donde se monitorizó la PIC tras cirugía, la DEX no alteró sus valores, pudiendo haber contribuido a su estabilización, ya que las cifras de PIC y PPC se mantuvieron en rangos normales en todo el proceso posquirúrgico. La DEX fue empleada un promedio de 4,2 días. Estabilizado el cuadro y decidida su retirada, suspendemos la infusión de DEX, siempre de manera paulatina (20% dosis cada 6h), habiendo comenzado 24h antes con risperidona oral (1,5-6mg/día) y clonazepam (1-4mg/día), manteniendo siempre analgesia coadyuvante. Con dicho protocolo no hemos observado efectos rebote de los efectos de la DEX (hipertensión, taquicardia).
Hasta donde conocemos, es la primera vez que se publica la utilización de DEX en pacientes con TCEM y TC patológica. Aunque reconocemos la limitante de ser una serie muy pequeña, los datos preliminares han evidenciado que la DEX ha demostrado ser un fármaco eficaz y seguro, consiguiendo niveles de analgesia (junto a coadyuvantes) y sedación adecuados durante un periodo de entre 3-6 días de duración, sin presentar problemas al suspenderse el fármaco de manera paulatina y controlada. Por ello, aunque series más amplias tienen que corroborar nuestros resultados, pensamos que la DEX puede ser una opción a considerar en el manejo integral de este grupo de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.