INTRODUCCIÓN
El uso de hemodiálisis (ya sea intermitente o mediante técnicas continuas) no ha mostrado beneficio en pacientes con fracaso hepático; sin embargo una sencilla variante (la diálisis con albúmina) ha demostrado ser de utilidad para reducir los pigmentos biliares en el suero de pacientes con insuficiencia hepática1. Sin embargo, la aplicación de esta variante conlleva un elevado coste. El sistema MARS (Molecular Adsorbent Recirculating System, Gambro®)2 permite reciclar el dializador con albúmina mediante adsorción, logrando disminuir el coste final del tratamiento y añadiendo un mecanismo de adsorción al perfil de eliminación de la técnica3. El monitor MARS aporta el circuito encargado de la recuperación de la albúmina, pero necesita ser usado junto a un monitor para hemodiálisis intermitente (HDI) o continua (TCRR) que aportará los sistemas de seguridad y la bomba de sangre (el sistema MARS es por tanto un sistema abierto y puede ser usado con diferentes monitores existentes en el mercado).
La experiencia con estos tratamientos está aumentando de forma constante, pero existe aún poca información que aborde aspectos puramente técnicos. Es necesario acumular datos que nos permitan desarrollar protocolos referidos a la técnica (duración de las sesiones, flujos necesarios, anticoagulación o monitorización) y a aspectos clínicos (seguridad, indicaciones o impacto sobre la mortalidad) para facilitar la comparación de las distintas series publicadas.
La mayor parte de los datos publicados se basan en el uso de monitores para HDI, pero el uso de monitores para TCRR puede, en determinadas circunstancias, suponer ventajas adicionales: mayor tolerancia, tecnología menos exigente y posibilidad de ser usados por personal de Unidad de Cuidados Intensivos (UCI). Sin embargo su uso podría implicar una disminución de la capacidad de depuración del sistema y puede suponer la necesidad de prolongar las sesiones para compensar esta pérdida de rendimiento.
Pretendemos comunicar los resultados obtenidos en nuestro centro, tanto en capacidad de depuración como en seguridad y tolerancia, mediante el uso del sistema MARS junto a un monitor para TCRR para el tratamiento tanto de pacientes con fracaso hepático agudo (FHA) como fracaso agudo sobre crónico (FHAsC).
PACIENTES Y MÉTODO
En nuestro centro (hospital universitario con una UCI polivalente de 42 camas que atiende el posoperatorio del trasplante hepático) se ha centralizado el uso de la terapia MARS en la UCI, no sólo para los pacientes con FHA sino también para el FHAsC.
Hemos realizado un estudio de cohortes prospectivo para lo cual utilizamos los datos incluidos en un registro prospectivo (diseñado específicamente para su uso en nuestro centro) que incluye datos epidemiológicos (edad, sexo, patología hepática y antecedentes), datos sobre la enfermedad (motivo de empeoramiento, órganos afectos, marcadores biológicos bilirrubina, transaminasas, coagulación, albúmina, creatinina, amonio y lactato), índices de severidad (MELD y SOFA), pronóstico (necesidad de trasplante, situación de la espera para órganos y mortalidad), aspectos técnicos (acceso vascular, anticoagulación, depuración renal, fluidos usados, flujos de albúmina, sangre y dializador empleados), depuración y aspectos relacionados con la seguridad (complicaciones, problemas con el material, datos de tolerancia presión arterial, frecuencia cardíaca, temperatura, frecuencia respiratoria, pulsioximetría, diuresis, grado de encefalopatía y disminución sérica de los marcadores biológicos).
Se solicitó a los pacientes o familiares allegados un consentimiento informado previamente aprobado por el Comité Ético de nuestro centro.
El tratamiento se inicia si los pacientes presentan síndrome hepatorrenal, hiperbilirrubinemia > 10 mg/dl, encefalopatía hepática ≥ II o prurito intratable.
Los pacientes con FHAsC se programan para tres sesiones semanales, ingresando en la Unidad en las primeras horas de la mañana para el inicio de la sesión y manteniéndose hasta que se detecta coágulo, aparece alguna complicación o han trascurrido al menos 15 horas desde su inicio. Posteriormente el paciente es de nuevo dado de alta hasta la siguiente sesión. El catéter vascular es de uso exclusivo para el procedimiento.
Los pacientes con FHA ingresan en la Unidad para su manejo, y en estos casos las indicaciones para el tratamiento son las ya mencionadas, pero si el paciente presenta fracaso renal agudo (FRA) o necesita la realización de una TCRR, el sistema MARS se mantiene de forma continuada, cambiando el sistema cada 24 horas para evitar tener que intercalar el tratamiento con TCRR entre las sesiones de MARS.
Se usa de manera preferente el acceso vascular femoral. El protocolo de anticoagulación se basa en la situación del paciente: en casos sin coagulopatía, trombopenia ni problemas de sangrado usamos heparina no fraccionada a 5-7 UI/kg/h, pero si se detecta coagulación precoz del sistema (duración menor de 8 horas) pautamos terapia mixta (heparina 3 UI/kg/h más epoprostenol 4 ng/kg/min); si existe coagulopatía pero las plaquetas están por encima de 50 x109/l usamos epoprostenol a 4-6 ng/kg/min; si existe trombopenia menor de 50 x109/l no usamos anticoagulación.
El monitor MARS se usa con un monitor Prisma (Hospal®), cebado en HDFVVC. Como fluidos para sustitución y diálisis usamos Hemosol®, una solución tamponada con bicarbonato, a la que añadimos potasio según el paciente y sodio para elevar la concentración final a 148 mmol/l.
El control del paciente depende de su situación clínica, realizándose de forma continua y registrando las constantes y parámetros hemodinámicos habituales en los pacientes de UCI. Se extraen muestras de sangre para analítica al inicio, tras 4 horas y al final de cada sesión.
En los últimos 14 pacientes tratados, al finalizar cada sesión se cultiva una muestra del dializador de albúmina y se realiza un seguimiento del paciente para detectar posibles signos de infección.
Los cálculos de eliminación se realizan mediante porcentaje de descenso de urea, creatinina, bilirrubina, amonio y transaminasas; el porcentaje de ascenso tras cada sesión se evalúa tras 24 horas en pacientes con FHAsC; la tolerancia hemodinámica se valora mediante cambios en la presión arterial media (PAM), frecuencia cardíaca (FC), pulsioximetría (SatO2) y diuresis (ml/h).
Análisis estadístico
Los resultados se expresan como media (95% intervalo de confianza [IC] para la media) para variables continuas y como n (%) para las categóricas. Las variables que expresan tiempo se presentan como mediana (percentil 25-75). Para el análisis de las variables continuas usamos «t» de Student o U de Mann-Whitney según el número de casos y análisis de la varianza para comparaciones múltiples. Para el análisis de las variables categóricas empleamos la Chi-cuadrado. En todos los procedimientos se aplicó un nivel de significación del 95%. Para valorar la relación entre dos variables continuas se empleó el coeficiente de correlación de Pearson. Hemos usado el paquete estadístico SPSS para Windows®.
RESULTADOS
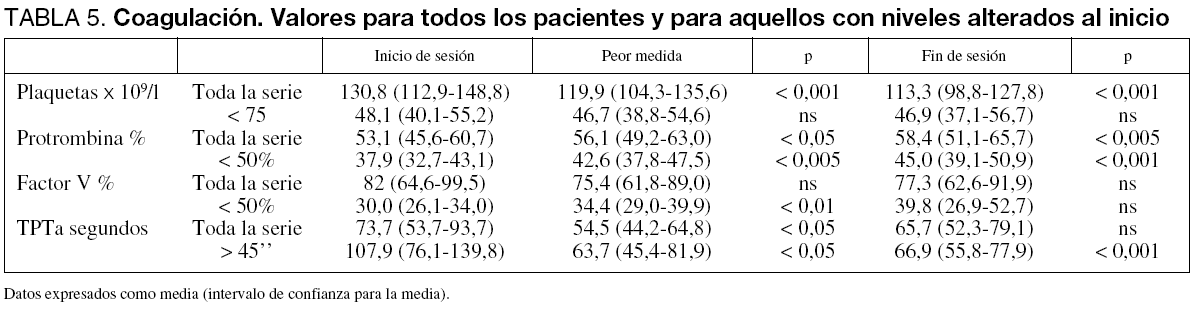
Hemos tratado a 31 pacientes, con una edad media de 44,6 (39,9-49,2) años, 8 de ellos (25,8%) mujeres. Nueve (29%) fueron admitidos por FHA y 22 (71%) tras FHAsC (tabla 1). La mediana de duración total de los tratamientos fue de 35 (12-51) horas.
Realizamos 76 sesiones X2,5 por paciente (1,9-2,9), con un total de 1.082 horas. Diez pacientes (32,3%) recibieron sólo una sesión; 7 (22,6%), dos, 8 (25,8%), tres, y 6, (19,4%); cuatro o más. La TCRR usada fue hemodiafiltración en 66 (86,8%) y hemodiálisis en 10 (13,2%) sesiones. El flujo de albúmina alcanzado fue 230,9 (223,1-238,8) ml/min, el flujo de sangre 164,6 (157,5-171,8) ml/min y el efluente total (ultrafiltrado más dializador) 2.973 (2.825-3.121) ml/h (tabla 1).
Como anticoagulante usamos heparina no fraccionada en 33 (43,4%) sesiones; epoprostenol, en 20 (26,3%); tratamiento mixto, en 15 (19,7%) y no anticoagulación, en 8 (10,5%). Las sesiones finalizaron de forma programada en 49 casos (64,5%); por coagulación, en 16 (21,1%), problemas con el acceso vascular en 4 (5,3%); por necesidad de cirugía o exploraciones especiales, en 5 (6,6%); por complicaciones de la técnica en uno (1,3%), y por solicitud del paciente en otro caso (1,3%). La mediana de duración de las sesiones fue 15 (10-18) horas con intervalo de 3 a 26 horas y el tipo de anticoagulante no supuso diferencias en la duración (con heparina 14,4 [12,9-16,0] horas, con epoprostenol 15,2 [12,7-17,7] y con ambos 15,6 [12,8-18,3], p = ns) pero cuando no se usó anticoagulante la duración fue menor (8,5 ± 4,5, p < 0,01).
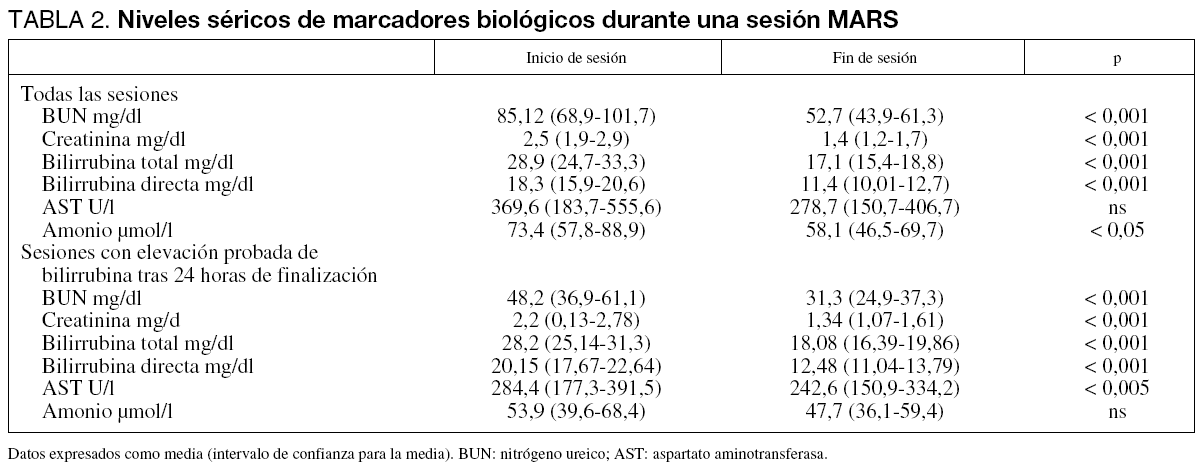
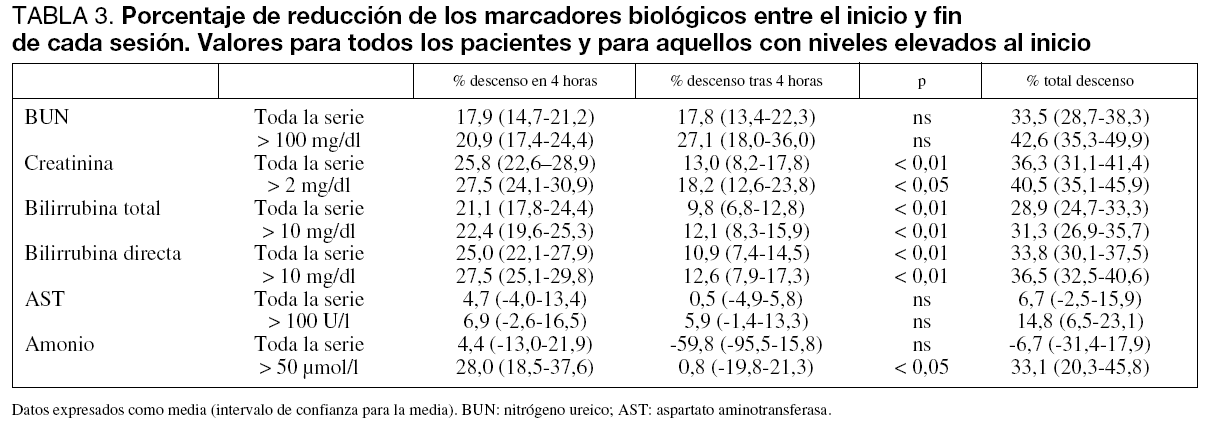
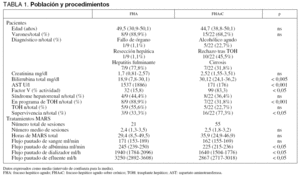
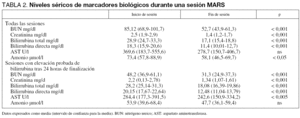
Los cambios en la concentración sérica de los marcadores biológicos se muestran en la tabla 2. Los porcentajes de disminución de esta concentración durante la sesión se exponen en la tabla 3. Si analizamos de forma separada aquellas sesiones en que los niveles de estos marcadores se encontraban por encima del rango normal, el porcentaje de eliminación fue aún más elevado (tabla 3).
Seleccionando para su análisis tan sólo aquellas sesiones en que tras su finalización se detectó una elevación de los niveles de bilirrubina sérica, con la intención de valorar tan sólo la eliminación proporcionada por el circuito y no artefactuada por el metabolismo del paciente (57 sesiones), detectamos un porcentaje de descenso de los niveles de bilirrubina directa de 36,01% (32,3-39,8) y 34,1% (30,1-38,1) de bilirrubina total.
Detectamos una elevación media 24 horas después de haber finalizado la sesión de 26,5% (13,9-39,1) para la urea, 35,9% (22,8-48,9) para la creatinina y 25,1% (15,7-34,5) para la bilirrubina total.
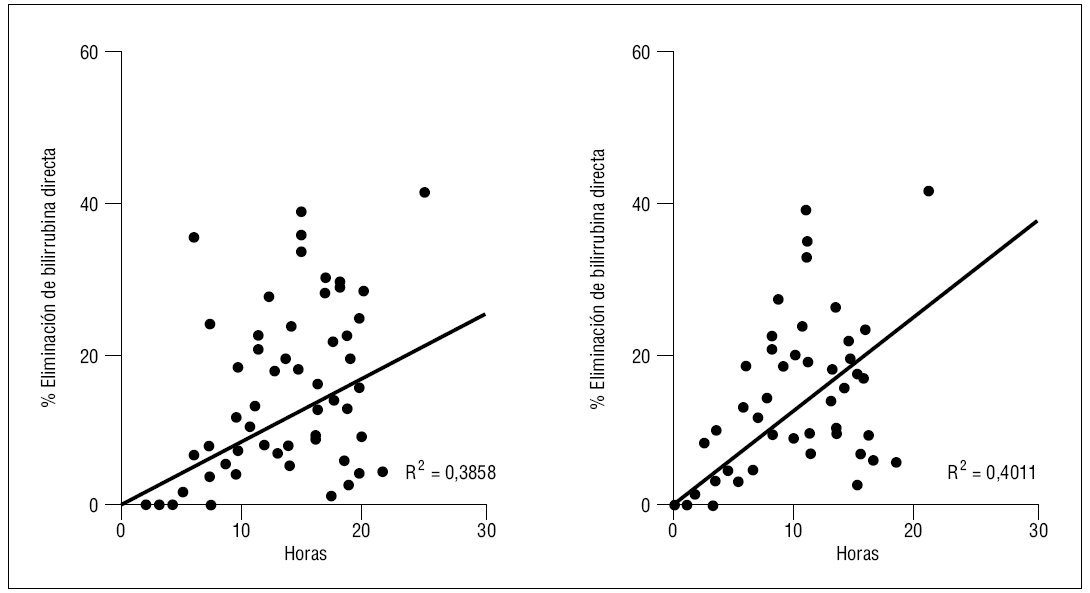
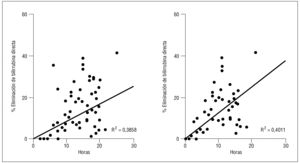
Cuando analizamos el descenso obtenido durante las primeras 4 horas de tratamiento comparado con el resto de la sesión, detectamos que éste era significativamente más elevado para la bilirrubina, pero similal para la urea o la creatinina (tabla 3), no obstante se puede observar cómo se mantiene una relación lineal entre duración y descenso de bilirrubina hasta el final de las sesiones (fig. 1), y esta relación se mantiene si analizamos sólo los datos obtenidos pasadas las 4 primeras horas de tratamiento (coeficiente de Pearson 0,35 [p < 0,001] para urea; 0,46 [p < 0,001] para creatinina; 0,43 [p < 0,05] para bilirrubina total y 0,28 [p < 0,05] para la directa).
Figura 1. Relación entre duración de la sesión y disminución de bilirrubina pasadas las primeras 4 horas de tratamiento. Izquierda: toda la serie; derecha: niveles elevados al comienzo.
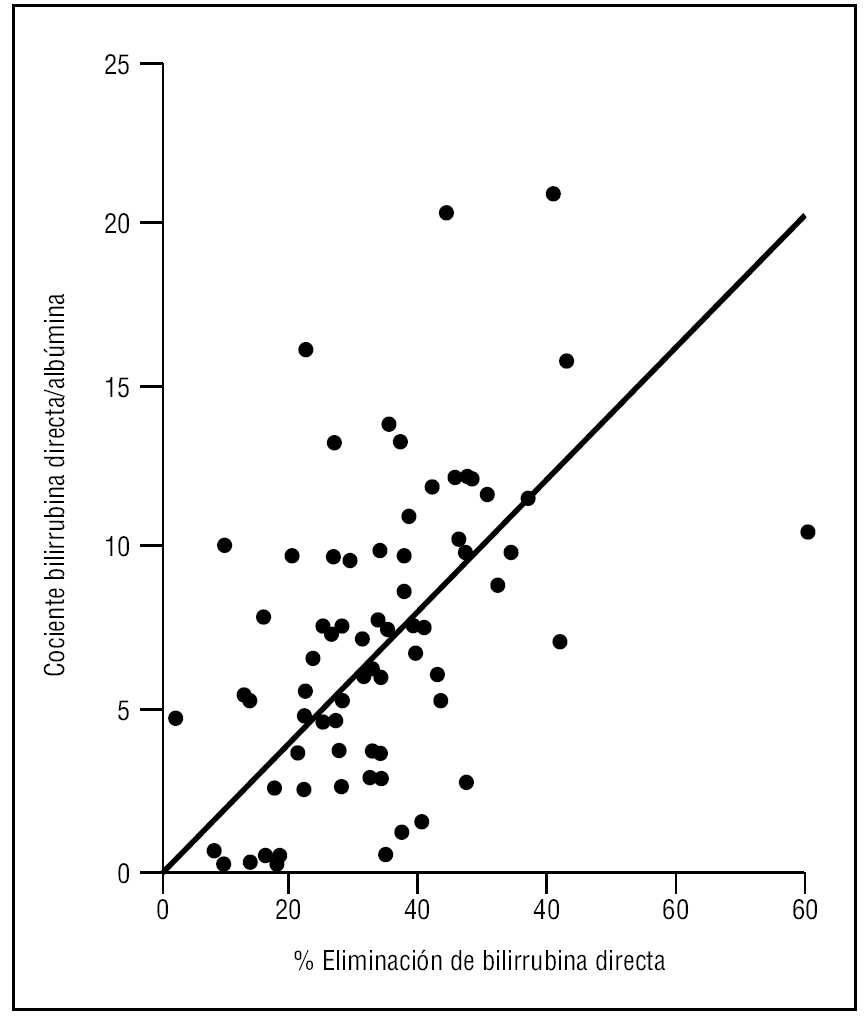
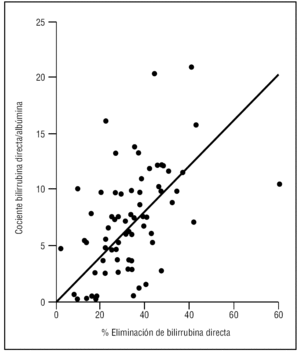
Finalmente valoramos la relación entre el cociente bilirrubina directa/albúmina y el porcentaje de reducción de la bilirrubina directa encontrando una correlación significativa (coeficiente de Pearson 0,53 [p < 0,001]) (fig. 2).
Figura 2. Relación entre el cociente bilirrubina directa/albúmina y el porcentaje de eliminación de bilirrubina.
Los problemas detectados durante el tratamiento se relacionaron con el acceso vascular: flujo inadecuado en 16 sesiones (21,1%) (en un caso motivo de su finalización). En dos sesiones la rotura del sistema con pérdida del dializador de albúmina (causado por una rotura del segmento de bomba) obligó a la retirada.
Con respecto a la tolerancia no detectamos problemas en la estabilidad de los pacientes, y todos los parámetros monitorizados se mantuvieron sin cambios o mejoraron (tabla 4). En una sesión, un paciente exigió tras 10 horas de tratamiento la retirada del mismo.
Detectamos complicaciones en 5 sesiones (6,6%). En un caso el catéter se insertó en la arteria femoral, siendo retirado sin posteriores problemas. En 4 sesiones localizamos sangrado leve en puntos de punción: 2 de 33 (6,1%) con heparina y 2 de 20 (10%) con epoprostenol (p = ns).
En las últimas 50 sesiones (14 pacientes, ninguno con signos de infección durante los tratamientos) cultivamos la solución de albúmina tras la retirada. En tres sesiones (6%) detectamos crecimiento (dos Staphylococcus epidermidis y un S. haemolyticus). En ningún caso encontramos signos de infección en el seguimiento.
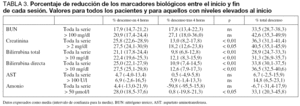
El efecto de las sesiones sobre el estado de coagulación de los pacientes y sobre los marcadores de la función de síntesis hepática se muestran en la tabla 5.
DISCUSIÓN
La insuficiencia hepática supone un serio problema, no sólo por su mal pronóstico sino también por las escasas opciones terapéuticas de que disponemos (siendo el trasplante la única alternativa efectiva). Por tanto, la posibilidad de disponer de métodos que nos permitan estabilizar el cuadro hasta la llegada del trasplante supondría un importante avance en el manejo de estos pacientes4. Si se dispusiera de un sistema de sostén de bajo coste y fácil implementación podríamos mejorar las expectativas de supervivencia en estos casos.
Los sistemas basados en componentes biológicos5 son técnicamente muy demandantes y otros sistemas más simples (hemofiltración, plasmaféresis, etc.) no se han mostrado de utilidad6. La albúmina es la principal proteína transportadora del plasma y su uso en los sistemas de diálisis (diálisis con albúmina) ha mostrado su utilidad en este escenario1 y ha despertado un elevado interés por tratarse de una técnica conceptualmente simple, fácil de usar y al alcance de aquellos Servicios con experiencia en el uso de otras técnicas extracorpóreas7.
La diálisis con albúmina de un solo paso (DASP) ha demostrado su utilidad8,9, pero no ha logrado popularidad debido a su limitada eficacia y a su elevado coste; de hecho, se han propuesto diferentes alternativas para disminuir este coste, una de las cuales es disminuir la concentración de albúmina en el dializador, lo que parece no repercutir negativamente en su capacidad de depuración10.
Otra alternativa propuesta es el uso del sistema MARS. Este método permite reciclar la albúmina mediante adsorción y disminuir el coste final del tratamiento2. Este sistema disminuye de forma eficaz los niveles de bilirrubina, ácidos biliares o creatinina y parece mejorar la función renal y hemodinámica, así como el grado de encefalopatía en los pacientes tratados. El porcentaje de eliminación de bilirrubina logrado oscila entre 25 y 40% según diferentes autores11-13, pero prácticamente todos los datos se basan en sesiones de corta duración (6 a 8 horas) y usando el monitor MARS junto a un monitor de HDI. El uso de sesiones de corta duración se justifica por la pérdida de capacidad adsortiva de los componentes del MARS que hace que su duración esté limitada en el tiempo (la eliminación es máxima durante las 6 primeras horas)11.
Nosotros optamos por ampliar la duración de las sesiones basándonos en que, en primer lugar, al usar flujos bajos de sangre y dializador (según las indicaciones del fabricante) el tratamiento es menos eficaz; en segundo lugar, esta menor eliminación podría suponer una más lenta saturación de los componentes adsortivos, y finalmente porque en pacientes con FHA con necesidad de mantener depuración extrarrenal entre sesiones la retirada del MARS supondría iniciar una sesión de TCRR entre las sesiones de MARS9. El protocolo que proponemos para estos pacientes supone el mantenimiento continuo de la depuración renal sin necesidad de cambios excesivamente frecuentes del circuito y el mantenimiento de una adecuada depuración hepática al realizarse cambios del sistema MARS cada 24 horas. La prolongación de las sesiones hasta 24 horas en estos casos ha sido ya comunicada por otros autores14, y recientemente Bellmann et al han publicado un protocolo similar al nuestro y aplicado a pacientes con FHAsC, con el que logran una duración media de las sesiones de 16 horas con buenos resultados en cuanto a eliminación14. La eliminación en estos casos, y según nuestros resultados, es comparable a la lograda en sesiones cortas mediante monitores de HDI12,13.
Los monitores para TCRR son ampliamente usados en las UCI de nuestro país, y si su aplicación junto al monitor MARS se muestra eficaz supondría ponerlo al alcance de un elevado número de centros. Según nuestros resultados su uso permitiría realizar tratamientos adecuados sin necesidad de personal altamente cualificado y con disponibilidad en un amplio número de centros, pero implicaría prolongar la duración de las sesiones para asegurar un adecuado rendimiento.
En un estudio reciente, Lee et al15 demuestran que el cociente entre bilirrubina y albúmina se relaciona de forma estrecha con la eliminación de bilirrubina y abogan por evitar los ascensos de albúmina sérica para optimizar los resultados. Nuestros datos concuerdan con lo publicado por Lee, y en función de ello aconsejamos (y hemos aplicado a nuestro protocolo) evitar la administración exógena de albúmina mientras se estén realizando las sesiones.
Como también se desprende de nuestros datos, la terapia MARS es bien tolerada16-20 y su uso en pacientes de intensivos no provoca problemas significativos21-23. Aunque no todos los autores pueden demostrar una mejoría en los parámetros hemodinámicos24, nuestros datos y los de otras series publicadas sugieren que al menos la tolerancia (y posiblemente la mejoría) hemodinámica es esperable25.
No obstante, podemos detectar algunos problemas con su uso, principalmente un descenso en la cifra de plaquetas26,27,28. En nuestros pacientes este fenómeno es también apreciable, pero en nuestra experiencia no es un descenso clínicamente relevante.
Algunos autores refieren un empeoramiento pasajero de la coagulación al inicio de las sesiones29, pero en nuestra experiencia esta complicación no se presenta, e incluso observamos una tendencia a la mejoría de la coagulación, efecto ya mencionado previamente por otros autores17.
Otro posible efecto secundario es la hipotermia26, pero en nuestra experiencia el calentador insertado en el monitor MARS es adecuado para los flujos empleados. Así mismo, se ha apuntado la posibilidad de que este tratamiento provoque una pérdida excesiva de glucosa30.
Otro aspecto que despierta preocupación es la posibilidad de que se produzca contaminación del dializador de albúmina. Dado que nuestro protocolo pasa por prolongar las sesiones, este riesgo teórico estaría aumentado en nuestros pacientes. Nuestros datos muestran, no obstante, que esta prolongación no ha resultado en un riesgo elevado de contaminación del dializador o infección posterior de los pacientes.
La facilidad de uso, eficacia y relativo bajo coste31 sitúan al sistema MARS como uno de los más prometedores en el campo de la depuración hepática. En este contexto, están apareciendo nuevas indicaciones para su uso en el campo del paciente crítico (intoxicaciones32,33, sepsis severa o síndrome de respuesta inflamatoria sistémica [SIRS]34,35).
En nuestra experiencia, y como muestran nuestros resultados, podemos afirmar que el sistema MARS puede ser aplicado mediante monitores para TCRR sin pérdida de la eficacia de eliminación y con el beneficio adicional de tratarse de monitores seguros para el paciente y ampliamente difundidos en nuestras UCI.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
*Este estudio se ha realizado sin financiación externa; los resultados provisionales del mismo fueron presentados en el European Intensive Care Society Congress de Berlín, en septiembre de 2004, pero no han sido publicados.
Correspondencia: Dr. M.E. Herrera Gutiérrez.
UCI. Hospital Carlos Haya.
Av. Carlos Haya, s/n.
29018 Málaga. España.
Correo electrónico: mehguci@wanadoo.es
Manuscrito aceptado el 24-I-2007.