INTRODUCCION
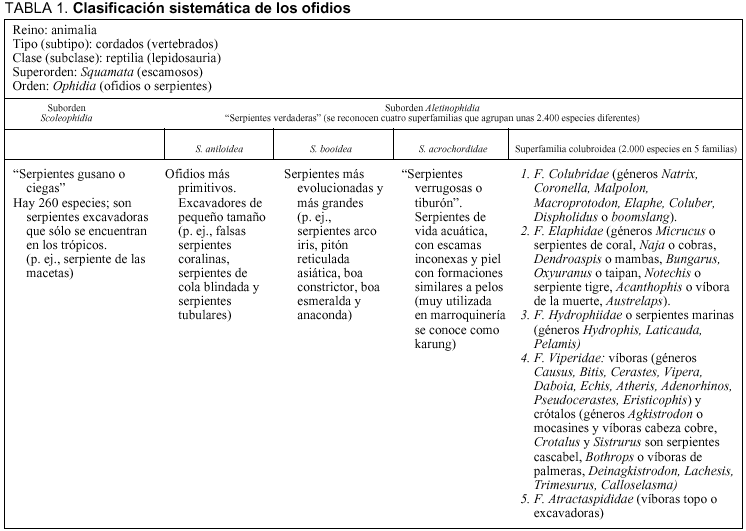
Cada día es más frecuente encontrar especies exóticas de animales a nuestro alrededor. Son un maravilloso reclamo de las tiendas de mascotas, de los bares de moda, de los circos, de las exposiciones itinerantes y tristemente de los servicios de urgencias de los hospitales. Si desconocidas nos resultan las especies autóctonas, todavía lo son más las especies exóticas (tabla 1)1-5. Los centros médicos no son avisados de las especies con que cuentan las exposiciones o circos; las tiendas no pueden vender especies venenosas; pero, ¿qué ocurre con el comercio ilegal de especies? Hay leyes y reales decretos que prohíben y que sancionan la caza, captura y cría de las especies autóctonas y exóticas6,7.
EL VENENO DE LAS SERPIENTES EXOTICAS
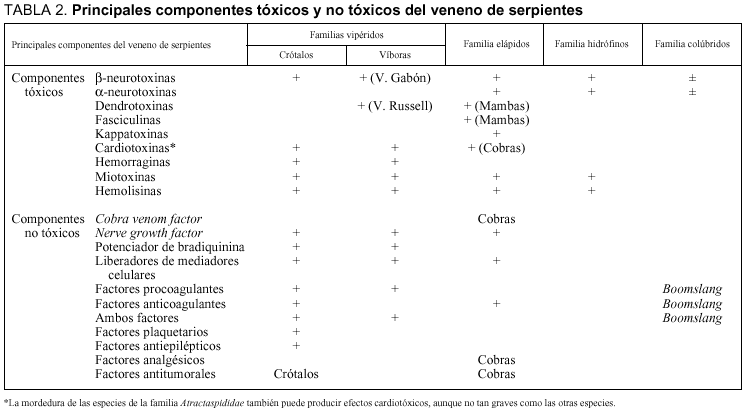
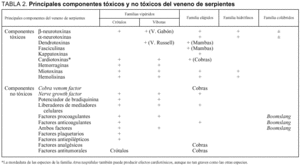
La composición y la actividad del veneno varía a través de las especies, pero cuanto más cercanas son filogenéticamente, más similares son las propiedades y la composición del veneno. En cuanto a las características macroscópicas no difieren mucho del veneno de las especies autóctonas8, pero sí que lo hace la composición proteica. Son los componentes proteicos, de los que se desconoce el número exacto, los que constituyen entre el 90 y el 95% del peso seco de los venenos y los responsables de la práctica totalidad de los efectos biológicos (tabla 2). Presentamos una sencilla clasificación de estas sustancias orgánicas proteicas:
Componentes tóxicos
Neurotoxinas
Son los componentes tóxicos más letales junto con las cardiotoxinas. Se han aislado aproximadamente 120 tipos diferentes del veneno de las familias Hidrophidae y Elapidae, con mecanismos y lugares de acción diferentes9-11. Suelen ser neurotoxinas de acción periférica más que de acción central, ya que aparentemente no pasan la barrera hematoencefálica. Se clasifican en:
Neurotoxinas presinápticas o betatoxinas. Afectan a la terminación presináptica del nervio donde aumentan la concentración de acetilcolina (ACo) y después de comenzar su liberación repentinamente la paralizan, de esta manera bloquean la transmisión neuromuscular. No suelen afectar a la despolarización del músculo o al transporte de ACo. Existen varios tipos de toxinas presinápticas: crotoxina (crótalos, vipéridos), betabungarotoxina (búngaros, elápidos), taipoxina (taipan, elápidos), textilotoxina (cobra, elápidos), notexina (serpiente tigre, elápidos), agkistrodotoxina (crótalo, vipérido) y ammoditoxina A, B y C (víbora, vipéridos).
Neurotoxinas postsinápticas o alfatoxinas. Afectan a la unión neuromuscular en la porción postsináptica, impidiendo que la ACo se fije a los receptores musculares y alterando así el mecanismo de transmisión nerviosa. Se han empleado para el estudio de la fisiopatología de la miastenia gravis. La estructura primaria de este tipo de toxinas postsinápticas, que son aproximadamente 100, no tiene homólogos en el veneno de otras especies como escorpiones, abejas o arañas. Toxinas de este tipo son: alfabungarotoxina (búngaros, elápidos), toxina F (búngaros, elápidos), cobrotoxina (cobra, elápidos), toxinas mayores y menores de las serpientes marinas (hidrófinos), lapemis toxin (hidrófinos).
Dendrotoxinas o neurotoxinas de los canales de potasio. Su mecanismo de acción consiste en un aumento de la transmisión del impulso nervioso en la placa neuromuscular, ya que se produce una inhibición de la inactivación lenta a través de los canales de potasio. Estos canales ejercen un papel importante en la repolarización del proceso de transmisión nerviosa; por tanto, al inhibirse este proceso existirá un aumento de la liberación de ACo y un aumento de la contracción muscular. La principal de estas toxinas es la dendrotoxina *, ß, * y * (mambas, elápidos), pero también presentan esta acción aunque con una potencia menor la ß-bungarotoxina y la notexina vistas anteriormente, el veneno de la víbora de Russell (víbora, vipéridos) y del Oxyuranus scutalatus (taipan, elápido).
Fasciculinas o neurotoxinas inhibidoras de la acetilcolinesterasa. Inhiben las acetilcolinesterasas alterando la normal transmisión del impulso nervioso provocando contracciones musculares muy prolongadas de incluso días. Las encontramos, sobre todo, en el veneno de mambas africanas (Dendroaspis, elápidos) y se han descrito diferentes tipos: fasciculina 1 y 2, toxina F7, toxina C y toxina D.
Kappatoxinas. Son toxinas más selectivas, cuya acción consiste en el bloqueo de ciertos receptores colinérgicos del sistema nervioso central. Las encontramos en el veneno de las especies del género Bungarus (elápidos).
Cardiotoxinas
Estructuralmente son similares a las neurotoxinas, sobre todo las del veneno de los elápidos, aunque funcionalmente son muy diferentes9-12. La diferencia en la estructura secundaria hace que las cardiotoxinas se liguen selectivamente a las membranas de las fibras del músculo cardíaco, ejerciendo allí su acción. Ésta consiste en una despolarización de las fibras musculares cardíacas, lo que provoca una disminución de la excitabilidad y del rendimiento cardíaco propiciando el shock o la depresión cardiovascular, que puede terminar en una parada cardíaca. Pero también actúan sobre otras células a elevadas concentraciones; así, son capaces de lisar los eritrocitos, las células epiteliales y las células pulmonares fetales. Este tipo de toxinas las encontramos sobre todo en el veneno de cobras (elápidos) un ejemplo sería la gammatoxina, y víboras topo o excavadoras (atractaspídidos, su gravedad es menor).
Toxinas del daño tisular
Se han aislado un gran número de toxinas hemorrágicas (metaloproteasas conteniendo cinc). Distinguiremos dos tipos de acción:
Toxinas hemorrágicas. Causan hemorragias por acción directa sobre el endotelio de los capilares vasculares. Suelen ser proteasas séricas (con acción similar a la trombina) o proteasas con cinc (toxinas hemorrágicas o no hemorrágicas, el cinc es el cofactor inorgánico). Toxinas de este tipo9-13 son la mucrotoxina A, toxinas hemorrágicas a, b, c y e, las sarafotoxinas tipos a, b y c (potentes vasoconstrictores que afectan al conjunto del sistema cardiovascular) y la AaHI (hemorragina I de la especie Agkistrodon acutus). Las encontramos sobre todo en las especies del género Agkistrodon y Crotalus (crótalos, vipéridos).
Miotoxinas. Destruyen las células musculares. Se han descrito tres tipos:
* Miotoxina a (degenera las fibras musculares interactuando con los canales de sodio dependientes de voltaje).
* Miotoxina con acción fosfolipasa A2 (que entre otras acciones también degenera las fibras musculares).
* Miotoxina con efectos hemorrágicos y miotóxicos. Un ejemplo de este tipo de toxina sería el factor hemorrágico-miotóxico de la víbora áspid (víbora, vipéridos), la viridotoxina (crótalo, vipéridos) y la toxina HTb (crótalos, vipéridos).
Factores hemolíticos
Los venenos de las serpientes tienen factores hemolíticos directos e indirectos. Los directos por sí mismos pueden hemolizar los hematíes. Los indirectos pueden lisar los glóbulos rojos más lentamente, pero pueden verse acelerados por la adicción de fosfatidilcolina; estos factores indirectos se han identificado con una fosfolipasa A2. La acción hemolítica depende de gran variedad de factores incluyendo el tipo de hematíes del receptor del veneno14-22. El veneno de los elápidos como las cobras contiene ambos tipos de factores. Hay que recordar que otros factores tóxicos como cardiotoxinas y miotoxinas también son capaces de producir hemólisis.
Componentes no tóxicos
Cobra venom factor (CVF)
Uno de los factores que induce la activación de la vía alterna del complemento es una glucoproteína aislada del veneno de cobras y otros elápidos denominado CVF23. El resultado de la activación de esta vía alterna por la acción de este CVF (en unión con un cofactor sérico) puede ser variado y puede provocar hemólisis, citólisis bacteriana, liberación de histamina, contracciones musculares, agregación y fusión de plaquetas, etc. Este componente se ha empleado para estudiar el papel del complemento en varias reacciones inmunológicas y el rechazo de los órganos trasplantados (parece que la supervivencia de éstos aumenta con el empleo de CVF como inmunosupresor).
Nerve growth factor (NGF) o factor promotor del crecimiento nervioso
Se trata de una glucoproteína no tóxica, que participa en el desarrollo y mantenimiento de muchos tejidos originados a partir de la cresta neural, incluido el sistema nervioso simpático9,24. Descubierto por Cohen y Levi-Montalcini, les valió el premio Nobel en 1986 (comprobaron cómo esta sustancia promovía el desarrollo y crecimiento de neuronas simpáticas a nivel periférico y también el de algunas neuronas sensitivas en las primeras fases de desarrollo embrionario, al inyectarlo en el vitelo de embriones de pollo). Este factor se ha aislado del veneno de muchos elápidos, vipéridos y, sorprendentemente, de las glándulas salivares de animales no venenosos como el ratón macho. Actualmente, se estudia la posibilidad de que esta sustancia pudiese ayudar a regenerar el tejido nervioso atrofiado de pacientes con demencia tipo Alzheimer.
Factor potenciador de la bradiquinina
Algunos péptidos del veneno actúan como un inhibidor de la enzima conversiva de la angiotensina (IECA) I (inactiva) en angiotensina II (activa), por tanto actúa como un hipotensor del tipo IECA. Descubierta esta sustancia en 1948 tras analizar la importante vasodilatación provocada por el veneno de las especies del género Bothrops (crótalos), supuso el descubrimiento de este importante eje de regulación de la presión arterial que es el sistema renina-angiotensina-aldosterona9,25,26 (p. ej., del estudio del veneno de la jararaca, Bothrops jararaca, se aisló y se desarrolló el conocido captopril y otros IECA).
Factores liberadores de mediadores celulares
Se trata de factores no tóxicos por sí mismos, pero que desencadenan la liberación de sustancias como bradiquinina, histamina, etc., por parte de los tejidos. Producen hipotensión, aumento de la permeabilidad capilar con importantes edemas tisulares acompañados de un intenso dolor, anemia y a veces rápidos descensos del volumen plasmático circulante. Los encontramos en el veneno de crótalos y víboras (vipéridos).
Factores que actúan sobre la coagulación sanguínea
Los venenos de serpientes tienen un importante efecto en la coagulación sanguínea. Según la actividad que presentasen, éstos se clasificaban en venenos anticoagulantes y venenos procoagulantes; pero lo más frecuente es que un veneno presente las dos funciones o que la actividad del veneno varíe según la concentración empleada14-22. Estas sustancias, una vez aisladas, han sido empleadas farmacológicamente como anticoagulantes o como instrumentos para el diagnóstico de alteraciones del proceso de la coagulación. Citamos las siguientes:
1. Activador del factor X de la coagulación. Muy abundante en el veneno de la víbora de Russell, permite la medición directa de la cantidad de factor X en sangre, el diagnóstico de ciertos trastornos hereditarios de la coagulación sanguínea y sirve para controlar la eficacia del tratamiento con ciertos anticoagulantes orales.
2. Batroxobina o Reptilase®. Es una hemocoagulasa aislada del veneno de un crótalo del género Bothrops, con acción similar a la trombina y que permite determinar la calidad y la concentración del fibrinógeno del paciente aunque esté con tratamiento anticoagulante. Su acción no es inhibida por la heparina pero sí por los productos de la degradación del fibrinógeno (PDF).
3. Protac®. Obtenido a partir de veneno de un crótalo del género Agkistrodon. Se trata de un activador de la proteína C que permite determinar la cantidad de esta proteína, cuyo déficit se asocia a un riesgo alto de trombosis vascular.
4. Ancrod o Arvin®. Es una fracción purificada del veneno de víbora malaya. Activa al igual que la trombina la conversión del fibrinógeno en fibrina, pero a diferencia de ésta sólo libera el fibrinopéptido A (y no el B) y no activa el factor XIII o estabilizante, por esta razón las moléculas de fibrina no se entrecruzan y al no tener consistencia el coágulo es más susceptible a la fibrinólisis y no produce obstrucción vascular. Pero el consumo continuado de fibrinógeno termina por agotar el contenido de este factor en sangre, la cual se hace incoagulable. Otras características a destacar son que tienen una corta vida farmacológica, y que por su pequeño tamaño y peso molecular no son alergizantes.
5. Proteínas inactivadoras de los factores X activado y IX. Estas proteínas anticoagulantes se obtienen del veneno de crótalos (géneros Agkistrodon y Trimesurus).
6. Atroxase-A. Se trata de una enzima no hemorrágica aislada de ciertas especies de crótalos, capaz de hidrolizar tanto la fibrina como el fibrinógeno in vivo e in vitro27.
7. Lebetase. Se trata de una enzima fibrinolítica con las mismas características que el Atroxase-A, que se ha aislado del veneno de una víbora (Vipera lebetina).
Factores con acción sobre las plaquetas
Encontramos dos tipos de factores, aquellos que promueven la agregación plaquetaria y aquellos que la inhiben. Los factores que causan agregación plaquetaria cursan con una disminución del recuento plaquetar. Destacamos el Factor Mambia (mambas, elápidos), glucoproteína antagonista del complejo de membrana GP II b/III a, que provocará un fracaso de la agregación plaquetaria, al bloquear este receptor para el fibrinógeno. El veneno de ciertos crótalos contiene factores de ambos tipos.
Factores con actividad antiepiléptica
Son factores aislados del veneno del crótalo Agkistrodon contortrix o "mocasín cabeza de cobre". Fueron estudiados en las primeras décadas del siglo xx28.
Factores con actividad antitumoral
A principios de la década de los treinta, basándose en los estudios de los doctores Calmette, Taguet y Rousseau y de los biólogos Olivero y Dumatras, sobre el veneno de la cobra capel (Naja tripudians), aparece una nueva técnica antitumoral denominada "cobroterapia"29-32. La inyección repetida de pequeñas dosis de este veneno conseguía la analgesia (por acción de la cobrotoxina, una potente neurotoxina postsináptica que consigue una rápida anestesia local) y en ocasiones la regresión de ciertos tipos de tumores en ratones de laboratorio. Los factores causantes de esta actividad antitumoral no llegaron a ser identificados. En la última década del siglo xx, de nuevo este tipo de terapia ha sido probado como tratamiento de cierto tipo de tumores refractarios a otros tratamientos; se han desarrollado preparados como el VRCTC-310, obtenidos de diferentes venenos y especies (crotoxina del veneno de crótalos más cardiotoxina del veneno de cobras) y que aplicados intramuscularmente parecen detener o frenar la evolución de determinados tumores. Pero estos estudios todavía están en fase experimental.
Factores analgésicos
En el año 1933, el doctor Adelph Monaelesser, en Nueva York, propuso el empleo del veneno de cobra como terapia analgésica, tratamiento que fue muy utilizado en las siguientes dos décadas28.
Factores antivirales y antibacterianos
Están poco estudiados28.
Otros factores
Empleados en cosmética, en alimentación como conservadores, en agricultura como fertilizantes28. Han sido poco estudiados.
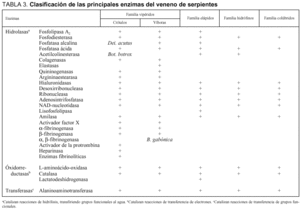
Enzimas
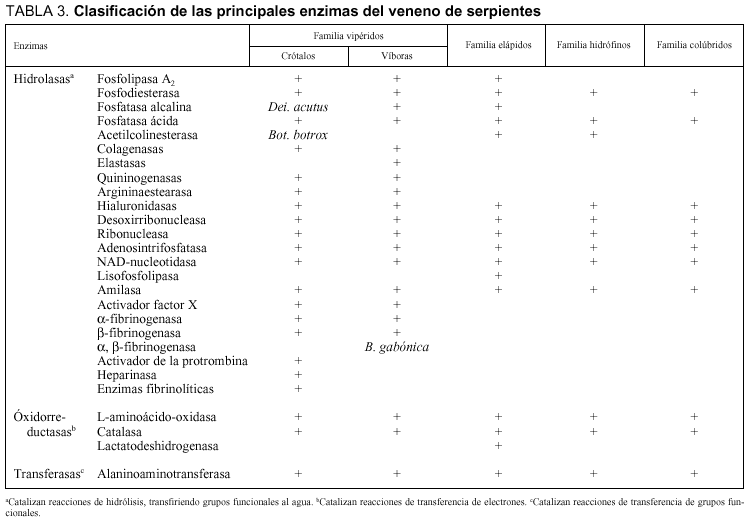
Son proteínas con una extraordinaria potencia catalítica, lo que les permite acelerar la velocidad con la que se desarrollan las reacciones químicas. Algunas de ellas necesitan un cofactor (componente químico no proteico adicional), que puede ser un ion inorgánico, como Fe2+, Mn2+, Zn2+, o una molécula orgánica (denominándose entonces coenzima). Estas macromoléculas sintetizadas por los seres vivos son proteínas globulares en un 99% de los casos9,33-35. La gran mayoría de las enzimas tienen acción hidrolítica (tabla 3):
Fosfolipasa A2. Enzima con especificidad de acción sobre ácidos grasos. Presentan diferentes efectos biológicos, rompen las cadenas de transporte de electrones y la integridad de la estructura mitocondrial, aumenta la permeabilidad de la membrana del axón nervioso y rompe las vesículas sinápticas, rompe los hematíes produciendo hemólisis y produce una mionecrosis que puede verse aumentada por la adición de fosfatidilcolina. Algunas toxinas presinápticas, como la betabungarotoxina, la crotoxina y la notexina, tienen una débil actividad fosfolipasa A2.
Fosfodiesterasa. Enzima que hidroliza los enlaces fosfodiéster. Encontramos dos tipos fundamentales de fosfodiesterasas, las exonucleasas (encargadas de separar unidades de mononucleótidos de la cadena de polinucleótidos comenzando por el extremo 3-terminal, tanto de ARN como ADN puro o desnaturalizado o polinucleótidos sintéticos) y las endonucleasas (que se encargan de hidrolizar el ADN y el ARN produciendo fragmentos de oligonucleótidos). Acción citolítica y hemolítica.
Fosfomonoesterasa. Enzima que hidroliza los enlaces fosfomonoéster. Suele tratarse de fosfatasas ácidas o alcalinas dependiendo del pH óptimo de acción. Encontramos, fundamentalmente, fosfomonoesterasas no específicas (hidrolizan enlaces fosfomonoéster; tóxicamente tienen poca importancia); y específicas (la 5-nucleotidasa hidroliza la variedad de 5 nucleótido fosfato, es la más abundante, su acción no es letal y se aísla de especies de búngaros, elápidos). La acción de estas enzimas también está basada en la hemólisis y en la citólisis.
Acetilcolinesterasas. Presentes normalmente en el veneno de elápidos y serpientes marinas. No son responsables de la acción neurotóxica que desarrollarán las neurotoxinas (fasciculinas), puesto que son fracciones diferentes del veneno.
Enzimas proteolíticas. Los venenos de las víboras y los crótalos son ricos en este tipo de enzimas, sobre todo endopeptidasas; sin embargo, el veneno de elápidos es rico en peptidasas (di y tripeptidasas). Podemos encontrar también proteasas específicas como quininogenasas (liberadoras de bradiquinina), proteasas con acción sobre la coagulación, colagenasas (con una intensa acción hidrolizante sobre el colágeno pero no sobre otras proteínas, esta acción es típica del veneno de crótalos) y elastasas (hidrolizan las fibras elásticas, pero la forma pura de esta enzima no ha sido aislada aún).
Estearasas. Como la arginina-estearasa, están presentes en el veneno de crótalos y de víboras.
Hialuronidasas. Enzima típica del veneno de elápidos y vipéridos (víboras y crótalos). El ácido hialurónico, sustrato de la acción de esta enzima, es un mucopolisacárido presente en la piel, en tejidos conectivos y en articulaciones y su misión es facilitar la adhesión intercelular y/o actuar como lubricante. A esta enzima se la suele denominar "factor difusor" porque con su acción facilita la difusión de las toxinas por los tejidos de las víctimas. La forma pura no ha sido aislada.
Nucleotidasas, ribonucleasas, desoxirribonucleasas, adenosintrifosfatasas. Enzimas que actúan sobre los ácidos nucleicos y sobre el ATP.
Enzimas no hidrolíticas: L-aminoácido oxidasas. Estas enzimas contienen FAD como grupo prostético (es la forma coenzimática de la vitamina B2 o riboflavina) y son las responsables del color amarillo del veneno. No causan acciones muy tóxicas.
Inhibidores enzimáticos
Se han aislado del veneno de serpientes una gran variedad de inhibidores enzimáticos. La actividad de enzimas como las potentes fosfolipasas A2, acetilcolinesterasas, proteinasas, quininogenasas, etc., se ve reducida por la acción de estos inhibidores enzimáticos presentes al mismo tiempo en el veneno (p. ej., IECA).
MANIFESTACIONES CLINICAS
La acción de cualquier veneno provoca la aparición de un variado cuadro de manifestaciones simultáneas8,36-38 y con intensidad variable según factores dependientes del sujeto y del ofidio. Describiremos a continuación las manifestaciones que podemos encontrar:
Alteraciones nerviosas
Las neurotoxinas actuarán de diferentes maneras:
Bloqueando el impulso nervioso. Las toxinas presinápticas (beta) inhiben la liberación de neurotrasmisores, y las postsinápticas (alfa) inhiben la fijación de éstos. La consecuencia, en ambos casos, será la parálisis muscular progresiva, de extremidades, tronco y craneofacial, que al final terminará provocando la parada respiratoria.
Estimulando el impulso nervioso. Tanto las dendrotoxinas como las fasciculinas facilitan la liberación de neurotrasmisores, lo que provoca una contracción constante y mantenida de los músculos, llegando a la tetania muscular y a la parálisis, lo que termina produciendo la muerte por asfixia.
Acción a nivel central. Ciertas toxinas tienen acciones sobre núcleos bulbares y espinales (posiblemente kappatoxinas).
Las primeras manifestaciones no tardan en aparecer: paresias y parestesias de la región de la mordedura, náuseas, mareos y fasciculaciones musculares. Después aparecerá sintomatología de afección de los pares craneales: disfagia, diplopía, disartria. Y en los casos más graves: ataxia, incoordinación motora y parada respiratoria. Si las primeras manifestaciones no han aparecido en 4-6 h, posiblemente ya no lo hagan.
Alteraciones cardíacas
Algunos venenos presentan la capacidad de alterar las células cardíacas o las células del sistema de inervación de éstas, provocando entre otros efectos arritmias, taquicardia o bradicardia, bajo rendimiento y gasto cardíaco, que se verá agravado por la hipotensión arterial que puede producir el propio veneno, fibrilación ventricular, miocarditis; pero, además, la citólisis y la hemólisis provocan cuadros de hiperpotasemia que agravarán estas manifestaciones.
Alteraciones sanguíneas
Estas alteraciones son complejas y cuando se presentan lo hacen de múltiples formas:
Hemorragias por destrucción de los vasos. Ciertas toxinas actúan directamente sobre el endotelio de los vasos sanguíneos destruyéndolo directamente; aparecen hemorragias locales (equimosis) e incluso hemorragias internas (si hay además alteración de los factores de la coagulación).
Hemólisis. Las alteraciones de la membrana de los glóbulos rojos son provocadas directamente por toxinas hemolíticas o por enzimas hidrolíticas, o por las elevadas concentraciones de otras toxinas (miotoxinas, cardiotoxinas). Como manifestaciones encontraremos alteración de la estructura de los eritrocitos (glóbulos rojos espiculados), anemia hemolítica, taquicardia, taquipnea, shock circulatorio, etc.
Alteraciones de la coagulación. Como a menudo los venenos contienen elementos procoagulantes y anticoagulantes que alteran a diversos niveles la cadena de los procesos de coagulación, en la clínica podremos encontrar cualquier manifestación que vaya desde la ausencia completa de coagulación (con hemorragias graves internas o externas) hasta la trombosis con coagulación intravascular diseminada (CID). Como manifestaciones analíticas encontraremos: disminución del hematócrito y la hemoglobina, aparición de eritrocitos espiculados, leucocitosis (aumento de los polimorfonucleares y eosinófilos), alargamiento de los tiempos de coagulación, etc.
Alteración de tejidos
Encontraremos afectados tanto los epitelios como el tejido conjuntivo o de sostén y el tejido muscular. Toxinas específicas, como las miotoxinas y las enzimas hidrolíticas (sobre todo proteolíticas), pueden provocar una intensa citólisis, degeneración muscular, miólisis intensas (rabdomiólisis), ulceraciones que en algunos casos pueden terminar en profundas y extensas necrosis, mioglobinuria, insuficiencia renal, etc.
Alteraciones renales
Los efectos nefrotóxicos son producidos fundamentalmente por la mioglobina y por la hemoglobina producidas por la miólisis y la hemólisis; estas sustancias aumentadas considerablemente en la filtración renal terminan por destruir los túbulos renales. El fallo en la función condicionará la aparición de oligoanuria o anuria, retención de toxinas urémicas y productos nitrogenados que favorecen la aparición de coma. La insuficiencia renal que se origina se verá agravada por la deshidratación del paciente y por la hipoperfusión del riñón en un paciente en estado de shock.
Procesos inflamatorios
Producidos por sustancias mediadoras de la inflamación como la histamina, bradiquinina, prostaglandinas, leucotrienos, etc., liberadas por mastocitos y leucocitos granulocíticos tras su activación provocada por enzimas proteolíticas y por la acción del complemento. Causarán una importante vasodilatación local y un aumento de la permeabilidad capilar, que terminan produciendo un importante edema y gran dolor, que puede pasar de ser localizado a generalizado con el consiguiente riesgo de que llegue a producir isquemia de la zona con necrosis (que agravaría el cuadro de citólisis y miólisis).
Alteraciones linfáticas
Provocadas por la absorción del veneno por esta vía, podemos encontrar linfangitis y adenopatías dolorosas que suelen extenderse hasta la raíz de la extremidad.
Procesos infecciosos
Provocados por las bacterias de la boca de la serpiente (Pseudomonas, E. coli, Klebsiella, Salmonella, Clostridium perfringens y tetani, Bacteroides fragilis, Fusobacterium y Peptostreptococcus) o por los gérmenes existentes en la piel del paciente o en la boca del sujeto que succionó la herida si esta medida se llevó a cabo. Por las alteraciones que presentan los tejidos próximos y los vasos sanguíneos es muy fácil que se produzca una septicemia.
Reacciones anafilácticas
Ciertas proteínas de elevado peso molecular son capaces de estimular al sistema inmune. La reacción inmunitaria que se desencadena puede ser de dos tipos: inmediata (de tipo 1) o tardía (de tipo 3 o por inmunocomplejos). Son reacciones alérgicas exactamente iguales a las que se pueden desencadenar en el paciente tras la aplicación del suero antiofídico como parte del tratamiento8.
Reacciones acompañantes
La mayoría de estos cuadros se acompañan de fiebre, náuseas, vómitos y sudación, que pueden tener una intensidad variable dependiendo del grado de envenenamiento alcanzado; además, todos los cuadros presentan una más que justificada ansiedad que puede agravar las reacciones acompañantes anteriormente descritas.
ANTIDOTOS DISPONIBLES
Remitimos al lector a la tabla 4. Señalaremos que de las especies europeas, el único antídoto disponible en España es el suero antiofídico Ipser Europe8. Respecto a los sueros frente a especies americanas, asiáticas y africanas, pocos hospitales dependientes del INSALUD cuentan con ellos (en la comunidad autónoma de Aragón ninguno de sus hospitales), aunque centros zoológicos y centros biológicos para el estudio de estas especies suelen disponer de este tipo de viales.
BOAS Y PITONES
Éstas suelen ser las especies más comunes en las tiendas de mascotas; por un módico precio que oscila entre las 17.000 y las 125.000 ptas. (según nuestro estudio), puedes presumir en tu domicilio de uno de estos llamativos ejemplares. Tanto boas como pitones son especies primitivas, que matan por constricción no por envenenamiento; no poseen aparato de dentición especializado como las víboras, crótalos, cobras, etc., sino que sus dientes son para sujetar la presa, son dientes cónicos, largos, afilados y curvados hacia atrás, están soldados a la mandíbula y carecen de raíces dentales. Como el resto de las serpientes, poseen dos arcos dentales en el maxilar superior y uno en la mandíbula, sólo que en estas especies la boca es de mayor tamaño y con una movilidad mucho mayor al resto de especies1-3. Algo que no debemos olvidar de estas especies de terrarios es el hecho de que ellas mismas pueden ser el huésped de otros agentes infecciosos, desde bacterias que provocan frecuentes abscesos cutáneos, a ectoparásitos (ácaros), endoparásitos (cestodos, nematodos), infecciones respiratorias, estomatitis, panoftalmitis, etc.39. El estado de salud del animal será algo que preguntaremos siempre al dueño del reptil (que suele ser el atendido en urgencias).
Las lesiones que podríamos encontrar en estos casos se limitarán a las señales de la mordedura, que serán grandes y muy dolorosas. Existe la posibilidad de que queden algunas piezas dentales en las lesiones por lo que deberemos observarlas detenidamente. Como tratamiento a aplicar, éste será igual al de una lesión cutánea infectada: limpieza superficial con agua, jabón y antisépticos cutáneos tipo povidona yodada, profilaxis antitetánica, pauta antibiótica y analgesia moderada.
A PROPOSITO DE UNA REVISION DE 54 CASOS
En relación al estudio realizado por nosotros sobre los 54 casos recogidos en nuestra comunidad autónoma40, diremos que sólo recogimos un caso de mordedura de serpiente exótica. El paciente era un varón, de mediana edad, mordido en la mano mientras manipulaba (exhibía) una de sus boas. Señalaremos que el paciente no tenía ninguna pieza dental en la herida de la mano, y que el dolor era muy intenso. Fue atendido en uno de los centros de referencia del estudio y el tratamiento aplicado fue el señalado anteriormente.