Análisis del perfil clínico, la evolución y las diferencias en morbimortalidad en el síndrome de bajo gasto cardiaco (SBGC) en el postoperatorio de cirugía cardiaca, según los 3 subgrupos de diagnóstico definidos en el Consenso SEMICYUC 2012.
DiseñoEstudio de cohortes prospectivo multicéntrico.
ÁmbitoUCI de hospitales españoles con cirugía cardiaca.
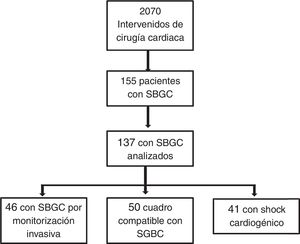
PacientesMuestra consecutiva de 2.070 pacientes intervenidos de cirugía cardiaca. Análisis de 137 pacientes con SBGC.
IntervencionesNo se realiza intervención.
ResultadosEdad 68,3±9,3 años, 65,2% varones, con un EuroSCORE II de 9,99±13. Los antecedentes a destacar fueron: NYHA III-IV (52,9%), FEVI<35% (33,6%), IAM (31,9%), HTP severa (21,7%), estado crítico preoperatorio (18,8%), cirugía cardiaca previa (18,1%) y ACTP/stent (16,7%). Según subgrupos, 46 pacientes cumplían criterios hemodinámicos de SBGC (grupo A), 50 criterios clínicos (grupo B) y el resto (n=41) fueron shock cardiogénico (grupo C). En la evolución, se encontraron diferencias significativas entre los subgrupos en el tiempo de ventilación mecánica (114,4, 135,4 y 180,3min, para A, B y C, respectivamente, p<0,001), la necesidad de reemplazo renal (11,4, 14,6 y 36,6%, p=0,007), el fracaso multiorgánico (16,7, 13 y 47,5%) y la mortalidad (13,6, 12,5 y 35,9%, p=0,01). La media de lactato máximo fue mayor en los pacientes con shock cardiogénico (p=0,002).
ConclusionesLa evolución clínica de estos pacientes con SBGC conlleva una elevada morbimortalidad. Encontramos diferencias entre los subgrupos en el curso clínico postoperatorio y la mortalidad.
An analysis is made of the clinical profile, evolution and differences in morbidity and mortality of low cardiac output syndrome (LCOS) in the postoperative period of cardiac surgery, according to the 3 diagnostic subgroups defined by the SEMICYUC Consensus 2012.
DesignA multicenter, prospective cohort study was carried out.
SettingICUs of Spanish hospitals with cardiac surgery.
PatientsA consecutive sample of 2,070 cardiac surgery patients was included, with the analysis of 137 patients with LCOS.
InterventionsNo intervention was carried out.
ResultsThe mean patient age was 68.3±9.3 years (65.2% males), with a EuroSCORE II of 9.99±13. NYHA functional class III-IV (52.9%), left ventricular ejection fraction<35% (33.6%), AMI (31.9%), severe PHT (21.7%), critical preoperative condition (18.8%), prior cardiac surgery (18.1%), PTCA/stent placement (16.7%). According to subgroups, 46 patients fulfilled hemodynamic criteria of LCOS (group A), 50 clinical criteria (group B), and the rest (n=41) presented cardiogenic shock (group C). Significant differences were observed over the evolutive course between the subgroups in terms of time subjected to mechanical ventilation (114.4, 135.4 and 180.3min in groups A, B and C, respectively; P<.001), renal replacement requirements (11.4, 14.6 and 36.6%; P=.007), multiorgan failure (16.7, 13 and 47.5%), and mortality (13.6, 12.5 and 35.9%; P=.01). The mean maximum lactate concentration was higher in cardiogenic shock patients (P=.002).
ConclusionsThe clinical evolution of these patients leads to high morbidity and mortality. We found differences between the subgroups in terms of the postoperative clinical course and mortality.
El síndrome de bajo gasto cardiaco (SBGC) es una potencial complicación de los pacientes que se intervienen de cirugía cardiaca (CC). Su incidencia varía entre un 3 y un 45% en los diferentes estudios publicados y se asocia a un aumento de la morbimortalidad, con una prolongación de la estancia en UCI y un aumento en el consumo de recursos1–4. Podemos considerar el SBGC como una insuficiencia cardiaca aguda (ICA) «peculiar», con unos desencadenantes, un modo de presentación, una evolución y un tratamiento diferentes a los de la ICA de origen médico. Las clasificaciones de ICA de la Sociedad Europea de Cardiología y de la American College of Cardiology no son aplicables, de manera directa, al postoperatorio de CC; de hecho, no recogen esta entidad5. El SBGC postoperatorio implica la asociación de componentes cardiogénicos, distributivos e hipovolémicos que afectan a la hemodinámica del paciente y conllevan una importante complejidad en su manejo, precisando un abordaje clínico dinámico. En este contexto, en el año 2012 se publica un documento de consenso en el que se establecen definiciones específicas de este cuadro clínico y se hacen unas recomendaciones globales sobre el manejo y tratamiento del mismo6.
En el presente estudio se determinan los posibles factores tanto prequirúrgicos como intraoperatorios que se asocian a SBGC y que pueden influir en su evolución. Se pretende conocer la compleja evolución postoperatoria de estos pacientes y estudiar las diferencias entre los distintos subgrupos de diagnóstico clínico (tanto en la asociación con factores predisponentes como en la evolución y el pronóstico).
Pacientes y métodosRealizamos un estudio de cohorte, observacional, prospectivo y multicéntrico, que analiza a un grupo de pacientes con SBGC en el postoperatorio de CC (estudio ESBAGA). Los objetivos planteados fueron conocer la evolución postoperatoria y el pronóstico (evolución clínica, presencia de complicaciones y mortalidad) en estos pacientes que desarrollaron SBGC, y las diferencias según los 3 distintos subgrupos diagnósticos de dicho síndrome. También se estudian los factores pre e intraoperatorios que se asociaron al desarrollo del mismo.
Población de estudioEl estudio fue realizado en 14 unidades de cuidados intensivos (UCI) de hospitales de todo el ámbito nacional. Son estudiados los pacientes a los que se realiza CC e ingresan en la UCI durante el periodo posquirúrgico precoz y que presentan diagnóstico de SBGC.
Criterios de inclusión: pacientes con datos de SBGC según criterios de las «Guías de práctica clínica para el manejo del síndrome de bajo gasto cardíaco en el postoperatorio de cirugía cardíaca» de la SEMICYUC6:
- -
SBGC poscirugía: índice cardiaco medido inferior a 2,2l/min/m2, sin hipovolemia relativa asociada. Puede deberse a fracaso ventricular izquierdo y/o derecho y asociar o no congestión pulmonar y/o sistémica.
- -
Cuadro clínico compatible con SBGC: comprende aquellos pacientes en los que no se está monitorizando y, por tanto, se desconoce, el gasto cardiaco, pero presentan un cuadro clínico compatible con bajo gasto cardiaco: oliguria (diuresis inferiores a 0,5ml/kg/h), saturación venosa central<60% (con saturación de oxígeno arterial normal) y/o lactato>3mmol/l, sin hipovolemia relativa.
- -
Shock cardiogénico (SC): corresponde a la situación más grave del espectro del SBGC. Se define como índice cardiaco<2,0l/min/m2, con presión arterial sistólica<90mmHg, sin hipovolemia relativa y con oliguria.
Criterios de exclusión: pacientes que no aceptaron participar en el estudio.
El periodo de inclusión fue desde junio de 2014 hasta junio de 2015. El médico intensivista eligió a los pacientes a medida que estos eran intervenidos quirúrgicamente y cumplían los criterios de inclusión y exclusión, según la técnica de muestreo consecutivo.
Se trata de un estudio no intervencionista. No fueron necesarias pruebas de laboratorio o de diagnóstico complementarias diferentes de las que por protocolo aplica cada centro.
En todos los hospitales participantes se obtuvo la aprobación de los comités de ética e investigación para la realización del estudio. Todos los pacientes (o representantes) firmaron la hoja de consentimiento informado para su inclusión en el estudio.
Las principales variables de valoración estudiadas fueron:
- -
Datos demográficos y generales: género, edad, tipo de intervención, comorbilidades y procedimiento quirúrgico.
- -
Variables prequirúrgicas: intervención quirúrgica previa, clase funcional (NYHA), antecedentes de riesgo cardiovascular y datos EuroSCORE II, angioplastia coronaria (ACTP)/colocación de stents previos, fracción de eyección del ventrículo izquierdo (FEVI), estado crítico preoperatorio según se define para EuroSCORE II (fibrilación o taquicardia ventricular o muerte súbita cardiaca reanimada, masaje cardiaco perioperatorio, ventilación mecánica previa, inotropos, balón de contrapulsación preoperatorio, anuria u oliguria<10ml/h).
- -
Variables intraoperatorias: carácter de la cirugía, tiempo de pinzamiento aórtico, tiempo de circulación extracorpórea (CEC), dificultad para salir de CEC (valorada como la necesidad de más de 2 fármacos vasoactivos al salir de la CEC o la necesidad de reentrada en bomba).
- -
Variables postoperatorias: tiempo en ventilación mecánica hasta la extubación, uso de fármacos inotrópicos/vasoactivos, presencia de complicaciones cardiacas y quirúrgicas (reintervención por hemorragia o taponamiento, edema agudo de pulmón, infarto agudo de miocardio [IAM] perioperatorio, troponina T ultrasensible máxima, arritmias), complicaciones renales (disfunción renal aguda, necesidad de terapia de depuración extracorpórea), complicaciones neurológicas, respiratorias, infecciosas, gastrointestinales, resultados de analíticas (lactato máximo, alanina aminotransferasa), FMO.
- -
Variables de datos de evolución globales: estancia en UCI y resultado final (vivo/exitus).
Las tablas y figuras se han calculado a partir del número de casos válidos (n), y este número es el que se ha considerado para el cálculo de porcentajes u otras consideraciones estadísticas. Las variables continuas se han resumido mediante el número de casos válidos, la media, la desviación estándar y los valores extremos, mientras que las variables categóricas se han descrito mediante el número de casos válidos y el porcentaje de cada categoría.
Las variables continuas se informan como medias y desviaciones estándar o como medianas y rangos intercuartílicos, usando el ANOVA o la prueba de Kruskal-Wallis, según la naturaleza de las variables (determinada por la prueba de Kolmogorov-Smirnov). Las variables categóricas se presentan como valores absolutos y porcentajes, y se usaron las pruebas de Chi-cuadrado o el test exacto de Fisher para comparar las diferencias entre los grupos, según correspondiera. El análisis estadístico se ha realizado utilizando el software de estadística SPSS 19.0 para Windows. Se consideró estadísticamente significativo un valor de p<0,05.
ResultadosEn el estudio ESBAGA han participado las UCI de 14 centros hospitalarios de ámbito nacional (tabla 1). Se analizan un total de 2.070 enfermos intervenidos de CC, de los que 155 presentan un SBGC en el postoperatorio inmediato, lo que indica una incidencia del 7,5%. De estos, 18 pacientes rechazaron formar parte del estudio, evaluándose 137 enfermos. En la figura 1 se muestra el diagrama de flujo de estos pacientes.
Centros participantes
| Centros participantes: 14 | Enfermos: 137 n (%) |
|---|---|
| Complejo Hospitalario Universitario de Canarias | 21 (15,2) |
| Hospital Universitario La Princesa, Madrid | 19 (14,3) |
| Hospital Universitario Fundación Jiménez Díaz, Madrid | 19 (14,3) |
| Hospital Universitario 12 de Octubre, Madrid | 15 (10,9) |
| Hospital Universitario Virgen de la Macarena, Sevilla | 12 (8,7) |
| Hospital Universitario de Bellvitge, Barcelona | 12 (8,7) |
| Hospital Universitario Miguel Servet, Zaragoza | 9 (6,5) |
| Hospital Universitario Carlos Haya, Málaga | 7 (5,1) |
| Hospital Universitario General de Valencia | 6 (4,3) |
| Complejo Hospitalario Universitario de A Coruña | 5 (3,6) |
| Hospital Universitario Marqués de Valdecilla, Santander | 5 (3,6) |
| Hospital Universitario Clínico San Carlos, Madrid | 4 (2,9) |
| Hospital Universitario Virgen de la Arrixaca, Murcia | 2 (1,4) |
| Hospital Universitario del Vinalopó, Alicante | 1 (0,7) |
Los pacientes presentan las características generales representadas en la tabla 2. La revascularización miocárdica aislada o acompañada de intervención valvular fueron los procedimientos quirúrgicos más frecuentes. De los antecedentes más relevantes (tablas 2 y 3), destaca que un elevado porcentaje de pacientes presentan una importante afectación clínica prequirúrgica, con clase funcional NYHA III-IV, estado crítico preoperatorio, necesidad de fármacos vasoactivos o disfunción ventricular con FEVI<35%. Un importante número de enfermos presentaba un IAM previo (22 casos en los 90 días previos a la intervención), intervencionismo percutáneo previo (ACTP/stent), una CC previa o HTP moderada-grave.
Datos demográficos y generales
| Pacientes con SBGC n=137 | ||
|---|---|---|
| Género, % | Hombre/mujer | 65,2/34,8 |
| Edad (años), media±DE | 68,26±9,33 | |
| EuroSCORE II, media±DE | 9,99±13 | |
| Comorbilidades y factores de riesgo, % | Hipertensión | 70,8 |
| Dislipidemia | 63,5 | |
| Diabetes | 33,3 | |
| Fumador | 26,3 | |
| HTP severa | 33,1 | |
| EPOC | 10,9 | |
| Endocarditis activa | 8 | |
| Carácter intervención | Electiva | 59,6 |
| Urgente | 33,8 | |
| Emergencia | 6,6 | |
| Procedimientos quirúrgicos, % | Revascularización miocárdica | 16,8 |
| Revascularización miocárdica+cirugía valvular | 24,8 | |
| Cirugía valvular aórtica | 11,7 | |
| Cirugía valvular mitral | 11,7 | |
| Cirugía mitral y aórtica | 8,1 | |
| Cirugía mitral y tricúspide | 3,7 | |
| Otros | 23,2 | |
Distribución de los pacientes en función del grupo de diagnóstico y las variables pre e intraoperatorias
| SBGC (n=46) | Cuadro clínico compatible con SBGC (n=50) | Shock cardiogénico (n=41) | Total | p | |
|---|---|---|---|---|---|
| Género femenino, n (%) Género masculino, n (%) | 15 (32,6) 31 (67,4) | 17 (34) 33 (66) | 15 (36,6) 26 (63,4) | 47 (34,3) 90 (65,7) | 0,925 |
| Edad media en años | 68,7 | 67,96 | 68,59 | 68,26 | 0,91 |
| EuroSCORE II, media | 5,58 | 9,33 | 15,83 | 9,99 | 0,001 |
| HTA, n (%) | 33 (72) | 35 (70) | 29 (71) | 97 (70,8) | 0,98 |
| Dislipidemia, n (%) | 28 (61) | 29 (58) | 30 (73) | 87 (63,5) | 0,29 |
| Diabetes, n (%) | 17 (37) | 21 (42) | 8 (20) | 46 (33,6) | 0,06 |
| Fumador, n (%) | 11 (24) | 14 (28) | 11 (27) | 36 (26,3) | 0,89 |
| EPOC, n (%) | 4 (8,7) | 6 (12) | 5 (12) | 15 (10,9) | 0,83 |
| Daño isquémico reciente (3 meses), n (%) | 10 (22) | 10 (20) | 13 (32) | 33(24,6) | 0,43 |
| Infarto de miocardio previo, n (%) | 14 (30) | 13 (26) | 17 (41) | 44 (32,1) | 0,27 |
| Angina en reposo (clase CCS 4), n (%) | 1 (2,2) | 3 (6) | 7 (17) | 11 (8) | 0,03 |
| ACTP/stent previo, n (%) | 7 (15) | 7 (14) | 9 (22) | 23 (16,8) | 0,56 |
| FEVI baja (<35%), n (%) | 14 (30) | 16 (32) | 15 (37) | 45 (33,8) | 0,89 |
| NYHA III-IV prequirúrgico, n (%) | 20 (43) | 24 (48) | 27 (66) | 71 (52,6) | 0,04 |
| Estado crítico preoperatorio, n (%) | 6 (13) | 7 (14) | 13 (32) | 26 (19) | 0,04 |
| Pacientes valvulares con HTP moderada-grave previa, n (%) | 15 (33) | 17 (34) | 12 (29) | 44 (33,1) | 0,82 |
| Cirugía cardiaca previa, n (%) | 4 (8,7) | 9 (18) | 11 (27) | 24 (17,5) | 0,08 |
| Endocarditis activa, n (%) | 2 (4,3) | 6 (12) | 3 (7,3) | 11 (8) | 0,37 |
| Cirugía de emergencia, n (%) | 2 (4,3) | 0 (0) | 7 (17) | 9 (6,6) | 0,002 |
| CEC>120min, n (%) | 23 (50) | 30 (60) | 32 (78) | 85 (62,5) | 0,03 |
| Reentrada en CEC, n (%) | 5 (10,9) | 6 (12) | 11 (26,8) | 22 (16) | 0,05 |
Como factores intraoperatorios, asociados con SBGC, encontramos que un 70,1% de los pacientes precisó 2 (o más) fármacos vasoactivos al salir de la CEC. La reentrada en bomba, para conseguir una salida definitiva de CEC, fue necesaria en 22 pacientes (16%). El tiempo medio de CEC fue de 147±60min y el tiempo medio de pinzamiento aórtico, de 105±43min. Se observaron tiempos quirúrgicos prolongados, con CEC>120min, en el 62,5% de los pacientes.
Comparamos estos factores entre los distintos sugbrupos de diagnóstico clínico de SBGC. Así, 46 pacientes cumplían criterios hemodinámicos de SBGC (grupo A), 50 cumplían los criterios clínicos (grupo B) y el resto (n=41) fueron diagnosticados de SC (grupo C). Encontramos que en la mayoría de los factores no hay diferencias significativas intergrupales. Sin embargo, sí se observaron diferencias en aquellos pacientes con una situación previa más comprometida, como es la presencia de angina de reposo, estado crítico prequirúrgico, situación clínica NYHA III/IV, necesidad de cirugía de emergencia y EuroSCORE II de alto riesgo. El porcentaje de enfermos con tiempos quirúrgicos prolongados (CEC superior a 2h) es más frecuente en los casos con SC (n=32; p=0,03). De forma similar, la necesidad de reentrada en CEC es más frecuente en el grupo de SC (26,8%, p=0,05). En la tabla 3 se presenta la distribución de los pacientes en función del grupo de diagnóstico y las variables pre e intraoperatorias.
De una manera global, la evolución postoperatoria de estos pacientes fue complicada, con una elevada morbimortalidad (tabla 4).
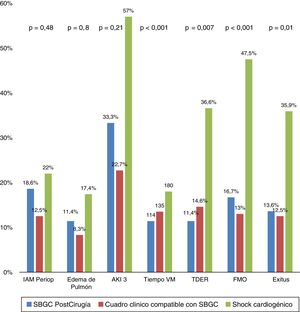
Se evaluó si las 3 situaciones clínicas de SBGC, propuestas en la definición diagnóstica que se estableció en el documento de consenso6, podrían tener una diferente evolución clínica y pronóstico. No se observaron diferencias (estadísticamente significativas) entre subgrupos respecto al número de pacientes que precisaron reintervención quirúrgica (por sangrado o taponamiento), ni en la incidencia de arritmias, complicaciones infecciosas, neurológicas, respiratorias o gastrointestinales. Hay que destacar que, aunque no se alcanzó una diferencia estadísticamente significativa, sí se observaron tendencias, con diferencias intergrupales (SBGC, cuadro clínico compatible con SGBC y SC) en las tasas de IAM perioperatorio (p=0,48), en el edema agudo de pulmón (p=0,80) y en el deterioro renal agudo (estadio AKI 3, p=0,21). Sí se observaron diferencias significativas en los tiempos de ventilación mecánica (p<0,001), el porcentaje de pacientes que requirieron técnicas de remplazo renal (p=0,007), pacientes que desarrollaron FMO en la evolución (p<0,001), y, consecuentemente en el porcentaje de exitus (p=0,01). Destacar, que los casos que evolucionan con FMO (n=32) fueron más frecuentes en el grupo con SC (19 vs. 7 grupo SBGC y 6 del grupo clínico; p<0,001). En la figura 2 observamos, de forma gráfica, las diferencias en las complicaciones postoperatorias analizándolas entre los 3 distintos grupos diagnósticos.
Diferentes complicaciones y evolución según los subgrupos de diagnóstico.
AKI 3: Acute Kidney Injury 3; FMO: fracaso multiorgánico; IAM periop: infarto agudo de miocardio perioperatorio; TDER: técnicas de depuración extrarrenal; Tiempo VM: tiempo de ventilación mecánica en minutos; SGBC: síndrome de bajo gasto cardiaco.
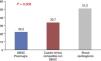
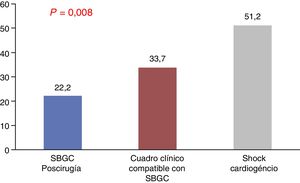
Se analizaron variables analíticas de daño miocárdico, como los valores de troponina T ultrasensible e I, que tampoco mostraron diferencias estadísticas. Por el contrario, la media de los valores de lactato máximo (como marcador de perfusión), que se muestran en la figura 3, y de alanina aminotransferasa fueron superiores en los pacientes con SC, alcanzando la significación (51,2±49 vs. 22,2±21 en el grupo A y 33,7±36 en el grupo B, p=0,002, respecto a lactato, y 679,7±1.040 vs. 215±769 en el grupo A y 167±358 en el grupo B, p=0,008, respecto a alanina aminotransferasa). El lactato, en todos los momentos en que fue medido, alcanzó la significación (ingreso p=0,001; 4h p=0,014; 12h p=0,012; 24h p=0,01; 48h p=0,003; alta p=0,01).
El análisis de los datos anteriores nos confirma la mayor gravedad, con mayor porcentaje de complicaciones y peor pronóstico del grupo de pacientes con SC. También hay que destacar que el grupo de diagnóstico clínico tiene una evolución similar al grupo de pacientes diagnosticados por monitorización invasiva.
DiscusiónA pesar del elevado número de enfermos que se intervienen de CC y de la incidencia relativa de SBGC poscirugía, hay pocos estudios con un amplio número de enfermos que caractericen esta forma clínica de ICA. Estos estudios analizan aspectos concretos y, en cualquier caso, ninguno analiza la evolución clínica por los diferentes subgrupos nosológicos clínicos. En este documento presentamos un estudio multicéntrico y prospectivo con un análisis de los pacientes con SBGC; se diferencian 3 subgrupos con diferencias evolutivas y pronósticas.
En la literatura encontramos múltiples factores pre e intraoperatorios relacionados con el SBGC. En el estudio de Rao et al.1, con postoperados de revascularización miocárdica, se describen como factores predictores independientes la FEVI<20%, la reintervención, el género femenino, la diabetes, la edad superior a 70 años, la estenosis del tronco coronario izquierdo, el IAM reciente y la enfermedad de 3 vasos. Algarni et al.7, en pacientes sometidos a revascularización, encuentran como predictores el recibir una reintervención de revascularización, la intervención el año previo, la FEVI disminuida (<40%), la cirugía de emergencia, el SC y el sexo femenino. Estos autores refieren un descenso en la prevalencia del SBGC en el tiempo. Ding et al.8 analizan a 205 pacientes con SBGC y reportan que la edad avanzada, la FEVI deprimida, la cirugía con CEC, la cirugía de emergencia y la revascularización incompleta son los factores que se asocian al SBGC. Asimismo, objetivan el aumento de la morbimortalidad en este grupo de enfermos. Factores muy similares son los que documentan Sá et al.9 cuando analizan 89 pacientes con SBGC (el 14,7% de los pacientes intervenidos de revascularización).
También se han relacionado con la aparición de bajo gasto factores relacionados con la protección miocárdica durante el proceso quirúrgico. Así, Algarni et al.10 publican que la prevalencia de SBGC fue más baja (p<0,001) en el grupo de pacientes que fueron revascularizados utilizando microplejía (2,7%) que en el grupo en el que se utilizó cardioplejía hemática estándar (5%). En un estudio realizado en pacientes sometidos a revascularización en el que se compara la incidencia de SBGC utilizando la cardioplejía hemática fría (7°C) vs. la tibia (29°C)11, los autores encuentran una mayor incidencia en el grupo de cardioplejía tibia. Likosky et al.12, en un grupo de pacientes con revascularización electiva con CEC, estudian el grado en el que el cirujano y las prácticas quirúrgicas pueden influir en la tasa de SBGC. Encuentran que las tasas de bajo gasto varían entre cirujanos y no pueden ser explicadas exclusivamente por el case-mix, lo que les sugiere que la variabilidad en las prácticas perioperatorias (tiempos quirúrgicos, cardioplejía, etc.) influye en el riesgo de desarrollar SBGC.
En un grupo de cirugía mitral aislada, Maganti et al.13 encuentran como factores predictores la urgencia en la intervención, intervención el año previo, FEVI<40%, NYHA IV, enfermedad mitral isquémica y tiempo de pinzamiento.
En general, en los artículos de revisión14 se consideran los predictores pre e intraoperatorios previamente mencionados. En nuestro estudio, el análisis de los factores asociados al desarrollo del SBGC muestra datos similares a los publicados en la literatura; destaca en nuestra serie la asociación a factores clínicos de gravedad prequirúrgica y también intraoperatorios.
El hecho de conocer los factores de riesgo que pueden facilitar el desarrollo de un SBGC nos obliga a plantear la búsqueda de enfermos con un perfil de alto riesgo para utilizar posibles estrategias de prevención. En este sentido, ya se están llevando a cabo estrategias de precondicionamiento en pacientes con disfunción ventricular. Las experiencias iniciales con la administración de levosimendán prequirúrgico en pacientes seleccionados han sido positivas15,16. Están en marcha ensayos que nos aportarán resultados definitivos sobre la práctica de uso de este fármaco en el precondicionamiento17. Recientemente, el ensayo LEVO-CTS muestra que levosimendán, utilizado de manera profiláctica prequirúrgica en pacientes con FEVI=35% que se intervienen de CC, no resulta en una disminución del objetivo compuesto por mortalidad, necesidad de terapia de depuración renal, IAM perioperatorio o uso de asistencia mecánica18. Por otro lado, la cardioplejía y los diferentes métodos de cardioprotección del miocardio utilizados durante la CC pueden modificar el desarrollo de la potencial afectación del miocardio ventricular por isquemia/reperfusión, aturdimiento secundario y, por tanto, el SBGC19–23. De esta manera, los enfermos con mayor probabilidad de desarrollar un SBGC podrían ser subsidiarios de estudios dirigidos, con terapias de cardioprotección específicas.
Por otro lado, en el documento de consenso de SBGC de SEMICYUC 20126 se diferencian 3 grupos clínicos de SBGC. Evaluamos si las 3 situaciones clínicas, propuestas en la definición diagnóstica del documento, podrían tener una diferente evolución clínica. Se comparan los grupos diagnósticos: A) SBGC: definición «clásica», con medición directa del índice cardíaco; B) cuadro clínico «compatible», no basado en datos de monitorización invasiva, y C) SC. Esta clasificación incluye, además de las definiciones clásicas de SBGC postoperatorio y SC, el grupo de cuadro clínico compatible, que no aparece en otras definiciones. Así, se comparan estos 3 subgrupos para determinar las diferencias respecto a la evolución clínica, las complicaciones y la mortalidad postoperatoria. Los resultados se muestran en las figuras 2 y 3. Como se comentó en el apartado de resultados, en las tasas de IAM perioperatorio, la evolución con edema agudo de pulmón y el deterioro agudo de la función renal por análisis de porcentaje de estadio AKI 3 se encontraron diferencias entre los distintos subgrupos, aunque sin alcanzar la significación estadística, probablemente debido al limitado número de pacientes incluidos. Sí que se objetivaron diferencias significativas en los tiempos de ventilación mecánica, la necesidad de técnicas de depuración extrarrenal, en el desarrollo de FMO y en la mortalidad, destacando el claro peor pronóstico del grupo de SC.
De esta manera, destacan en este análisis 2 hallazgos relevantes:
1. La necesidad de reconocer la importancia, en la práctica clínica, del grupo de diagnóstico «clínico». La valoración de datos clínicos como la oliguria y la hipoperfusión clínica y datos analíticos, al alcance de cualquier centro (incluso como point of care), como es la determinación del lactato y la saturación venosa central de oxígeno, nos permiten reconocer una situación de bajo gasto en estos enfermos. Así, puede no ser estrictamente necesaria la monitorización invasiva avanzada (con catéter de arteria pulmonar o termodilución transpulmonar) en todos los pacientes para hacer un diagnóstico y tratamiento de SBGC24. En este trabajo se observa como este grupo «clínico» presenta una evolución postoperatoria con un claro aumento de los datos de morbimortalidad muy similar al grupo diagnosticado por parámetros de monitorización hemodinámica. Por ello, a nivel de manejo clínico práctico, siempre es necesario mantener un alto nivel de sospecha clínica para poder comenzar un tratamiento adecuado y precoz en este subgrupo de pacientes (similar al subgrupo con diagnóstico por monitorización invasiva).
2. La clara peor evolución clínica y pronóstico del SC respecto a los otros 2 grupos. El SC muestra una mayor gravedad, con asociación a una peor evolución postoperatoria, mayor desarrollo de FMO y mayor mortalidad. En los pacientes que desarrollan shock, debemos considerar que el ecocardiograma transesofágico muestra disfunción ventricular derecha en alrededor del 40% de los pacientes25. Esta situación puede conllevar cambios en la aproximación terapéutica26,27.
En cualquier caso, el SBGC se asocia a una elevada morbimortalidad y complicaciones postoperatorias (tablas y figuras correspondientes). En nuestra serie, la mortalidad fue similar a la referida en la literatura, con diferencias significativas dependiendo de los subgrupos clínicos referidos.
LimitacionesAunque el estudio tiene un importante número de enfermos, hay que reconocer que este es limitado y sin comparación con grupo control. Además, aunque más de dos terceras partes de los participantes confirmaron seguir los algoritmos de manejo publicados en el documento de consenso, es probable que pueda haber diferencias en el tratamiento de los pacientes entre los diferentes centros, por lo que puede existir cierto grado de falta de homogeneidad.
ConclusionesLa evolución clínica de los pacientes con SBGC es compleja, presentando una importante morbimortalidad.
Es importante conocer el perfil de los factores pre e intraoperatorios que puedan conducir a SBGC para intentar definir posibles estrategias de manejo preventivo.
En la serie estudiada, se encontraron diferencias en los datos de evolución clínica posquirúrgica y mortalidad entre los distintos grupos de diagnóstico de SBGC.
Se precisa un mayor número de enfermos para poder establecer estas afirmaciones de una manera definitiva.
AutoríaTodos los autores que aparecen como tales al principio del artículo y como firmantes del mismo han realizado contribuciones sustanciales en la concepción y el diseño del estudio, la adquisición de datos, el análisis y la interpretación de los mismos. Asimismo, han participado en el borrador del artículo o la revisión crítica del contenido. Y, por tanto, en la aprobación definitiva de la versión que se presenta.
Como corresponde a un grupo de trabajo, el resto de los autores participantes o colaboradores en la tabla (estudio ESBAGA), y que figuran al final del documento, han participado en la adquisición de los datos.
Colaboradores como la Dra. Ana Ochagavía Calvo, el Dr. Rafael Hinojosa Pérez, el Dr. Juan José Marín Salazar, la Dra. M. Victoria Boado Varela y el Dr. José Luis Romero Luján no han aportado pacientes, pero colaboraron en la concepción y el diseño del trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Autores:
Dr. José Luis Pérez Vela (Hospital Universitario 12 de Octubre, Madrid), Dr. Juan José Jiménez Rivera (Complejo Hospitalario Universitario de Canarias, Tenerife), Dr. Miguel Ángel Alcalá Llorente (Fundación Jiménez Díaz, Madrid), Dra. Begoña González de Marcos (Hospital Universitario de La Princesa, Madrid), Dra. Herminia Torrado (Hospital Universitario de Bellvitge, Barcelona), Dr. Francisco Javier González Fernández (Hospital Universitario Virgen Macarena, Sevilla), Dra. Cristina García Laborda (Hospital Universitario Miguel Servet, Zaragoza), Dra. M. Dolores Fernández Zamora (Hospital Universitario Carlos Haya, Málaga), Dr. Juan Carlos Martín Benítez (Hospital Clínico Universitario San Carlos, Madrid).
Colaboradores, por hospitales:
Hospital de Sabadell: Dra. Ana Ochagavía Calvo. Hospital Universitario Virgen del Rocío, Sevilla: Dr. Rafael Hinojosa Pérez. Complejo Hospitalario Universitario de A Coruña: Dr. Salvador Fojón Polanco, Dra. Leticia Seoane Quiroga, Dr. Miguel A. Solla Buceta, Dra. M. Luisa Martinez Rodriguez, Dra. M. Teresa Bouza Vieiro, Dra. Alexandra Ceniceros Barros. Hospital Universitario Marqués de Valdecilla, Santander: Dr. Miguel F. Llano Cardenal, Dra. Virginia Burgos Palacios, Dr. Manuel Cobo Belaustegui, Dra. Angela Canteli Alvarez, Dra. Cristina Castrillo Bustamante. Hospital Universitario Virgen de la Arrixaca, Murcia: Dr. Rubén Jara Rubio, Dr. David Bixquert Genovés, Dr. Carlos Albacete Moreno. Hospital Universitario del Vinalopó, Alicante: Dr. Rafael Carrasco Moreno, Dra. Teresa Arce Arias. Hospital Universitario 12 de Octubre, Madrid: Dra. Silvia Chacón Alves, Dr. Emilio Renes Carreño, Dr. Teodoro Grau Carmona. Complejo Hospitalario Universitario de Canarias, Tenerife: Dr. José Luis Iribarren Sarrias, Dra. M. Teresa Brouard Martín, Dra. Samantha Huidobro, Dr. Javier Málaga Gil, Dra. Carolina Garcia Martin, Dr. Ramon Galvan. Fundación Jiménez Díaz, Madrid: Dra. Anxela Vidal González, Dr. César Pérez Calvo, Dr. Renzo Portilla. Hospital Universitario de Bellvitge, Barcelona: Dr. Alain Pinseau Castillo, Dra. Neus López Suñé, Dr. Vicente Corral Vélez, Dr. Nelson Betancur Zambrano, Dr. Gabriel Moreno González, Dra. Elisabeth Periche Pedra. Hospital Universitario Virgen Macarena, Sevilla: Dra. Sonia Ibáñez Cuadros, Dr. Francisco Vela Núñez, Dra. Cristina López Martín. Hospital Universitario Miguel Servet, Zaragoza: Dr. Pablo Gutierrez Ibañes. Hospital Universitario de La Princesa, Madrid: Dra. Irene Garcia Rico, Dr. Ricardo Andino Ruiz, Dra. Judit Iglesias Franco, Dra. Esther Díaz Rodriguez, Dra. Nuria Arevalillo Fernández, Dra. M. José Pérez San José, Dra. Ana Gutiérrez García. Hospital Universitario Carlos Haya, Málaga: Dra. Teresa García Paredes. Complejo Asistencial Universitario de Salamanca: Dr. Juan José Marín Salazar. Hospital de Cruces, Barakaldo (Vizcaya): Dra. M. Victoria Boado Varela. Hospital Dr. Negrín, Las Palmas: Dr. José Luis Romero Luján. Hospital Universitario General de Valencia: Dr. Juan Carlos Valía, Dr. Javier Hernández Laforet.