El síndrome de dificultad respiratoria aguda (SDRA), inicialmente descrito en 1967, se caracteriza por insuficiencia respiratoria aguda con hipoxemia profunda, disminución de la distensibilidad pulmonar e infiltrados bilaterales en la Rx de tórax. En 2012 la definición de Berlín estableció tres categorías con base en la hipoxemia (SDRA leve, moderado y grave), precisando aspectos temporales y permitiendo el diagnóstico con ventilación no invasiva. La pandemia de COVID-19 llevó a reconsiderar la definición, enfocándose en el monitoreo continuo de la oxigenación y la oxigenoterapia de alto flujo. En 2021 se propuso una nueva definición global de SDRA, basada en la definición de Berlín, pero incluyendo una categoría para pacientes no intubados, permitiendo el uso de saturación periférica de oxígeno medida con oximetría de pulso/fracción inspirada de oxígeno (SpO2/FiO2) y la ecografía pulmonar para el diagnóstico, y sin ningún requerimiento de soporte especial de la oxigenación en regiones con recursos limitados. Aunque persisten debates, la evolución continua busca adaptarse a las necesidades clínicas y epidemiológicas, y personalizar tratamientos.
Acute respiratory distress syndrome (ARDS), first described in 1967, is characterized by acute respiratory failure causing profound hypoxemia, decreased pulmonary compliance, and bilateral CXR infiltrates. After several descriptions, the Berlin definition was adopted in 2012, which established three categories of severity according to hypoxemia (mild, moderate and severe), specified temporal aspects for diagnosis, and incorporated the use of non-invasive ventilation. The COVID-19 pandemic led to changes in ARDS management, focusing on continuous monitoring of oxygenation and on utilization of high-flow oxygen therapy and lung ultrasound. In 2021, a New Global Definition based on the Berlin definition of ARDS was proposed, which included a category for non-intubated patients, considered the use of SpO2, and established no particular requirement for oxygenation support in regions with limited resources. Although debates persist, the continuous evolution seeks to adapt to clinical and epidemiological needs, and to the search of personalized treatments.
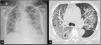
Conceptualmente, el síndrome de distrés respiratorio agudo (SDRA) consiste en un cuadro de insuficiencia respiratoria de comienzo agudo causada por edema pulmonar inflamatorio, caracterizado por el aumento de la permeabilidad vascular con extravasación de líquidos al intersticio alveolar y consecuente inundación de los espacios alveolares1. La pérdida de tejido pulmonar aireado exacerbada por la atelectasia de las zonas dependientes de la gravedad secundaria al incremento del peso del tejido pulmonar suprayacente, lleva al deterioro profundo de la oxigenación por aumento del shunt intrapulmonar y del espacio muerto alveolar; junto con una marcada disminución de la distensibilidad del sistema respiratorio. Esta situación fisiopatológica corresponde con la presencia de infiltrados pulmonares en la radiografía (Rx) y en la tomografía axial computarizada (TAC) de tórax (fig. 1 A y B). Desde el punto de vista anatomopatológico, la característica principal del SDRA es un patrón denominado daño alveolar difuso (DAD), que incluye la presencia de membranas hialinas, edema, necrosis de células alveolares tipo I y II, y hemorragia2,3. Esta descripción constituye el «modelo conceptual» del SDRA, y refleja como los clínicos «perciben» al síndrome4.
El SDRA puede desarrollarse secundariamente a una multiplicidad de factores de riesgo tanto de origen pulmonar (o directos), como extrapulmonares (o indirectos). Esta heterogeneidad etiológica probablemente refleje la activación de diferentes mecanismos de lesión (tabla 1)5.
Factores de riesgo asociados a SDRA
| Pulmonares |
|---|
| • Neumonía (bacteriana, viral)• Aspiración de contenido gástrico• Inhalación de humo• Trauma pulmonar directo• Casi-ahogamiento• Toxicidad por O2 |
| Extrapulmonares |
|---|
| • Sepsis (bacteriana, viral, parásitos)• Shock• Quemaduras• Politraumatismo grave• Traumatismo de cráneo grave• Pancreatitis aguda• Embolia grasa• Embolia de líquido amniótico• Exposición a grandes alturas• Pos-bypass cardiovascular• Otros |
Otra cuestión fundamental es que no existe un gold standard para definir al SDRA. Ni siquiera el DAD es patognomónico ya que no se encuentra presente en la totalidad de los casos diagnosticados clínicamente como SDRA6. Dada la complejidad fisiopatológica del SDRA y las diversas causas que lo generan -aunque todas confluyan finalmente en la activación de mecanismos proinflamatorios- fue necesario construir una definición que facilite la delimitación de la entidad para homogeneizar el diagnóstico, el manejo clínico y la utilización de los distintos enfoques terapéuticos. Adicionalmente, la definición de una patología favorece el desarrollo de la investigación científica relacionada, fomentando la inclusión estandarizada de pacientes que reúnan los criterios mencionados.
Las definiciones de SDRA a lo largo del tiempoLa definición original de SDRA se remonta a 1967 y fue efectuada por Ashbaugh et al., quienes describieron un grupo de 12 pacientes con insuficiencia respiratoria aguda, con hipoxemia profunda secundaria principalmente a shunt intrapulmonar, infiltrados bilaterales en la Rx de tórax y disminución de la distensibilidad toraco-pulmonar, sin antecedentes de insuficiencia respiratoria crónica, y en ausencia de fallo ventricular izquierdo7. Este cuadro ocurría luego de la exposición a lo que se se denominaba un «evento catastrófico», a los cuales hoy se consideran factores de riesgo para SDRA, de causa pulmonar o extrapulmonar (tabla 2). Debido a presentar similitud clínica y radiológica al SDRA en los recién nacidos secundario al déficit de surfactante, los autores denominaron «SDRA del adulto» a la nueva entidad. La definición de Ashbaugh et al. identifica a lo que actualmente se conoce como SDRA grave, ya que desde el punto de vista del deterioro de la oxigenación incorporaba pacientes con una presión arterial de oxígeno (PaO2)<50mmHg con una fracción inspirada de oxígeno (FiO2) >0,6; o sea, que exhibían una hipoxemia profunda, con una PaO2/FiO2 de aproximadamente 80mmHg7.
Definición del síndrome de distrés respiratorio del adulto
| Antecedente de una agresión inicial |
| • Pulmonar (aspiración de contenido gástrico, neumonía, contusión pulmonar) |
| • No pulmonar (shock, politraumatismo) |
| Excluyendo |
| • Enfermedad pulmonar crónica |
| • Insuficiencia ventricular izquierda (presión Wedge <12 mmHg) |
| Presencia de dificultad respiratoria clínicamente evidenciada a través de: |
| • Taquipnea (> 20 respiraciones/minuto) |
| • Esfuerzo respiratorio marcado |
| Presencia de Rx de tórax con evidencia de: |
| • Infiltrados pulmonares bilaterales inicialmente intersticiales, luego alveolares |
| Presencia de deterioro del intercambio gaseoso |
| • PaO2 <50 mmHg con FiO2>0,6 |
| • Incremento del shunt y del espacio muerto |
| Presencia de deterioro en la distensibilidad del sistema respiratorio |
| • Compliance toraco-pulmonar <50 mL/cmH2O (usualmente 20 a 30 mL/cmH2O) |
Tomado de Ashbaugh et al. (1967)7.
Desde esta aproximación inicial se efectuaron varias modificaciones de la definición. En 1988, Murray et al. propusieron el score de lesión pulmonar (LIS) con el fin de cuantificar la gravedad del síndrome. El LIS era el valor promedio de cuatro variables, expresadas en una puntuación de 0 a 4 que reflejaban gravedad creciente: hipoxemia (definida por la PaO2/FiO2); extensión de los infiltrados pulmonares en la Rx de tórax (en número de cuadrantes afectados), distensibilidad (compliance) toraco-pulmonar (en mL/cmH2O) y utilización de presión positiva de fin de espiración [PEEP] en cmH2O). El SDRA se definía con un LIS> 2,58. El LIS fue utilizado, pero la definición continuaba siendo una construcción de unos pocos expertos.
En 1994 se publicó la definición de la Conferencia de Consenso Americano-Europea (AECC), en la que el síndrome conocido hasta entonces como SDRA del adulto pasó a considerarse como dos cuadros de gravedad progresiva: la lesión pulmonar aguda (ALI) y el SDRA, definidas por el compromiso de la oxigenación: PaO2/FiO2 ≤ 300 y ≤ 200, respectivamente (tabla 3)9. Se mantenían las características agudas del síndrome, y la exclusión de causas cardiovasculares en la generación del edema pulmonar.
Comparación de las distintas definiciones de SDRA
| Variable | AECC (1994)9 | Berlín (2012)4 | Kigali (2016)19 |
|---|---|---|---|
| Tiempo | Inicio agudo | Dentro de 1 semana de una enfermedad clínica conocida o síntomas respiratorios nuevos o que empeoran | Dentro de 1 semana de una enfermedad clínica conocida o síntomas respiratorios nuevos o que empeoran |
| Imágenes de tórax | Infiltrados bilaterales en la Rx frontal de tórax | Opacidades bilaterales no explicadas completamente por derrames, colapso lobar/pulmonar o nódulos en la Rx o tomografía axial computarizada de tórax | Opacidades bilaterales no explicadas completamente por derrames, colapso lobar/pulmonar o nódulos en la Rx, tomografía axial computarizada o ecografía pulmonar |
| Origen del edema | Debe descartarse el edema cardiogénico. Presión wedge <18 mmHg si es posible medirla, o ausencia de signos clínicos o ecográficos de hipertensión auricular izquierda | Insuficiencia respiratoria que no se explica completamente por insuficiencia cardiaca o sobrecarga de líquidos. Necesita una evaluación objetiva (p. ej., ecocardiografía) para excluir edema hidrostático si no hay ningún factor de riesgo presente. | Insuficiencia respiratoria que no se explica completamente por insuficiencia cardiaca o sobrecarga de líquidos. Necesita una evaluación objetiva (p. ej., ecocardiografía) para excluir edema hidrostático si no hay ningún factor de riesgo presente. |
| Oxigenación | 2 categorías: a) ALI: PaO2/FiO2 ≤ 300b) SDRA: PaO2/FiO2 ≤ 200 | SDRA Leve: 200 <PaO2/FiO2 ≤ 300SDRA Moderado: 100 <PaO2/FiO2 ≤ 200SDRA Grave: PaO2/FiO2 ≤ 100 | SDRA: SpO2/FiO2 ≤ 315 |
| PEEP | Independiente del nivel de PEEP | Al menos 5 cmH2O a través de ventilación mecánica invasiva (o no invasiva en SDRA leve) | No se necesita PEEP |
La definición AECC, al igual que el score LIS, sufrió varias críticas, centradas principalmente en dos aspectos. En primer lugar, por las dificultades diagnósticas desde el punto de vista radiológico, ya que la evaluación de los infiltrados en la Rx de tórax presenta gran variación intra e interoperador. Adicionalmente, por la decisión de excluir el uso de la PEEP, ya que al modificar la oxigenación presenta un gran impacto en la definición del SDRA, y los pacientes podían rápidamente pasar de una categoría a otra, sin que implique un cambio real en la enfermedad de base10–12.
En 2012 se produjo otro cambio sustancial a través de la aparición de la definición de Berlín (tabla 3)4. Así, a la definición vigente de la AECC se le incorporó la temporalidad respecto al inicio: la insuficiencia respiratoria aguda debe ocurrir dentro de una semana de la exposición al factor de riesgo. Además, se añadieron precisiones respecto al origen del edema y al criterio imagenológico, permitiendo la definición por TAC. Asimismo, se establecieron tres categorías mutuamente excluyentes de gravedad del SDRA con base en la relación PaO2/FiO2, evaluada con un nivel mínimo de PEEP de 5 cmH2O. También se estableció la posibilidad de considerar como SDRA leve a pacientes que cumplían los criterios diagnósticos y se encontraban recibiendo ventilación no invasiva (VNI). Hasta ese momento, el SDRA solo podía ser diagnosticado en pacientes que estuvieran recibiendo ventilación mecánica invasiva.
La actualización de Berlín constituyó un claro avance. Una de sus fortalezas fue su validación empírica en 3.670 pacientes, a diferencia de las definiciones de consenso previas que consistían en acuerdos entre expertos. También se trató de que la nueva definición fuera compatible con las definiciones anteriores, especialmente con la de la AECC. Otro rasgo positivo es su validez predictiva en relación con la mortalidad. Así, puede observarse un incremento de la mortalidad como de las comorbilidades a medida que aumentan los estadios de gravedad del SDRA. Se buscó que las variables que definían al SDRA fueran fácilmente medibles, es decir que la aplicación de la definición fuera factible. Por ejemplo, se consideró que el aumento del agua extravascular pulmonar era la variable que mejor reflejaba el SDRA, pero se descartó su incorporación a la definición por las dificultades y la costosa tecnología que implica su medición. Adicionalmente, los expertos establecieron un «modelo conceptual» de SDRA, que ya fue mencionado al inicio de esta revisión.
Sin embargo, la definición de Berlín presenta limitaciones. La primera es que obliga a la utilización de un nivel mínimo de PEEP para el diagnóstico, ya sea con ventilación invasiva o no invasiva. La evaluación de los infiltrados bilaterales en la Rx de tórax continúa careciendo de reproducibilidad (confiabilidad) intra e interobservador, y la consideración de un intervalo de siete días dentro de los que debe aparecer el síndrome luego de la exposición a un factor de riesgo es totalmente arbitraria13.
Otro debate histórico más profundo, que se reaviva luego de la presentación de cada nueva definición, es sobre si el síndrome llamado SDRA realmente existe o es simplemente una compilación de múltiples causas, muy heterogéneas, de insuficiencia respiratoria aguda hipoxémica. De esta forma, todas las definiciones de SDRA serían «insatisfactorias y superficiales»13–16.
Más allá de estas críticas, utilizando la definición de la AECC se establecieron logros terapéuticos cruciales: fundamentalmente la ventilación protectora, que en comparación con el enfoque convencional de ventilación mecánica utilizado hasta entonces, disminuye la mortalidad en el SDRA; también, se demostró que la utilización de PEEP elevada comparada con el enfoque convencional de PEEP intermedia no conlleva ningún beneficio17,18. De modo que la definición de Berlín fue rápida y ampliamente adoptada.
En 2016, se publica un estudio sobre SDRA efectuado en Kigali, Ruanda19. Los investigadores notaron que ningún paciente con insuficiencia respiratoria aguda hipoxémica podía ser diagnosticado como SDRA con ninguna de las definiciones existentes, porque en Kigali carecían de medición de gases en sangre; era imposible por lo tanto conocer la PaO2/FiO2, esencial para el diagnóstico. Solo disponían de una única medición diaria de saturación periférica de oxígeno medida con oximetría de pulso (SpO2). Tampoco las imágenes típicas del SDRA podían constatarse, ya que la Rx de tórax estuvo disponible en menos de 50% de los pacientes con hipoxemia; sin embargo, era posible efectuar ecografía pulmonar. Finalmente, por carencia de respiradores, menos de 30% de los pacientes hipoxémicos pudieron recibir ventilación mecánica; por lo tanto, el criterio de PEEP ≥ 5 cmH2O tampoco era posible de aplicar. Además, por falta de camas, solo 30% de los pacientes con insuficiencia respiratoria aguda hipoxémica pudieron ser admitidos a la Unidad de Cuidados Intensivos (UCI); por lo tanto, pacientes con SDRA de menor gravedad posiblemente fueran subdiagnosticados. Estas profundas deficiencias en la provisión de cuidados críticos también se encuentran presentes en otras áreas de bajos recursos. Los investigadores propusieron entonces la definición de Kigali de SDRA como modificación de la definición de Berlín: (tabla 3)
- •
La PaO2/FiO2 ≤ 300 requerida para el diagnóstico de SDRA fue reemplazada por la SpO2/FiO2 ≤ 315, con base en la aceptable correlación lineal entre PaO2 y SpO2, siempre y cuando la SpO2 sea ≤ 97%, no existan anormalidades en la hemoglobina y el paciente presente perfusión periférica adecuada. La ecuación de Rice refleja esta relación:
SpO2 /FiO2 = 64 + 0·84 (PaO2/FiO2)20
Sin embargo, por encima del umbral de 97%, los cambios en la PaO2 generan un impacto mínimo en la SpO2, debido a la forma de la curva de disociación de la oxihemoglobina; por lo tanto, en la parte plana de la curva se pierde la correlación entre ambos métodos de evaluación de la oxigenación.
- •
Se incorporó a la ecografía pulmonar como método diagnóstico para la definición del síndrome, en ausencia de la posibilidad de efectuar Rx de tórax o TAC pulmonar.
Más allá de que estas variables no fueran anexadas en ese momento a la definición de Berlín como hubiera sido adecuado, lo ocurrido es una clara muestra de lo que sucede cuando los paneles de expertos no incorporan integrantes de todas las regiones del mundo. La definición de SDRA de Berlín, como la previa de la AECC, había sido diseñada por expertos de países de altos ingresos provenientes de Norteamérica y de Europa, sin intervención de expertos de países de medianos y bajos ingresos21.
La definición de Kigali además reflejó otro cambio reciente en referencia al diagnóstico de SDRA: la expansión de la ecografía como método diagnostico en la UCI, un método que posiblemente sea más confiable que la Rx de tórax en la evaluación de los infiltrados, siempre y cuando se efectúe por operadores entrenados22,23.
La pandemia por SARS-CoV-2 que asoló a la humanidad y que puso en máximo stress a los sistemas de salud, particularmente a las áreas críticas, también propició una reevaluación de la definición de SDRA. Miles de pacientes con insuficiencia respiratoria aguda hipoxémica secundaria a COVID-19 ingresaron simultáneamente a los hospitales en todo el mundo; alrededor de 15-20% presentaron enfermedad grave y 5% requirieron ingreso a la UCI24. Esto motivó la necesidad de monitoreo continuo de la oxigenación a pacientes que podrían rápidamente agravarse y requerir algún tipo de soporte respiratorio, desde oxigenoterapia hasta ventilación mecánica invasiva. De este modo, el monitoreo habitual de la PaO2/FiO2 con gasometría arterial, que es intermitente, laborioso, invasivo y que consume muchos recursos, fue reemplazado por la medición continua, no invasiva, y de menor costo de la SpO2, capaz de detectar los cambios rápidamente.
Asimismo, durante la pandemia se generalizó la utilización de la cánula nasal de alto flujo (CNAF), que ya constituía una alternativa no invasiva válida y de uso creciente en la insuficiencia respiratoria aguda hipoxémica25.
A raíz de estos cambios, en 2021, 54 años después de la publicación de Ashbaugh et al.7, se propuso una actualización de la definición de SDRA, que además fuera aplicable universalmente. Se planteó que debía evolucionarse desde los «consensos de expertos» previamente efectuados a la utilización de «un sistema científico de categorización», utilizando enfoques adoptados en otros campos del conocimiento para construir definiciones de síndromes (también llamados «constructos») para los que no existen gold standards26. Este es el caso del SDRA; pero la carencia de gold standards ocurre frecuentemente en medicina; por ejemplo, en los conocidos síndromes de colon irritable, fragilidad, e insuficiencia cardiaca, entre otros27.
Por estos motivos, para la construcción de la nueva definición global se siguió una metodología estricta aplicada en otras definiciones: descripción del fenómeno clínico (o síndrome, o «constructo») que se desea «capturar», justificación de los cambios que se proponen para una nueva definición, criterios explicitados sobre la elección del panel, que adicionalmente deberá reflejar diversidad de género, cultural, geográfica, socioeconómica y étnica, y la especificación del método con el que se llegará a los acuerdos: se definen cuando se logra una mayoría de al menos 70% en la votación de una variable para ser aceptada o rechazada.
Se propuso reevaluar el modelo conceptual de SDRA, en referencia al planteado en la definición de Berlín, y construir una nueva definición global de SDRA (tabla 4)28. Asimismo, se evaluó la factibilidad de la nueva definición global; es decir, que las variables que la compongan sean fácilmente medibles, tanto en situaciones clínicas como en la investigación, y que pudieran medirse en todo el mundo; y también su confiabilidad o reproducibilidad, o sea la capacidad de la definición de diagnosticar igualmente a un mismo paciente en distintos escenarios, y cuando es aplicada por distintos profesionales. Finalmente, se propuso analizar la validez de la nueva definición, o sea su capacidad para reflejar lo que los clínicos realmente buscan identificar. Dentro de estos conceptos se incluyen la validez de superficie, que es la capacidad de identificar las características que son obviamente parte del SDRA y en conjunto distinguen a los pacientes con SDRA de los que no lo presentan; y la validez predictiva, que se refiere a si la definición predice resultados, por ejemplo, mortalidad, que habitualmente es mayor en los pacientes con el síndrome en comparación con quienes no lo tienen29.
Criterios de diagnóstico para la nueva definición global de SDRA
| Modelo conceptual: El SDRA es una lesión pulmonar inflamatoria, difusa y aguda precipitada por un factor de riesgo predisponente, como neumonía, infección no pulmonar, traumatismo, transfusión, quemaduras, aspiración o shock. La lesión resultante conduce a un aumento de la permeabilidad vascular y epitelial pulmonar, edema pulmonar y atelectasia dependiente de la gravedad, todo lo cual contribuye a la pérdida de tejido pulmonar aireado. Las características clínicas son hipoxemia arterial y opacidades radiológicas difusas asociadas con un aumento del shunt, un aumento del espacio muerto alveolar y una disminución de la distensibilidad pulmonar. La presentación clínica está influenciada por el tratamiento médico (posición, sedación, parálisis, PEEP y el balance de líquidos). Los hallazgos histológicos varían y pueden incluir edema intraalveolar, inflamación, formación de membranas hialinas y hemorragia alveolar. | |||
| Criterios que se aplican a todas las categorías de SDRA | |||
| Factores de riesgo y origen del edema | Precipitado por un factor de riesgo predisponente agudo, como neumonía, infección no pulmonar, traumatismo, transfusión, aspiración o shock. El edema pulmonar no es atribuible exclusiva o principalmente al edema pulmonar cardiogénico/sobrecarga de líquidos, y la hipoxemia o anomalías del intercambio gaseoso no son atribuibles principalmente a la atelectasia. Sin embargo, el SDRA se puede diagnosticar en presencia de estas afecciones si también está presente un factor de riesgo predisponente al SDRA. | ||
| Tiempo | Inicio agudo o empeoramiento de la insuficiencia respiratoria hipoxémica dentro de la semana siguiente al inicio estimado del factor de riesgo predisponente o síntomas respiratorios nuevos o que empeoran. | ||
| Imagen de tórax | Opacidades bilaterales en la Rx de tórax y tomografía computarizada o líneas B bilaterales y/o consolidaciones en la ecografía que no se explican completamente por derrames, atelectasias o nódulos/masas. | ||
| Criterios que se aplican a categorías específicas de SDRA | |||
| Oxigenación | SDRA no intubado | SDRA intubado | Definición modificada para países con recursos limitados |
| PaO2/FiO2 ≤ 300 o SpO2/FiO2 ≤ 315 (si SpO2 <97%) en CNAF con flujo> 30 L/minoVNI/CPAP ≥ 5 cmH2O de PEEP | Leve:200 <PaO2/FiO2 ≤ 300 o235 <SpO2/FiO2 ≤ 315(si SpO2 <97%)Moderado:100 <PaO2/FiO2 ≤ 200 o148 <SpO2/FiO2 ≤ 235 (si SpO2 <97%)Grave:PaO2/FiO2 ≤ 100oSpO2/FiO2 ≤ 148(si SpO2 <97%) | SpO2/FiO2 ≤ 315(si SpO2 <97%)No se requiere PEEP ni un flujo mínimo de oxígeno para el diagnóstico en entornos con recursos limitados | |
*Tomado de Matthay et al. (2024)28.
Adicionalmente, se buscó que la nueva definición global de SDRA fuera refrendada por diferentes sociedades de cuidados críticos de todo el mundo. Después de un meticuloso proceso de revisión, se incorporaron las siguientes actualizaciones a la definición de consenso de Berlín.
La nueva definición global de SDRA28Modelo conceptualSe mantuvo el modelo conceptual presentado en la definición de Berlín1,2,4, y se agregó el concepto que la presentación clínica se puede encontrar muy influida por el tratamiento médico administrado: cambio en la posición, sedación, parálisis, PEEP y el balance de líquidos.
Momento del diagnóstico, factores de riesgo y factores extrapulmonaresEn cuanto al tiempo de inicio de la patología, y la exposición al factor de riesgo, se conservaron los siete días establecidos por los criterios de Berlín, al igual que en el modelo conceptual.
El SDRA es un edema inflamatorio por aumento de la permeabilidad, descartando factores cardiogénicos o sobrecarga hídrica. Sin embargo, el SDRA también se puede diagnosticar en presencia de estas afecciones si se identifica un factor de riesgo predisponente al SDRA y si se considera que los factores hidrostáticos no son la causa principal de la hipoxemia.
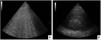
Imágenes de tóraxEl criterio imagenológico debe incluir infiltrados bilaterales en las Rx o TAC de tórax. Adicionalmente, en esta actualización se incorpora la ecografía pulmonar (evidencia de líneas B o consolidación (fig. 2 A y B). Cualquiera sea la modalidad empleada, debe sugerir pérdida de la aireación no totalmente explicada por colapso lobar, nódulos pulmonares o derrame pleural.
La Rx de tórax es la modalidad más ampliamente utilizada en pacientes críticos. No obstante, una de sus limitaciones es la alta variabilidad para identificar las opacidades bilaterales entre distintos evaluadores. De hecho, esta característica fue demostrada cuando una misma Rx de tórax fue revisada por investigadores expertos en el área de ventilación mecánica y SDRA30. Recientemente, un estudio evidenció una mejora en la interpretación de la Rx de tórax utilizando el score radiographic assessment of lung edema (RALE). Esta herramienta cuantifica el número de cuadrantes afectados en cada hemitórax en 0-4 puntos, junto con la densidad radiográfica de cada cuadrante, asignándole 1 a 3 puntos. Se demostró que su aplicación presentaba gran concordancia interobservador (r=0,83 [0,8 – 0,85], p <0,0001 para 488 estudios). El RALE, además, se correlacionó con la concentración de biomarcadores y con la evolución a ventilación mecánica prolongada31.
Para la nueva definición global de SDRA se incorporó a la ecografía para detectar la pérdida de aireación, en especial cuando no se encuentra disponible la Rx de tórax o la TAC. La ecografía pulmonar es especialmente útil cuando el operador se encuentra capacitado para la detección de consolidaciones bilaterales y edema pulmonar no cardiogénico, que es lo sugerido por esta definición. En el caso de la definición modificada para países con recursos escasos, la falta de pericia del operador podría conducir al aumento del sobrediagnóstico del SDRA, ya que se elimina la PEEP como criterio diagnóstico.
Si bien el uso de la ecografía pulmonar para este fin podría ser cuestionado, existe evidencia que la sustenta como un muy buen complemento para el diagnóstico imagenológico de SDRA32. Por otro lado, en un estudio muy reciente, se evalúo el score de edema pulmonar (LUS) para el diagnóstico de SDRA. En este estudio multicéntrico se demostró, a través de un modelo luego aplicado exitosamente a una cohorte de validación, que posee una muy buena capacidad diagnóstica, y que podría detectar el SDRA correctamente con un rendimiento comparable a evaluadores expertos de imágenes, e incluso con mayor precisión diagnóstica. Si bien se requiere validación en un mayor número de pacientes, representa un excelente punto de partida23.
OxigenaciónUna de las mayores innovaciones del reciente consenso fue la creación de tres categorías nuevas de SDRA con el objetivo de ampliar la definición preexistente. Así, se establecieron tres grupos:
- •
SDRA en pacientes no intubados.
- •
SDRA en pacientes intubados.
- •
Categoría modificada de SDRA para entornos con recursos limitados.
Dentro de la categoría de pacientes no intubados se incorpora a los pacientes con VNI (que ya se incluían en los criterios de Berlín) y CNAF. Además, se generó la tercera categoría para garantizar que la definición alcance a los lugares con escasez de recursos. Para eso, se tomó como referencia la propuesta de modificación de Kigali para los entornos en que no se dispone de métodos diagnósticos ni de dispositivos avanzados de soporte ventilatorio.
Esta flexibilización de los criterios presenta beneficios y desventajas. Por ejemplo, es posible efectuar el diagnóstico de SDRA más precozmente, desde el momento que el paciente se encuentra recibiendo soporte con CNAF. Esto permite la implementación temprana de distintos tratamientos, que en ocasiones hasta pueden evitar la progresión a la ventilación mecánica invasiva33.
Hay algunas consideraciones especiales a tener en cuenta con la CNAF. Con respecto a la FiO2 proporcionada existe una relación entre el flujo programado en el dispositivo de CNAF y el flujo inspiratorio tidal del paciente que puede impactar en la FiO2 entregada y provocar errores en el cálculo de la PaO2/FiO234. Por otro lado, la inclusión de la CNAF en el diagnóstico de SDRA podría ser cuestionada por su capacidad de generar presión. En la Nueva Definición de SDRA los autores asumen que 30 L/m de flujo logran alcanzar 5 cmH2O de PEEP; sin embargo, la presión generada en la vía aérea por el uso de CNAF estará determinada por el flujo programado y por otros factores tales como la distensibilidad del sistema respiratorio o la condición de la boca (abierta o cerrada)33, lo que también podría conducir a errores de interpretación. Sin embargo, es destacable que los pacientes con hipoxemia severa (SDRA) que reciben CNAF continúan cumpliendo criterios de SDRA luego de haber sido intubados, aunque podrían ser considerados como SDRA menos graves34,35.
En cuanto a la evaluación de la gravedad, el gold standard es la utilización de la gasometría arterial para conocer PaO2. Sin embargo, como se ha comentado, la amplia utilización de la SpO2 y del índice SpO2/FiO2 ha demostrado ser una alternativa válida para el diagnóstico, identificando características clínicas y resultados muy similares entre pacientes con ARDS diagnosticados por medio de SpO2/FiO2 o de PaO2/FiO236. Aunque el valor absoluto de la SpO2 puede diferir respecto al de la saturación arterial de oxígeno (medida en forma invasiva), la buena correlación entre ambas y con la PaO2, ya comentada, han propiciado la adopción universal de la medición continua de la SpO2, y su incorporación a la nueva definición global de SDRA como standard de cuidado. Asimismo, se han incluido los puntos de corte de la SpO2/FiO2 para el SDRA leve, moderado y grave20,37,38.
Por los argumentos expuestos, el comité acordó permitir el uso de la SpO2/FiO2 como alternativa a la PaO2/FiO2 para el diagnóstico de SDRA. Además, si bien la SpO2/FiO2 presenta un buen rendimiento para evaluar la oxigenación, es importante tener presente que si bien la sensibilidad y la especificidad de la SpO2/FiO2 para el diagnóstico de SDRA según la definición de Consenso Americano-Europeo son buenas (alrededor de 85% para ambos), la especificidad cae marcadamente (56%) con valores de PaO2/FiO2 entre 300 y 20020. Además, cabe considerar los dispositivos que se emplean para la medición de la SpO2 (oxímetros de pulso digitales) presentan un margen de error considerable, lo cual expone a potenciales diagnósticos erróneos38,39.
Al sopesar todos los beneficios y limitaciones enumeradas, el comité consideró que la fácil disponibilidad de la oximetría de pulso en todos los entornos sanitarios era superior a la desventaja de pasar por alto la hipoxemia o categorizarla erróneamente en algunos pacientes. Además, el efecto global será el aumento de la equidad en salud en entornos en los que actualmente el SDRA se encuentra subdiagnosticado.
La nueva definición global de SDRA influirá notoriamente en los estudios epidemiológicos y en los ensayos clínicos de intervención, ya que, al presentar un alcance global, se podrán conocer datos adicionales sobre los factores de riesgo, el curso de la enfermedad, y los resultados de los distintos tratamientos en poblaciones diferentes. Sin embargo, es posible que la definición modificada para regiones de bajos recursos presente un aumento de sensibilidad diagnóstica, ya que podrían diagnosticarse como SDRA, por ejemplo, pacientes con atelectasias29. La incorporación de pacientes no intubados también favorece la heterogeneidad de la población diagnosticada como SDRA, pero permitiría, como ya se ha comentado, efectuar un diagnóstico precoz y por lo tanto una rápida iniciación de distintos tratamientos. En un futuro, la identificación de distintos subfenotipos de SDRA (subgrupos distintos de pacientes que pueden ser discriminados de manera confiable de otros subgrupos, con base en un patrón de propiedades medibles) podrá reducir el impacto de la heterogeneidad sobre los efectos clínicos, fisiológicos o biológicos de cualquier tratamiento40.
Temas que no se incluyeron en la nueva definición globalExisten varios temas que podrían haber sido considerados en la nueva definición global. Por ejemplo, discutir sobre el enriquecimiento pronóstico mediante estrategias que optimicen validez y aplicabilidad de los resultados obtenidos en los ensayos clínicos sobre el SDRA. En este sentido, la adopción de criterios de inclusión más estrictos, como limitar la participación en estudios a pacientes intubados con SDRA moderado a grave, o a los que cumplan con la definición de SDRA con un valor programado de PEEP de 10 cmH2O, podría identificar subgrupos de pacientes más homogéneos. A su vez, se lograría mejorar la comprensión de la variabilidad clínica y facilitar una interpretación más precisa de los resultados, permitiendo una extrapolación más fiable de los hallazgos a la práctica clínica.
Otro aspecto que no se trató es cómo considerar a los infiltrados unilaterales en la Rx de tórax. En la práctica clínica, constituyen una condición excluyente de SDRA, lo que puede llevar a la falta de aplicación de estrategias de ventilación protectora14. Sin embargo, es conocido que la evaluación de la Rx de tórax es propensass a sesgos y limitaciones, ya que los infiltrados bilaterales pueden pasar desapercibidos, especialmente cuando son tomadas con los equipos habitualmente utilizados en las UCI y en pacientes con enfermedades pulmonares preexistentes41. Otro concepto erróneo común es que los pacientes con infiltrados unilaterales y necesidad de ventilación mecánica presentan una mejor oxigenación y menor mortalidad en comparación con aquellos con infiltrados bilaterales y SDRA42. Un análisis de datos del estudio LUNG SAFE revela que, aunque los pacientes con infiltrados unilaterales presentan una menor gravedad inicial, la mortalidad no difiere significativamente de la de los pacientes con SDRA. Además, existen variables de monitoreo ventilatorio como la presión inspiratoria (driving pressure) que actúan como factor de riesgo importante para desarrollar SDRA en pacientes con infiltrados unilaterales, resaltando la importancia de estrategias de ventilación protectora en esta población43.
Por otro lado, algunos temas continúan siendo debatidos. Los investigadores podrían optar por centrarse en los sujetos con SDRA que continúan cumpliendo la definición más allá de las 24 horas si desean excluir los que mejoran rápidamente o por otorgarles un periodo de estabilización tal como lo propone Guerin en su estudio PROSEVA, logrando subgrupos más homogéneos en la evaluación de una respuesta a una maniobra terapéutica44–46. Otras subcategorías de SDRA (subgrupos y subfenotipos) no integradas en la definición actual han sido propuestas para determinar si existen distintas respuestas a los tratamientos, que incluyen el uso de biomarcadores, la distribución de las imágenes (focales o difusas), el potencial de reclutamiento y su variabilidad o incluso variables fisiológicas como la presión inspiratoria, el comportamiento de la elasticidad, o el ventilatory ratio47–53.
Consideraciones finalesLa nueva definición global de SDRA constituye una extensión de la definición de Berlín en aspectos referidos al diagnóstico y al monitoreo de la enfermedad. La categoría de pacientes intubados preserva los puntos de corte de gravedad de PaO2/FiO2 descritos anteriormente, pero permite el uso de SpO2/FiO2 en situaciones en que la gasometría arterial no se encuentra disponible. Dos innovaciones relevantes son las dos nuevas categorías que se suman: el SDRA en pacientes no intubados y el SDRA en pacientes asistidos en regiones con escasos recursos sanitarios, destacando especialmente que las modificaciones diagnósticas propuestas para la definición en estas regiones se aplican solo en ellas. Se recomienda que los investigadores continúen reportando sus datos con base en la definición de Berlín, cuando sea posible. Todavía es incierto el impacto epidemiológico de la definición modificada para zonas de escasos recursos. Mirando hacia el futuro, existe gran expectativa en que la identificación de subfenotipos de SDRA podrá facilitar la evaluación de la respuesta a distintos tratamientos y el desarrollo de tratamientos personalizados.
FinanciaciónNinguna.
Conflicto de interesesGustavo A. Plotnikow ha recibido financiación para programas de enseñanza por parte de Medtronic LATAM y Vapotherm Inc. USA.
A Emiliano Descotte del Hospital Británico de Buenos Aires por su aporte desinteresado con las imágenes de ecografía.