INTRODUCCIÓN
La insuficiencia hepática aguda (IHA) es un cuadro de elevada gravedad que requiere el ingreso en una unidad de cuidados intensivos, donde aplicaremos tan sólo una terapia de soporte con un elevado coste y poca efectividad. El único tratamiento con una efectividad real es el trasplante hepático (TOH), finalmente requerido por un elevado porcentaje de pacientes. En los pacientes en que no se llega a recibir un órgano, la mortalidad llega al 80%1.
La reagudización de la hepatopatía crónica representa, a su vez, un problema serio en términos de incidencia y coste y, dado que en esta situación no se puede esperar la recuperación del órgano nativo, una vez más es necesario el TOH como único tratamiento eficaz, con el agravante de tener que decidir qué paciente será subsidiario de éste y, sobre todo, "cómo mantenerlo en condiciones idóneas hasta su realización"2.
Por tanto, es necesario disponer de un soporte que permita mantener al paciente en buenas condiciones hasta que haya disponibilidad de un órgano o incluso (gracias a la teórica estabilidad proporcionada por el soporte artificial) se recupere la función del hígado nativo (obviando la necesidad del trasplante y de la inmunodepresión crónica).
El éxito conseguido con el soporte artificial de diferentes órganos durante los últimos 50 años ha estimulado el uso de estas técnicas en el fallo hepático grave, y hay experiencias publicadas desde hace más de 40 años. Sin embargo, en esta afección no se han conseguido los espectaculares resultados registrados en otros campos. La explicación puede encontrarse en la complejidad de la función hepática, que comprende funciones de detoxificación (amonio, metabolismo de alcohol o fármacos, etc.) junto con funciones de metabolismo y síntesis (proteínas, bilis o factores de coagulación), que dificultan el diseño de cualquier sistema que aspire a realizar la suplencia completa del órgano.
Esta doble vertiente explica la existencia de 2 planteamientos de asistencia extracorpórea hepática (AEH): los sistemas de detoxificación (artificiales) y los de síntesis (bioartificiales). El primer grupo se basa en la experiencia acumulada en otras afecciones en la depuración a través de membranas biocompatibles mediante mecanismos de diálisis, filtración o adsorción; el segundo se basa en el uso de órganos o hepatocitos aislados, tanto de origen humano como animal3.
SISTEMAS BIOARTIFICIALES DE ASISTENCIA EXTRACORPÓREA HEPÁTICA
Podemos considerar el hígado como un biorreactor y no un órgano eminentemente excretor. Este planteamiento ha desplazado el interés de los sistemas de purificación hacia aquellos orientados a realizar un soporte metabólico2. Bajo este concepto, se han desarrollado distintos sistemas basados en el uso de hepatocitos para suplir la función deteriorada de las células nativas, cuyas posibilidades clínicas se conocen desde hace varias décadas4-6.
Inicialmente se usaron órganos de animales perfundidos con la sangre de los pacientes, pero la respuesta inmunológica generada por éstos hace poco viable esta alternativa7, por lo que posteriormente (asumiendo que el hepatocito es el principal responsable de la función hepática y que su uso aislado despertará una respuesta inmunológica menos agresiva que la del órgano completo) se ha desarrollado un concepto diferente, el de biorreactor (introducción de una cantidad suficiente de hepatocitos viables en una estructura artificial fabricada a partir de membranas biocompatibles dispuestas en capilar que conforman un circuito extracorpóreo por el que se hará circular la sangre o el plasma del paciente).
Para el diseño de estos biorreactores hay 2 alternativas: hepatocitos aislados a partir de hígados viables o líneas celulares clonadas.
En el primer grupo se encuentra el sistema desarrollado por Demetriou et al (hígado bioartificial [BAL]), basado en el uso de hepatocitos porcinos adheridos a microtransportadores8. Un importante inconveniente de este sistema se debe al hecho de que los hepatocitos no se dividen en cultivos artificiales, lo que significa que para cada biorreactor es necesario recolectar la cantidad total de células necesarias (con las dificultades de infraestructura y coste que esto supone) y, además, la viabilidad celular es limitada, por lo que estos reactores no pueden ser usados durante períodos prolongados (usualmente de 6 a 8 h)9. A su favor cuenta el hecho de que las células pueden ser criopreservadas, con lo que se puede disponer de una cantidad suficiente de éstas y preparar el biorreactor en el momento de su uso. Sin embargo, el principal problema de este sistema no es la exigencia de una infraestructura y una capacidad tecnológicas avanzadas, ni la dificultad de contar con suficientes órganos que proporcionen un volumen adecuado de células, sino el riesgo potencial de transmisión de enfermedades virales. Actualmente, en la Comunidad Europea hay una moratoria para su uso en tanto se demuestra su seguridad10.
El uso de líneas celulares clonadas es la alternativa lógica a estos problemas. El desarrollo por Kelly y Darlington11 de una línea celular (C3A) a partir de células tumorales humanas (con funcionalidad normal demostrada mediante generación de urea, glutamina o síntesis de factores de la coagulación y capacidad para multiplicarse en cultivo) ha permitido el desarrollo de un sistema basado en éstas (extracorporeal liver assist device [ELAD])6,12,13. El hecho de que estas células se multipliquen permite inyectar una baja cantidad de éstas en el reactor y cultivarlas posteriormente hasta conseguir el número de hepatocitos adecuado (prolongando, además, la vida útil de cada biorreactor). Como inconveniente podemos citar el hecho de que estas células no pueden ser preservadas, por lo que es necesario mantener siempre un número de reactores con células en crecimiento para poder realizar el tratamiento en el momento adecuado.
Independientemente del origen de los hepatocitos, hay aspectos técnicos de aparente menor complejidad pero que suponen una dificultad adicional para el uso de estos tratamientos. Debe existir un suministro de oxígeno y glucosa suficiente para cubrir las demandas metabólicas de las células, lo que supone añadir al sistema un oxigenador extracorpóreo y sistemas de control del aporte y el consumo de ambos nutrientes. Es necesario prever la eliminación de productos metabólicos de desecho mediante la adición de un sistema de detoxificación (uno de los principales inconvenientes de los sistemas bioartificiales es su escasa capacidad de detoxificación). La depuración puede realizarse sobre la sangre del paciente o bien sobre el plasma (lo que implica la existencia de un sistema de separación de plasma que aumenta aún más las demandas tecnológicas y de entrenamiento de la técnica)14.
Por último, queda por definir la masa celular necesaria para producir un biorreactor. La biopsia de pacientes con fracaso hepático demuestra que cuando la necrosis excede del 70% del órgano, el cuadro suele ser fatal15. Este dato nos permite suponer que se precisarán alrededor de 400 g de hepatocitos viables para lograr un sistema eficaz.
SISTEMAS ARTIFICIALES DE ASISTENCIA EXTRACORPÓREA HEPÁTICA (DETOXIFICACIÓN)
Dada la complejidad de los sistemas de suplencia hepática, no es de extrañar que exista un interés mantenido por el uso de sistemas de detoxificación artificiales, ya que si se demuestra un efecto positivo con estos tratamientos dispondremos de un sistema sencillo, relativamente barato y asequible a casi cualquier nivel asistencial para estabilizar a los pacientes con fallo hepático hasta la llegada del tratamiento definitivo.
Tras el fallo hepático se acumula en el organismo una amplia gama de sustancias tóxicas, entre las que destacan las sustancias liposolubles que circulan unidas a proteínas. Mediante estas técnicas se pretende eliminar aquellas sustancias a las que se les atribuyen efectos clínicos en el cuadro de fallo hepático (encefalopatía, fracaso hemodinámico o renal e, incluso, empeoramiento progresivo de la función hepática, generando un círculo vicioso que hace difícil el control del paciente; tabla 1)16 y, por tanto, no se trata de una suplencia hepática real, ya que no disponemos de función de síntesis, pero presentan algunas características que las hacen interesantes, como el ser conceptualmente simples, fáciles de usar por personal entrenado y seguras para el paciente17.
Se han realizado tratamientos mediante hemodiálisis intermitente (HDI), diálisis peritoneal, plasmaféresis, hemoadsorción y hemofiltración o hemodiálisis continua (TCRR) con resultados poco valorables18 y, en general, buscando el control de las complicaciones renales secundarias al fallo hepático (en la mayor parte de los casos en referencia al síndrome hepatorrenal [SHR])19.
La HDI es eficaz para eliminar sustancias hidrosolubles de muy pequeño tamaño (hasta 2.000 D) y, por tanto, no parece adecuada en este contexto, aunque se ha apuntado un posible efecto beneficioso de la diálisis peritoneal20, no confirmado en estudios posteriores19.
Las TCRR (basadas en la eliminación por convección y la diálisis lenta) amplían el espectro de eliminación al abarcar moléculas de mediano tamaño molecular (hasta 30 kD según la membrana usada)21 lo que, junto a su mayor tolerancia hemodinámica22, sus efectos beneficiosos sobre la presión intracraneal23 y la posibilidad de eliminar mediadores proinflamatorios24 las convierte en la técnica de suplencia renal de elección en estos pacientes (debemos considerar contraindicada la HDI en pacientes con signos de edema cerebral). También se dispone de experiencia sobre su uso durante la cirugía del TOH, con buenos resultados25. Dado el espectro de eliminación que comprende moléculas de tamaño molecular medio (amonio, lactato, ácido gammaaminobutírico [GABA] o octopamida, así como citocinas proinflamatorias)26, podemos esperar un efecto beneficioso sobre el cuadro clínico de la insuficiencia hepática.
La plasmaféresis es una alternativa interesante al facilitar la eliminación de sustancias presentes en el plasma y adheridas a proteínas (un espectro de eliminación diferente del de los tratamientos mencionados previamente), pero su potencial teórico no ha sido confirmado por la experiencia clínica27. Con similar planteamiento teórico, las técnicas basadas en la adsorción también han despertado interés, pero sin resultados clínicos aceptables (y con una elevada incidencia de complicaciones)28,29.
La ampliación del espectro de eliminación de estos tratamientos es una razonable y prometedora vía para el futuro. Realizar simultáneamente la plasmaféresis y un tratamiento mediante TCRR puede mejorar la situación neurológica de los pacientes e incluso se ha señalado un posible efecto positivo sobre la supervivencia30. El uso simultáneo de plasmaféresis y adsorción (con un rango de eliminación superior incluso al de la diálisis con albúmina) ha mostrado eficacia en estudios preliminares, tanto en pacientes sépticos como con fracaso hepático grave31,32.
Dado que la albúmina es la proteína transportadora más importante en el plasma y se ha relacionado, entre otros, con el transporte de bilirrubina, aminoácidos aromáticos, cobre o ácidos biliares (que han demostrado ser tóxicos mediante la estimulación de la apoptosis en astrocitos y hepatocitos), el concepto de "diálisis con albúmina" emerge como un concepto prometedor, ya que permite eliminar los compuestos adheridos a la albúmina y amplía así el rango de eliminación de los sistemas mencionados33. Ash et al34 han demostrado su eficacia, tanto en la eliminación de toxinas hepáticas como en la mejora clínica de pacientes con SHR o elevación de la presión intracraneal35.
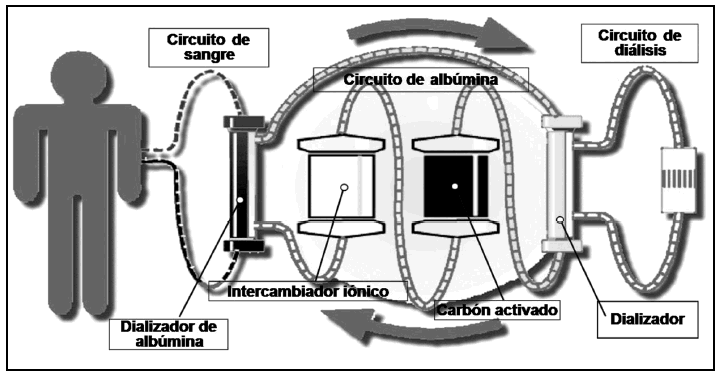
Sin embargo, esta técnica basada en el uso de albúmina en un solo paso implica un consumo muy elevado de ésta y, por tanto, un alto coste. Recientemente se ha desarrollado un sistema que permite reutilizar la albúmina para su uso continuo, con lo que es posible realizar tratamientos prolongados con un coste más contenido, el Molecular Adsorbent Recuirculating System (MARS®; fig. 1). Este sistema se basa en realizar la depuración mediante un dializador que contiene albúmina humana al 20% y que se encuentra incluido en un circuito cerrado con una capacidad total de 600 ml e incorporado a un monitor específico (MARS®, Teraklin). La albúmina de este circuito es puesta en contacto contracorriente con la sangre del paciente a través de una membrana de polisulfona de alto flujo logrando, por una parte, la depuración de sustancias dializables mediante extracción al solvente y, por otra, el paso de las sustancias vehiculadas por la albúmina del paciente a la albúmina del dializador, dado que el gran tamaño de poro de esta membrana posibilita una aproximación entre las moléculas en ambos compartimentos. Con posterioridad, la albúmina es regenerada mediante su paso a través de una columna con carbón activo y una segunda columna con una resina de intercambio aniónico, de forma que las sustancias absorbidas en la proteína son retenidas en estos filtros haciendo que se recupere la capacidad de detoxificación, en tanto que el solvente es regenerado mediante su paso a través de un sistema de diálisis habitual para eliminar las moléculas hidrosolubles de pequeño tamaño (amonio, urea, creatinina, etc.) extraídas al paciente. Por este medio se logra el reciclado de la solución y, por tanto, restringir el consumo total de albúmina por sesión a los 600 ml que contiene el sistema.
Figura 1. Diagrama del sistema de diálisis con albúmina mediante regeneración del dializador. Sistema MARS®.
Una ventaja adicional de este sistema sobre la diálisis con albúmina en un solo paso radica en la posibilidad de eliminar los estabilizantes incluidos en las soluciones comerciales de albúmina humana36.
La sencillez de su utilización y los resultados obtenidos hasta el momento con su uso hacen del tratamiento con MARS® la alternativa más prometedora en el campo de la detoxificación hepática y la única que en la actualidad puede considerarse una realidad para la práctica clínica.
EXPERIENCIA CLÍNICA CON LOS SISTEMAS BIOARTIFICIALES DE ASISTENCIA EXTRACORPÓREA HEPÁTICA
El sistema ELAD se probó inicialmente en 10 pacientes con IHA, en los que se demostró su viabilidad pero escaso beneficio clínico. Con posterioridad se realizó un ensayo controlado sobre 24 pacientes (12 casos y 12 controles) que mostró tan sólo cierta mejora en los parámetros de coagulación y en un paciente un descenso de la presión intracraneal, pero ningún resultado significativo37,38. Se ha demostrado la regeneración del hígado nativo (aumento de su tamaño y aumento de los valores de α-fetoproteína) en pacientes tratados con este sistema6. Recientemente, Millis et al39 han publicado su experiencia con el uso como puente hasta el trasplante en 5 pacientes con fallo hepático fulminante, pero su estudio se centra en los aspectos técnicos del biorreactor y en su seguridad y no ha demostrando un beneficio clínico (auque todos ellos recibieron un órgano y sólo un paciente había fallecido a los 30 días de su inclusión en el estudio)39. El sistema BAL ha sido probado en varios trabajos también con resultados irregulares (sobre todo, mejoría de la presión intracraneal en pacientes hepatectomizados en puente a TOH) y, curiosamente, ausencia de mejora en los parámetros de síntesis hepática9,40-42.
CARACTERÍSTICAS DEPURATIVAS Y RESPUESTA CLÍNICA AL USO DEL SISTEMA MARS®
Este tratamiento ha mostrado su eficacia en la detoxificación de moléculas unidas a la albúmina16: disminución media de las cifras de bilirrubina sérica de 18% y de ácidos biliares del 44%43, normalización del balance entre aminoácidos de cadena ramificada y aromáticos, y disminución de los valores de triptófano en suero de pacientes con IHA44. El uso adicional de una TCRR permite controlar de manera adecuada la función renal en estos pacientes45,46, aunque este aspecto, lógicamente, dependerá de la dosis de depuración renal administrada y no puede considerarse un efecto beneficioso específico de este tratamiento.
Dado que la eficacia del tratamiento difiere según los pacientes, para valorar a priori su efectividad podemos calcular el cociente molar de bilirrubina (total y conjugada) respecto de la albúmina sérica: un cociente menor de 8 permite predecir poca eficacia del tratamiento. Este dato nos permite presuponer, además, que la infusión de albúmina previa al tratamiento reducirá la eficacia de éste47.
Desde el punto de vista clínico, la experiencia comunicada, aunque basada en series reducidas de casos o en comunicaciones clínicas aisladas, muestra de forma consistente una mejoría de las funciones renal y cardiovascular, así como del grado de encefalopatía, tanto en pacientes agudos como con enfermedad crónica agudizada48-52.
Por último, se trata de una técnica muy bien tolerada35, incluso por los pacientes más graves, con estabilidad hemodinámica (e incluso mejoría)53 y con un número muy bajo de complicaciones, aunque se ha descrito un descenso del recuento de plaquetas y un alargamiento del tiempo de protrombina al inicio de la terapia43 que podrían condicionar la aparición de complicaciones hemorrágicas54. También se ha demostrado su seguridad en pacientes pediátricos55.
Pese a que, dadas sus características, no debemos esperar una mejoría de los parámetros clínicos y analíticos dependientes del fracaso de la función de síntesis, Awad et al35 han comunicado una mejoría de los parámetros de coagulación tras el uso de este tratamiento, que explican por la disminución del efecto tóxico de la bilirrubina sobre la función hepática o la eliminación de carga metabólica sobre el hígado insuficiente, con una mejoría indirecta de su función35.
INDICACIONES ACTUALES Y FUTURAS DEL MARS®
El planteamiento inicial para el uso de la AEH es estabilizar al paciente y detener su deterioro el tiempo suficiente para realizar un tratamiento definitivo (en realidad, TOH), pero dados los alentadores resultados publicados en las primeras series, la lista de indicaciones se va ampliando de forma progresiva.
Podemos considerar que las indicaciones principales son el fallo hepático con encefalopatía hepática o con SHR, ya que en estos pacientes el beneficio se mantiene en las distintas series publicadas54; no obstante, existen datos aislados de tratamientos o series reducidas de pacientes con enfermedad hepática aguda grave con resultados alentadores, como fallo hepático agudo56, pacientes trasplantados con fallo primario del injerto para suplir el hígado no funcionante hasta la recepción de un nuevo órgano, o ante la posibilidad de mantener al paciente durante la fase anhepática si es necesaria la extracción prematura del injerto fracasado57 o en pacientes con fallo hepático tras cirugía de resección amplia58, aunque por el momento no disponemos de estudios controlados que aporten evidencias para su uso en ninguna de estas indicaciones.
En referencia a los pacientes con hepatopatía crónica, se dispone de una experiencia más amplia, pero aún insuficiente (con frecuencia casos clínicos aislados), que sugiere un efecto beneficioso de la diálisis con albúmina en el control del medio interno y disminución del grado de encefalopatía54,59. Hasta el momento se dispone de datos aislados en el tratamiento de pacientes con descompensación de cirrosis hepática60, cirrosis biliar primaria61, colestasis familiar62, enfermedad de Wilson (se ha comunicado su eficacia como puente hasta el trasplante en casos aislados y se ha demostrado la eliminación de cobre mediante este tratamiento)63 o agudización de la hepatitis alcohólica o viral16,49,64. Por último, se ha usado (una vez más, sólo se han comunicado series de casos) con buen resultado aparente en el paciente con prurito intratable65.
Su utilidad podría ampliarse en el futuro con indicaciones diferentes. En un estudio realizado en pacientes con síndrome de distrés respiratorio agudo severo tratados con ECMO, Peek et al detectaron que la bilirrubina elevada era un marcador muy específico de mortalidad, por lo que posteriormente realizaron tratamiento con MARS® en un número reducido de pacientes de similares características, y encontraron una supervivencia superior a la esperada66. También puede ser más efectivo que la hemofiltración aislada para eliminar mediadores inflamatorios67.
Aún no disponemos de criterios que permitan decidir el momento de inicio del tratamiento; sin embargo, considerando los datos mencionados acerca del cociente bilirrubina/albúmina, podríamos considerar que no está indicado en pacientes con un índice MELD (Model for End-Stage Liver Disease) menor de 1047.
IMPACTO SOBRE LA MORTALIDAD
La experiencia acumulada con los AEH nos permite afirmar que pueden estabilizar la función hepática, e incluso se ha indicado que podrían mejorar la supervivencia de los pacientes con fallo hepático agudo o agudización de la hepatopatía crónica (aunque no hay evidencias a este respecto)65. No obstante, no hay trabajos comparativos de la eficacia de los distintos sistemas de AEH.
Respecto de los sistemas biológicos, las experiencias comunicadas sugieren que la AEH con hepatocitos porcinos no supone una mejoría en el tratamiento intensivo actual, pero el uso de hepatocitos humanos sí podría suponer un medio adecuado de soporte temporal68.
Respecto a la diálisis con albúmina, aunque la mejoría bioquímica obtenida con este tratamiento parece evidente, su impacto sobre la mortalidad está aún por determinar52,58. Hay un registro internacional de datos de tratamientos con sistema MARS® realizados en diferentes países en el que hasta 2002 se había incluido a 176 pacientes (agudización de hepatopatía crónica del 56%, fallo hepático agudo del 22%, fallo primario de injerto del 15%, fallo hepático tras hepatectomía amplia del 4% y un grupo variado del 3%). Los datos que se derivan de este registro sugieren una mejoría evidente de la encefalopatía y la hemodinámica, así como de las cifras de bilirrubina, creatinina, urea, albúmina, INR y amonio (así como de la puntuación MELD) y la posibilidad de una mayor supervivencia51.
Sin embargo, por el momento sólo se han publicado 3 trabajos con efectos positivos en la supervivencia. En un estudio realizado en 2 centros en 26 pacientes con hepatopatía crónica, Stange et al69 encontraron una supervivencia del 100% en pacientes en escala UNOS (United Network for Organ Sharing) 2b y 44% en pacientes en escala 2a. En un ensayo prospectivo realizado por Mitzner et al46 en 13 pacientes con SHR tipo I, la mortalidad fue del 100% en el grupo control y de 62,5% al séptimo día, y de 75% el día 30 en pacientes tratados con MARS® (p < 0,01). Por último, en un estudio controlado reciente realizado en 24 pacientes con descompensación de cirrosis y bilirrubina superior a 20 mg/dl, Heemann et al han demostrado (junto a una mejoría de los marcadores bioquímicos y clínicos de función hepática) una reducción de la mortalidad a los 30 días (11/12 frente a 6/12 en el grupo control; p < 0,05). La baja muestra de este estudio se debió a una finalización precoz aconsejada por el comité ético encargado de su supervisión, dados los favorables resultados obtenidos. Otro dato marginal interesante de este estudio es que sólo desarrolló disfunción renal el 8% del grupo tratado frente al 58% del grupo control60. Actualmente están en marcha 2 estudios multicéntricos que podrían aportar la evidencia necesaria para avalar estos buenos resultados preliminares.
CONCLUSIÓN
Los sistemas biológicos de AEH basados en biorreactores se encuentran ya en fase de ensayo clínico, pero su sofisticación y las exigencias tecnológicas los alejan por el momento de la mayoría de los centros; asimismo, aún hay muchos interrogantes pendientes de respuesta antes de que su uso se extienda a la práctica clínica.
Los sistemas de detoxificación basados en la combinación de TCRR y plasmaféresis o adsorción parecen llenar un escalón intermedio entre la suplencia ideal y la realidad clínica al permitir, sin grandes exigencias tecnológicas, estabilizar a estos pacientes e, incluso, mejorar en cierto grado la función de su hígado nativo, dotándonos de tiempo para alcanzar el trasplante o la recuperación. Un beneficio adicional de estos tratamientos es la posibilidad de eliminar mediadores proinflamatorios67, en tanto que los sistemas biológicos pueden, de hecho, aumentar sus valores70. Dentro de este grupo, la diálisis con albúmina constituye la opción más interesante; el sistema MARS® proporciona estabilidad clínica en el paciente con IHA o hepatopatía crónica y, dado su excelente perfil de seguridad y su sencillez de aplicación (que lo ponen a disposición de cualquier unidad de cuidados intensivos con experiencia en técnicas de depuración extrarrenal), es el medio AEH más usado en la actualidad.
Dado que los resultados obtenidos en términos de mortalidad no son espectaculares, la detoxificación por sí sola puede ser insuficiente y la suplencia de la función biológica debe también ser considerada. Por tanto, la tendencia en el futuro deberá orientarse a unir ambas aproximaciones en un único tratamiento que combine los beneficios de ambos sistemas, compensando la pérdida de función metabólica y de detoxificación, y que permita, mediante un diseño modular, aplicar la suplencia biológica aislada o añadir un componente de detoxificación u otro de suplencia renal cuando sea necesario, según las características de cada paciente71,72.