Analizar la supervivencia y el pronóstico neurológico a corto y medio plazo de los pacientes atendidos en nuestro hospital tras sufrir una parada cardiorrespiratoria (PCR) extrahospitalaria secundaria a un ritmo desfibrilable y tratados con hipotermia terapéutica moderada (HTM).
DiseñoEstudio prospectivo, observacional desde el 1 de enero de 2010 al 31 de diciembre de 2012, con un seguimiento de 6meses.
ÁmbitoHospital de tercer nivel.
PacientesPacientes que sufrieron una PCR extrahospitalaria secundaria a ritmos desfibrilables. Criterios de exclusión: ritmos no desfibrilables, maniobras de reanimación >45min sin recuperación de pulso, shock séptico, coagulopatía previa, enfermedad terminal u orden de limitación del esfuerzo terapéutico.
IntervenciónHipotermia moderada (33°C) y cuidados postresucitación según protocolos estandarizados.
Variables principalesDatos demográficos y epidemiológicos, datos de la PCR y supervivencia y pronóstico neurológico al alta hospitalaria y a los 6meses. Para valorar el deterioro neurológico de los pacientes se utilizó la escala Cerebral Performance Categories (CPC).
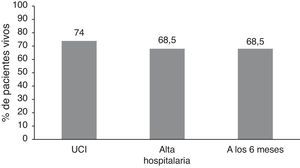
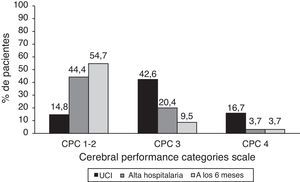
ResultadosSe analizaron un total de 54 pacientes. Treinta y siete fueron dados de alta del hospital, lo que implica una supervivencia al alta hospitalaria de 68,5%, que se mantiene al cabo de 6meses, pues ningún paciente dado de alta fallece durante el periodo de seguimiento. En cuanto al pronóstico neurológico, el 44,4% de los pacientes estaban vivos y con una CPC 1-2 al alta hospitalaria, y hasta el 54,71% a los 6meses.
ConclusionesLos resultados de supervivencia y situación funcional neurológica obtenidos en nuestro centro tras la implementación de la HTM son comparables a los de las series publicadas en la literatura.
To analyze survival and neurological outcome at short and medium term in patients treated with mild therapeutic hypothermia (HTM) in our hospital after suffering an out-of-hospital cardiac arrest (CA) secondary to a shockable rhythm.
DesignProspective, observational study from September 1, 2010 to December 31, 2012, with a follow up of 6months.
SettingTertiary hospital.
PatientsAll patients who suffer an out-of-hospital CA due to shockable rhythms. Exclusion criteria: non-shockable rhythms, resuscitation >45minutes without pulse recovery, septic shock, previous coagulopathy, terminal illness or order for withholding treatment.
InterventionMild hypothermia (33°C) and postresuscitation care on the basis of standardized protocols.
Main variablesDemographic and epidemiological data, CA data and survival and neurological outcome at hospital discharge and after 6months. To assess the patients’ neurological status, Cerebral Performance Categories (CPC) scale was used.
ResultsA total of 54 patients were analyzed. 37 patients were discharged to hospital, representing a survival at discharge of 68.5%, which remains 6months later because no discharged patient died during the follow up period. Regarding neurological outcome, 44.4% of patients were alive and with CPC 1-2 at discharge and up to 54.71% at 6months.
ConclusionsThe results of survival and neurological functional status obtained in our center after implementation of HTM are comparable to those published in the literature.
La enfermedad coronaria o cardiopatía isquémica representa en España la segunda causa de muerte (22%). Aproximadamente un tercio de los casos se manifiesta por primera vez en forma de una parada cardiorrespiratoria (PCR), por lo que esta constituye una de las principales causas de muerte en los países desarrollados, con una incidencia en Europa que se estima en alrededor de 375.000 al año1,2.
Desde el nacimiento de la resucitación cardiopulmonar hace más de 40años se han ido desarrollando y mejorando los algoritmos, las técnicas y los recursos ante una PCR, consiguiendo así una mayor proporción de pacientes que logran la recuperación de la circulación espontánea. A pesar de ello, la supervivencia global no ha mejorado, manteniéndose tan solo entre el 5 y el 15%2–4. La mayoría de estos pacientes mueren en los primeros 3días como consecuencia del daño cardíaco, del daño cerebral o del síndrome posparada cardíaca, y en los que logran sobrevivir el daño cerebral es una importante causa de morbimortalidad a corto, medio y largo plazo, así como de gasto familiar, social y sanitario5.
A principios de los años setenta se introdujo el término «enfermedad postresucitación»6, pero hasta la actualidad los cuidados postresucitación han carecido de protocolos y guías clínicas estandarizadas y se han llevado a cabo según el juicio clínico y la experiencia de los profesionales de cada unidad de cuidados intensivos. No fue hasta el año 2008 que se publicó un documento científico de consenso del International Liason Committee on Resuscitation (ILCOR) en el que se abordaba por primera vez el tratamiento del síndrome posparada cardíaca7.
En las últimas 2 décadas se han realizado numerosos estudios para optimizar los cuidados postresucitación, y la única medida que se ha demostrado científicamente que aumenta la supervivencia y mejora el pronóstico neurológico en estos pacientes es la instauración de la hipotermia terapéutica moderada (HTM). En los años noventa, los resultados obtenidos en estudios con modelos animales en los que usaban hipotermia moderada (34°C) para conseguir neuroprotección tras una PCR fueron prometedores8,9. Poco después empezaron a emerger los primeros resultados de su uso en humanos, pero no fue hasta 2002 cuando se publicaron 2 grandes estudios aleatorizados en los que se demostraba que la aplicación de HTM (32-34°C durante 12-24h) mejoraba la supervivencia y el pronóstico neurológico de los pacientes comatosos supervivientes de una PCR extrahospitalaria secundaria a ritmos desfibrilables (fibrilación ventricular [FV] y taquicardia ventricular sin pulso [TVSP])10,11. A partir de estas publicaciones, el European Resuscitation Council (ERC) y la American Heart Association (AHA) recomendaron en sus guías su aplicación en este tipo de pacientes con un grado de evidenciaI, y desde el año 2010 también en aquellos pacientes comatosos supervivientes de una PCR intrahospitalaria o extrahospitalaria secundaria a cualquier ritmo. Se postula que la HTM tiene efecto neuroprotector por diferentes mecanismos ante una agresión anóxica, independientemente de la causa; por ello cabe esperar que, a pesar de no tener aún evidencia científica, mejore la supervivencia y el pronóstico neurológico en todo paciente superviviente de una PCR, independientemente del ritmo inicial3,12. Desgraciadamente, a pesar de los beneficios demostrados, su uso no está universalizado en todos los centros, por lo que muchos pacientes candidatos no reciben este tratamiento de forma estandarizada.
El objetivo del presente trabajo es examinar, de forma prospectiva, la supervivencia y el pronóstico neurológico en la Unidad de Cuidados Intensivos, al alta y a los 6meses, de los pacientes atendidos en nuestro hospital tras sufrir una PCR extrahospitalaria secundaria a un ritmo desfibrilable y tratados con HTM.
Pacientes y métodosDurante el período comprendido desde el 1 de enero de 2010 al 31 de diciembre de 2012 se realiza un análisis prospectivo, observacional, de la supervivencia y el pronóstico neurológico a corto (en UCI y al alta hospitalaria) y a medio plazo (6meses) de los pacientes atendidos en nuestro hospital tras sufrir una PCR extrahospitalaria secundaria a un ritmo desfibrilable (FV/TVSP) y tratados con HTM.
Criterios de exclusiónLos criterios de exclusión para la instauración de la HTM fueron: PCR por ritmos no desfibrilables (asistolia o actividad eléctrica sin pulso), realización de maniobras de reanimación durante más de 45min sin recuperación de pulso en ningún momento, shock séptico (definido como inestabilidad hemodinámica de origen infeccioso), coagulopatía previa (definida como tiempo de protrombina <50%, plaquetas <50.000), enfermedad terminal conocida u orden de limitación del esfuerzo terapéutico por parte de la familia o documento de voluntades anticipadas.
Protocolo de hipotermia- -
Inducción.
- -
En el box de Urgencias, tras comprobar que los pacientes permanecían en coma tras la recuperación de la circulación espontánea (Glasgow Coma Scale <10) se procede a iniciar el enfriamiento rápido mediante la infusión de fluidos fríos, en base a publicaciones previas13,14. Nuestro protocolo prevé la administración de suero salino a 4°C a razón de 30cc/kg en bolos hasta un máximo de 2l en 30min (en 60min si hay signos de insuficiencia ventricular [IV]). Posteriormente, si la temperatura axilar es superior a 33,5° se infunden otros 500cc en 10min (en 30min si hay signos de IV). Si por el contrario la temperatura es <33,5°, se procede a parar la infusión.
- -
Mantenimiento. Los pacientes son sondados con una sonda vesical con sensor de temperatura (Foley Catheter, Curity, Tyco®) y conectados al sistema de control de temperatura Medivance Arctic Sun 2000 (Medivance, INC., Lousville, CO, EE.UU.) consistente en la colocación de unas placas adhesivas de transferencia de energía y de un módulo de control de la temperatura, para la consolidación y el mantenimiento de la HTM y para el posterior recalentamiento del paciente. Una vez alcanzada la temperatura objetivo de 33°C, esta se mantiene durante 24h.
- •
Sedo-analgesia y relajación neuromuscular. Tras una evaluación del estado neurológico inicial, a todos los pacientes se les inicia perfusión de midazolam y cloruro mórfico con dosis que se ajustan para el manejo de la ventilación mecánica, pero nunca superiores a 0,2 y 0,15mg/kg/h, respectivamente. Se procede a la relajación neuromuscular con perfusión de cisatracurio a razón de 0,1mg/kg/h.
- •
Monitorización. Presión arterial invasiva, electrocardiograma, end-tidal de CO2, saturación de O2, temperatura central e índice biespectral.
- •
- -
Recalentamiento y fase de normotermia. Se realiza paulatinamente en 24-30h, con una tasa de 0,1-0,15°C/h. Transcurridas las primeras 48h, y tras finalizar el recalentamiento, se retira la perfusión de cisatracurio, pero los pacientes son mantenidos en normotermia a 36°C durante 24h más para evitar una posible hipertermia de rebote, tras lo cual se procede a retirar la máquina y el resto de la sedo-analgesia para proceder al despertar del paciente si su situación hemodinámica lo permite.
Además de la instauración de la HTM, se inicia un tratamiento rutinario que incluye la ventilación mecánica y la corrección de la inestabilidad cardiovascular mediante la administración de fármacos vasoactivos, teniendo en cuenta su perfil hemodinámico, valorado mediante el uso de ecocardiografía transtorácica. Se intenta realizar una optimización terapéutica guiada por objetivos6,7:
- •
Estrategia ventilatoria. PCO2: entre 38 y 42mmHg; SpO2: entre el 94 y el 96%.
- •
Control moderado de la glucemia cada 4 o 6h (rango entre 100 y 180mg/100ml).
- •
Estrategia hemodinámica, manteniendo una presión arterial media entre 80-100mmHg, una frecuencia cardíaca entre 50-100latidos/min y una presión venosa central entre 8-12mmHg.
- •
Control de las convulsiones y mioclonías, principalmente con levetiracetam.
- •
Antibioterapia empírica en todos los pacientes con sospecha de broncoaspiración (amoxicilina-ácido clavulánico o levofloxacino, en caso de alergia a la penicilina). Posteriormente, la pauta se modifica según los resultados de los cultivos.
Todos los pacientes permanecieron con el cabezal de la cama incorporado aproximadamente 30° para favorecer el retorno venoso, disminuir el edema cerebral y prevenir la neumonía asociada al ventilador.
Se obtienen analíticas cada 6h, incluyendo gasometría, bioquímica, hemograma, perfil hepático y coagulación durante las fases de hipotermia y recalentamiento. Además, durante la fase de hipotermia se determinan 2 hemocultivos y un urinocultivo, junto con aspirados traqueales en los pacientes con sospecha de infección respiratoria.
Datos recogidos y análisis estadísticoLos datos recogidos fueron datos demográficos, factores de riesgo cardiovascular (hipertensión arterial [HTA], diabetes mellitus [DM], dislipidemia [DL], cardiopatía previa y tabaquismo), datos de la PCR y de las maniobras de reanimación cardiopulmonar, junto con la supervivencia. La valoración neurológica fue realizada de forma prospectiva mediante la escala Glasgow-Pittsburgh Cerebral Performance Categories (CPC) (tabla 1) al alta de la UCI, al alta hospitalaria y a los 6meses mediante contacto telefónico, siempre por la misma persona. Se consideró buena recuperación neurológica un valor de CPC 1 o 2.
Escala Glasgow-Pittsburgh Cerebral Performance Categories (escala CPC)
| CPC | Condición clínica del paciente |
| 1 | Buena recuperación neurológica: consciente, alerta, capaz de trabajar. Puede tener algún déficit psicológico o neurológico menor que no comprometa la función cerebral o física |
| 2 | Incapacidad cerebral moderada: consciente, alerta, independiente para las actividades básicas de la vida diaria. Puede presentar hemiplejia, ataxia, disartria, disfasia o alteraciones de la memoria |
| 3 | Incapacidad cerebral severa: consciente, dependiente para las actividades básicas de la vida diaria. Incluye pacientes con graves trastornos de memoria o demencia, así como pacientes con parálisis |
| 4 | Coma o estado vegetativo persistente: inconsciente, sin interacción verbal y/o psicológica con el ambiente. Puede parecer despierto debido a la apertura espontánea de los ojos durante el ciclo sueño-vigilia |
| 5 | Criterios de muerte encefálica (apnea, arreflexia, silencio electroencefalográfico) o de muerte cardíaca |
Fuente: Safar P. Resuscitation after Brain Ischemia. En: Grenvik A, Safar P, editors. Brain Failure and Resuscitation. New York: Churchill Livingstone; 1981; p. 155-184.
El análisis estadístico descriptivo muestra las medidas centrales y de dispersión para variables cuantitativas, expresadas como media±desviación estándar (DE) y las tablas de frecuencia para variables cualitativas, presentadas como porcentajes. Se analizan también algunos factores que pueden influir en la supervivencia final, así como también en el pronóstico neurológico a los 6meses. Para ello se realiza una prueba t de Student para el análisis de variables cuantitativas y pruebas no paramétricas (Chi-cuadrado) para el análisis de variables cualitativas. El análisis se realizó mediante el paquete estadístico aplicado a las ciencias sociales (SPSS v.18).
Se respetaron los aspectos éticos, obteniendo la aprobación del Comité Ético de nuestro hospital, y la confidencialidad de los datos, y todos los familiares de los pacientes fueron debidamente informados sobre la aplicación de la HTM.
ResultadosEntre el 1 de enero 2010 y el 31 de diciembre 2012, 54 pacientes fueron atendidos en nuestro hospital tras sufrir una PCR extrahospitalaria por FV/TVSP. La edad media fue de 55,8años (DE16,8) y 41 eran hombres (75,9%). Los datos demográficos, así como los factores de riesgo cardiovascular, se recogen en la tabla 2. Fueron atendidos en la vía pública, la mayor parte de ellos inicialmente por personas que presenciaron la PCR, y posteriormente por el Servicio de Emergencias Médicas (SEM). El ritmo inicial fue FV en 46 casos (85,2%) y TVSP en 8 (14,8%). El tiempo medio hasta el inicio del Soporte Vital Básico fue de 4,5min (DE4,4) y el tiempo total de Soporte Vital fue de 22,6min (DE23,7). Todos los pacientes recuperaron la circulación espontánea previo al traslado a nuestro hospital. En el box de Paros y en la UCI los pacientes fueron tratados de forma estandarizada y sometidos a HTM según el protocolo de nuestro hospital. Todos llegaron a la temperatura objetivo (33°C) en un tiempo medio de 5,68h (DE1,67).
Datos demográficos y epidemiológicos
| Datos demográficos y factores de riesgo cardiovascular (FRCV) | n=54 |
| Sexo, n (%) | |
| Hombre | 41 (75,9) |
| Mujer | 13 (24,07) |
| Edad (años), media ± DE | 55,8 ± 16,8 |
| FRCV, n (%) | |
| DM | 7 (12,9) |
| HTA | 20 (37) |
| Dislipidemia | 15 (27,7) |
| Cardiopatía previa | 13 (24) |
| Tabaquismo | 27 (50) |
| ≥ 3 FCRV | 10 (18,5) |
Cuarenta de 54 pacientes fueron dados de alta de la UCI, representando una supervivencia del 74%. Treinta y siete de 54 pacientes fueron dados de alta del hospital, lo que implica una supervivencia al alta hospitalaria del 68,5%. Las causas de mortalidad fueron, en la mayoría de los casos (82%), la inestabilidad hemodinámica refractaria o el edema cerebral con herniación y muerte encefálica. Un porcentaje menor (18%) murió por insuficiencia respiratoria secundaria a infecciones respiratorias en la sala de hospitalización convencional, debido a la encefalopatía anóxica cerebral. A los 6meses, todos los pacientes dados de alta del hospital continuaban vivos, manteniendo por tanto el porcentaje de supervivencia global a los 6meses del 68,5% (fig. 1).
En cuanto al pronóstico neurológico, al alta de la UCI, 9 pacientes (16,6%) presentaban un estado vegetativo persistente (CPC4); 23 (42,6%) eran capaces de conectar con el medio externo sin poder ser independientes para las actividades básicas de la vida diaria (ABVD) (CPC3), y 8 pacientes (14,8%) no presentaban ningún déficit neurológico limitante para las ABVD (CPC1-2).
De los 9 pacientes con CPC 4 en la UCI, 3 murieron en la sala de hospitalización debido a complicaciones respiratorias derivadas de la encefalopatía anóxica y 4 recuperaron la conciencia, presentando una CPC al alta hospitalaria de 3 o menor. Únicamente 2 pacientes permanecían en estado vegetativo persistente al alta del hospital. Ningún paciente con CPC3 o menor falleció durante el ingreso; la mitad de los pacientes con CPC3 mejoraron su estado neurológico, representando un porcentaje al alta hospitalaria del 20,3%. Por último, 24 pacientes (44,4%) fueron dados de alta a domicilio sin ningún tipo de déficit neurológico limitante para las ABVD (fig. 2).
En relación con los resultados neurológicos a los 6meses de la PCR se pudieron obtener datos de 36 pacientes. Destaca que 5 pacientes con CPC3 al alta hospitalaria (el 50%) mejoraron su situación neurológica, siendo capaces de vivir de forma autónoma al cabo de 6meses. De los 24 pacientes dados de alta sin déficit neurológico limitante, 15 se habían reincorporado al trabajo o a los estudios. El porcentaje total de «buena recuperación neurológica» al alta hospitalaria y a los 6meses de la PCR fue, por tanto, del 44,4 y del 54,7%, respectivamente (fig. 2).
Por lo que se refiere a las variables que pueden asociarse con la mortalidad o con el pronóstico neurológico, el análisis univariante no evidenció diferencias estadísticamente significativas, a excepción del sexo, que podría influir en la mortalidad (sobreviven más las mujeres) y el ritmo inicial, que podría asociarse a un peor pronóstico neurológico (TV presenta peor pronóstico) (tablas 3 y 4).
Factores que influyen en la supervivencia a los 6meses
| Supervivientes (n=36) | Fallecidos (n=17) | Significación estadística (p<0,05) | |
| Edad (años)a | 52,1 ± 17,3 | 59,5 ± 17,5 | 0,183 |
| Tiempo hasta el inicio de SVB (min)a | 4,1 ± 5,00 | 5,7 ± 4,1 | 0,299 |
| Tiempo total de SV (min)a | 20,7 ± 25,5 | 34,9 ± 32,8 | 0,159 |
| Tiempo hasta alcanzar 33°C (h)a | 5,8 ± 1,6 | 5,3 ± 1,9 | 0,404 |
| Sexo (varones)b | 65,5% | 88,2% | 0,019 |
| > 3 FRCVb | 39,3% | 50% | 0,362 |
| Ritmo inicial (FV)b | 86,2% | 88,2% | 0,99 |
Factores que influyen en el pronóstico neurológico a los 6meses
| CPC 3-4 (n=7) | CPC 1-2 (n=29) | Significación estadística (p<0,05) | |
| Edad (años)a | 46,6 ± 17,5 | 53,3 ± 17,03 | 0,305 |
| Tiempo hasta el inicio de SVB (min)a | 4,2 ± 6,6 | 4,1 ± 4,6 | 0,617 |
| Tiempo total de SV (min)a | 40,5 ± 49,7 | 16,3 ± 13,3 | 0,107 |
| Tiempo hasta alcanzar 33°C (h)a | 6 ± 2,4 | 5,8 ± 1,4 | 0,673 |
| Sexo (varones)b | 60% | 66,7% | 0,178 |
| > 3 FRCVb | 20% | 43,5% | 0,197 |
| Ritmo inicial (FV)b | 80% | 87,5% | 0,002 |
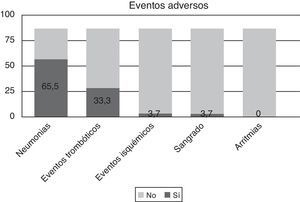
Las complicaciones principales descritas en la literatura son las infecciones, el sangrado y las arritmias15,16. En nuestro centro, las complicaciones más frecuentes son las neumonías y los episodios trombóticos, representados como trombosis del stent implantado, un caso de trombosis venosa profunda y un tromboembolismo pulmonar subsegmentario. El 65,5% de nuestra serie de pacientes presentó neumonía, mientras que el 33,3% presentó algún episodio trombótico. Ningún paciente presentó arritmias prolongadas o letales o sangrado que pudiera relacionarse exclusivamente con la aplicación de la técnica (fig. 3). En un caso se interrumpió el tratamiento al cabo de 12h debido a inestabilidad hemodinámica y sangrado incontrolable, y el paciente falleció al segundo día de ingreso hospitalario. Este sangrado se justifica por hallarse el paciente en ECMO (extracorporeal membrane oxigenation) y, por tanto, descoagulado con heparina. Dos pacientes presentaron complicaciones neurológicas; uno presentó hemorragia subaracnoidea traumática y hematoma subdural tras entrar en PCR con realización de fibrinólisis en la ambulancia por inestabilidad hemodinámica, y el otro paciente presentó isquemia cerebral con transformación hemorrágica en el territorio de la arteria cerebral media derecha. El primer paciente murió a los 4días del ingreso; el segundo presentaba una CPC al alta de 3, con paresia de la extremidad superior izquierda que fue mejorando progresivamente. A los 6meses presentaba una CPC2, con mejoría de la paresia y problemas espaciales, numéricos, así como lentitud en la toma de decisiones. Todos estos pacientes fueron incluidos en nuestro análisis.
DiscusiónEn nuestro centro, la HTM se introdujo en el año 2008, pero no fue hasta finales de 2009 que el protocolo quedó establecido y unificado entre médicos de urgencias, internistas, anestesiólogos y cardiólogos, por lo que se incluyen en nuestro análisis los pacientes atendidos en nuestro hospital a partir de enero del 2010.
Tras la publicación de los estudios de la HACA y de Bernard en el 2002 se han llevado a cabo, en estos últimos 10años, numerosos estudios comparativos sobre la HTM, intentando ampliar sus indicaciones y desvelar las incógnitas respecto a la temperatura óptima, el tiempo y el modo de inducción, mantenimiento y recalentamiento, o el método a utilizar, sin que ninguno de ellos fuera concluyente2,17–20. En nuestro centro se escogieron el método de infusión de líquidos fríos a 4°C, para la inducción, y el sistema de enfriamiento externo con parches de hidrogel Medivance Arctic Sun (Medivance, INC., Lousville, CO, EE.UU.), para la inducción, mantenimiento y recalentamiento, por ser métodos sencillos, no invasivos, rápida y fácilmente aplicables y manejables por la unidad de enfermería. A pesar de ser un método de enfriamiento más lento que los métodos invasivos, no está demostrado que un enfriamiento precoz mejore el pronóstico neurológico ni la supervivencia17, y todos nuestros pacientes alcanzaron la temperatura objetivo en menos de 8h desde la PCR, tal y como se recomienda actualmente en las guías3,10. La mayoría de estudios recomiendan una tasa de recalentamiento de 0,25-0,5°C para conseguir llegar a 36°C en 12-24h, sin especificar la tasa de recalentamiento óptima, aunque sí se recomienda que nunca sea superior a 0,5°C/h. En nuestro centro se escogió una tasa menor, de 0,1-0,15°C, para conseguir la normotermia en 24-30h, basándonos en estudios que afirman que un rápido recalentamiento revierte los beneficios obtenidos con la HTM21,22. De esta forma se consigue controlar la temperatura del paciente de una manera más estricta y durante más tiempo, lo que nos da la oportunidad de disminuir la aparición del temido efecto rebote, caracterizado por la aparición de picos febriles mantenidos. Por este mismo motivo, y siguiendo la misma filosofía, se decidió mantener un periodo de normotermia (36°C) de 24h posterior al recalentamiento. Cabe subrayar que el protocolo usado en nuestro centro incluye algunas medidas que se alejan de las recomendaciones generales, como sería el uso de manera continua y habitual de relajantes musculares y el ya comentado recalentamiento ultralento en 24-30h. Consideramos adecuado el uso de perfusión de relajante muscular a dosis bajas para prevenir la aparición de temblores, que aumentarían el metabolismo basal del paciente y por lo tanto disminuirían el efecto beneficioso de la hipotermia. Esta perfusión se retira cuando el paciente llega a los 35°C durante la fase de recalentamiento, cuando ya no existe posibilidad de aparición de temblores; este hecho, asociado al recalentamiento lento y al periodo de normotermia controlada, permite la eliminación completa del fármaco.
La tasa de mortalidad de nuestro centro es de 31,49% al alta hospitalaria y se mantiene a los 6meses, pues ningún paciente dado de alta falleció durante el período de seguimiento. En la literatura se describe una tasa de mortalidad tras la implementación de HTM que oscila entre el 35 y el 50%, porcentaje mayor al encontrado en nuestro estudio10,11,13,23,24. Tras las recomendaciones de la ILCOR en el año 2003, 2 metaanálisis23,25, diversos estudios observacionales y análisis retrospectivos26,27 y 2 publicaciones basadas en registros nacionales28,29 describen tasas globales de pacientes vivos y con buen pronóstico neurológico comparables y que oscilan entre el 40 y el 60%, tanto al alta hospitalaria como a los 6meses. Esto representa que más del 50% de los pacientes tratados con HTM tras una PCR secundaria a FV/TVSP y dados de alta del hospital presentan un buen pronóstico neurológico y son capaces de ser autónomos en su vida cotidiana. En nuestro centro, la tasa global de buena recuperación neurológica es del 44,4% al alta hospitalaria y alcanza el 54,7% a los 6meses (fig. 2). Esto representa que el 64,8% de los supervivientes a una PCR presenta una buena recuperación neurológica al alta hospitalaria, porcentaje que aumenta hasta el 80,55% a los 6meses.
Nuestros resultados son comparables a los encontrados en la literatura, con porcentajes de supervivencia ligeramente superiores y tasas de buena recuperación neurológica que se sitúan en el límite alto. Esto puede ser debido a los criterios de exclusión aplicados que han llevado a seleccionar un grupo de pacientes que, de por sí, presentan un mejor pronóstico en cuanto a supervivencia y pronóstico neurológico. Los resultados obtenidos no son generalizables a enfermos con PCR no asociada a FV/TVSP o a enfermos con tiempos de maniobras muy largos (>45min). En la literatura se describen como principales determinantes de la supervivencia los tiempos de la asistencia a la PCR5. En nuestro análisis no se encontraron diferencias estadísticamente significativas entre los supervivientes y los fallecidos en cuanto a estos tiempos. En cambio, obtenemos significación estadística (p<0,05) en 2 variables: el sexo, por lo que respecta a la mortalidad, y el ritmo inicial, por lo que respecta al pronóstico neurológico. Estos resultados podrían ser debidos principalmente al tamaño de la muestra y de nuevo a los criterios de exclusión aplicados, por lo que no se puede afirmar que alguno de estos factores influya positiva o negativamente en la supervivencia o en el pronóstico neurológico de nuestros pacientes.
Por lo que se refiere a los episodios adversos de la técnica, se detectó un mayor número de neumonías, entendidas como hipoxemia en la gasometría arterial, broncoaspirado positivo o imagen radiológica compatible, y de episodios trombóticos, entendidos como trombosis de stents implantados durante el ingreso u otro tipo de episodio trombótico no cardíaco. El aumento de la incidencia de infecciones, especialmente de neumonías, así como el aumento del riesgo de sangrado y de arritmias asociadas a la aplicación de la técnica, ha sido ampliamente descrito en los diversos estudios publicados16,30, sin que la aparición de estas haya influido estadísticamente en la supervivencia de los pacientes. El aumento de los episodios trombóticos no ha sido tan descrito, y aunque algunos autores lo relacionan con la disminución de la absorción de clopidogrel a nivel gástrico, la causa sigue siendo incierta31,32. En nuestra serie de pacientes, solo uno falleció a raíz de una tormenta arrítmica desencadenada por una trombosis aguda del stent implantado. Ninguno falleció por insuficiencia respiratoria o sepsis secundaria a neumonía. Se puede concluir que la aplicación de esta técnica no es inocua y conlleva en los pacientes diversas alteraciones que todo profesional debe conocer y tener en cuenta; pero también es cierto que los beneficios que aporta, sobre todo en lo que respecta el pronóstico neurológico, son muy superiores, y por tanto la aparición de estos episodios adversos no es motivo suficiente para no instaurar este tratamiento33.
Son varias las limitaciones de este trabajo. En primer lugar, al ser un estudio descriptivo no se compara con los pacientes a los que no se realizó hipotermia, pues son los pacientes que no cumplían criterios de inclusión y por tanto su pronóstico era mucho peor desde el inicio y no comparable con el grupo de hipotermia. Por otro lado, aunque se analizan los factores epidemiológicos y los factores propios de la PCR como factores que podrían influir en la supervivencia y en el pronóstico neurológico, no se analizan en este estudio muchos otros factores relacionados sobre todo con los cuidados posresucitación, como los requerimientos de fármacos vasoactivos y los niveles de glucemia, entre otros. El objetivo del presente estudio no es analizar todos estos factores, sino describir los resultados obtenidos en nuestro centro en los primeros años de la implementación de la HTM. Por ello consideramos que el tratamiento de los pacientes tras una PCR está estandarizado y solo difiere en la aplicación o no de la HTM.
La conclusión de este trabajo es, por tanto, que la aplicación de la HTM es factible y segura, y puede haber contribuido a la obtención de unos resultados favorables de supervivencia y pronóstico neurológico en nuestros pacientes, equiparables a los resultados de las series internacionales publicadas. Llama la atención que, a pesar de las recomendaciones, de los estudios realizados y —lo más importante— de los resultados obtenidos, esta terapia no se aplique de forma rutinaria en todos los centros34. Esto podría deberse a las innumerables incógnitas que existen alrededor de la misma, que dificultan y entorpecen la realización y la unificación de protocolos, dando lugar así que muchos profesionales no estén familiarizados con la técnica y fracasen a la hora de introducir la HTM en los protocolos de soporte vital avanzado de cada centro. Tras décadas de resultados desalentadores en la reanimación cardiopulmonar, con tasas de supervivencia invariablemente inferiores al 20%, actualmente, en los centros donde se ha implantado la HTM, aproximadamente la mitad de los pacientes que han sufrido una PCR secundaria a ritmos desfibrilables regresan a su vida normal en menos de 6meses. Por ello, es recomendable que los hospitales que dispongan de protocolos de HTM promulguen su difusión y expongan los resultados obtenidos para estimular y conseguir, por un lado, que los pacientes tributarios dispongan de un tratamiento con beneficios probados y, por otro, aumentar el número de investigaciones necesarias para ir desvelando las incógnitas que giran aún en torno a la hipotermia terapéutica.
FinanciaciónEste trabajo ha sido financiado mediante una beca del Fondo de Investigación Sanitaria del Ministerio de Sanidad, Política Social e Igualdad (Instituto Carlos III y FEDER. Unión Europea. Una manera de hacer Europa).
Conflicto de interesesEl dr. Jaume Fontanals fue el investigador principal de un proyecto financiado por el Fondo de Investigación Sanitaria PI-07-0256. El resto de autores declaran no tener ningún conflicto de intereses.