Editado por: Federico Gordo - Medicina Intensiva del Hospital Universitario del Henares (Coslada-Madrid)
Última actualización: Octubre 2023
Más datosPseudomonas aeruginosa es el microorganismo que participa con mayor frecuencia en las principales infecciones adquiridas en la UCI, con especial importancia en la neumonía asociada a ventilación mecánica. Su importancia radica, además de en su elevada incidencia en el paciente crítico, en la gravedad de las infecciones que causa y en la dificultad de su tratamiento antimicrobiano, directamente relacionada con el elevado porcentaje de resistencias a los antibióticos considerados clásicamente de primera línea. Recientemente se han desarrollado nuevos antibióticos activos frente a Pseudomonas aeruginosa, incluso frente a cepas multirresistentes. La presente revisión analiza tanto las características diferenciales de las infecciones por Pseudomonas aeruginosa como las nuevas opciones terapéuticas, centrando el foco en la Pseudomonas aeruginosa multirresistente.
Pseudomonas aeruginosa is the microorganism most frequently involved in the main ICU-acquired infections, with special importance in ventilator associated pneumonia. Its importance lies, in addition to its high incidence in critically ill patients, in the severity of the infections it causes and in the difficulty of its antimicrobial treatment, directly related to the high percentage of resistance to antibiotics classically considered first-line. New active antibiotics have recently been developed against Pseudomonas aeruginosa, even against multi-drug resistant strains. This review analyzes both the differential characteristics of Pseudomonas aeruginosa infections and the new therapeutic options, focusing on multi-drug resistant Pseudomonas aeruginosa.
Pseudomonas aeruginosa (PA) presenta resistencia intrínseca a varias familias de antibióticos, y, además, puede adquirir resistencia a prácticamente cualquier antibiótico. En una reunión de expertos de la OMS, celebrada en Ginebra en 2017, se realizó una lista de prioridades para la investigación sobre algunos patógenos. En esta lista, con 3 grados de prioridad, en el más alto se incluyó a PA resistente a carbapenemes1.
EpidemiologíaPA es un bacilo gramnegativo, aerobio, que no fermenta la lactosa, y móvil. Está distribuido ampliamente tanto dentro como fuera de los hospitales, a menudo en agua o contaminando zonas acuosas. PA es un patógeno oportunista que puede causar infecciones en pacientes con alteraciones en los mecanismos de defensa. Así, es un patógeno muy frecuente en infecciones pulmonares en pacientes con fibrosis quística. Además, por lo que respecta a las infecciones graves o en pacientes graves, PA es uno de los agentes etiológicos más frecuentes en neumonía nosocomial (incluyendo, sobre todo, neumonía asociada a la ventilación mecánica [NAV]), bacteriemia e infección urinaria asociada a sondaje vesical (ITU-SV).
Según el informe ENVIN del año 20202, PA fue, con un 16,2%, el patógeno más frecuentemente aislado en las principales infecciones intra-UCI. PA fue el primer patógeno causante de NAV en nuestro país en 2020, representando más del 30% de los casos2.
Si hablamos de PA, es de gran importancia considerar los episodios causados por cepas multirresistentes. De acuerdo con las definiciones derivadas del consenso entre el European Centre for Disease Prevention and Control (ECDC) y los Centers for Disease Control and Prevention (CDC)3, podemos catalogar como PA multirresistente (PA-MDR) a aquella cepa que es no sensible a, al menos, un agente antimicrobiano de 3 o más grupos de antimicrobianos con actividad frente PA. Se califica como PA extensamente resistente (PA-XDR) cuando el aislamiento es no sensible a algún antimicrobiano en todos salvo 2 o menos grupos. Se clasifica como PA panresistente (PA-PDR) a aquella no sensible a ningún agente antimicrobiano. Empleamos el término no sensible, una forma poco agradable a la lectura, porque incluye los conceptos resistente e intermedio. Se ha propuesto también el concepto de PA difícil de tratar (PA-DTR), que incluye a aquellas PA no sensibles a piperacilina-tazobactam, ceftazidima, cefepima, aztreonam, meropenem, imipenem-cilastatina, ciprofloxacino y levofloxacino4.
En el informe ENVIN de 2020 se informó del aislamiento de 255 episodios de colonización/infección por PA-MDR, aproximadamente el 25% de ellos detectados en el momento del ingreso en la UCI2. Es de destacar que, en las plantas de hospitalización, la resistencia a betalactámicos, incluidos carbapenemes, es solo 5-9 puntos porcentuales más bajo que en la UCI5. Dentro de los pacientes ingresados en la UCI que presentan una neumonía no asociada a ventilación mecánica por PA, hasta la mitad de los episodios pueden ser causados por cepas multirresistentes6.
Resistencias y actividad in vitro de los diferentes antimicrobianos frente a PAComo hemos comentado, uno de los aspectos más relevantes de las infecciones por PA es su resistencia antimicrobiana. Podemos clasificar sus mecanismos de resistencia en intrínsecos, adquiridos y adaptativos.
La resistencia intrínseca se debe a la expresión de bombas de eflujo que expulsan antibióticos de la célula, a la producción de enzimas que inactivan o hidrolizan antibióticos (como betalactamasas de espectro extendido [BLEE], AmpC o carbapenemasas) y a la baja permeabilidad de su membrana externa (especialmente relevante es la regulación a la baja de la proteína de la membrana externa OprD, que reduce la permeabilidad de la membrana a algunos antibióticos y suele ser la responsable de la resistencia a carbapenem).
La resistencia puede ser adquirida tanto por transferencia horizontal (a través de plásmidos, transposones, integrones y profagos, de la misma o diferente especie bacteriana), como por cambios mutacionales, que pueden provocar ventajas para la bacteria, como reducción de la captación de antimicrobianos, modificación de la diana del antibiótico, sobreexpresión de bombas de eflujo o aparición de enzimas que inactivan el antibiótico.
La resistencia adaptativa incrementa la capacidad de la bacteria para sobrevivir en respuesta a un estímulo ambiental y es reversible cuando el estímulo cesa; en el caso de PA, la resistencia adaptativa consiste en la formación de biofilm7,8.
Un estudio, publicado en 2019, analizó una muestra de 1.445 PA aisladas en infecciones asociadas a cuidados sanitarios en 51 hospitales españoles. Detectaron un 26,2% de PA-MDR, un 17,3% de PA-XDR y un 0,1% de PA-PDR, con mayores porcentajes en cepas recuperadas de la UCI (41,4, 28,4 y 1,6%, respectivamente). En el 3,1% de las PA analizadas (16,7% de las PA-XDR), el mecanismo de resistencia subyacente fue una BLEE/carbapanemasa, incluyendo VIM (1,9%), IMP (0,3%), GES (0,6%), PER (0,2%) y OXA (0,1%), y hasta el 65% de las cepas XDR presentaron un patrón de resistencias sugestivo de hiperproducción de AmpC. También se detectaron otros mecanismos de resistencia, no enzimáticos: más del 60% presentaban alteraciones en OprD, y también fueron frecuentes las mutaciones en las bombas de eflujo (56 cepas). Además de la resistencia a betalactámicos, el 56% de las PA-XDR poseían enzimas modificadoras de aminoglucósidos adquiridas, implicadas en la resistencia a tobramicina y a otros aminoglucósidos, y el 75% una presentaban una mutación en la GyrA, responsable de la resistencia a ciprofloxacino. Este estudio nos reafirma la importancia de conocer la microbiología local, ya que detecta significativas variaciones geográficas9.
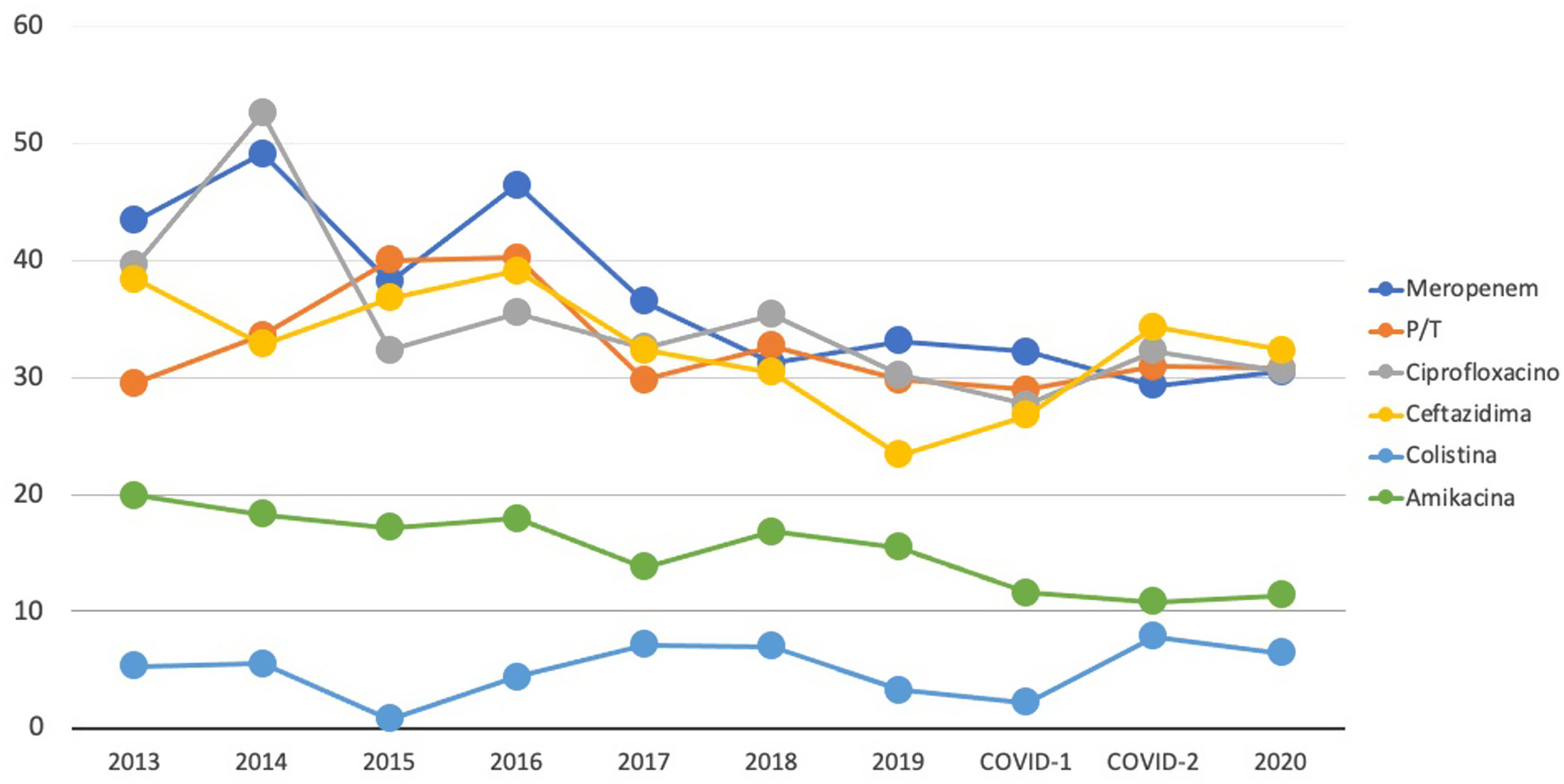
Si atendemos a las infecciones adquiridas en las UCI de nuestro país, según los últimos informes ENVIN, alrededor del 30% de las PA son resistentes a carbapenemes, piperacilina-tazobactam, ceftazidima y quinolonas, y los únicos antibióticos con una tasa de resistencia menor (cercana al 10%) son los aminoglucósidos y la colistina (fig. 1)2.
El Consorcio Internacional de Control de la Infección Nosocomial ha descrito la tasa de resistencias de PA a los principales antibióticos en las infecciones asociadas a dispositivos. En la NAV, la resistencia frente a carbapenemes, quinolonas, piperacilina-tazobactam y cefepima es del 39,4, del 34,6, del 39,2 y del 40,5%, respectivamente; en ITU-SV se alcanza el 39,3, el 40,2, el 38,2 y el 48,1% (siguiendo el mismo orden), y en BRC, el 43,5, el 20, el 33 y el 41,7%. Únicamente amikacina mantiene unas tasas de resistencia menores del 30%: 24,7% en NAV, 26,8% en ITU-SV y 21,4% en BRC10.
Debemos mencionar que ni el estudio anterior ni los informes ENVIN incluyen, hasta el momento, datos sobre los nuevos antibióticos.
Un estudio europeo ha descrito que el 99,5% de las PA son sensibles a colistina, el 95,5% a ceftazidima/avibactam, el 94,3% a imipenem-relebactam, el 93,3% a ceftolozano-tazobactam y el 88,7% a meropenem/vaborbactam11.
En la misma línea, se ha observado que ceftolozano-tazobactam y ceftazidima-avibactam mantienen la sensibilidad en el 73,4% y el 71,0%, respectivamente, de PA-XDR, y en el 84,3 y el 83,3% de las PA no sensibles a carbapenemes. Solo el 3,9% de los PA analizadas fueron resistentes a ambos antibióticos, generalmente debido a la presencia de carbapenemasas, pero también a la presencia de AmpC mutantes9,12-15.
Otras publicaciones muestran resultados un tanto diferentes: un estudio de cepas aisladas entre 2013 y 2018 en 24 países europeos demuestra que el 99,7% de las PA son sensibles frente a cefiderocol, incluyendo el 97,5% de aquellas resistentes a carbapenemes16. Los resultados del análisis de las cepas incluidas en este estudio procedentes de España muestran que el 99,2% de las PA son sensibles a cefiderocol, bajando al 96% en caso de PA resistentes a carbapenemes. En esta serie, solo el 40 y el 50% de las PA resistentes a carbapenemes fueron sensibles a ceftazidima-avibactam y ceftolozano-tazobactam, respectivamente, y tan solo la colistina se acerca a los resultados de cefiderocol, con un 94% de PA sensibles17. Similares resultados se detectaron en otro estudio que analizó las PA resistentes a carbapenemes detectadas en 44 hospitales españoles: hasta el 30,6% eran productoras de carbapenemasas, principalmente metalo-beta-lactamasas tipo VIM, y el 26,7% eran sensibles únicamente a colistina18.
Se ha observado que las mutaciones en la región AmpC-AmpR, que se asocian con el desarrollo de resistencias a ceftolozano-tazobactam y ceftazidima-avibactam durante el tratamiento, reducen también la actividad de cefiderocol y, por el contrario, pueden aumentar la sensibilidad frente a imipenem-relebactam19.
Enlazando con esto, la actividad in vitro de imipenem-relebactam frente a PA sin carbapenemasas es hasta 5veces mayor que la de imipenem en solitario y muestra una elevada actividad frente a la presencia de una betalactamasa tipo AmpC asociadas a impermeabilidad y también frente a cepas productoras de KPC20,21. Al añadir relebactam, se pasa de un 2% de cepas de PA resistentes a carbapenemes (no productoras de carbapenemasas) sensibles a imipenem, a un 63% de sensibles a imipenem-relebactam; cabe destacar que el 98 y el 80% de este grupo de PA son, además, sensibles frente a colistina y a ceftolozano-tazobactam, respectivamente22. Un estudio español describió a imipenem-relebactam como el antibiótico con mayor porcentaje de PA sensibles, con un 97,3%23.
Respecto al otro carbapenem con inhibidor de betalactamasas disponible en la actualidad, meropenem-vaborbactam es activo frente al 82,1% de PA (en comparación con el 67,3% de meropenem en solitario), y, lo que es más relevante, frente al 41,0% de PA-MDR (frente al 13,0% de meropenem) recuperadas de neumonías (incluyendo NAVM) en Europa24.
El grupo de Sader et al.11,25 ha publicado dos estudios evaluando la actividad in vitro de los nuevos betalactámicos asociados a nuevos inhibidores de betalactamasas (ceftazidima-avibactam, ceftolozano-tazobactam, imipenem-relebactam y meropenem-vaborbactam) frente a cepas de PA recuperadas de pacientes con neumonía e infección de piel y partes blandas. Es interesante destacar como en los aislamientos resistentes a algún antibiótico sin inhibidor de betalactamasas, la adición del inhibidor aumenta el porcentaje de cepas sensibles: el 78,7-87,5% de aislamientos resistentes a imipenem eran sensibles a la combinación imipenem-relebactam, y el 79,8-87,5% de los casos resistentes a ceftazidima se volvían sensibles al añadir avibactam; en el caso de meropenem, la adición de vaborbactam convertía en sensibles el 61,1% de los casos con CMI>2mg/l y el 5,7% de las cepas con CMI>8mg/l.
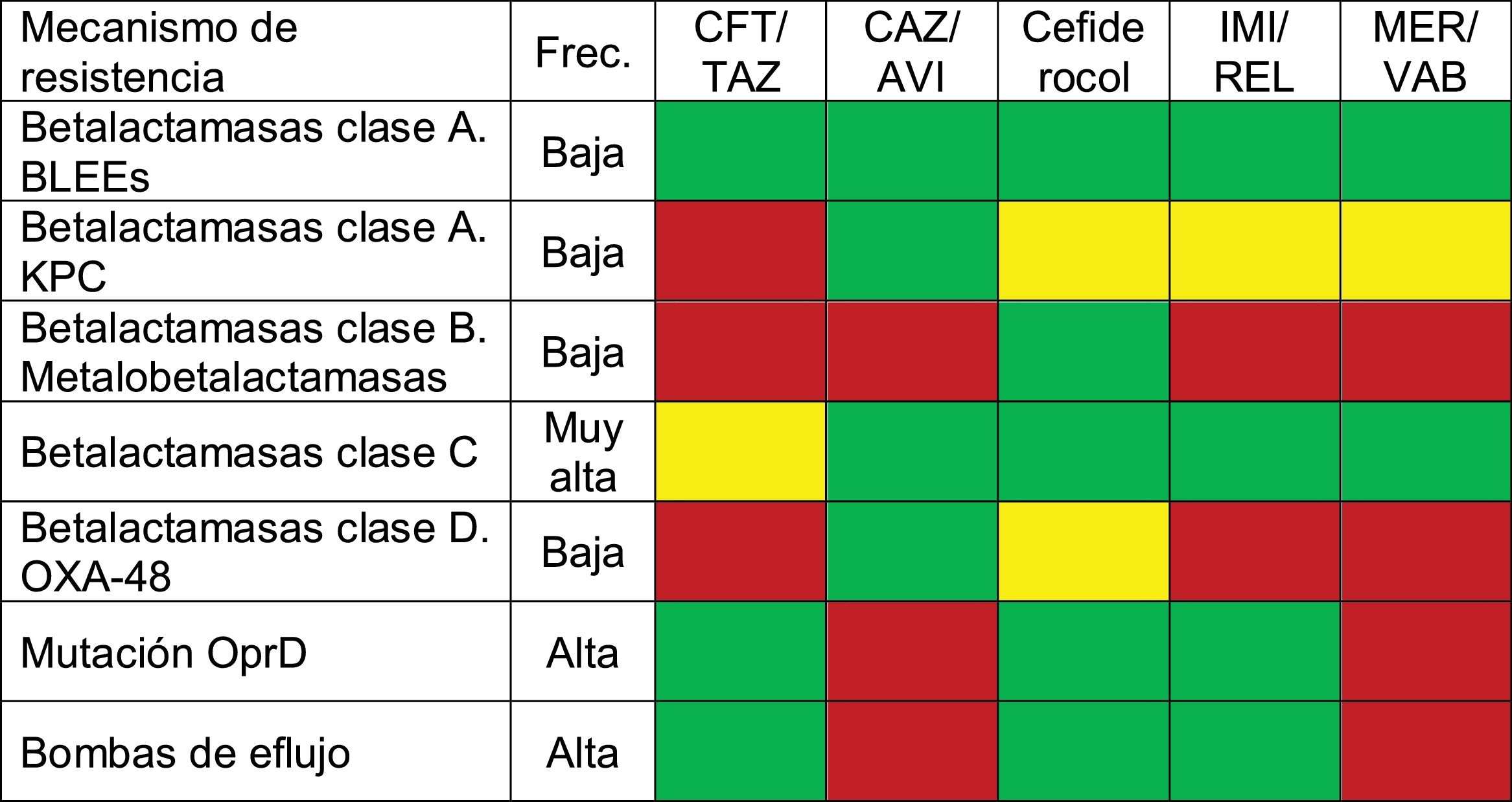
En la tabla 1 se resume la actividad de los nuevos antibióticos frente a los distintos mecanismos de resistencia de la PA.
Actividad de nuevos antibióticos frente a los distintos mecanismos de resistencia de PA
BLEE: Enterobacteriaceae productoras de betalactamasas de espectro extendido; CAZ/AVI: ceftazidima-avibactam; CFT/TAZ: ceftolozano-tazobactam; Frec: frecuencia; IMI/REL: imipenem-relebactam; MER/VAB: meropenem-vaborbactam. Leyenda colores: usamos el rojo para indicar no actividad frente a ese mecanismo de resistencia, el verde para aquellos antibióticos cuya actividad no es superada por otro frente al mecanismo de resistencia (pueden ser varios antibióticos, que se considerarían equivalentes), y el amarillo para aquellos antibióticos activos frente al mecanismo de resistencia, pero con disponibilidad de otros con mayor actividad.
Fuente: adaptada de Blomquist y Nix83.
Los factores de riesgo clásicos para una infección por PA son la enfermedad pulmonar estructural (fibrosis quística, bronquiectasias), las neoplasias hematológicas, especialmente si conllevan neutropenia, el trasplante de órgano sólido, las grandes quemaduras, el tratamiento antibiótico recibido en los 90días anteriores, la presencia de catéter venoso o sonda urinaria, la hospitalización prolongada y la ventilación mecánica26.
Parece de mayor interés (y dificultad) conocer en qué situaciones la PA puede ser PA-MDR. Se ha propuesto un score para predecir infección por PA resistente a carbapenemes que incluye las siguientes variables: residencia en centro sociosanitario, ser portador de traqueostomía, infección por PA resistente a carbapenemes en los 30días previos al ingreso, hospitalización en los 6meses previos y haber recibido tratamiento con carbapenemes, cefalosporinas o quinolonas en los 30días anteriores. El área bajo la curva ROC de este score es de 0,81. Los mismos autores proponen otro score para identificar infecciones por PA resistente a carbapenemes, ceftazidima y piperacilina-tazobactam, cuyas variables son: residencia en centro sociosanitario, ser portador de traqueostomía o de catéter venoso central, infección por PA resistente a carbapenemes en los 30días previos al ingreso, hospitalización en los 6meses previos y haber recibido carbapenemes 30días antes de la fecha de infección, con un área bajo la curva ROC de 0,8227.
Otros factores de riesgo que se han identificado son: edad, presencia de sonda urinaria, recibir nutrición parenteral, antibioterapia previa, tratamiento con corticoides, gravedad del episodio, comorbilidades (índice de Charlson ≥3), origen nosocomial o neoplasia hematológica28.
En una revisión sistemática se identificaron hasta 38 factores de riesgo distintos para infección por PA resistente a carbapenemes. Estos factores de riesgo fueron, posteriormente, clasificados en función de su importancia y relevancia en nuestro contexto por un grupo de expertos. Aquellos clasificados como importantes están relacionados con el contacto previo con el hospital (hospitalización previa o días de estancia hasta la infección) y con la antibioterapia previa (carbapenemes, aminoglucósidos, cefalosporinas, quinolonas o aminoglucósidos); la hospitalización en UCI, la gravedad medida por los scores SAPSII o APACHE y la presencia de dispositivos invasivos se consideraron un factor de riesgo moderadamente importante29.
En general, los factores de riesgo o los scores desarrollados tienen una elevada sensibilidad pero una baja especificidad (y, consecuentemente, un elevado valor predictivo negativo, pero un bajo valor predictivo positivo); por tanto, es fundamental conocer la microbiología y el perfil de resistencias local.
Infecciones por PAPA provoca infecciones agudas de adquisición en pacientes hospitalizados y en pacientes inmunodeprimidos y, además, infecciones crónicas en pacientes con lesiones pulmonares estructurales, como fibrosis quística o bronquiectasias26.
Analizando en primer lugar las infecciones hospitalarias, según un estudio internacional, PA causa el 23% de todas las infecciones adquiridas en la UCI30.
En España, según los resultados de los sucesivos informes ENVIN, PA es la primera causa de NAV, aumentando incluso tras la pandemia COVID-19, y una de las primeras causas de infección urinaria asociada a sonda urinaria (provocando entre un 10-15% de los casos) y de BRC (alrededor del 5%)2. Esta situación es similar en los países de nuestro entorno. Así, según los datos del National Healthcare Safety Network (NHSN) de Estados Unidos, PA fue el segundo agente causal más frecuente de NAV (con un 16,5%), solo por de detrás de Staphylococcus aureus31, y ha causado el 10,3% de las ITU-SV nosocomiales (solo por detrás de Escherichia coli y Candida albicans) y el 4% de los episodios de bacteriemia asociada a catéter venoso central (BRC)31.
Una entidad, cuya relevancia se ha demostrado recientemente, es la neumonía nosocomial que acontece en pacientes ingresados en la UCI pero no ventilados (UCI-NVAP). El estudio de Giuliano et al.32 describe una incidencia de UCI-NVAP de 1,6% (3,63 episodios por 1.000 pacientes-días) y PA puede representar el primer patógeno en orden de frecuencia, causando hasta un tercio de los casos6.
PA es, además, el bacilo gramnegativo implicado con más frecuencia en la infección de las heridas del paciente quemado33.
Respecto a las infecciones comunitarias, PA juega un papel importante en las infecciones pulmonares en pacientes con patología estructural crónica, como puede ser la fibrosis quística y las bronquiectasias. En Europa se ha constatado una prevalencia de PA de entre el 40 y el 53% de los enfermos con fibrosis quística mayores de 18años34; de igual modo, PA coloniza con frecuencia el pulmón de los pacientes con bronquiectasias no relacionadas con fibrosis quística, aumentando, además, el riesgo de sufrir una exacerbación35.
Otro grupo de especial riesgo son los pacientes inmunodeprimidos, especialmente aquellos que presentan neutropenia: hasta el 11-13% de las sepsis en el paciente con cáncer están causadas por PA36, siendo frecuente también en pacientes con trasplante de órgano sólido.
Pronóstico de las infecciones por PA-MDRSabemos que las infecciones causadas por PA conllevan, cuando las comparamos con las causadas por otras bacterias, una mayor mortalidad (OR: 1,435; IC95%: 1,043-1,933)37, tanto en la población general como, de forma más marcada, en pacientes neutropénicos con enfermedades hematológicas (OR: 36,07; IC95%: 9,36-138,9)38.
Uno de los factores más influyentes es el tratamiento antibiótico inapropiado39, y este se incrementa ante episodios producidos por patógenos multirresistentes40. En un estudio realizado en 78 hospitales de Estados Unidos se evaluó el exceso de mortalidad y de costes41 relacionados con el hecho de que la PA responsable de la infección sea PA-MDR, estableciendo en un 20% el exceso de mortalidad y en 20.000$ el exceso de coste; y un metaanálisis publicado en 2016 calculó una OR de 3,07 (IC95%: 1,60-5,89) para la mortalidad de las infecciones causadas por PA resistente a carbapenemes42. Sin embargo, Tumbarello et al.43 encontraron que la presencia de PA-MDR, tanto en neumonía como en bacteriemia, no se relaciona con una mayor mortalidad, y que el que es un factor predictor de mortalidad independiente es el tratamiento antibiótico inapropiado.
Tratamiento de las infecciones por PA-MDREn la tabla 2 se muestran los principales antimicrobianos activos frente a PA.
Dosificación de los antibióticos activos frente a Pseudomonas aeruginosa
| Antibiótico | Dosis |
|---|---|
| Amikacina | 20 mg/kg iv y ajuste en función de niveles |
| Cefiderocol | 2 g/8 h iv, infundidos en 3 horas |
| Ceftazidima/avibactam | 2,5 g/8 h iv, infundidos en 3 horas |
| Ceftolozano/tazobactam | 3 g/8 h iv, infundidos en 3 horas |
| Ciprofloxacino | 400 mg/8 h iv |
| Colistina | Dosis inicial: 9 MU colistimetato (300mg de colistina base) iv, infundidas en 0,5-1 horas• Función renal normal: 4,5 MU iv/12 h, infundidas en 0,5-1 h |
| Imipenem-cilastina | 500 mg/6 h iv, infundidos en 30 minutos |
| Imipenem-cilastina-relebactam | 1,25 g/6 h iv, infundidos en 30 minutos |
| Levofloxacino | 750mg iv cada 24 horas |
| Meropenem | 2 g/8 h iv, infundidos en 3 horas |
| Meropenem-vaborbactam | 4 g/8 h iv, infundidos en 3 horas |
| Plazomicina | 15 mg/kg y ajuste en función de niveles |
| Tobramicina | 7 mg/kg iv y ajuste en función de niveles |
Fuente: adaptada de Tamma et al.4.
Ante una infección por PA, conocer el patrón de sensibilidad es de una enorme ayuda, y, en ocasiones, podremos utilizar los antibióticos clásicos. La situación es más compleja cuando se trata de iniciar un tratamiento en un paciente que ha recibido un antibiótico previo. Hemos de tener presente que cuando una cepa de PA es resistente a algún fármaco antipseudomónico, normalmente también lo es a algunos fármacos más. Por ejemplo, los pacientes que han recibido ceftazidima presentarán con mayor frecuencia resistencia cruzada para piperacilina-tazobactam, cefepima o aztreonam, y el uso de imipenem o ceftolozano-tazobactam serían, a priori, mejores opciones44. Lob et al.5 han descrito que, de los aislamientos resistentes a piperacilina-tazobactam, apenas el 20% son sensibles a ceftazidima, y solo alrededor del 40% son sensibles a imipenem o meropenem.
En los últimos años se han desarrollado varios fármacos; algunos son nuevas moléculas, y otros, combinaciones de algunos existentes con inhibidores de betalactamasas, como cefepima-tazobactam, cefepima-enmetazobactam, cefepima-zidebactam, aztreonam-avibactam, meropenem-nacubactam, cefepima-taniborbactam o plazomicina45. Algunos de estos fármacos estarán disponibles próximamente, pero dedicaremos esta revisión a algunas de las opciones disponibles actualmente para el tratamiento de infecciones graves por PA-MDR.
Ceftolozano-tazobactamEste fármaco combina una nueva cefalosporina con un inhibidor de betalactamasas ya conocido. Presenta actividad ante Enterobacteriaceae productoras de betalactamasas de espectro extendido (BLEE), PA, incluidas cepas extremadamente resistentes, y algunas especies de Streptococcus46. Ceftolozano-tazobactam ha sido aprobado para el tratamiento de infecciones intraabdominales complicadas46 e infecciones urinarias complicadas, con una dosificación de 1,5g/8h47, y para el tratamiento de la neumonía nosocomial, incluyendo NAV, con una dosis de 3g/8h48.
En el ensayo clínico aleatorizado (ECA) de infección abdominal se produjo el aislamiento de PA en 72 pacientes (8,9% de los casos), con 9 aislamientos no sensibles a 3 o más clases de antipseudomónicos. La sensibilidad de los aislamientos de PA fue del 98,6% para ceftolozano-tazobactam y del 89.9% para meropenem46. En ITU complicadas, la tasa de erradicación de PA fue superior con ceftolozano-tazobactam que con levofloxacino47. En el ECA de Kollef et al.48, que evaluó la no inferioridad de ceftolozano-tazobactam frente a meropenem en la neumonía nosocomial, la presencia de PA se detectó en 128 (17,6%) de los episodios, y en 50 (39%) de ellos la cepa era MDR o XDR. Los resultados de ceftolozano-tazobactam frente a PA en los ECA y en los principales estudios observacionales se recogen en la tabla 3.
Resultados de ceftolozano-tazobactam frente a Pseudomonas aeruginosa
| Estudio | Infección | C | Erradicación microbiológica | Curación clínica | Mortalidad | |||
|---|---|---|---|---|---|---|---|---|
| CFT/TAZ | C | CFTA/TAZ | C | CFT/TAZ | C | |||
| ASPECT-cUTI47 (ECA) | ITU complicada | Levofloxacino | 85,7% | 58,3% | ||||
| ASPECT-CIAI46 (ECA) | Infección abdominal complicada | Meropenem | 100% | 93,1% | ||||
| ASPECT-NP48 (ECA) | Neumonía nosocomial | Meropenem | 57,1% | 60,0% | 25,4% | 18,5% | ||
| Pogue84 (Obs) | PA-MDR o PA-XDR | Regímenes basados en aminoglucósido o colistina | 81% | 61% | 20% | 25% | ||
| Almangour85 (Obs) | PA-MDR | Colistina | 77% | 57% | 39% | 49% | ||
| Pinilla-Rello86 (Obs) | PA-MDR y PA-XDR | Aminoglucósidos/colistina | 67,4% | 68% | 67,4% | 68,0% | 32,6% | 26,6% |
| Balandin87 (Obs) | PA en UCI. 48,4% MDR, 84,2% R a carbapenem | 42,1% | 71,6% | 36,5% | ||||
| Gallagher88 (Obs) | PA-MDR | 70,7% | 73,7% | 19% | ||||
| Haidar89 (Obs) | PA-MDR | 71% | 10% | |||||
| Munita90 (Obs) | PA resistente a carbapenem | 74% | ||||||
| Bassetti91 (Obs) | 83,2% | |||||||
| Díaz-Cañestro92 (Obs) | 63,8% | 27,6% | ||||||
C: comparador; CFT/TAZ: cefatolozano-tazobactam; ECA: ensayo clínico aleatorizado; ITU: infección tracto urinario; Obs: estudio observacional; PA-MDR: Pseudomonas aeruginosa multirresistente; PA-XDR: Pseudomonas aeruginosa extensamente resistente.
El tratamiento con dosis de 2g de ceftolozano y 1g de tazobactam alcanzaría el objetivo pK/pD (tiempo de permanencia de la concentración de la fracción libre de ceftolozano sobre la CMI —fT>CMI—, que debe ser del 100% en el paciente crítico) en más del 90% de las cepas de PA sensibles al fármaco (CMI ≤4mg/l). Optimizando la administración, mediante infusión extendida (4h), se alcanzaría una probabilidad de alcanzar el objetivo (PTA) >90% en cepas con una CMI hasta 6mg/l, y la administración en perfusión continua permite obtener un PTA >90% incluso en cepas con CMI de 8mg/l y para un objetivo de 100% fT>4xCMI (lo que permitiría, al menos teóricamente, evitar la selección de cepas resistentes)49.
Un metaanálisis que comparó el uso de ceftolozano/tazobactam en monoterapia frente el tratamiento combinado (con una gran variedad de antibióticos, que incluye quinolonas, aminoglucósidos, colistina, carbapenemes y otros beta-lactámicos) detectó una asociación entre el tratamiento combinado y una reducción de la mortalidad (OR: 0,31; IC95%: 0,10-0,97)50.
Ceftazidima-avibactamEn este caso, la combinación se realiza entre una cefalosporina ya conocida, con avibactam, que es un inhibidor de betalactamasas no betalactámico. Avibactam inactiva las betalactamasas de claseA y claseC, algunas de claseD (como OXA-48), pero no las metalobetalactamasas.
Ceftazidima-avibactam está indicado en el tratamiento de infecciones intraabdominales complicadas51, infección complicada del tracto urinario, incluyendo pielonefritis52 y neumonía adquirida en el hospital, incluyendo también NAV53. En los tres casos, los estudios que han permitido alcanzar la indicación de ceftazidima-avibactam fueron de no inferioridad y se comparaba con un carbapenem. Los resultados de ceftazidima-avibactam frente a PA en los ECA y en los principales estudios observacionales se recogen en la tabla 4.
Resultados de ceftazidima-avibactam frente a Pseudomonas aeruginosa
| Estudio | Infección | C | Erradicación microbiológica | Curación clínica | Mortalidad | |||
|---|---|---|---|---|---|---|---|---|
| CAZ/AVI | C | CAZ/AVI | C | CAZ/AVI | C | |||
| Mazuski51 (ECA) | Infección abdominal complicada | Meropenem | 90,6% | 94,4% | ||||
| RECAPTURE52 (ECA) | ITU complicada | Doripenem | 66,7% | 75,0% | ||||
| REPRISE93 (ECA) | ITU e IA complicadas | Mejor terapia disponible | 79% | 60% | 86% | 100% | ||
| REPROVE53 (ECA) | Neumonía nosocomial | Meropenem | 42,0% | 40,0% | 64,3% | 77,1% | ||
| Corbella60 (Obs) | PA-MDR y PA-XDR | 54,1% | 13,1 | |||||
| Vena59 (Obs) | PA resistente a carbapenem | 87,8% | ||||||
| Jorgensen94 (Obs) | PA-MDR | 69,8% | 17,5% | |||||
| Rodríguez-Núñez95 (Obs) | PA-MDR y PA-XDR | 50% | 13 y 38% a 30 y 90 días | |||||
C: comparador; CAZ/AVI: ceftazidima-avibactam; ECA: ensayo clínico aleatorizado; IA: infección abdominal; ITU: infección tracto urinario; Obs: estudio observacional; PA-MDR: Pseudomonas aeruginosa multirresistente; PA-XDR: Pseudomonas aeruginosa extensamente resistente.
Los datos publicados hasta el momento respecto a la optimización en función de parámetros pK/pD de ceftazidima-avibactam para PA son escasos54. La dosis estándar (2g de ceftazidima, 0,5g de avibactam, cada 8h) permite alcanzar un PTA >90%, teniendo como objetivo 100% fT>CMI, en PA sensibles al antibiótico (CMI ≤4mg/l), pero sería necesario aumentar la dosis en caso de CMI más elevada, sin apenas beneficio de la perfusión extendida (más allá de las dos horas) o infusión continua55.
A pesar de la evidencia de sinergia in vitro con antibióticos como meropenem, aztreonam, amikacina, colistina56,57 y fosfomicina58, los resultados clínicos disponibles apuntan a que no existe beneficio del tratamiento combinado para PA59,60. Pese a todo, en general, la mayoría de los pacientes incluidos en los estudios en vida real de tratamiento de PA con ceftazidima-avibactam reciben tratamiento combinado61,62.
CefiderocolCefiderocol es una nueva cefalosporina siderófora, con amplia actividad ante patógenos aerobios gramnegativos, incluyendo las cepas MDR. Cefiderocol aprovecha un mecanismo de transporte iónico, y, tras unirse a hierro libre, penetra en el interior de la bacteria. Cefiderocol es activo frente a enterobacterias, incluyendo BLEE, PA, Acinetobacter baumannii, Stenotrophomonas maltophilia y otras bacterias aerobias gramnegativas, incluyendo sensibles y resistentes a carbapenemes.
Cefiderocol está indicado en el tratamiento de infecciones del tracto urinario complicadas63, infecciones graves por bacterias aerobias gramnegativas resistentes a carbapenem64 y neumonía nosocomial, incluyendo NAV y neumonía asociada a la asistencia sanitaria65. Los estudios se han realizado comparándolo con un carbapenem63,65 o con el mejor tratamiento disponible cuando se investigó en el caso de infecciones por patógenos resistentes a carbapenemes64. Los resultados de cefiderocol frente a PA en estos ECA y un estudio observacional se muestran en la tabla 5.
Resultados de cefiderocol, imipenem-relebactam y meropenem-vaborbactam frente a Pseudomonas aeruginosa
| Estudio | Infección | C | Erradicación microbiológica | Curación clínica | Mortalidad | |||
|---|---|---|---|---|---|---|---|---|
| Cefiderocol | C | Cefiderocol | C | Cefiderocol | C | |||
| Portsmouth63 (ECA) | ITU complicada | Imipenem-cilastatina | Resolución clínica y microbiológica | |||||
| Cefiderocol 47% | ||||||||
| C: 50% | ||||||||
| APEKS-NP65 (ECA) | Neumonía nosocomial | Meropenem | 38% | 46% | 67% | 71% | 8% | 13% |
| CREDIBLE64 (ECA) | PA resistente a carbapenem | Mejor tratamiento posible | 8% | 20% | 58% | 50% | 35%Sin A: 18% | 17%Sin A: 18% |
| Meschiari67 | PA-DTR | 76,5% | 70,6% | 35,3% | ||||
| Imipenem-relebactam | ||||||||
|---|---|---|---|---|---|---|---|---|
| Estudio | Infección | C | Erradicación microbiológica | Curación clínica | Mortalidad | |||
| IMP/REL | C | IMP/REL | C | IMP/REL | C | |||
| RESTORE-IMI 170 (ECA) | PA resistente a imipenem | Imipenem + colistina | 81% | 63% | ||||
| RESTORE-IMI 271 (ECA) | Neumonía nosocomial | Piperacilina/tazobactam | 46,7% | 68% | 33,3% | 12,0% | ||
| Rebold72 (Obs) | 16 infecciones por PA (94% PA-MDR) | 68,7% | 18,7% | |||||
| Meropenem-vaborbactam | ||||||||
|---|---|---|---|---|---|---|---|---|
| Estudio | Infección | C | Erradicación microbiológica | Curación clínica | Mortalidad | |||
| MER/VAB | C | MER/VAB | C | MER/VAB | C | |||
| Alosaimy76 (Obs) | 8 infecciones por PA | 12,5% | ||||||
C: comparador; IMP/REL: imipenem-relebactam; MER/VAB: meropenem-vaborbactam; ECA: ensayo clínico aleatorizado; ITU: infección tracto urinario; Obs: estudio observacional; PA: Pseudomonas aeruginosa; PA-MDR: Pseudomonas aeruginosa multirresistente; PA-DTR: Pseudomonas aeruginosa de difícil tratamiento.
Se recomienda el empleo de cefiderocol en infusión extendida de 3horas, en base a estudios en modelos animales, en los que se ha observado una mayor reducción de la carga bacteriana con esta pauta66.
Es frecuente el uso de cefiderocol combinado con otros antibióticos, pero no disponemos de estudios que hayan evaluado su eficacia67.
Imipenem-cilastatina-relebactamRelebactam es un nuevo inhibidor de betalactamasas activo frente a betalactamasas de claseA y de claseC68. En un estudio enzimológico, Young et al.68 encontraron que la adición de relebactam a imipenem-cilastatina permitía recuperar su actividad frente a PA resistente a imipenem con una disminución de la CMI de hasta 8veces. Lob et al.69 determinaron que la adición de relebactam permitía restaurar la sensibilidad en el 80% de los aislamientos de PA no sensible a imipenem. La combinación de imipenem-cilastatina con relebactam permite también recuperar la actividad frente a KPC y otras enterobacterias productoras de carbapenemasa y PA, incluyendo aquellas que producen o sobreexpresan betalactamasas, pérdida de porinas y bombas de eflujo70. Imipenem-cilastatina-relebactam no es activa frente a carbapenemasas de claseB y de claseD68.
Las indicaciones de imipenem-cilastatina-relebactam aprobadas por la EMA son neumonía nosocomial, incluyendo NAV, bacteriemia que ocurre en asociación o con sospecha de asociación con neumonía nosocomial y en el tratamiento de infecciones producidas por microorganismos gramnegativos en adultos con opciones terapéuticas escasas70,71. En la tabla 4 se muestra un resumen de los resultados de cefiderocol frente a PA en ECA y estudios observacionales.
Un estudio observacional describe el uso de imipenem-relebactam en combinación en alrededor del 30% de los casos72.
Meropenem-vaborbactamMeropenem-vaborbactam está indicado en infecciones del tracto urinario, incluyendo pielonefritis, infecciones intraabdominales complicadas y neumonía nosocomial, incluyendo NAV. La adición de vaborbactam permite la restauración de la actividad frente a algunos bacilos gramnegativos productores de betalactamasas, especialmente los aislamientos de K.pneumoniae productoras de carbapenemasas73, aunque también aumenta, como hemos comentado anteriormente, el porcentaje de sensibilidad para PA. Ninguno de los dos ECA pivotales de meropenem-vaborbactam incluye infecciones por PA74,75, y la experiencia publicada es muy limitada76 (tabla 4).
Recomendaciones de tratamientoSociedades de prestigio y reconocidos expertos han publicado sus recomendaciones de tratamiento para infecciones causadas por BGN multirresistentes, incluyendo PA4,77,78.
Debemos tener en cuenta que existen pocos estudios que haga comparaciones entre los antibióticos activos frente a PA-MDR, ninguno que compare directamente los nuevos antimicrobianos, y debemos ser cautos al comparar resultados de estudios diferentes79.
La Infectious Disease Society of America (IDSA) establece diferentes recomendaciones en función del foco, proponiendo ceftolozano-tazobactam, ceftazidima-avibactam e imipenem-cilastatina-relebactam como tratamiento de primera línea en monoterapia para infecciones por PA-DTR fuera del tracto urinario y cefiderocol como alternativa. Contempla el tratamiento combinado en aquellas situaciones en las que ninguno de los tres antibióticos de primera línea sea activo in vitro, sugiriendo el empleo de un aminoglucósido si es activo, o colistina en caso de que no, combinado con aquel betalactámico con CMI más próxima al umbral de sensibilidad4.
Por su parte, la European Society of Clinical Microbiology and Infectious Diseases (ESCMID), en unas guías avaladas por la European Society of Intensive Care Medicine (ESICM), posiciona a ceftolozano-tazobactam como tratamiento de elección de infecciones graves provocadas por PA resistente a carbapenem (recomendación condicional, con muy bajo nivel de evidencia). Con la misma graduación, recomiendan tratamiento combinado en aquellas infecciones graves en las que sea necesario emplear colistina, aminoglucósidos o fosfomicina, sin establecer recomendaciones sobre tratamiento combinado en caso de empleo de ceftolozano-tazobactam, ceftazidima-avibactam o cefiderocol, por falta de evidencia77.
Bassetti y Garau78 proponen un esquema terapéutico para el tratamiento de la PA resistente a carbapenem, que se inicia con ceftolozano-tazobactam, ceftazidima-avibactam y cefiderocol combinado con colistina/aminoglucósidos/fosfomicina como primeras opciones y, en caso de resistencia a avibactam, relebactam, vaborbactam o ceftolozano-tazobactam, un régimen basado en colistina o aminoglucósidos combinados con un carbapenem y/o fosfomicina y/o rifampicina.
El tratamiento combinado o en monoterapia es un tema controvertido, en el que no disponemos de evidencia suficiente para establecer recomendaciones firmes. Desde un punto de vista teórico, basándonos en estudios de sinergia in vitro frente a PA resistente a carbapenem, es posible que las siguientes combinaciones puedan ser beneficiosas: imipenem +amikacina, ceftolozano-tazobactam +colistina, colistina +imipenem/meropenem y meropenem +amikacina, y muy poco probable que lo sean ceftolozano-tazobactam +aztreonam/amikacina o ceftazidima +amikacina80. Asimismo, se ha observado sinergia in vitro de imipenem-relebactam con colistina, pero no con amikacina, frente a PA-MDR81.
A la hora de recomendar emplear un tratamiento combinado o monoterapia, debemos considerar dos escenarios diferentes: tratamiento empírico o tratamiento dirigido.
En el contexto de un paciente con una sospecha de infección que pueda estar causada por PA-MDR y con criterios de gravedad (sepsis), recomendamos el tratamiento empírico combinado con el objetivo de aumentar las probabilidades de que la pauta antimicrobiana sea activa frente al microorganismo causal82. La elección de los antibióticos dependerá de la microbiología local, teniendo en cuenta los mecanismos de resistencia más frecuente en cada lugar (tabla 1), tanto en PA como, en función del foco de infección, en otros bacilos gramnegativos.
Una vez disponible el antibiograma, consideramos que el tratamiento dirigido puede ser en monoterapia si la PA es sensible a un antibiótico de primera línea: betalactámico clásico o nuevo (con o sin inhibidor de betalactamasas), seleccionado en función del antibiograma, y con dosis ajustadas para obtener el mayor rendimiento pK/pD (tabla 2). En esta situación no hay evidencia de que el tratamiento combinado mejore el pronóstico, y es posible que añada efectos secundarios/toxicidad. En caso de que no sea posible emplear un antibiótico de primera línea, y el régimen deba estar basado en colistina o en un aminoglucósido, creemos oportuno el tratamiento combinado, como sugieren las guías4,77.
ConclusionesDisponemos de dos antibióticos, ceftolozano-tazobactam y ceftazidima-avibactam, que muestran una elevada actividad in vitro incluso frente a PA-MDR, PA-XDR y PA resistente a carbapenemes y que han demostrado unos buenos resultados clínicos en estas infecciones de alta complejidad. Dos nuevos antibióticos, cefiderocol e imipenem-relebactam, muestran resultados prometedores in vitro, si bien la evidencia que los respalda es, hasta el momento, más escasa. Estos antimicrobianos presentan, además, un mejor perfil de seguridad que otros antibióticos clásicos con una actividad in vitro comparable (colistina, aminoglucósidos).
Es fundamental conocer no solo los porcentajes de resistencia/actividad de cada antibiótico frente a PA en nuestro ámbito, sino también los mecanismos de resistencia implicados con mayor probabilidad para poder seleccionar el tratamiento más adecuado.
Conflicto de interesesPablo Vidal-Cortés ha recibido honorarios de MSD, Pfizer y Shionogi. Los demás autores declaran no tener ningún conflicto de intereses.