El tratamiento temprano basado en la monitorización frecuente de parámetros fisiológicos puede disminuir la mortalidad de los enfermos con sepsis grave o shock séptico.
Artículo: Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, et al. for the Early Goal-Directed Therapy Collaborative Group. Early Goal-Directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001;345:1368-77.
Antecedentes: el shock séptico es una entidad clínica que mantiene una elevada mortalidad.
Se han evaluado estrategias de tratamiento basadas en la "optimización" hemodinámica de estos pacientes en la UCI, empleando para guiar esta "optimización" diferentes indicadores como el gasto cardíaco, el transporte de oxígeno o la saturación venosa mixta. Estas estrategias han tenido éxito en pacientes traumatizados o en cirugía de alto riesgo, mientras que han fracasado en los pacientes ya ingresados en UCI. Algunos autores han sugerido que esta diferencia se debe a que la estrategia de "optimización" fracasa cuando se aplica de forma tardía y ya se ha iniciado el proceso del daño multisistémico.
Objetivo: valorar si una estrategia de "optimización" hemodinámica (antes del ingreso en UCI), en comparación con un tratamiento estándar, iniciados ambos de forma temprana, reduce la mortalidad en los pacientes con sepsis grave o shock séptico.
Diseño: ensayo clínico con asignación aleatoria.
Lugar: servicio de urgencias de un hospital terciario norteamericano de 850 camas.
Período de estudio: desde marzo de 1997 a marzo de 2000.
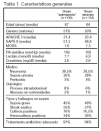
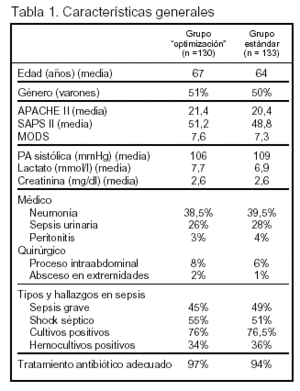
Pacientes (tabla 1) (fig. 1):
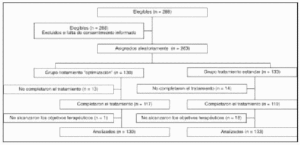
Figura 1
Criterios de inclusión: a) dos de los siguientes criterios de SIRS (temperatura > 38 o < 36 ºC; frecuencia cardíaca > 90 lat/min; frecuencia respiratoria > 20 respiraciones/min o PaCO2 < 32 mmHg; leucocitos > 12.000 o < 4.000/μl o presencia de más del 10% de formas inmaduras); b) presión arterial sistólica < 90 mmHg (tras aporte de cristaloides de 20 a 30 ml/kg de peso en 30 min) o concentración de lactato en sangre ≥ 4 mmol/l.
Criterios de exclusión: edad < 18 años; embarazo; accidente cerebrovascular agudo; síndrome coronario agudo; edema agudo de pulmón; status asmático; arritmia cardíaca como diagnóstico principal; contraindicación para cateterización de vía central; hemorragia digestiva aguda; crisis epiléptica; sobredosis de drogas; quemadura; traumatismo; necesidad de cirugía urgente; inmunodepresión por trasplante o enfermedad sistémica; instrucciones de no resucitación; instrucciones previas de no inclusión en el protocolo de investigación, y cáncer no curado (durante quimioterapia).
Intervenciones que se comparan: todos los enfermos fueron tratados durante las primeras 6 h en el servicio de urgencias y posteriormente fueron ingresados en la UCI.
Los objetivos del tratamiento común para ambos grupos durante las primeras 6 h fueron: a) alcanzar una PVC entre 8 y 12 mmHg mediante administración de cristaloides a velocidad de 500 ml/30 min; b) mantener PA media ≥ 65 mmHg, administrando vasopresores si fuera necesario, y c) obtener diuresis ≥ 0,5 ml/kg/hora (no se especifica ninguna intervención específica para alcanzar este objetivo).
La antibioterapia empírica se inició en ambos grupos a juicio de los médicos encargados del paciente.
Grupo tratamiento "optimización": secuencialmente se actuó del siguiente modo: una vez alcanzada la PVC entre 8-12:
1. Si PA media < 65 mmHg, se administraron vasopresores.
2. Si PA media > 90 mmHg se administraron vasodilatadores.
Una vez conseguida PA media entre 65 y 90 mm Hg,
3. Si la Sv O2 central (catéter en la vena subclavia con medición de saturación de O2 continua) < 70%, se mantuvo hematócrito ≥ 30%, mediante transfusión de hematíes cuando fue necesario.
4. Si la Sv O2 central persistía < 70% se administró dobutamina, comenzando con dosis de 2,5 μg/kg/min e incrementando 2,5 μg/kg/min cada 30 min hasta obtener Sv O2 central ≥ 70% o alcanzar dosis de dobutamina de 20 μg/kg/min o frecuencia cardíaca > 120 lat/min o PA media < 65 mmHg.
5. Si la Sv O2 central persistía < 70% los enfermos fueron sedados y ventilados mecánicamente.
Grupo tratamiento estándar: recibieron el tratamiento común para ambos grupos.
Asignación aleatoria: sí. Oculta.
Enmascaramiento: tras ser los enfermos ingresados en la UCI, los médicos desconocían qué tratamiento habían recibido en el servicio de urgencias.
Desenlaces principales: mortalidad intrahospitalaria.
El período de seguimiento fue hasta 60 días o hasta el fallecimiento.
Análisis por intención de tratar: sí.
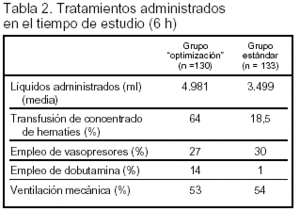
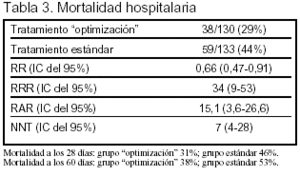
Resultados principales (tablas 2 y 3): los objetivos comunes a ambos grupos (PVC entre 8 y 12 mmHg; PA media ≥ 65 mmHg; diuresis ≥ 0,5 ml/kg/h) fueron obtenidos en el 86% de los pacientes del grupo de tratamiento estándar y en el 99% del grupo de tratamiento de "optimización".
Los enfermos asignados al grupo de tratamiento estándar fueron transferidos a la UCI en 6,3 h (media) y los asignados al tratamiento "optimización" en 8,0 h (p < 0,001)
Información sobre costes: no consta.
Se refiere que no existieron diferencias en la duración de la ventilación mecánica ni en la estancia hospitalaria media, aunque en el subgrupo de los supervivientes la estancia hospitalaria fue 3,8 días inferior en el grupo de tratamiento "optimización".
Financiación del estudio: Henry Ford Health Systems Fund for Research. Edwards Lifesciences (catéteres y equipo de oximetría). Nova Biomedical (equipo para análisis de laboratorio).
Conclusiones de los autores: el tratamiento temprano basado en objetivos terapéuticos específicos para PVC, PA media y Sv O2 central disminuye la mortalidad de los enfermos con sepsis grave o shock séptico.
Conclusiones de los revisores: las conclusiones de los autores deben valorarse con precaución. El análisis de ambos grupos demuestra que los enfermos del grupo con tratamiento estándar recibieron en las primeras 6 horas menos líquidos, y alcanzaron PVC y PA inferiores a las del grupo con tratamiento "optimización", sin que este hecho estuviera justificado por las diferencias en los protocolos de tratamiento, ya que los objetivos terapéuticos iniciales en ambos grupos fueron iguales. Este hecho sugiere que los enfermos del grupo de tratamiento estándar fueron "infrarresucitados" en comparación con los del otro grupo. A favor de esta hipótesis está el hallazgo de que 18 enfermos del grupo con tratamiento estándar no alcanzaron los objetivos terapéuticos iniciales en comparación con uno en el grupo con tratamiento "optimización". Tampoco resultan evidentes las razones por las que los enfermos del grupo "optimización" estuvieron 2 h más en el servicio de urgencias. Otros ensayos clínicos en los que se evaluaron protocolos con objetivos terapéuticos definidos (índice cardíaco, Sv O2) no demostraron reducción de la mortalidad. Las diferencias en los resultados con este ensayo clínico no están suficientemente explicadas, salvo por el posible efecto beneficioso del inicio temprano del tratamiento de estos enfermos. También es difícil precisar qué maniobras de las utilizadas en el tratamiento de los enfermos incluidos en el estudio (administración de fluidos, vasopresores, hematíes o dobutamina) son responsables de la reducción de la mortalidad observada.
Otras referencias
Alía I, Esteban A, Gordo F, Lorente JA, Díaz C, Rodríguez JA, et al. A randomized and controlled trial of the effect of treatment aimed at maximizing oxygen delivery in patients with severe sepsis and shock. Chest 1999;115:453-61.
Gattinoni L, Brazi L, Pelosi P, Latini R, Tognoni G, Pesenti A, et al. A trial of goal-oriented hemodynamic therapy in critically ill patients. N Engl J Med 1995;333:1025-32.
Hayes MA, Timmins AC, Yau EHS, Palazzo M, Hinds CJ, Watson D. Elevation of systemic oxygen delivery in the treatment of critically ill patients. N Engl J Med 1994;330:1717-22.
Kern JW, Shoemaker WC. Meta-analysis of hemodynamic optimization in high-risk patients. Crit Care Med 2002;30:1686-92.
Glosario
RR (riesgo relativo): es el cociente entre el riesgo de que ocurra un suceso en el grupo tratado dividido por el riesgo de que ocurra el suceso en otro/s grupo/s.
En el caso de los ensayos clínicos, se suele comparar el grupo con un tratamiento (experimental) con el grupo control (habitualmente placebo).
RRR (reducción relativa del riesgo): es la reducción proporcional en el riesgo de que ocurra un hecho adverso (p. ej., muerte) expresada en porcentaje. Se calcula (1-RR) *100%.
RAR (reducción absoluta del riesgo): es la diferencia entre el riesgo de que ocurra un hecho adverso en el grupo control menos el riesgo de que ocurra en el grupo tratado expresada en porcentaje. Se calcula (Rc Rt) * 100.
IRR (incremento relativo del riesgo): es el aumento proporcional en la incidencia de un hecho desfavorable expresada en porcentaje. Se calcula (RR-1)*100%.
IAR (incremento absoluto del riesgo): es la diferencia entre el riesgo de que ocurra un hecho adverso en el grupo tratado menos el riesgo de que ocurra en el grupo control expresada en porcentaje. Se calcula (Rt Rc) *100.
IRB (incremento relativo del beneficio): es el aumento proporcional en la incidencia de un hecho favorable expresada en porcentaje. Se calcula (RR-1)*100%.
IAB (incremento absoluto del beneficio): es la diferencia entre el beneficio en el grupo tratado menos el beneficio en el grupo control, expresada en porcentaje. Se calcula (Rt Rc) *100.
NNT (número necesario para tratar): es el número de pacientes que hay que tratar para prevenir un efecto adverso. Se calcula 100/RAR.
NNP (número necesario para perjudicar): es el número de pacientes que hay que tratar para provocar un efecto adverso. Se calcula 100/IAR.
OR (odds ratio): debe considerarse como un estimador del riesgo relativo.