La trombosis de senos venosos cerebrales (TSVC) es una entidad rara que ocurre generalmente en jóvenes (menores de 50 años) suponiendo un 0,5-1% de todos los ictus1. La pandemia de coronavirus 2019 (COVID-19) ha tenido un importante impacto sociosanitario. A día de hoy, el desarrollo de vacunas es la principal herramienta terapéutica2. Comentamos 2casos de TSVC que precisaron ingreso en la Unidad de Cuidados Intensivos (UCI).
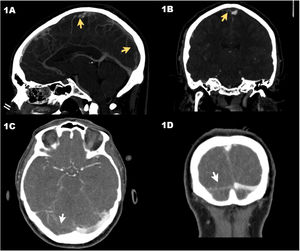
El caso 1 se trata de un varón de 30 años que acudió a Urgencias por cefalea intensa 8 días después de recibir la primera dosis de la vacuna del vector adenoviral recombinante que codifica el antígeno de la proteína de la espícula del coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2) (ChAdOx1 nCov-19, AstraZeneca). La tomografía computarizada (TAC) craneal no mostró hallazgos significativos. Tras observación de 8h en Urgencias, mantuvo la cefalea y destacó la elevación del D-dímero, pasando de 5.360 a 49.732 ng/ml; se repitió la TAC craneal con estudio vascular (incluyendo venograma), observándose TSVC longitudinal superior (fig. 1A y B). En la evolución el paciente desarrolló trombocitopenia (78.000 plaquetas/μl), confirmándose finalmente el diagnóstico de trombocitopenia inmune protrombótica inducida por vacuna (VIPIT) con la positividad de los anticuerpos antifactor plaquetario 4 (anti-FP4) utilizando la técnica de enzimoinmunoanálisis de adsorción (ELISA). El paciente desarrolló crisis comiciales generalizadas tónico-clónicas con posterior bajo nivel de consciencia, con una puntuación en la escala de coma de Glasgow (GCS) de 6 (M: 4, O: 1, V: 1). Ingresó en la UCI, donde presentó pupilas medias arreactivas; se repitió la TAC craneal en la que se observó infarto venoso agudo parietal izquierdo, con signos de transformación hemorrágica e importante edema cerebral. Junto con Neurocirugía y Neurorradiología, se decidió la colocación de drenaje ventricular externo (DVE) y trombectomía mecánica. Los procedimientos se realizan sin incidencias y en la angiografía de sustracción digital se consigue adecuado resultado angiográfico tras 2pases de stent Retriever® (Stryker Neurovascular, Kalamazoo, MI, EE. UU.). El paciente desarrolló hipertensión intracraneal refractaria a medidas de tercer nivel. El doppler transcraneal mostró ondas sistolizadas. Se mantuvo tratamiento con argatroban con dosis entre 0,5-1 μg/kg/min, ajustándose para un tiempo parcial de tromboplastina activado de 1,5-3 veces el control, e inmunoglobulinas humanas inespecíficas (Flebogamma®; Grifols, S. A., Barcelona, España) a dosis de 1 g/kg/día durante 3días. Finalmente, al cuarto día de ingreso, se confirmó el diagnóstico de muerte encefálica.
Tomografía axial computarizada (TAC) en fase venosa del caso 1, en la que se observa la trombosis del seno venoso longitudinal superior (flechas) en el corte sagital (A) y coronal (B). TAC en fase venosa del caso 2 con ausencia de repleción del seno venoso transverso derecho (flechas) en el corte axial (C) y coronal (D).
El caso 2 es una mujer de 64 años que acudió a Urgencias por cefalea de 2semanas de evolución, con un incremento manifiesto en las 48h previas al ingreso, que se acompañó de inestabilidad de la marcha. Había recibido la primera dosis de la vacuna ChAdOx1 nCov-19. Buen nivel de consciencia (GCS 15). En la TAC craneal se observó un infarto cerebeloso derecho con transformación hemorrágica y en el estudio vascular presentó TSVC del transverso derecho (fig. 1C y D). Destacaban la trombocitopenia (64.240 plaquetas/μl) y la elevación de D-dímero hasta 51.292 ng/ml. Se trasladó a nuestro centro, donde se completó el estudio de posible VIPIT, el cual se confirmó con la positividad de anticuerpos anti-FP4. Se decidió manejo conservador y se mantuvo en neurovigilancia, iniciándose tratamiento anticoagulante con argatroban y Flebogamma® a dosis similares a las del caso 1. A las 12h del ingreso en la UCI presenta midriasis arreactiva de pupila derecha y disminución del nivel de consciencia, con deterioro del GCS a 8 (M: 4, O: 2, V: 2); en la TAC craneal presentó hidrocefalia. Se decidió la colocación de DVE. La paciente evolucionó favorablemente, se retiró la ventilación mecánica al 5.° día y el DVE al 10.° día. Al alta de la UCI (día 11), la paciente permanecía consciente, colaboradora, sin focalidad neurológica y con una escala de Rankin modificada de 1. El resumen analítico y de las características clínicas se presentan en la tabla 1.
Resumen de características clínicas, analíticas, tratamientos y resultados de los 2casos
| Características | Caso 1 | Caso 2 |
|---|---|---|
| Edad (años) | 30 | 64 |
| Sexo | Varón | Mujer |
| Antecedentes | Ninguno | Vejiga hiperactiva, osteoporosis |
| Tratamiento previo | Ninguno | Tramadol más paracetamol, solifenacina, denosumab |
| Tiempo vacuna-hospitalización (días) | 8 | 22 |
| Tiempo Urgencias-diagnóstico (h) | 18 h 42 min | 1 h 32 min |
| Tiempo Urgencias-UCI (h) | 25 h 18 min | 06 h 09 min |
| Tiempo Urgencias-anticoagulación objetivo (h) | 33 h 20 min | 22 h 29 min |
| Síntomas | Cefalea brusca, mialgias | Cefalea, náuseas, vómitos, inestabilidad de la marcha |
| Localización lesiones | Trombosis seno longitudinal superior, infarto parietal izquierdo con transformación hemorrágica, edema cerebral | Trombosis seno venoso transverso derecho, infarto cerebeloso con transformación hemorrágica |
| GCS (M, O, V) al momento de valoración por UCI | GCS 6 (M: 4, O: 1, V: 1) | GCS 15 (M: 6, O: 4, V: 5) |
| Alteraciones pupilares | Medias y arreactivas (bilateral) | Midriasis unilateral (derecha) arreactiva |
| Crisis comiciales | Sí | No |
| Anticuerpos anti-FP4 | Positivo | Positivo |
| Anticoagulación | Argatroban | Argatroban |
| Otros tratamientos | Inmunoglobulinas. DVE, trombectomía mecánica | Inmunoglobulinas. DVE |
| Resultado al alta de UCI | Muerte | Vivo | ||
| Ingreso | Nadir (día) | Ingreso | Nadir (día) | |
| Plaquetas (100-400 ×1.000/μl) | 212 | 9 (3) | 64 | 49 (2) |
| TTPa (20-38,0 s) | 25 | 90,2 (3) | 30 | 65,7 (3) |
| TT (15,8 s) | 17 | NV | 19.2 | NV |
| Actividad de protrombina (70-120%) | 88 | 18 (3) | 87 | 35 (3) |
| INR (0,8-12) | 1.1 | 3,8 (3) | 1,07 | 1,9 (3) |
| Fibrinógeno (derivado, 180-350 mg/dl) | 492 | 272 (2) | 229 | 234 (2) |
| D-dímero (0,0-500,0 ng/ml) | 5.360 | 220.914 (2) | 51.292 | 64.805 (2) |
| PCR (0-8,0 mg/dl) | 26.7 | 100,7 (2) | 47,.9 | 50,2 (2) |
| PCR SARS-CoV-2 | Negativo | Negativo | ||
DVE: drenaje ventricular externo; FP4: factor plaquetario 4; GCS: Glasgow Coma Scale; h: horas; INR: razón internacional normalizada; M: motor; mg/dl: miligramos por decilitros; ng/ml: nanogramos por decilitros; NV: no valorado; O: ocular; PCR SARS-CoV-2: reacción en cadena de polimerasa del coronavirus 2 del síndrome respiratorio agudo severo; PCR: proteína C reactiva; s: segundos; TT: tiempo de trombina; TTPa: tiempo parcial de tromboplastina activado; U/l: unidades por litro; UCI: Unidad de Cuidados Intensivos; V: verbal.
La TSVC es una entidad poco frecuente, con una incidencia anual de entre 0,22 y 1.57 cada 100.000 habitantes, afecta mayormente a mujeres jóvenes (35-40 años) y se asocia a estados protrombóticos genéticos o adquiridos1.
Se ha visto que la infección por SARS-CoV-2 es un factor de riesgo para desarrollar TSVC. Un estudio retrospectivo demostró un aumento en la incidencia de TSVC después del inicio de la pandemia COVID-19 (42,8 por millón de habitantes), lo cual era mayor en comparación con pacientes con influenza (RR=3,83, IC del 95%, 1,56-9,41, p <0,001) y a personas que recibieron la vacuna del ARNm (RR=6,67, IC del 95%, 1,98-22.43, p <0,001)3.
Recientemente, se han asociado episodios de trombosis y trombocitopenia con el uso de algunas vacunas contra el SARS-CoV-2 que se ha denominado VIPIT. Al parecer, su etiopatogenia es debida a un mecanismo autoinmune similar al observado en la trombocitopenia inducida por heparina4. Su manejo y diagnóstico no están del todo claros, pero destaca su alta mortalidad, la aparición de trombosis en sitios inusuales y la presencia de anticuerpos anti-FP4 en pacientes no expuestos previamente a heparinas4,5.
Tras la aparición de los primeros casos de TSVC, en España se suspendió el uso en menores de 60 años de la vacuna ChAdOx1 nCov-196. A fecha del segundo ingreso, España había administrado 3.817.930 dosis de la vacuna ChAdOx1 nCov-19, de las cuales 161.800 correspondía a nuestra región (Castilla-La Mancha)7. Según el 5.° informe de farmacovigilancia sobre vacunas de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), en España se habían notificado 11 casos de VIPIT, de los cuales 3 fallecieron8. Nosotros comentamos 2 casos de TSVC asociados a la vacuna ChAdOx1 nCov-19, en los que uno tuvo un desenlace fatal. El manejo se realizó siguiendo las recomendaciones internacionales con inmunoglobulinas y tratamiento anticoagulante mediante argatroban. Cabe señalar que el fondaparinux, la bivalirudina y los inhibidores directos del factor X activado, como el rivaroxabán y apixabán, son alternativas al argatroban9.
La heterogeneidad en la presentación clínica dificulta su abordaje precoz, lo cual puede impactar en los resultados5. El paciente que falleció tuvo mayores tiempos desde que es admitido en urgencia hasta el diagnóstico (18 h 42min vs. 1 h 32min) hasta el ingreso en UCI (25 h 18min vs. 6 h 09min), y hasta la anticoagulación objetivo (33 h 20min vs. 22 h 29min). La realización de trombectomía mecánica tampoco fue útil, a pesar de tener un buen resultado angiográfico.
A día de hoy, se trata de una entidad extremadamente rara, cuya relación con la vacuna ha generado alarma por su severidad y el impacto que produciría la suspensión de la vacuna en un escenario como el actual. Sin embargo, muchos aspectos quedan por dilucidar en lo que se refiere al origen, la presentación, la evolución, el pronóstico y el manejo. Se debe destacar que una TAC normal no excluye el diagnóstico de TSVC. En todo caso, acelerar el enfoque diagnóstico y terapéutico puede repercutir en los resultados, por lo que es importante estar atentos ante pacientes que, tras la vacunación, presenten datos clínicos compatibles.
Al Servicio de Medicina Intensiva del Complejo Hospitalario de Toledo.