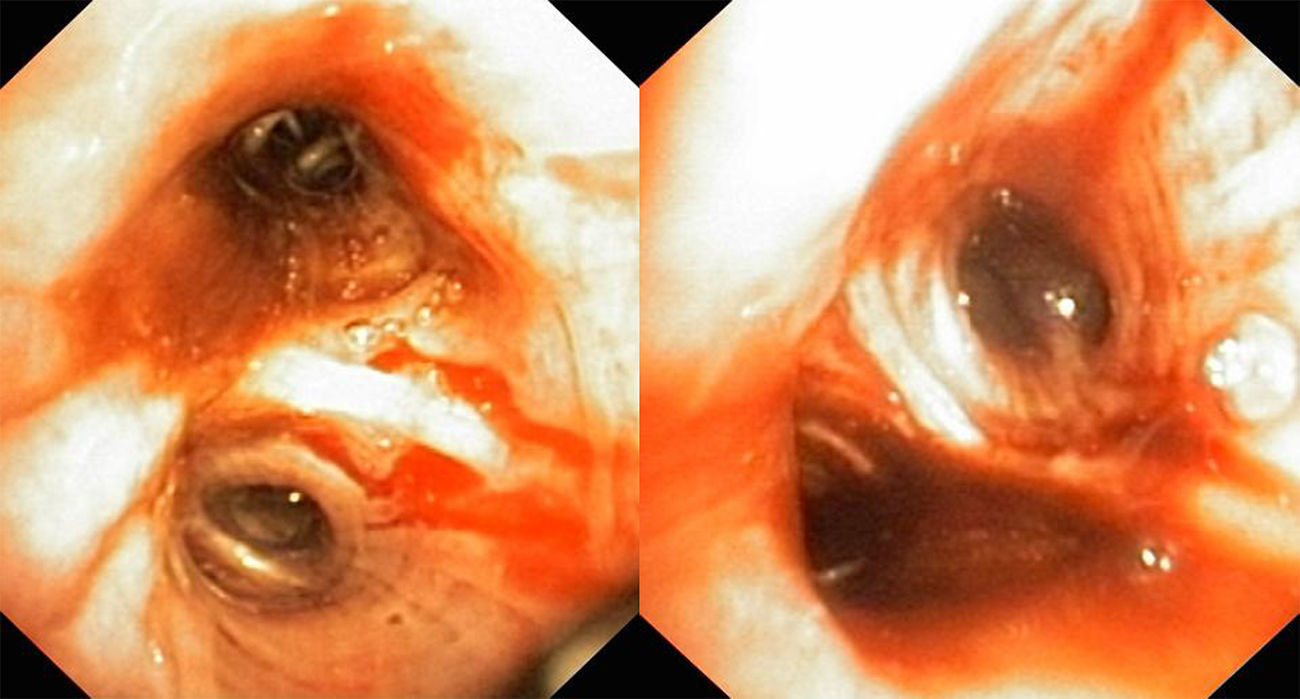
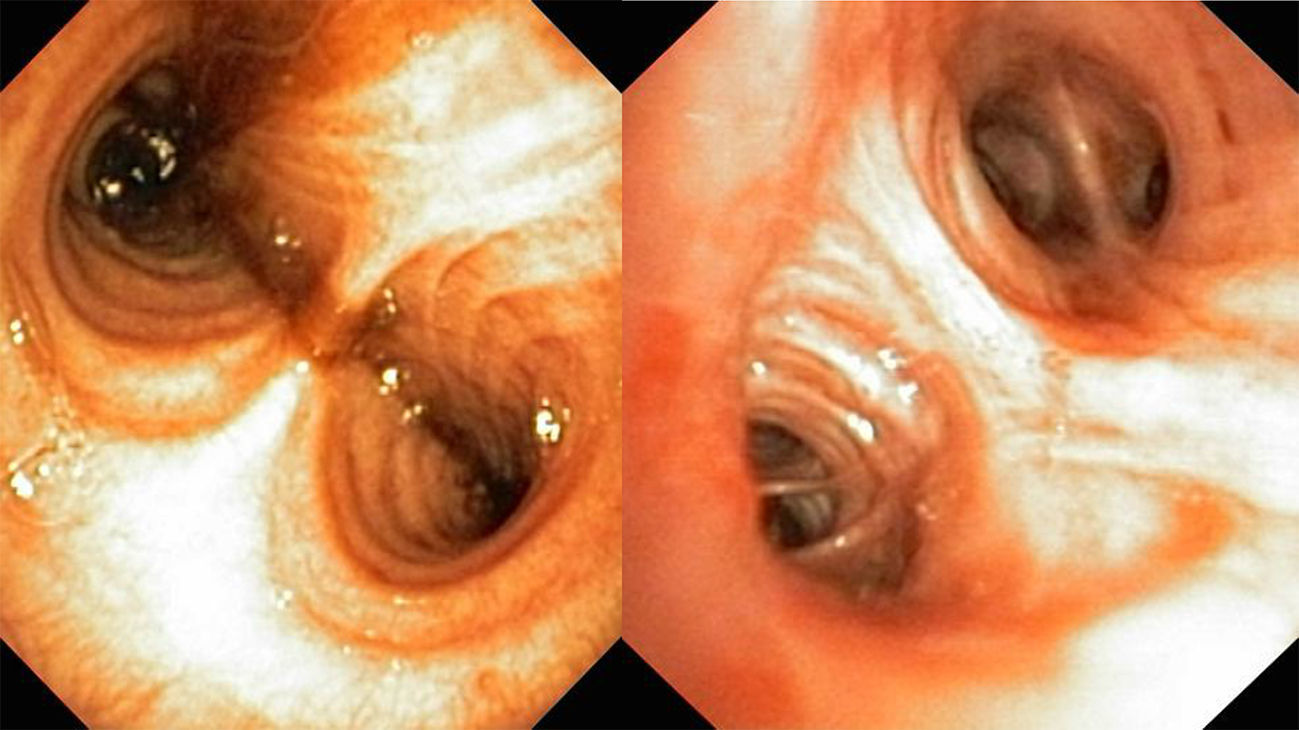
Cuatro etiologías suponen el 90% de las causas de hemoptisis masiva: cáncer, tuberculosis, neumonía y bronquiectasias1, seguidas de otras entre las que se encuentra la hipertensión pulmonar (HTP).
Presentamos un caso de hemoptisis multifactorial (infección, HTP y anticoagulación) en el postoperatorio de una paciente sometida a cirugía cardiaca, tratada con éxito con factor VII recombinante activado (rFVIIa) aplicado mediante lavado broncoalveolar (LBA), técnica descrita en pocos casos en la literatura2,3.
Se trata de una paciente mujer de 63 años con antecedentes de hipertensión arterial, fibrilación auricular crónica, hematoma subdural traumático, portadora de prótesis mecánicas mitral y aórtica, con doble lesión tricúspide con insuficiencia severa, estenosis moderada e HTP severa y deterioro de la función ventricular derecha leve.
La paciente fue intervenida de reparación de los velos anterior y posterior de la válvula tricúspide con parche de pericardio y se colocó un anillo tricuspídeo. Durante el postoperatorio en la UCI una de las complicaciones más relevantes fue un cuadro de hemoptisis multifactorial (infección, anticoagulación e HTP).
Se descartaron otras etiologías diferentes a las mencionadas previamente. Una vez resuelta la infección pulmonar, el sangrado no se pudo solo atribuir a anticoagulación, ya que persistió tras su retirada. Se realizaron varias broncoscopias diagnósticas y terapéuticas, que evidenciaron diferentes localizaciones del sangrado en el árbol bronquial. Precisó transfusión de hemoderivados en el contexto de sangrado activo (normalizando todos los parámetros hematológicos sin un control eficaz del sangrado pulmonar). Se realizó un estudio basal de la coagulación por parte de hematología que resultó normal a posteriori. Una vez descartadas y resueltas otras posibles causas, se realizó tratamiento dirigido al control de la HTP (depleción de volumen, sildenafilo, óxido nítrico, etc.), que mejoró las cifras sistólicas de presión pulmonar de 82mmHg hasta 52mmHg. Las pruebas de imagen (angio-TC, arteriografías y venografías pulmonares) llevadas a cabo, no identificaron un punto de sangrado activo, a pesar de ello, ante el sangrado bronquial permanente, se realizó una embolización de las arterias bronquiales que no controló el sangrado. Se descartó además, la intervención quirúrgica, dadas las múltiples localizaciones de sangrado.
Ante la persistencia de la hemoptisis y tras el fracaso de los otros tratamientos descritos se decidió realizar un LBA con rFVIIa como medida compasiva, lo que permitió controlar el sangrado de manera inmediata. La técnica consistió en administrar 50μg/kg de rFVIIa en 50ml de suero salino, introduciendo 25ml en cada bronquio2. El sangrado pulmonar se controló de manera inmediata, lo que se comprobó mediante una fibrobroncoscopia a los 30min de la instilación y a las 48h. La paciente permaneció libre de sangrado durante 16 días tras la aplicación de rFVIIa. Finalmente, falleció tras 48 días de ingreso en UCI por un shock séptico con fracaso multiorgánico secundario a neumonía por Pseudomonas aeruginosa.
Las hemoptisis se presentan con un patrón muy heterogéneo, desde formas crónicas, hasta eventos catastróficos de hemorragia masiva asociada a shock hipovolémico y deterioro cardiopulmonar que pone en peligro la vida del paciente. Nosotros presentamos un caso con buen resultado inmediato en el control del sangrado, donde otras alternativas habían fracasado (figs. 1 y 2).
El rFVIIa es una glicoproteína de 406 aminoácidos, análogo sintético del factor VII plasmático, con una estructura y actividad similar, un peso molecular de 50kDa y una vida media de 3h. Se desarrolló a partir de los años 80 para el tratamiento de hemorragia en enfermos con hemofilia o deficiencia congénita del factor VII. A partir de los años 90, se publicaron las primeras series de su uso en enfermos no hemofílicos con hemorragia grave de diferentes etiologías4.
La utilización del rFVIIa en las hemoptisis se ha descrito en casos clínicos aislados o series pequeñas; habitualmente se trata de hemorragias alveolares secundarias a procesos autoinmunes o posteriores a trasplantes hematopoyéticos5. Está registrado su empleo en sangrados secundarios a metástasis de coriocarcinoma6, sangrado por aspergilosis7 y fibrosis quística8.
El mecanismo de acción del FVII recombinante activado se fundamenta en la interacción con el factor tisular (FT) y la superficie plaquetaria, que genera un proceso que implica las fases de iniciación, amplificación y propagación, cuyo objetivo final es la producción de trombina. Se acepta que el factor VIIa actúa sobre la hemostasia local, en el sitio del daño, evitando así el efecto de hipercoagulabilidad sistémico, y los indeseables efectos trombóticos. Existen 2 mecanismos para su acción: el primero, consiste en la generación de trombina tras la activación del factor X por el complejo FT y factor VIIa, este mecanismo se ha denominado como dependiente del FT. El segundo, se produce por la adición de FVIIa con plaquetas activadas, produciendo la síntesis de trombina (independiente del FT).
El FT alveolar se ha demostrado en altas concentraciones en condiciones de inflamación pulmonar, lo que desembocaría en una activación de la vía dependiente del FT a nivel local.
Los efectos adversos relacionados con la administración intravenosa, se relacionan con la presencia de FT expuesto anormalmente en el endotelio enfermo con el consecuente riesgo de trombosis arterial o venosa9. Diversos estudios evalúan el uso de rFVIIa intravenoso en hemorragia refractaria en pacientes sometidos a cirugía cardiaca, algunos de ellos, muestran un incremento en la incidencia de accidentes cerebrovasculares10. Debido a estos posibles efectos adversos, en nuestro caso, se decidió la aplicación broncoalveolar y no la endovenosa.
A pesar de que describimos un único caso, lo que indudablemente limita las conclusiones, la utilización de rFVIIa resultó determinante para el control del sangrado en esta paciente, ya que otros tratamientos fracasaron previamente y se evidenció la resolución inmediata de este con fibrobroncoscopia tras su aplicación.
Tras todo lo expuesto, podemos decir que la aplicación broncoalveolar de rFVIIa puede ser una alternativa eficaz y segura para el control de la hemoptisis cuando fracasan otros tratamientos.
AutoríasTodos los autores ha participado en la/el: concepción y diseño del manuscrito, recogida de datos, interpretación de los datos, redacción, revisión y aprobación del manuscrito remitido.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Pablo Alonso.