Conocer los tipos de terapias de depuración extracorpórea (TDE) utilizadas en los Servicios de Medicina Intensiva (SMI), sus indicaciones y pautas de prescripción.
DiseñoEstudio multicéntrico observacional y prospectivo.
ÁmbitoServicios de Medicina Intensiva.
PacientesTodos los pacientes ingresados en los SMI que requirieron TDE durante 2 meses en 2011.
IntervencionesNinguna.
Variables de interésCaracterísticas demográficas y basales de los pacientes, características de las TDE y materiales utilizados.
ResultadosSe analizó a 33 pacientes. Las TDE se iniciaron en las primeras 24 h de ingreso en un 52% (n = 17). En un 18% (n=6) de pacientes se inició en el estadio R de disfunción renal aguda (DRA) según el RIFLE. La patología más frecuente asociada a la DRA fue el síndrome de disfunción multiorgánica en un 64% (n=21). El 24% (n=8) mantenía estabilidad hemodinámica al inicio de la TDE y el tipo de terapia más utilizada en estos pacientes fueron las terapias continuas de depuración extracorpórea (TCDE) en un 63% (n=5). El 76% (n=25) de los pacientes presentaron inestabilidad hemodinámica y en todos la terapia utilizada fue la TCDE. Se utilizó anticoagulación en un 55% (n=18) de casos y la vía de acceso preferida fue la femoral derecha en un 61% (n=20). En el 84% (n=28) de los pacientes se utilizó una dosis pautada de ultrafiltración ≤ 35ml/kg/h.
ConclusionesLos SMI estudiados siguen las recomendaciones actuales del uso de las TDE. Existe una mayor preferencia de las terapias continuas frente a las intermitentes, indistintamente al estado hemodinámico del paciente.
To assess the indications, settings and techniques used in renal replacement therapy (RRT) in Intensive Care Units (ICUs).
Study designA prospective, multicenter observational study was carried out.
SettingIntensive Care Units.
PatientsAll patients admitted to ICUs during the two-month study period in 2011 who required RRT.
InterventionsNone.
Variables of interestPatient demographic characteristics, baseline clinical data, RRT technique and materials used.
ResultsThirty-three patients were analyzed. RRT was started within the first 24hours after ICU admission in 17 of the 33 patients (52%). At the start of RRT, 18% of the patients (n=6) presented grade R on the RIFLE acute kidney injury (AKI) scale. The most common disorder associated with AKI was multiple organ dysfunction syndrome (64%; n=21). At the start of RRT, most patients (76%; n=25) presented hemodynamic instability, while the remaining 24% (n=8) were considered hemodynamically stable. The most common RRT technique in hemodynamically stable patients was continuous renal replacement therapy (CRRT) (63%; n=5). CRRT was the technique of choice in all 25 of the hemodynamically unstable patients (100%). Anticoagulation was used in 55% (n=18) of the patients. In most cases (61%, n=20), RRT was administered through the right femoral vein. In 84% (n=28) of the patients, the ultrafiltration effluent flow rate was ≤ 35ml/kg/h.
ConclusionsThe ICU physicians in this study followed current RRT guidelines. CRRT was preferred over intermittent renal replacement therapy, regardless of patient hemodynamic status.
Las terapias de depuración extracorpórea (TDE) son tratamientos cada vez más utilizados en los Servicios de Medicina Intensiva (SMI)1. Aproximadamente, un 4% de los pacientes que ingresan en los SMI requieren TDE, siendo su principal indicación la disfunción renal aguda (DRA)2. Un estudio realizado en los SMI españoles evidenció una prevalencia de DRA grave (aclaramiento de creatinina<60ml/min−1/1,73 m−2) del 42,4%, con una mortalidad del 29,7%3. En otro estudio previo realizado también en SMI españoles4, la necesidad de TDE fue de un 38% y el 75% de estas técnicas fueron terapias continuas de depuración extracorpórea (TCDE).
Las TCDE fueron descritas a finales de los años 70 por Kramer et al.5. Desde entonces, su uso se ha extendido, siendo en la actualidad un procedimiento habitual en los SMI6. Las TCDE han experimentado una constante evolución, lo que permite en la actualidad disponer de sistemas y accesorios más efectivos y fáciles de utilizar. Este desarrollo de las TCDE ha permitido ampliar sus indicaciones, por ejemplo, como coadyuvante en el shock séptico, como terapia antiinflamatoria-inmunomoduladora y en intoxicaciones, entre otras7,8. La efectividad en estas indicaciones denominadas no renales7 es controvertida y su utilización en los distintos SMI es desconocida.
En la actualidad, no disponemos de un estudio epidemiológico sobre la aplicación de las TDE en los SMI de Cataluña. Por esta razón, hemos realizado un estudio observacional que nos permita conocer los tipos de terapias utilizadas y sus indicaciones y pautas prescritas en la práctica clínica habitual. La finalidad del presente estudio ha sido obtener una primera aproximación del uso de las TDE en los SMI de Cataluña que sirva de base para la realización de estudios más amplios y específicos que están en ejecución9.
Materiales y métodosEl estudio fue realizado en 6 SMI polivalentes (4 de tercer nivel y 2 comarcales) de Cataluña, España. Los servicios participantes fueron: H. de la Santa Creu i Sant Pau, Barcelona (644 camas), H. Germans Trias i Pujol, Badalona (617 camas), H. Parc Taulí, Sabadell (452 camas), H. General de Granollers, Granollers (320 camas), Hospital de Barcelona SCIAS, Barcelona (300 camas), y H. General de Vic, Vic (300 camas).
Con excepción de un SMI que no disponía de terapias intermitentes, todos los demás podían realizar TDE continuas e intermitentes.
PacientesTodos los pacientes ingresados en los SMI participantes durante los meses de junio y julio del 2011 y que requirieron de TDE fueron incluidos en el estudio.
ProtocoloSe trata de un estudio multicéntrico, prospectivo, observacional y sin intervención alguna. Se incluyó a los pacientes en el momento en que su médico responsable decidió iniciar la TDE. Considerando las características del estudio, no se pidió consentimiento informado al paciente. El estudio fue autorizado por el Comité de Ética del Hospital Germans Trias i Pujol, Badalona, Cataluña.
La definición y la clasificación de la DRA se basaron en el consenso del grupo ADQI, del inglés Acute Dialysis Quality Initiative10, que recibe el acrónimo de RIFLE, del inglés Risk (riesgo), Injury (daño), Failure (fallo), Loss and End-stage kidney failure (pérdida y fallo renal terminal).
En pacientes con creatinina basal desconocida y sin historia de fracaso renal crónico se asumió el valor basal de 1,25mg/dl.
El momento de inicio de la TDE se clasificó de 2 maneras11-13: 1) según el tiempo desde el ingreso en el SMI: a) inicio temprano, con tiempo de inicio inferior a 24 h desde ingreso al SMI, y b) inicio tardío, con tiempo de inicio mayor a 24 h desde ingreso al SMI, y 2) según la clasificación RIFLE: a) inicio temprano, con el nivel R de esta clasificación, y b) inicio tardío, con el nivel I o F.
Para cada paciente se recogieron sus características demográficas y basales (edad, género, peso, creatinina al ingreso); las características al inicio de la TDE (creatinina, hematocrito, diuresis 24 h antes del inicio de la TDE); patología asociada a la DRA (síndrome de disfunción multiorgánica [SDMO], hiperhidratación, DRA aislada, trastorno de la temperatura, trastornos hidroelectrolíticos); situación hemodinámica; características de la TDE (tipo de TDE, filtro y catéter utilizados, acceso venoso, volumen de líquido de reposición prefiltro y posfiltro, volumen de líquido de diálisis, velocidad de bomba de sangre, volumen de extracción, tipo de anticoagulación); indicación de cambio de filtro (aumento exponencial de presión transmembrana [PTM], PTM>200mmHg, coagulación de filtro, 72 h de uso).
Análisis estadísticoLos datos fueron analizados empleando el programa informático estadístico SPSS v. 17.0 (SPSS INC., Chicago, EE. UU.). Las variables cuantitativas se expresan como mediana y rango intercuartílico. Las variables cualitativas se expresan en número y porcentaje.
ResultadosSe incluyó a 36 pacientes; 3 formularios de recolección estuvieron incompletos y fueron excluidos del análisis.
La mediana de la edad fue de 67 (62-76) años, con un peso real de 80 (70-95) kg. El 79% (n=26) fueron varones. La creatinina al ingreso en el SMI fue de 2,41 (1,24-3,82) mg/dl.
La patología más frecuente asociada a la DRA fue el SDMO en un 64% (n=21), seguido de la hiperhidratación refractaria a diuréticos en un 18% (n=6) de los casos (tabla 1).
Indicaciones y terapias de depuración extracorpórea de inicio
| Patología asociada a la DRA | |
| Síndrome de disfunción multiorgánica | 21 (64) |
| Hiperhidratación refractaria a diuréticos | 6 (18) |
| DRA aislada | 4 (12) |
| Trastornos de la temperatura | 1 (3) |
| Trastornos hidroelectrolíticos | 1 (3) |
| TDE de inicio con estabilidad hemodinámica (n=8) | |
| TCDE | 5 (63) |
| Hemodiálisis intermitente | 3 (37) |
| TCDE de inicio con inestabilidad hemodinámica (n=25) | |
| Hemodiafiltración | 18 (72) |
| Hemofiltración | 5 (20) |
| Hemodiálisis | 2 (8) |
DRA: disfunción renal aguda; TDE: terapia de depuración extracorpórea; TCDE: terapia continua de depuración extracorpórea.
Los valores están expresados en número (porcentaje).
El 24% (n=8) de los pacientes presentaron estabilidad hemodinámica en el momento del inicio de la TDE y las terapias más empleadas en estos pacientes fueron las TCDE en el 63% (n=5). El 76% (n=25) de los pacientes presentaron inestabilidad hemodinámica y en todos se empezó con TCDE (tabla 1).
La creatinina al inicio de la TDE fue de 2,70 (2,20-4,06) mg/dl. El 100% de los pacientes cumplían alguno de los criterios de RIFLE antes del inicio de la TDE, siendo en la mayoría de casos de la categoría F (61%, n=20) (tabla 2). Se evidenció un inicio temprano de las TDE en un 18% (n=6) y en un 52% (n=17) de pacientes, según la clasificación RIFLE y el tiempo de ingreso al SMI, respectivamente (tabla 2).
Características de los pacientes y momento de inicio de la terapia
| Creatinina (mg/dl), mediana (RI) | 2,70 (2,20-4,06) |
| Diuresis total de las 24 h previas (ml), mediana (RI) | 600 (184-1183) |
| Hematocrito (%), mediana (RI) | 29 (27-32) |
| Tiempo de ingreso en el SMI antes de inicio (días), mediana (RI) | 1 (0-4) |
| RIFLE | |
| Riesgo, n (%) | 6 (18) |
| Lesión, n (%) | 7 (21) |
| Fallo, n (%) | 20 (61) |
| Inicio temprano de TDE según RIFLE, n (%) | 6 (18) |
| Inicio tardío de TDE según RIFLE, n (%) | 27 (82) |
| Inicio temprano de TDE según tiempo de ingreso en el SMI, n (%) | 17 (52) |
| Inicio tardío de TDE según tiempo de ingreso en el SMI, n (%) | 16 (48) |
RI: rango intercuartílico; RIFLE: Risk (riesgo), Injury (daño), Failure (fallo) y Loss and End-stage kidney failure (pérdida y fallo renal terminal); SMI: Servicio de Medicina Intensiva; TDE: terapia de depuración extracorpórea.
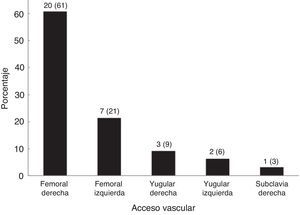
El tipo de filtro más utilizado fue el de membrana de poliacrilonitrilo de 0,9 m2 en el 72% (n=24) de los pacientes; el catéter más utilizado fue el de 13Fr y 20cm de longitud en un 52% (n=17) de casos y se utilizó anticoagulación en el 54% (n=18) de los pacientes (tabla 3). La vía de acceso preferida fue la femoral derecha en un 61% (n=20) (fig. 1).
Prescripción inicial de la TDE y materiales utilizados
| Extracción de líquidos (ml/h), mediana (RI) | 55 (0-100) |
| Velocidad de sangre (ml/min), mediana (RI) | 220 (200-250) |
| Fracción de filtración (%), mediana (RI)a | 17 (13-21) |
| Dosis de ultrafiltración | |
| Inferior a 35 ml/kg/h, n (%) | 14 (42) |
| Igual a 35 ml/kg/h, n (%) | 14 (42) |
| Superior a 35 ml/kg/h, n (%) | 2 (6) |
| Sin ajuste según el peso, n (%) | 3 (9) |
| Pauta de líquido de reposición | |
| Posfiltro, n (%) | 16 (49) |
| Prefiltro, n (%) | 8 (24) |
| Sin reposición, n (%) | 5 (15) |
| Pre y posfiltro, n (%) | 4 (12) |
| Tipo y dosis de anticoagulación | |
| Ninguna, n (%) | 15 (46) |
| Heparina Na+ dosis<500 UI/h, n (%) | 11 (33) |
| Heparina Na+ dosis>500 UI/h, n (%) | 4 (12) |
| Heparinas de bajo peso molecular, n (%) | 3 (9) |
| Tipo de filtro utilizado | |
| Membrana de poliacrilonitrilo de 0,9 m2, n (%) | 24 (72) |
| Membrana de polisulfona de 1,2 m2, n (%) | 3 (10) |
| Membrana de polisulfona de 1,9 m2, n (%) | 6 (18) |
| Tipo de catéter utilizado | |
| 11 Fr y 20cm, n (%) | 5 (15) |
| 12 Fr y 20cm, n (%) | 4 (12) |
| 13 Fr y 20cm, n (%) | 17 (52) |
| 13 Fr y 25cm, n (%) | 6 (18) |
| 14 Fr y 25cm, n (%) | 1 (3) |
| Reemplazo de filtro | |
| Aumento exponencial de PTM, n (%) | 13 (39) |
| PTM>200mmHg, n (%) | 10 (30) |
| Coagulación de filtro, n (%) | 4 (12) |
| A las 72 h de uso, n (%) | 1 (4) |
| Otros, n (%) | 5 (15) |
PTM: presión transmembrana; RI: rango intercuartílico; TDE: terapia de depuración extracorpórea.
En el 42% (n=14) de los pacientes se utilizó una dosis pautada de ultrafiltración inferior a 35ml/kg/h. Similar porcentaje se evidenció con una dosis pautada de 35ml/kg/h. En el 6% (n=2) de los pacientes se pautó una dosis superior a 35ml/kg/h y en el 9% (n=3) de los pacientes no se ajustó la dosis de ultrafiltración según el peso.
En la mayoría de las ocasiones, el líquido de reposición fue pautado posfiltro, 49% (n=16). El cálculo de la fracción de filtración se realizó en el 85% (n=28) de los pacientes. La fracción de filtración fue del 17% (13-21). El criterio para cambiar el filtro del circuito fue un aumento exponencial de la PTM en un 39% (n=13) de los casos, seguido de la presencia de una PTM superior a 200mmHg en el 30% (n=10) de los casos (tabla 3).
DiscusiónEl presente estudio evidencia que en los SMI de Cataluña las TCDE son preferidas frente a las intermitentes, independientemente del estado hemodinámico del paciente. En la mitad de los pacientes ingresados, el inicio de las TDE es temprano de acuerdo con el tiempo de ingreso en el SMI (menos de 24 h); sin embargo, presentan un grado avanzado de disfunción renal. La indicación más frecuente de la TDE fue la DRA asociada a disfunción multiorgánica, el acceso venoso preferido fue el femoral y la dosis de ultrafiltración pautada en la mayoría de las situaciones fue igual o inferior a 35ml/kg/h, con una fracción de filtración ligeramente inferior a la adecuada.
Tipo de técnicaVarios estudios previos no han evidenciado una mejoría en los resultados de supervivencia con el uso de las TCDE frente a las intermitentes14-16. Las TCDE presentan mejor tolerancia hemodinámica15,17, lo que hace que su indicación se establezca en pacientes con inestabilidad hemodinámica18. Sin embargo, su superioridad en este aspecto frente a las terapias intermitentes sigue siendo controvertido19,20. Un estudio monocéntrico21 realizado en uno de los SMI que participan en este trabajo evidenció un aumento progresivo del uso de las TCDE, sin cambios en el porcentaje de uso de las terapias intermitentes. En ese mismo estudio21, las terapias intermitentes se indicaron en aproximadamente la mitad de los pacientes y como técnica de destete. Un importante hallazgo de nuestro trabajo, es la preferencia de las TCDE frente a las intermitentes y que su indicación es independiente del estado hemodinámico del paciente.
Dentro de los diferentes tipos de TCDE disponibles, la hemofiltración y la hemodiafiltración continuas son las más empleadas en nuestro estudio, al igual que en los diferentes SMI alrededor del mundo22. Aunque la hemofiltración continua es más efectiva en la eliminación de moléculas de mediano tamaño, no ha demostrado mejoría de la supervivencia frente a la hemodiálisis continua22. El uso de hemofiltración continua se ha relacionado con un menor tiempo de duración del filtro y, consecuentemente, un mayor costo de la terapia22.
La elección de la técnica inicial debe realizarse de manera individualizada considerando en primer lugar la situación clínica y metabólica del paciente. Si el estado clínico lo permite, se debe meditar sobre el mayor valor económico que implica el uso de las terapias continuas frente a las intermitentes23,24, así como de la hemofiltración continua frente a la hemodiálisis continua22, sin existir diferencias en la supervivencia entre ellas14-16,22.
Momento de inicio de la terapia de depuración extracorpóreaEl momento óptimo para iniciar la terapia de reemplazo renal en la DRA es controvertido. Múltiples criterios, basados en la urea y la creatinina séricas, la diuresis o el grado de RIFLE, han sido utilizados para clasificar a los pacientes en inicio temprano o tardío11-13. Diversos estudios y metanálisis25,26 han puesto de manifiesto la mejoría en los resultados y en la supervivencia de los pacientes en los que se ha iniciado la terapia de forma temprana. Sin embargo, la diversidad en el diseño de estos estudios y en la definición de inicio temprano y tardío hace que su recomendación sea relativa mientras no existan estudios aleatorizados y multicéntricos que reafirmen los resultados. Chou et al.27, en un estudio en pacientes sépticos, evidenciaron que la clasificación de tiempo de inicio de las TDE basándose en la escala RIFLE (R=inicio temprano, i o F=inicio tardío) fue un marcador pobre para predecir los beneficios del inicio temprano o tardío.
En la actualidad, existen algunas recomendaciones para el inicio de las TDE. Bagshaw et al.28 propusieron un algoritmo basado en indicaciones absolutas, grado de RIFLE e indicaciones no renales. En España, Leoz et al.29 también han elaborado una guía con recomendaciones para el inicio y la forma de inicio de las TDE. Desconocemos si en el presente estudio los facultativos se basaron en alguna de estas guías. Lo que destaca en nuestro trabajo es que el inicio de las TDE fue en la mitad de los pacientes durante el primer día de ingreso en el SMI; pero al considerar el grado de disfunción renal, su inicio es tardío, es decir, cuando existe un alto grado de lesión renal (i o F de la clasificación).
Indicación y dosis de ultrafiltradoEn el presente estudio, al igual que en estudios previos2, la principal indicación de las TDE es la DRA asociada al SDMO. En la actualidad, se postula que la DRA asociada a la sepsis es una entidad propia y distinta de la de la DRA aislada. Hay cambios histopatológicos en la sepsis, como la infiltración leucocitaria de los capilares glomerulares y la apoptosis tubular renal, que son distintos de la necrosis tubular aguda, que sí se observa en la DRA aislada30.
En el año 2000, Ronco et al.31 plantearon que la dosis de ultrafiltrado no debe ser inferior a 35ml/kg/h por su impacto en la supervivencia de los pacientes con DRA en el contexto de SDMO. Estudios posteriores, que compararon dosis altas (≥ 35ml/kg/h) frente a dosis menores de ultrafiltrado en pacientes con DRA de múltiple etiología, no evidenciaron diferencias en la supervivencia32-34. Un reciente estudio35 demostró que con dosis de ultrafiltrado bajas (14ml/kg/h) se obtienen similares resultados que con las dosis denominadas estándar (20-25ml/kg/h). En la actualidad, las guías Kidney Disease Improving Global Guidelines (KDIGO) recomiendan el uso de las dosis estándar18.
En nuestro estudio, solamente en un porcentaje muy pequeño de pacientes se utilizaron dosis superiores a 35ml/kg/h. A la espera de nuevos estudios que determinen la dosis inicial adecuada, es recomendable el uso de la llamada dosificación dinámica, que consiste en ajustar la depuración extracorpórea en función del estado metabólico y la evolución clínica del paciente36.
Catéter y acceso vascularEl acceso vascular y el catéter utilizado son fundamentales para el correcto funcionamiento y duración de la TDE. En situaciones de riesgo, como insuficiencia respiratoria, alteraciones de la coagulación, etc., la vía femoral sigue siendo la vía recomendada37. La vía yugular facilita la movilización al paciente y no presenta diferencias frente a la vía femoral en términos de disfunción o duración del catéter38. Además, el acceso yugular derecho parece más eficiente cuando se plantea administrar dosis altas de depuración extracorpórea38. En la actualidad, se recomienda el uso de catéteres de mayor diámetro interno y con longitud necesaria para alcanzar un vaso con el mayor calibre posible y evitar así la recirculación39.
El presente estudio evidencia que los profesionales siguen las recomendaciones al utilizar la vía femoral con catéteres de diámetro suficiente. Sin embargo, si se utiliza la vía femoral, deberían emplearse catéteres de mayor longitud para alcanzar la vena cava inferior y mejorar la eficacia de la TDE.
AnticoagulaciónEl uso de anticoagulantes en las TDE es una importante medida para prolongar la duración del filtro. Llama la atención que en la mitad de los pacientes de este estudio no se utilizó anticoagulación. Una posible explicación sería la alteración de la coagulación que se asocia a la disfunción multiorgánica. Sin embargo, se debería considerar el uso de dosis bajas de heparina sódica, que no alteran los parámetros de hemostasia y pueden aumentar la duración del filtro40. La heparina sigue siendo el medicamento más utilizado en los SMI de todo el mundo40. Las guías actuales18 recomiendan en las TCDE valorar la utilización de anticoagulación regional con citrato. En nuestro estudio, la heparina sódica fue el fármaco más utilizado, pero debemos recalcar que este estudio fue realizado antes de la publicación de las guías mencionadas18.
LimitacionesEl presente trabajo tiene las limitaciones propias de un estudio observacional, con un número pequeño de pacientes, y de ser realizado en SMI con experiencia en el manejo de las TDE.
ConclusionesEl presente estudio nos proporciona una aproximación del uso actual de las TDE en los SMI de Cataluña y ha servido de base para realizar estudios más amplios y específicos que están en curso. Los profesionales de estas unidades siguen las recomendaciones del uso de las terapias de reemplazo renal, aunque llama la atención la mayor preferencia de las terapias continuas frente a las intermitentes, indistinta del estado hemodinámico del paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.