La ventilación mecánica (VM) es clave en el manejo del síndrome de distrés respiratorio del adulto (SDRA) ya que existe un alto nivel de evidencia de que la ventilación con volúmenes tidales de 6ml/kg (ventilación protectora) mejora la supervivencia. La oxigenación con membrana extracorpórea (ECMO) veno-venosa es una terapia de rescate en el tratamiento de la insuficiencia respiratoria refractaria que mejora la oxigenación, reduce el CO2 y facilita la aplicación de VM protectora, reduciendo potencialmente la lesión pulmonar asociada a VM.
Aunque las estrategias ventilatorias en pacientes con SDRA han sido analizadas en numerosos estudios, no existe consenso respecto a cómo ventilar a pacientes con ECMO veno-venosa. El concepto de «lung rest», introducido hace años, carece aún de evidencias para recomendar su uso pero podría promover la recuperación pulmonar y facilitar el destete de la VM.
El objetivo de esta revisión es describir las diferentes estrategias de ventilación en pacientes tratados con ECMO veno-venosa.
Mechanical ventilation (MV) is a crucial element in the management of acute respiratory distress syndrome (ARDS), because there is high level evidence that a low tidal volume of 6ml/kg (protective ventilation) improves survival. In these patients with refractory respiratory insufficiency, venovenous extracorporeal membrane oxygenation (ECMO) can be used. This salvage technique improves oxygenation, promotes CO2 clearance, and facilitates protective and ultraprotective MV, potentially minimizing ventilation-induced lung injury.
Although numerous trials have investigated different ventilation strategies in patients with ARDS, consensus is lacking on the optimal MV settings during venovenous ECMO. Although the concept of “lung rest” was introduced years ago, there are no evidence-based guidelines on its use in application to MV in patients supported by ECMO. How MV in ECMO patients can promote lung recovery and weaning from ventilation is not clear.
The purpose of this review is to describe the ventilation strategies used during venovenous ECMO in clinical practice.
La VM constituye la base del tratamiento de los pacientes afectados de SDRA e insuficiencia respiratoria de otras etiologías. Hasta la fecha, solo el uso de VM con volúmenes bajos y limitación de presión meseta (Pm) ha demostrado una reducción de la mortalidad en estos pacientes1. En estudios más recientes, la VM en decúbito prono mejoró la supervivencia en pacientes con SDRA grave2.
A pesar de los avances tecnológicos que han tenido lugar en los últimos años, la mortalidad del SDRA sigue siendo alta, situándose en torno al 40-50%3. En las formas más graves, con gradiente PaO2/FiO2 ≤ 100mmHg, según la nueva definición de Berlín4, la mortalidad esperable sería del 45%, pero históricamente se han reportado mortalidades que pueden ser superiores al 60%5. No obstante, en un trabajo reciente donde se incluyó a 98 pacientes con SDRA, la mortalidad hospitalaria fue del 37,7%, que no varió entre el grupo con SDRA moderado y grave, siendo esta dependiente de otros factores, como la Pm>30cmH2O durante las primeras 72 h6.
La oxigenación con membrana extracorpórea (ECMO) permite dar soporte respiratorio mediante ECMO veno-venoso (ECMO VV) o soporte cardiaco y respiratorio con la configuración veno-arterial (ECMO VA). Su uso ha crecido en los últimos años, debido fundamentalmente a los buenos resultados de la técnica (especialmente con ECMO VV) en la epidemia de gripe A H1N1, donde se alcanzaron supervivencias del 77% con el uso de la técnica en centros de referencia7, y también debido a los avances tecnológicos (uso de bombas centrífugas, membranas de oxigenación de mayor duración), una mayor biocompatibilidad de los sistemas y unos menores requerimientos de anticoagulación8.
La ECMO es una terapia de rescate en la insuficiencia respiratoria refractaria, que permite oxigenar y depurar CO2, pero además permite aplicar una estrategia de ventilación protectora (Vt 4-8ml/kg de peso ideal, Pm < 28-30cmH2O) o «ultraprotectora» (Vt ≤ 4ml/kg de peso ideal, Pm<25cmH2O), para minimizar la lesión pulmonar inducida por VM (VILI)9. Con dispositivos más sencillos que la ECMO VV, los denominados depuradores de carbónico (ECCO2R), se ha demostrado una reducción en la concentración de citocinas a nivel pulmonar (en el lavado broncoalveolar) ventilando con Vt ≤ 6ml/kg de peso ideal, consiguiendo de manera eficaz una eliminación de CO210. Estos dispositivos eliminan CO2 de manera efectiva en pacientes con hipercapnia de varias etiologías, pero también permiten realizar una ventilación ultraprotectora en pacientes con SDRA grave, cuyo beneficio está por determinar11. En ausencia de ECMO VV o ECCO2R, estaríamos obligados a aceptar unos niveles de hipoxemia y/o hipercapnia permisiva que no están claramente establecidos. No obstante, aunque este tipo de ventilación con ECMO VV o con ECCO2R parece prometedora, no se ha demostrado aún un efecto beneficioso en la mortalidad12, y en la actualidad la mayoría de los centros priorizan el destete de los dispositivos extracorpóreos frente el destete del respirador13.
No existen guías de evidencia clínica que nos recomienden ventilar a los pacientes en ECMO VV de una manera determinada, aunque el 77% de los centros con experiencia aplican el concepto de «lung rest», con bajo Vt, baja frecuencia respiratoria (FR) y PEEP elevada13.
Lesión pulmonar inducida por ventilación mecánicaLa VILI se produce a 4 niveles. La utilización de elevadas presiones meseta generará barotrauma, la lesión derivada de la ventilación con Vt alto causará volutraumatismo y la activación de determinados procesos inflamatorios en células epiteliales y endoteliales alveolares inducidas por una VM agresiva dará lugar al biotraumatismo. Además, el cierre y la reapertura cíclica de las unidades alveolares generarán atelectraumatismo, definido este como el porcentaje de pulmón colapsado que se abre al final de la inspiración y se colapsa de nuevo al final de la espiración14.
El pulmón con SDRA es heterogéneo. En estudios con tomografía computarizada (TC) torácica se ha comprobado que existen zonas de alvéolos colapsados en zonas dependientes y otras con alvéolos ventilados en zonas no dependientes, siendo estas últimas las que reciben la mayor parte del Vt. Utilizando ventilación protectora con Vt de 6ml/kg, produciremos sobredistensión alveolar en casi un 30% de los pacientes con SDRA1. Los pacientes con SDRA que son tratados con ECMO están profundamente hipoxémicos, con grandes áreas de pulmón colapsado, frecuentemente afectando a los 4 cuadrantes pulmonares, de manera que las áreas de alvéolos ventilados reciben la mayor parte del Vt y están sujetos a sobredistensión, a pesar del uso de ventilación protectora15. No obstante, no parece que el Vt exclusivamente tenga un papel importante en el desarrollo del VILI, pero necesitamos información regional y dinámica de la ventilación y de la circulación pulmonar de los pulmones con SDRA para evaluar la aplicación de diferentes estrategias de ventilación. En este sentido, además de la TC torácica, la tomografía de impedancia eléctrica (TIE) permite tener una visión a tiempo real de la ventilación regional y proporcionarnos información de cómo afectan los diferentes parámetros ventilatorios al pulmón para minimizar la VILI16.
Desconocemos cuánto contribuyen el cierre y la apertura cíclica, y la sobredistensión alveolar al VILI. En un estudio con pacientes afectados de lesión pulmonar aguda y SDRA manejados con PEEP alta se midieron la actividad inflamatoria alveolar mediante tomografía por emisión de positrones y la distensión alveolar mediante TC al final de la inspiración y al final de la espiración. La inflamación en las áreas de pulmón ventilado y del resto del pulmón se relaciona con valores de Pm>26-27cmH2O, pero no se encontró relación entre actividad metabólica y cierre/apertura cíclica alveolar17.
El uso de PEEP alta para mejorar el reclutamiento alveolar minimizando la sobredistensión alveolar no ha demostrado reducir la mortalidad en pacientes con SDRA18. En pacientes tratados con ECMO, el uso de niveles altos de PEEP (> 10cmH2O) en los 3 primeros días de soporte extracorpóreo se asoció de manera independiente a una reducción de la mortalidad19.
Por tanto, una estrategia de ventilación protectora debe ser una constante en los pacientes con SDRA con o sin ECMO, pero desconocemos cómo utilizar la PEEP para reducir la VILI en estos pacientes donde la heterogeneidad pulmonar es una realidad. El incremento de PEEP protege al pulmón siempre y cuando se acompañe de un cambio en la mecánica pulmonar, es decir, que el mismo Vt produzca una mejoría en la compliance respiratoria (CRS)20. Por ello los estudios con utilización de elevados niveles de PEEP no han demostrado beneficios en supervivencia21, pero la PEEP sí ha mostrado beneficio en pacientes con mayor reclutabilidad pulmonar22.
Es la reducción de la driving pressure (ΔP=Vt/CRS) la que se ha asociado a una mejoría en la supervivencia en pacientes con SDRA, teniendo en cuenta que la CRS está íntimamente relacionada con el volumen pulmonar aireado, es decir, el tamaño pulmonar funcional20. Calculada como Pm-PEEP (cmH2O), si la ΔP decrece, el pronóstico mejora; si la ΔP aumenta, el pronóstico empeora.
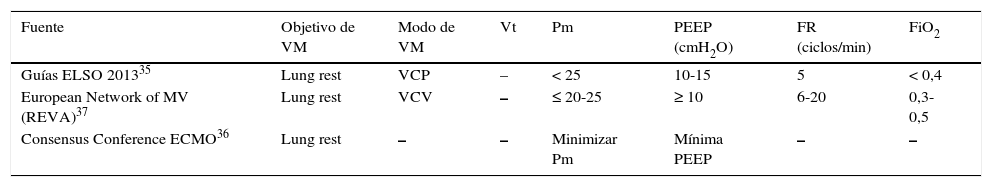
Modo de ventilación mecánica con membrana de oxigenación extracorpóreaNo está establecido qué modo de VM debemos utilizar en pacientes tratados con ECMO y no disponemos de ningún estudio comparativo. En la tabla 1 se muestran los diversos modos de ventilar a los pacientes en ECMO VV según las distintas opiniones de expertos.
Ventilación mecánica en ECMO VV según las distintas opiniones de expertos
| Fuente | Objetivo de VM | Modo de VM | Vt | Pm | PEEP (cmH2O) | FR (ciclos/min) | FiO2 |
|---|---|---|---|---|---|---|---|
| Guías ELSO 201335 | Lung rest | VCP | – | < 25 | 10-15 | 5 | < 0,4 |
| European Network of MV (REVA)37 | Lung rest | VCV | – | ≤ 20-25 | ≥ 10 | 6-20 | 0,3-0,5 |
| Consensus Conference ECMO36 | Lung rest | – | – | Minimizar Pm | Mínima PEEP | – | – |
PEEP: presión positiva al final de la espiración; Pm: presión meseta; FiO2: fracción inspiratoria de oxígeno; FR: frecuencia respiratoria; REVA: Réseau Europeen de Recherche en Ventilation Artificielle; VCP: ventilación controlada por presión; VCV: ventilación controlada por volumen; VM: ventilación mecánica; Vt: volumen tidal.
En un estudio reciente internacional en el que formaron parte 141 centros de 28 países de todos los continentes pertenecientes a la Extracorporeal Life Support Organization (ELSO), la mayoría de ellos (62%) utilizaban modos controlados de VM, mientras que solo un 27% usaba modos asistidos en pacientes con ECMO VV13. En el estudio internacional de Camporota et al., recientemente publicado, con 133 centros encuestados, el modo controlado por presión fue el utilizado en el 64,4% de los centros, la presión asistida en el 47,3%, la BIPAP en el 17,1%, el modo controlado por volumen en el 11,6% y el airway pressure release ventilation (APRV) en el 4,6%, el neurally adjusted ventilatory assist (NAVA) y la ventilación de alta frecuencia en el 1% de los centros encuestados23. Por último, en un estudio multicéntrico realizado en 3 hospitales de Australia y Francia, el 55% de los pacientes tratados con ECMO (ECMO VV en el 98% de los casos) recibieron modos controlados por presión19.
En general, los modos por presión permiten monitorizar diariamente el Vt, informándonos de la mejoría o empeoramiento de la compliance pulmonar, pudiendo hacer incrementos en el Vt hasta alcanzar al menos 6ml/kg para iniciar destete de ECMO VV. El inconveniente es que en el modo asistido la limitación del Vt puede resultar dificultoso24. El modo APRV requiere ventilación espontánea del paciente, pudiendo ser una alternativa al modo presión control en pacientes con ventilación espontánea15.
En las fases iniciales del SDRA es más difícil mantener la respiración espontánea y frecuentemente el paciente está bloqueado neuromuscularmente. Tras esta fase, la ventilación espontánea permite un entrenamiento de los músculos respiratorios y de la actividad diafragmática con una reducción de las necesidades de sedación, pero mal aplicada puede empeorar la asincronía paciente-ventilador24. El modo NAVA en pacientes con ECMO reduce el número de asincronías paciente-ventilador en la fase de recuperación de la función pulmonar25.
Volumen tidal y presión meseta con membrana de oxigenación extracorpóreaEntre los centros pertenecientes a la ELSO y respecto al Vt utilizado, el 76% de ellos reconocieron que ventilaban a sus pacientes con Vt ≤ 6ml/kg y un 21% no especificaba ninguna cifra de Vt durante el soporte con ECMO VV13. En animales, la reducción del Vt<4ml/kg de peso ideal ha demostrado una reducción del edema pulmonar y de la lesión pulmonar26. En el estudio multicéntrico Xtravent, la «ventilación ultraprotectora» con ECCO2R frente a una ventilación protectora no demostró una reducción en los días de VM, pero sí una reducción en los niveles de interleucina-6 alveolar12, ya reportada previamente10. En el análisis post hoc, en el grupo de pacientes con PaO2/FiO2 ≤ 150mmHg se objetivó una reducción en los días de VM en el grupo tratado con ECCO2R (40,9±12,8 vs. 28,2±16,4; p=0,033)12.
En una revisión sistemática reciente con 2.042 pacientes de 49 estudios, la tendencia es a utilizar una estrategia «ultraprotectora», ventilando con Vt ≤ 4ml/kg para limitar la Pm a ≤ 30cmH2O, reflejo quizá de la imposibilidad de mantener una adecuada ventilación sin riesgo de daño pulmonar antes de instaurar el soporte extracorpóreo26. En otra encuesta internacional, un 31% de centros ventilaban a los pacientes en ECMO con una estrategia «ultraprotectora»13. Según diversos estudios, cómo utilicemos la VM durante el soporte con ECMO VV, parece tener impacto en la mortalidad15,26,27. El estudio de Pham et al. pone de manifiesto que la reducción de la Pm en el día 1 de ECMO se asocia de forma independiente a una reducción de la mortalidad28. De la misma manera, en un estudio multicéntrico internacional uno de los factores predictores de muerte en pacientes tratados con ECMO fue la Pm>30 cmH2O previa a la instauración de ECMO19.
El score de riesgo de mortalidad Predicting death for severe ARDS on VV-ECMO (PRESERVE) tiene en cuenta 8 parámetros pre-ECMO para predecir la probabilidad de supervivencia en pacientes con SDRA severo tratados con ECMO VV. La edad, en índice de masa corporal, la inmunosupresión, el uso de decúbito prono, los días de VM, el SOFA, la PEEP y la Pm>30 cmH2O fueron los parámetros calculados29.
No existen recomendaciones de cómo proceder a la reducción del Vt una vez iniciado el soporte con ECMO VV. Podría recomendarse una reducción en los días 1-3 del inicio del soporte hasta menos de 4ml/kg de peso ideal19. En un estudio reciente, solo el parámetro Pm ≤ 31cmH2O se asoció a supervivencia hospitalaria30.
Presión positiva al final de la espiración con membrana de oxigenación extracorpóreaEn pacientes con SDRA, la PEEP se aplica para mantener el reclutamiento pulmonar, mejorar la oxigenación y prevenir el VALI (atelectraumatismo con cierre y apertura cíclica alveolar). No obstante, la sobredistensión alveolar y el aumento de la poscarga ventricular derecha son efectos deletéreos del uso indiscriminado de PEEP.
Es controvertido qué nivel de PEEP debemos utilizar en pacientes tratados con ECMO. La reducción del Vt, especialmente cuando hacemos «ventilación ultraprotectora» (Vt<4ml/kg de peso ideal), puede provocar atelectasias con empeoramiento de la relación ventilación/perfusión. Por ello la ELSO recomienda un nivel de PEEP de 10cmH2O, a diferencia de la pauta que establecen Richard et al. en la Conferencia de Consenso, donde simplemente recomiendan el uso de una «PEEP mínima» para una «Pm mínima» (tabla 1). Niveles más altos de PEEP podrían provocar sobredistensión alveolar18, además de reducción del retorno venoso en pacientes con ECMO VV y deterioro de la función ventricular derecha en ECMO VA15.
En pacientes con ECMO VV, la PEEP no es necesaria para mejorar la oxigenación, excepto en pacientes que están profundamente hipoxémicos o que necesitan flujos de sangre elevados (> 5 l/min) durante el soporte (p. ej., pacientes en shock séptico). A diferencia de la ECMO VV, los sistemas ECCO2R precisan de PEEP y FiO2 en el respirador para mejorar la oxigenación ya que funcionan con un flujo de sangre mucho menor que la ECMO VV y la depuración de CO2 depende fundamentalmente del flujo de gas11,31,32.
En ECMO, el uso de niveles altos de PEEP favorecería el reclutamiento alveolar, lo que podría acelerar la recuperación pulmonar mediante la prevención de fuga capilar y activación macrofágica generada en áreas de hipoxia pulmonar inducidas por la presencia de atelectasias10,28,33.
En una encuesta internacional con 133 centros, en el 63% de ellos el nivel de PEEP era fijo, el 21% ajustaba según compliance, el 9,3% según radiografía y el 7,3% mediante TIE. El 34,9% de los centros utilizaba niveles de PEEP ≥ 10cmH2O y el 27,9% por debajo de este punto. Solo el 15,5% usaba niveles de PEEP 15-20 cmH2O33.
Como se ha comentado anteriormente, en un estudio retrospectivo, el uso de PEEP por debajo de 10cmH2O durante los 3 primeros días de tratamiento con ECMO se asoció a mayor mortalidad. Por otro lado, en un estudio más reciente, retrospectivo, con 62 pacientes, el incremento en el nivel de PEEP en un punto se asoció a un 36,2% de descenso en la odds ratio de supervivencia a los 30 días del alta (IC del 95%=10,8% a 54,4%, p = 0,009) (PEEP supervivientes 8,5±2, supervivientes 7,3±2; p = 0,04)30. Es posible que en un grupo de pacientes expuestos a mayor sobredistensión el efecto de la PEEP sea deletéreo y en aquellos pacientes con más áreas reclutables podamos utilizar niveles más altos de PEEP34.
Sería, por tanto, muy difícil recomendar un nivel de PEEP en estos pacientes. En la tabla 1 figuran las diferentes recomendaciones de grupos de expertos. La ELSO en sus últimas guías advierte de que «en pacientes con fallo respiratorio y ECMO podría ser un error intentar reclutar volumen pulmonar en fases iniciales», lo que iría a favor del riesgo de sobredistensión pulmonar en determinados pacientes, recomendando unos niveles de PEEP entre 5-15cmH2O35. En el mismo sentido, en la única Conferencia de Consenso europea en ECMO del año 2014, la recomendación para ventilar el SDRA en ECMO sería «ajustar la VM para minimizar la Pm mientras aplicamos un mínimo de PEEP»36. El Réseau Europeen de Recherche en Ventilation Artificielle (REVA) recomendaba en pacientes con SDRA por gripe A H1N1 reducir el Vt para mantener una Pm ≤ 20-25cmH2O, aplicando un nivel de PEEP ≥ 10cmH2O37.
Como se ha comentado en el apartado anterior, es la reducción en driving pressure (ΔP = Pm – PEEP) la que ha demostrado una reducción de mortalidad en pacientes con SDRA20. En pacientes con ECMO, estudios publicados con anterioridad mostraron que altas ΔP se asociaron con peores supervivencias11,19. En un estudio recientemente publicado para evaluar la asociación entre los parámetros ventilatorios durante ECMO para hipoxemia refractaria en SDRA, los autores concluyen que el incremento de la ΔP es el único parámetro ventilatorio durante ECMO que muestra asociación independiente con la mortalidad hospitalaria en estos pacientes38. En este estudio, Serpa Neto et al. incluyen a 545 pacientes pertenecientes a 9 estudios, donde además de la ΔP, la edad avanzada, el sexo masculino y el índice de masa corporal bajo se asociaron también de manera independiente a la mortalidad.
Frecuencia respiratoria en ECMOTampoco está establecido qué FR debemos utilizar en pacientes tratados con ECMO. La ELSO recomendaba FR baja (4-5 ciclos/min) para evitar el «estrés» mecánico del pulmón, pero en general el rango está entre 4-30 ciclos/min teniendo en cuenta las diferentes publicaciones15. En general, el ajuste de la FR va orientada al mantenimiento del pH arterial, pero este concepto cambia en un paciente en ECMO VV, donde el mantenimiento del pH arterial y la PaCO2 depende directamente del flujo de gas en la membrana de oxigenación, debiendo reducir lentamente la PaCO2 una vez instaurado el soporte, con una relación 1:1 flujo de gas/flujo de sangre en ECMO31,32.
En una reciente encuesta internacional, el 55% de los centros ventilaban a sus pacientes en ECMO con una FR de 5-10 ciclos/min23, reflejando quizá una tendencia a ventilar con FR menores como en el modelo de «lung rest» propuesto por Gattinoni et al. años atrás, y donde la ventilación con baja FR (3-5 ciclos/min) y baja presión inspiratoria pico con un sistema ECCO2R en pacientes con SDRA grave de origen pulmonar, mejoró la función pulmonar en el 72,8% de los pacientes34. En este sentido, las últimas recomendaciones de la ELSO abogan por «el uso de VM con parámetros bajos para permitir lung rest»35.
Fracción inspiratoria de O2 en pacientes con membrana de oxigenación extracorpóreaEs evidente que para minimizar la VILI debemos reducir la FiO2 a niveles mínimos, con el objetivo de mantener una SatpO2>80% en ECMO VV31 o entre 84-88% según los diferentes grupos35,37.
ConclusionesEn pacientes con SDRA, la VM con reducción de la Pm ha demostrado una reducción de la mortalidad; no obstante, no existen evidencias, guías ni recomendaciones claras respecto a cómo ventilar a los pacientes en ECMO. La reducción en la driving pressure se ha asociado a una mejoría en la supervivencia hospitalaria en pacientes con SDRA grave tratados con ECMO, de manera que podría recomendarse la monitorización de este parámetro de VM al igual que en los pacientes sin ECMO.
Dado que el sistema extracorpóreo oxigena y depura CO2, la VM protectora y «ultraprotectora» es posible, lo que permitiría una reducción del VILI en estos pacientes. La reducción del Vt (< 4ml/kg de peso ideal), la Pm (< 25 cmH2O), la PEEP (5-15 cmH2O) y la FR baja permiten mantener un pulmón en reposo evitando la sobredistensión alveolar, el biotraumatismo y el atelectraumatismo. Son necesarios estudios que demuestren el impacto de esta estrategia ventilatoria en la mortalidad de pacientes con SDRA grave tratados con ECMO VV o sistemas ECCO2R.
Conflicto de interesesNo hay conflicto de intereses.
No existen.