La contaminación ambiental en la unidad de cuidados intensivos (UCI) juega un papel fundamental en la transmisión de patógenos como Acinetobacter baumannii (A. baumannii). El contacto de manos y guantes de los profesionales sanitarios con los pacientes y el ambiente contaminado, es uno de los mecanismos de trasmisión habitual1–3. Algunos estudios han demostrado que los pacientes ingresados en una habitación previamente ocupada por un paciente colonizado/infectado por microorganismos multirresistentes (MMR), tienen un riesgo mucho mayor de adquirir uno de estos patógenos que un paciente ingresado en una habitación cuyo ocupante anterior no estaba colonizado/infectado1,4. La limpieza terminal realizada al alta de un paciente no es suficiente. Esto se ha demostrado en varios estudios que confirman que hasta el 50% de las superficies de las habitaciones no se consiguen limpiar adecuadamente5. Para reducir la contaminación ambiental se han desarrollado métodos de desinfección que utilizan peróxido de hidrógeno y luz ultravioleta6. Debido a los múltiples aparatajes y equipamiento médico, limpiar un box de la UCI es una ardua labor cargada de obstáculos, y tarea casi imposible de realizar de forma exhaustiva en poco tiempo. Si hay una gran presión asistencial —con permanente y urgente recambio de pacientes— se imposibilita la realización de una limpieza terminal exhaustiva, aumentando progresivamente la carga bacteriana ambiental que favorece la trasmisión de microorganismos. Esto, junto a las peculiaridades del paciente crítico, la dificultad en el cumplimiento estricto/permanente de la higiene de manos y la falta de cumplimiento escrupuloso en el aislamiento de pacientes colonizados/infectados, genera la tormenta perfecta que explica el elevado número de infecciones nosocomiales que padecemos en las UCI.
A. baumannii es un enorme problema y un desafío sanitario mundial. Es uno de los microorganismos más frecuentes en las infecciones del paciente crítico y causa infecciones graves como neumonía asociada a ventilación mecánica o bacteriemia7,8. Entre sus características destaca la gran adhesividad, capacidad para sobrevivir en el medio ambiente y la dificultad para eliminarlo con las medidas higiénicas habituales, lo que le permite colonizar fácilmente las superficies y el equipamiento médico. En estudios sobre brotes epidémicos en la UCI, A. baumannii se ha identificado en reservorios como respiradores, monitores, humidificadores, transductores de presión, termómetros o colchones7,9. Estos brotes se pueden mantener en el tiempo, haciéndose endémicos por la gran carga de colonización ambiental, convirtiéndose en un inmenso problema con gran repercusión clínico/epidemiológica, agravado por su habitual multirresistencia. Los fómites hospitalarios, la colonización/infección de pacientes y los profesionales sanitarios forman un triángulo que se interrelaciona, retroalimenta y perpetua la transmisión del microorganismo manteniendo la situación endémica, por lo que el cumplimiento estricto de la higiene de manos por el personal sanitario es siempre fundamental para controlar una situación de endemia.
La UCI polivalente de nuestro hospital padecía desde hace más de 18 años una endemia de A. baumannii multirresistente. Durante este tiempo se ensayaron las medidas recomendadas clásicamente en la literatura: cultivos de vigilancia epidemiológica, aislamiento de pacientes colonizados/infectados, aislamiento de cohortes de pacientes colonizados/infectados en una unidad específica —cuando era posible—, programas de limpieza ambiental exhaustiva anual (incluida pintura nueva en las superficies), talleres repetidos de higiene de manos y labor educacional (tabla 1). Todas las medidas fracasaron y la endemia incluso aumentó después del traslado a un nuevo hospital, lo que nos indica que un entorno arquitectónico nuevo y «limpio» de MMR, que a priori representa un escenario favorable no soluciona una situación de endemia si seguimos manteniendo las mismas prácticas. Los pacientes colonizados/infectados y el equipamiento médico contaminado se trasladaron al nuevo hospital, manteniéndose la histórica situación endémica ya que el traslado no se acompañó de nuevas estrategias de lucha contra el A. baumannii.
Estrategias de control de Acinetobacter baumannii
| Investigación epidemiológica: |
| Genotipado |
| Cultivos de vigilancia |
| Cultivos ambientales |
| Medidas de aislamiento estricto |
| Aislamiento de cohortes de pacientes |
| Mejorar el cumplimiento de la higiene de manos |
| Mejorar la limpieza y desinfección ambiental |
| Medidas educacionales |
Ante el repetido fracaso, y partiendo de que una única limpieza terminal es insuficiente se planteó una intervención de limpieza exhaustiva y mantenida en el tiempo a principios del mes de abril del año 2016. Cuando un paciente era dado de alta, el box se bloqueaba 2 días. Durante este tiempo, en turno de mañana y tarde se realizaban un total de 4 limpiezas terminales. Si el paciente estaba colonizado/infectado por un MMR o se consideraba de riesgo para tal se realizaban 6 limpiezas, registrándose su cumplimiento en una hoja con la firma de la enfermera/auxiliar de enfermería y limpiadora responsable. Si el microorganismo aislado era A. baumannii se repetían los ciclos de limpieza de forma variable —según la disponibilidad de camas— llegando en ocasiones hasta realizar 12 limpiezas terminales. Complementariamente se utilizó desinfección con peróxido de hidrógeno, pero de forma muy restringida, ya que la mayoría de los boxes no disponen de puertas, por lo que solo se pudo realizar en 8 de 38 boxes y de forma limitada durante 1-2 días al mes. En el mes de julio los últimos pacientes que quedaban colonizados/infectados se aislaron en una unidad y en los meses de julio, agosto y septiembre debido a una menor presión asistencial se pudo realizar una desinfección con peróxido de hidrógeno en 3 de las 4 unidades que dispone la UCI.
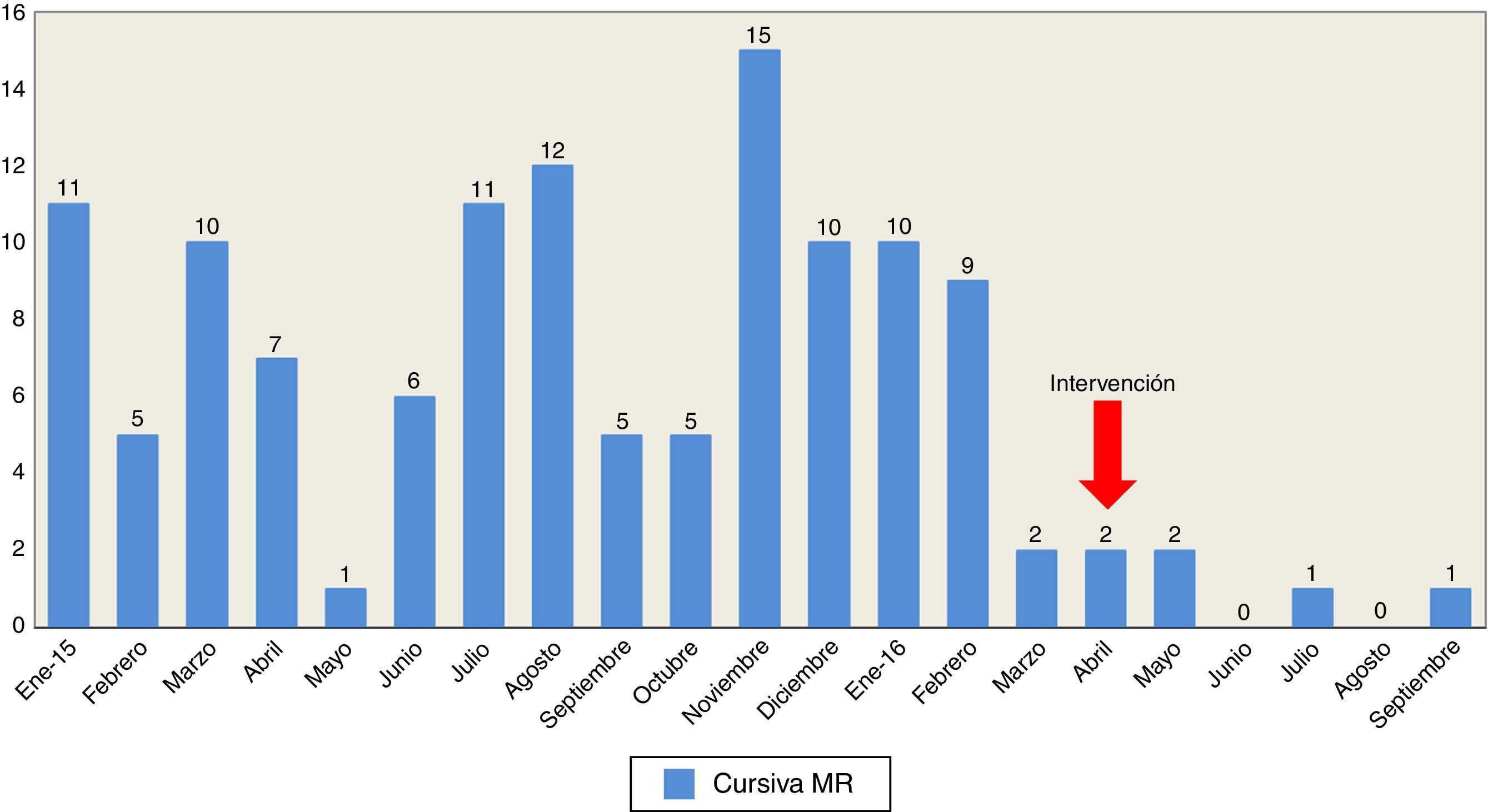
Tras iniciar la campaña de limpieza exhaustiva, A. baumannii descendió significativamente desde 98 pacientes colonizados/infectados en el año 2015 (tasa 9,8 pacientes/1.000 días de estancia) a 27 en el 2016 hasta septiembre incluido (tasa 3,9 pacientes/1.000 días de estancia), de los cuales 21 pertenecen al primer trimestre del año, es decir, antes de iniciar la intervención de limpieza. Si comparamos un periodo de 6 meses antes y después de la intervención, durante octubre 2015-marzo 2016 el número de pacientes colonizados/infectados fue de 51 (tasa 9,7 pacientes/1.000 días de estancia) versus 6 pacientes en los meses abril-septiembre 2016 (tasa 1,4 pacientes/1.000 días de estancia). Uno de los objetivos del programa Resistencia Zero es reducir un 20% la tasa de pacientes en los que se identifican MMR. En nuestra UCI con la intervención de limpieza descrita y comparando el periodo de 6 meses pre y postintervención se ha logrado una disminución del 88,3% en el número de pacientes colonizados/infectados. El descenso de A. baumannii provocó una disminución sustancial del gasto en colistina. En el año 2015 se utilizaron 8.380 viales (80mg) con un coste de 46.146€, versus 4.274 viales (23.961€) hasta septiembre del 2016 y esto teniendo en cuenta que la mayor parte del gasto del 2016 es atribuible al primer trimestre, antes de iniciar la intervención. En la figura 1 se muestra el número de pacientes colonizados/infectados por A. baumannii durante los años 2015-2016.
La detección precoz, el aislamiento de los pacientes colonizados y la limpieza del medio ambiente son algunas de las medidas recomendadas para controlar un brote de A. baumannii1,7,9,10. En nuestro caso, estas medidas rutinarias fueron ineficaces durante muchos años. Solamente la implementación añadida de una campaña de limpieza ambiental exhaustiva y mantenida en el tiempo, complementada con desinfección puntual con peróxido de hidrógeno consiguió controlar la situación de endemia.
Mejorar la limpieza ambiental es una de las intervenciones recomendadas como fundamental para mitigar la transmisión de A. baumannii. Lo sabemos y es algo obvio, pero tenemos que seguir recordándolo y trabajando activamente sobre ello si queremos controlar los brotes en las UCI. En nuestra experiencia, el viejo mensaje de implementar una campaña de limpieza ambiental verdaderamente exhaustiva y además realizada de forma constante y protocolizada ha funcionado satisfactoriamente.
A todos los profesionales de la UCI, y al equipo de limpiadoras de la UCI por su esfuerzo y empeño en controlar la endemia de Acinetobacter baumannii.