Las infecciones del tracto respiratorio inferior que afectan al paciente intubado constituyen un serio problema de salud por la morbimortalidad asociadas. Las microaspiraciones de las secreciones de la cavidad bucofaríngea constituyen el principal mecanismo fisiopatológico que explica el desarrollo de la neumonía y la traqueobronquitis asociadas a la ventilación mecánica. En todos los paquetes de medidas para prevención de estas infecciones, se incluye la antisepsia orofaríngea para disminuir la colonización orofaríngea. La clorhexidina es el antiséptico más evaluado en ensayos clínicos y metaanálisis que concluyen que la higiene bucal con clorhexidina reduce la incidencia de neumonía asociada a ventilación mecánica, siendo mayor la eficacia cuando se administra al 2%. Sin embargo, 2metaanálisis han alertado sobre un posible aumento de mortalidad cuando se emplea la clorhexidina como antiséptico oral. Eso nos lleva a recomendar su uso pero extremando la precaución en su aplicación para impedir aspiración de la misma.
Este artículo forma parte del suplemento «Antisepsia en el paciente crítico», que cuenta con el patrocinio de Becton Dickinson.
Lower respiratory tract infections in the intubated patient constitute a serious health problem due to their associated morbidity and mortality. Microaspiration of the buccopharyngeal secretions is the main physiopathological mechanism underlying the development of pneumonia and tracheobronchitis in intubated patients. All care bundles designed to prevent these infections include the use of antiseptics to reduce buccopharyngeal colonization. Chlorhexidine is the antiseptic most frequently assessed in clinical trials and meta-analyses that conclude that oral hygiene with chlorhexidine reduces the incidence of ventilator-associated pneumonia - maximum effectiveness being achieved when the product is administered at a concentration of 2%. However, 2meta-analyses have warned of a possible increase in mortality when chlorhexidine is used as an oral antiseptic. We therefore recommend its use but with extreme caution during application in order to avoid aspiration of the antiseptic.
This article is part of a supplement entitled “Antisepsis in the critical patient”, which is sponsored by Becton Dickinson.
Las infecciones del tracto respiratorio inferior ocupan el primer lugar entre las infecciones relacionadas con el cuidado sanitario que se diagnostican en las Unidades de Cuidados Intensivos (UCI)1. La neumonía nosocomial es un proceso inflamatorio pulmonar de origen infeccioso, ausente en el momento del ingreso hospitalario, y que se desarrolla tras más de 48 h de haber ingresado en el hospital, es la segunda infección más frecuente en el hospital y la primera en las Unidades de Medicina Intensiva, la cual se puede incrementar hasta 20 veces en presencia de ventilación mecánica (VM), siendo considerada entonces como neumonía asociada a la VM (NAV). La traqueobronquitis asociada a VM (TAV), sin embargo, no es hasta fechas más recientes que ha recibido mayor atención.
Aunque la NAV es una infección nosocomial que ha sido objeto de múltiples estudios que han analizado su impacto en la morbilidad y la mortalidad2 de los pacientes críticos (mortalidad atribuible del 13% según un metaanálisis), existen menos estudios en relación con el impacto de la TAV en el pronóstico de los pacientes críticos3, mostrando no obstante estos un incremento en los días de VMy estancia en UCI, aunque sin encontrar un incremento de mortalidad atribuible a la TAV4.
Diversos factores han sido relacionados con el desarrollo de la infección del tracto respiratorio inferior, aunque el mecanismo más frecuente consiste en la aspiración de microorganismos que colonizan la orofaringe o el tracto gastrointestinal superior. Esta aspiración ocurre hasta en el 45% de individuos sanos durante el sueño, donde no tiene consecuencias porque su microbiota orofaríngea contiene microorganismos comensales. En individuos ingresados en UCI, en cambio, la combinación de una serie de factores inherentes a dichas unidades, unido a factores propios del individuo, hacen que la aspiración sea un factor contribuyente significativo para favorecer el desarrollo de estas infecciones.
Prevenir las infecciones del tracto respiratorio inferior relacionadas con la VM se ha convertido en un objetivo fundamental en las UCI, para ello se han implementado paquetes de medidas que resultan eficaces en dicho objetivo. Álvarez Lerma et al.5, en un trabajo recientemente publicado, describen los resultados del proyecto Neumonía Zero, encontrando una reducción significativa de más del 50% de NAV con el empleo de un paquete de medidas, pasando de 9,83 episodios de NAV por 1.000 días de VM a 4,34 episodios por 1.000 días de VM en los últimos 3meses de intervención.
Dichos paquetes de medidas pueden variar entre distintos países, pero la mayoría de ellas son comunes. En España las medidas aplicadas son las recogidas en el proyecto Neumonía Zero e incluye 7 medidas básicas obligatorias y 3medidas altamente recomendadas, todas ellas con eficacia comprobada en la prevención de NAV6 (tabla 1).
Paquete de medidas para la prevención de NAV
| Medidas básicas de obligado cumplimiento | Medidas específicas altamente recomendables |
|---|---|
| 1. Formación y entrenamiento apropiado en el manejo de la vía aérea | 1. Descontaminación selectiva del tubo digestivo |
| 2. Higiene estricta de manos en el manejo de la vía aérea | 2. Aspiración continua de secreciones subglóticas |
| 3. Control y mantenimiento de la presión del neumotaponamiento por encima de 20 cmH2O | 3. Antibióticos sistémicos durante la intubación en pacientes con disminución del nivel de consciencia |
| 4. Higiene bucal cada 6-8 h utilizando clorhexidina (0,12-0,2%) | |
| 5. Evitar, siempre que sea posible, la posición de decúbito supino a 00 | |
| 6. Favorecer todos los procedimientos que permitan disminuir de forma segura la intubación o su duración | |
| 7. Evitar los cambios programados de las tubuladuras, humidificadores y tubos traqueales |
Dentro de las medidas de obligado cumplimiento se encuentra la higiene oral con clorhexidina como medida de antisepsia oral evitando la colonización orofaríngea. Esto obedece a que la cavidad oral se comporta como un reservorio de bacterias que potencialmente pueden causar infecciones del tracto respiratorio inferior debido, en parte, a que en las primeras 48h de estancia en la UCI existe un cambio de la flora habitual, Streptococcus pneumoniae, Haemophilus influenzae y Staphylococcus aureus (S. aureus) sensibles a meticilina, por microorganismos que tradicionalmente se asocian a NAV, como S. aureus resistente a meticilina, Acinetobacter baumannii o Pseudomonas aeruginosa (P. aeruginosa). Además del cambio de flora que se produce en los pacientes intubados, se produce una pérdida de los mecanismos fisiológicos de defensa, así como la presencia de un cuerpo extraño (tubo endotraqueal) que facilita la microaspiración de secreciones buco-faríngeas. La placa dental de igual forma puede ser un reservorio de infección por patógenos respiratorios en pacientes ingresados en UCI, independientemente de la enfermedad de base. La higiene oral deficiente se relaciona directamente con el acúmulo de placa dental, colonización de la orofaringe y alto índice de infecciones tales como NAV y TAV.
A lo largo de este capítulo, realizaremos una revisión acerca de los conocimientos actuales de la antisepsia oral, las ventajas y los posibles inconvenientes, y trataremos de establecer una serie de recomendaciones para su aplicación.
Antisépticos en la prevención de neumonía asociada a ventilación mecánicaLos antisépticos son sustancias químicas que se aplican sobre los tejidos vivos, con la finalidad de destruir o inhibir el crecimiento de microorganismos patógenos. No tienen actividad selectiva ya que eliminan todo tipo de gérmenes. A altas concentraciones pueden ser tóxicos para los tejidos vivos. Los agentes inhibitorios más eficaces son aquellos cuya acción persiste en la boca durante el mayor tiempo posible. Son sustancias de uso estrictamente externo y deben responder a un doble criterio de eficacia e inocuidad.
A continuación, exponemos los agentes más empleados en la higiene oral de los pacientes críticos7.
- –
Gluconato de clorhexidina es el antiséptico más usado ya que se trata de un agente de amplio espectro que combate tanto bacterias grampositivas como gramnegativas y tiene efecto antibacteriano frente a muchos patógenos causales de las infecciones respiratorias asociadas a la VM, ya que disminuye la colonización orofaríngea y encial de pacientes ventilados y tiene efecto antiplaca dental y encial. Clorhexidina se une fuertemente a la membrana celular bacteriana, lo que a bajas concentraciones produce un aumento de la permeabilidad con filtración de los componentes intracelulares incluido el potasio (efecto bacteriostático). En concentraciones más altas, produce la precipitación del citoplasma bacteriano y la muerte celular (efecto bactericida). En boca se adsorbe rápidamente a las superficies de contacto, incluidos los dientes con película adquirida, proteínas salivales y a la hidroxiapatita, la clorhexidina adsorbida se libera gradualmente en 8-12 h en su forma activa, después de 24 h aún pueden recuperarse concentraciones bajas de clorhexidina, lo que evita la colonización bacteriana durante ese tiempo. La seguridad de la clorhexidina ha sido ampliamente documentada, la baja absorción de clorhexidina es un factor en su baja toxicidad.Las presentaciones más comunes de la clorhexidina para su uso en odontología son colutorios en varias concentraciones (por ejemplo al 0,2, el 0,12 y el 0,10%), así como también en forma de geles, sprays, barnices y pastas dentales. Labeau et al. (2011)8, en una revisión sistemática del uso de antisépticos orales en la prevención de NAV, concluyeron que la clorhexidina reduce significativamente el desarrollo de NAV.
- 1.
Soluciones orales: se presentan en varias concentraciones: 0,2%, 0,12% y 0,10%; inicialmente se desarrollaron como soluciones alcohólicas. Actualmente existen formulaciones de clorhexidina en medio no alcohólico igual de efectiva que la formulación de la misma en solución alcohólica. Es el método más utilizado en los protocolos de higiene oral en el paciente crítico.
- 2.
Gel: al 0,2% o al 0,12% para aplicación en localizaciones concretas.
- 3.
Dentífricos: de aparición más reciente.
- 4.
Otras presentaciones: sprays, barnices, irrigadores, chips, etc.
- –
Triclosán es un compuesto fenólico, bactericida y bacteriostático, virucida y fungicida pero no es efectivo contra esporas ni P. aeruginosa. El triclosán ha sido utilizado en jabones y pastas de dientes. Solo como colutorio al 0,2% tiene un efecto inhibitorio moderado de la placa y una sustantividad antimicrobiana de alrededor 5h. Más que beneficios en el control de placa, el triclosán parece tener importancia en control de la gingivitis al tener un papel antiinflamatorio. Tiene un control antiplaca similar al fluoruro sódico pero muy inferior a clorhexidina al 0,12%. No se han observado efectos adversos importantes con esta sustancia. Un único estudio (Zhao 2012)9, compara el enjuague con triclosán con enjuague con solución salina en la prevención de NAV sin encontrar diferencias significativas en la incidencia de esta.
- –
Peróxido de hidrógeno, conocido también como agua oxigenada, es un agente químico líquido incoloro a temperatura ambiente, con sabor amargo; posee propiedades antisépticas. Como antiséptico oral se utiliza en combinación con bicarbonato a una concentración en torno al 3%. Es activo frente a hongos, virus, esporas y bacterias grampositivas según la concentración y condiciones de utilización.Es muy inestable, se descompone con la luz y al contacto con el aire y los tejidos. Algunas bacterias son resistentes a sus efectos por poseer catalasas y peroxidasas. A concentraciones por encima del 3% puede producir irritación de las mucosas. Este estudio realizado por Nobahar et al.10 es el único que compara los efectos del enjuague bucal con peróxido de hidrógeno al 3% en la prevención de NAV. Utilizaron como comparador solución salina al 0,9%, detectándose en este grupo un riesgo 2,60 veces mayor de desarrollar una NAV que en el grupo de intervención (RR=2,60, IC del 95%: 1,04-6,49, p=0,0279).
- –
Povidona iodada es un agente antibacteriano eficaz contra bacterias grampositivas, gramnegativas, virus, micobacterias, hongos y protozoos. Es un agente bactericida y fungicida. Su acción antimicrobiana es rápida a bajas concentraciones, pero su mecanismo de acción exacto es desconocido. La acción antiséptica es afectada por el pH, la temperatura, el tiempo de contacto, la concentración de yodo disponible y la concentración de los emolientes. Se neutraliza rápidamente en presencia de materia orgánica. Como antiséptico bucofaríngeo se utiliza a concentraciones del 10%. Puede inducir reacciones de hipersensibilidad. Un metaanálisis que incluyó los resultados de 2estudios que había empleado este antiséptico no halló reducción de la incidencia de NAV (RR 0,39; IC del 95%: 0,11-1,36; p=0,14)9.
- –
Clorhidrato de iseganan es un análogo de protegrina sintética que posee un amplio espectro de actividad in vitro contra levaduras y bacterias grampositivas, gramnegativas aeróbicas y anaeróbicas; es rápidamente microbicida en saliva y tiene una baja propensión a inducir resistencia. Es utilizado de forma habitual en el tratamiento de las mucositis de los pacientes tratados mediante quimioterapia con un buen perfil de seguridad y tolerabilidad. Kollef et al.11, en un estudio aleatorizado en el que se incluyó a 709 pacientes, evaluaron la eficacia de iseganan administrado de forma tópica frente a placebo en la prevención de NAV, la variable principal de eficacia fue la incidencia de NAV entre los supervivientes en el día 14. La tasa de NAV entre los supervivientes en el día 14 fue del 16% (45/282) en los pacientes tratados con iseganan y del 20% (57/284) en los tratados con placebo (p=0,145). Por todo ello, los autores concluyeron que no existía beneficio del tratamiento con iseganan para la prevención de NAV.
En un grupo de pacientes postoperados de cirugía cardíaca, se comparó un protocolo de higiene oral con clorhexidina al 0,12% frente a placebo, lográndose una reducción significativa de la incidencia de infecciones nosocomiales. Así, la reducción del riesgo de desarrollar una infección respiratoria fue del 6,5 (IC del 95%: 2,3%-10,7%; p=0,002). También se halló una disminución de la estancia hospitalaria de 0,8 días (IC del 95%: 0,24-1,88); p=0,04)12.
Desde entonces se han realizado múltiples estudios controlados que posteriormente se han analizado en revisiones sistemáticas y metaanálisis con resultados algo más contradictorios. En 2011 en una revisión sistemática del uso de antisépticos orales en la prevención de NAV concluyó que la clorhexidina reduce significativamente el riesgo de NAV (RR 0,67; IC del 95%: 0,50 a 0,88). El efecto fue superior en pacientes de cirugía cardíaca y con clorhexidina al 2%, mientras que la reducción del riesgo no fue significativa para concentraciones más bajas9. Zhang et al.13 realizaron un metaanálisis incluyendo 18 estudios controlados aleatorizados para evaluar la efectividad de la clorhexidina para la prevención de la neumonía asociada al ventilador y explorar la mejor concentración. Todos los estudios indicaron que la clorhexidina podría prevenir y reducir significativamente la incidencia de NAV (RR=0,59, IC del 95%: 0,50-0,69; p<0,00001). Nueve estudios mostraron que la clorhexidina al 0,12% tenía un efecto protector (RR=0,53, IC del 95%: 0,43-0,67; p <0,00001) y 3estudios demostraron que el efecto era más favorable con clorhexidina al 2% en la prevención de la NAV (RR=0,55, IC del 95%: 0,37-0,81; p=0,002), por lo que los autores concluyen que la clorhexidina puede prevenir y reducir la incidencia de NAV y que la concentración al 2% tiene el mejor efecto en la prevención.
Posteriormente, Villar et al.14 publicaron en el año 2016 el resultado de un metaanálisis y una revisión sistemática donde tratan de establecer si en pacientes intubados al menos 48 h la descontaminación oral con clorhexidina previene el desarrollo de NAV comparado con placebo, cuidados estándar o no tratamiento. Incluyeron 10 estudios controlados y aleatorizados publicados entre 2000 y 2012. El análisis incluyó a 1.349 pacientes adultos y reveló que en los pacientes que se realizaba la higiene oral con clorhexidina se encontraba una tendencia a la reducción en la incidencia de NAV (RR 0,70, IC del 95%: 0,48-1,00; I2 47%]. Los autores realizaron un segundo análisis para evaluar qué dosis, frecuencia o forma de uso de la clorhexidina era más efectiva, encontrando que la efectividad se lograba cuando se administraba en concentraciones al 2%, 4 veces al día (RR 0,56, IC del 95%: 0,38-0,81; I2 0%).
La conclusión de este segundo metaanálisis concuerda con los resultados de un reciente ensayo clínico de Zand et al.15, que realizan un estudio controlado aleatorizado en pacientes adultos, con VM al menos 48 h ingresados en UCI. Comparan 2protocolos de higiene oral, uno con clorhexidina al 0,2% y otro al 2%, encontrando que la descontaminación oral con clorhexidina al 2% comparada con una concentración al 0,2% es más efectiva en la prevención de NAV p=0,007. Además, no hubo diferencias entre ambas concentraciones en cuanto a efectos adversos a nivel oro-faríngeo.
En una revisión de la Cochrane16 publicada recientemente, se incluyeron 18 estudios controlados y aleatorizados de alta calidad y un total de 2451 pacientes; los resultados demuestran que el uso de clorhexidina en solución oral o gel utilizada como parte de la higiene oral diaria reduce el riesgo de NAV comparado con placebo o cuidados habituales del 24 al 18% (RR 0,75, IC del 95%: 0,62-0,91; p=0,004). Lo cual indica que por cada 17 pacientes ingresados en una UCI a los que se le realiza la higiene oral diaria con clorhexidina, se previene el desarrollo de un episodio de NAV. No se encontraron diferencias significativas en cuanto a mortalidad, duración de VM o estancia en UCI. Solo 2estudios informaron de efectos adversos y fueron leves, con similar frecuencia en el grupo de clorhexidina o placebo.
Antisépticos orales y cepillado dentalDada la evidencia existente entre la higiene bucal, la colonización por patógenos y desarrollo de NAV, diversos ensayos clínicos han evaluado si el empleo de cepillado dental, asociado a la antisepsia oral con clorhexidina, logra reducir la incidencia de NAV. En nuestro país, Pobo et al.17, en un estudio aleatorizado y abierto, incluyeron a 147 pacientes con más de 48 h de VM (74 en el grupo de cepillado con cepillo eléctrico cada 8 h). La incidencia de NAV, tanto por sospecha clínica como confirmada microbiológicamente, fue similar en ambos grupos. Tras ajuste por variables de confusión (gravedad y motivo de ingreso), se confirmó que no existían diferencias entre los 2grupos de estudio. Lorente et al. realizaron un ensayo clínico abierto que incluyó a 436 pacientes adultos con más de 24 h en VM (217 en el grupo de cepillado dental y 219 en el grupo control). El empleo de cepillado bronquial además de higiene bucal con clorhexidina al 0,12% no redujo la incidencia de NAV (21 de 217 [9,7%] con cepillado dental vs. 24 de 219 [11,0%] sin cepillado dental; odds ratio [OR]=0,87, IC del 95%: 0,469-1,615; p=0,75)18.
Un metaanálisis que incluyó 6ensayos clínicos publicados hasta marzo del 2012 y con un total de 1.408 pacientes, 5de los cuales compararon el cepillado dental con el cuidado oral habitual y otro comparó el cepillado eléctrico con el manual. El cepillado dental no redujo significativamente el riesgo global de NAV ni afectó a la mortalidad o la estancia en la UCI19.
Más recientemente, otro ensayo clínico ha evaluado la eficacia del cepillado dental asociado a la antisepsia con clorhexidina al 0,12% comparado con un grupo control en el que solo se usó la antisepsia con clorhexidina. En este caso, se incluyó a 105 pacientes en el grupo de estudio y 108 en el grupo control. El cepillado dental más clorhexidina al 0,12% redujo incidencia de NAV, aunque esta diferencia no fue estadísticamente significativa (p=0,084). Además, hubo una reducción significativa de la duración de la VMen el grupo de intervención (p=0,018) y una tendencia a una reducción de la estancia en UCI: 13,9±8,6 vs. 11,9±7,77 (p=0,064)20.
Solo un estudio ha comparado 2modalidades de cepillado dental. El estudio fue llevado a cabo en pacientes neurocríticos y no mostró diferencias en eficacia (incidencia de NAV) o presentación de efectos adversos entre el cepillado dental manual o eléctrico21. Debemos señalar finalmente que el empleo de cepillado dental puede ocasionar bacteriemia de floral bucal, especialmente en pacientes neutropénicos22.
Clorhexidina y aumento de mortalidadUn aspecto controvertido es la posible asociación entre el uso de antisepsia oral con clorhexidina y aumento de mortalidad. Hasta la fecha, se han publicado 4 metaanálisis23-26 evaluando la eficacia y seguridad de la clorhexidina oral para la prevención de la NAV, cuyos resultados se resumen en la tabla 2. Solo 2de ellos concluyen que el uso de esta estrategia de prevención de la NAV se asocia a un exceso de mortalidad. Price et al. analizan el efecto de la descontaminación digestiva selectiva (DDS), descontaminación selectiva de la orofaringe (DEOF) y de la antisepsia oral con clorhexidina. Para ello, realizan un metaanálisis convencional y un metaanálisis en red incluyendo todos los estudios publicados hasta diciembre del 2012. Mientras la DDS tuvo un efecto protector sobre la mortalidad, el uso de clorhexidina (1.288 pacientes en el brazo de intervención y 1.330 en el control) se asoció a un aumento de la mortalidad (OR 1,25 [IC del 95%: 1,05-150]). Cuando cada intervención se comparó con la otra, tanto la DDS como la DSOF fueron superiores a la clorhexidina en la prevención de la NAV. Los autores reconocen que la mortalidad no fue el objetivo primario en ninguno de los ensayos clínicos incluidos en el metaanálisis y que solo en uno de ellos observó un aumento de mortalidad en el grupo de intervención25.
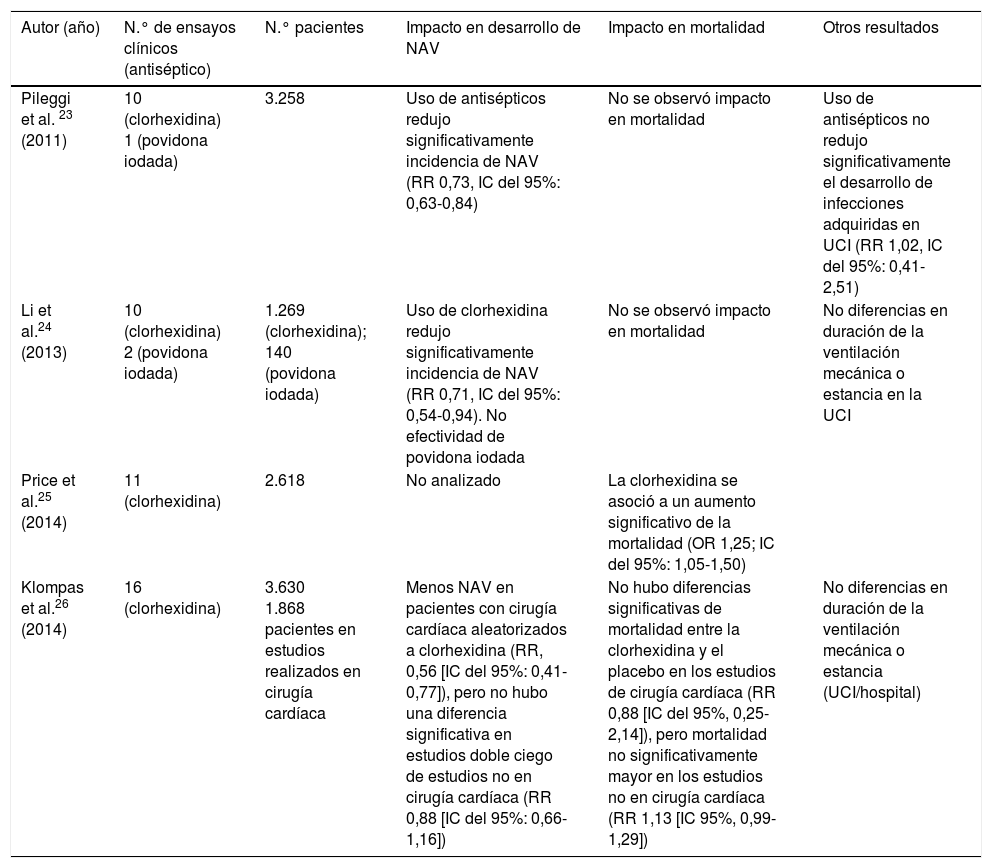
Resumen de los principales metaanálisis que han analizado la eficacia y seguridad de antisépticos orales en pacientes conectados a ventilación mecánica
| Autor (año) | N.° de ensayos clínicos (antiséptico) | N.° pacientes | Impacto en desarrollo de NAV | Impacto en mortalidad | Otros resultados |
|---|---|---|---|---|---|
| Pileggi et al. 23 (2011) | 10 (clorhexidina) 1 (povidona iodada) | 3.258 | Uso de antisépticos redujo significativamente incidencia de NAV (RR 0,73, IC del 95%: 0,63-0,84) | No se observó impacto en mortalidad | Uso de antisépticos no redujo significativamente el desarrollo de infecciones adquiridas en UCI (RR 1,02, IC del 95%: 0,41-2,51) |
| Li et al.24 (2013) | 10 (clorhexidina) 2 (povidona iodada) | 1.269 (clorhexidina); 140 (povidona iodada) | Uso de clorhexidina redujo significativamente incidencia de NAV (RR 0,71, IC del 95%: 0,54-0,94). No efectividad de povidona iodada | No se observó impacto en mortalidad | No diferencias en duración de la ventilación mecánica o estancia en la UCI |
| Price et al.25 (2014) | 11 (clorhexidina) | 2.618 | No analizado | La clorhexidina se asoció a un aumento significativo de la mortalidad (OR 1,25; IC del 95%: 1,05-1,50) | |
| Klompas et al.26 (2014) | 16 (clorhexidina) | 3.630 1.868 pacientes en estudios realizados en cirugía cardíaca | Menos NAV en pacientes con cirugía cardíaca aleatorizados a clorhexidina (RR, 0,56 [IC del 95%: 0,41-0,77]), pero no hubo una diferencia significativa en estudios doble ciego de estudios no en cirugía cardíaca (RR 0,88 [IC del 95%: 0,66-1,16]) | No hubo diferencias significativas de mortalidad entre la clorhexidina y el placebo en los estudios de cirugía cardíaca (RR 0,88 [IC del 95%, 0,25-2,14]), pero mortalidad no significativamente mayor en los estudios no en cirugía cardíaca (RR 1,13 [IC 95%, 0,99-1,29]) | No diferencias en duración de la ventilación mecánica o estancia (UCI/hospital) |
Klompas et al. realizaron un metaanálisis convencional con todos los estudios publicados hasta julio del 2013 (16 ensayos clínicos con un total de 3.630 pacientes). No hallaron diferencias significativas de mortalidad entre la clorhexidina y el placebo en los estudios realizados en cirugía cardíaca (RR 0,88 [IC del 95%: 0,25-2,14]) pero sí un incremento no estadísticamente significativo de la mortalidad en los estudios que incluyeron a pacientes no tratados mediante cirugía cardíaca (RR 1,13 [IC del 95%: 0,99-1,29])26.
Más recientemente, se ha publicado un estudio retrospectivo que ha analizado el impacto en la mortalidad en 82.274 pacientes ingresados. El uso de clorhexidina se asoció a un incremento global de la mortalidad: OR 2,61; IC del 95%: 2,32-2,91. Hay que resaltar que este incremento de la mortalidad no se observó en los pacientes ingresados en UCI, estuvieran o no con VM invasiva27.
Se especula que la existencia de microaspiraciones de clorhexidina ocasionaría un daño pulmonar que explicaría este aumento de mortalidad observado en los metaanálisis. La clorhexidina no es un compuesto inocuo y se han comunicado casos de síndrome de distrés respiratorio agudo grave en caso de ingesta e inhalación accidental28. En modelos animales, la instilación de clorhexidina en vía aérea ocasiona lesión pulmonar aguda con edema intraalveolar y focos hemorrágicos29,30.
Con base en los resultados de estos metaanálisis y la posible asociación entre el empleo de clorhexidina y mortalidad, las recientes guías internacionales no se posicionan sobre el uso de clorhexidina oral para prevenir la NAV31. Muchas son las estrategias que se han propuesto para reducir la incidencia de la NAV. Sin embargo, más que una estrategia aislada, parece que la combinación de varias de ellas en paquetes de medidas es lo que logra la reducción de la incidencia de NAV. En este sentido, 2estudios a gran escala recientemente publicados sobre el impacto de un paquete de medidas de prevención de la NAV han demostrado la reducción significativa de la incidencia de esta tras aplicación de dichos paquetes de medidas. Ambos estudios incluían la descontaminación oral con clorhexidina6,32.
ConclusionesA pesar de la controversia existente, pensamos debe emplearse la antisepsia oral con clorhexidina 4veces al día en todos los pacientes en VM invasiva como medida para prevenir el desarrollo de NAV. No obstante, debe extremarse la precaución siempre que se realice la antisepsia oral con clorhexidina para impedir aspiración de la misma. Basándonos en lo anteriormente expuesto, resulta de extrema importancia, antes de su administración, asegurar el correcto inflado del balón de neumotaponamiento del tubo endotraqueal.
Conflicto de interesesLos autores no declaran conflictos de intereses.
Nota al suplementoEste artículo forma parte del suplemento «Antisepsia en el paciente crítico», que cuenta con el patrocinio de Becton Dickinson.