El uso de sedantes en las unidades de cuidados intensivos (UCI) es esencial para aliviar la ansiedad y el estrés en pacientes con ventilación mecánica (VM), y está relacionado con el resultado clínico, la duración de la VM y la estancia del paciente en la UCI. Los sedantes inhalados ofrecen beneficios, como un despertar y una extubación más rápidos, la disminución de la dosis total de opioides y de bloqueantes neuromusculares (BNM), además de tener efectos broncodilatadores, anticonvulsivantes y protectores cardiopulmonares y neurológicos. La sedación inhalada se administra mediante un vaporizador específico. El isoflurano es el agente recomendado debido a su perfil de eficacia y de seguridad. La sedación inhalada se recomienda en la sedación moderada y profunda, en la sedación prolongada, en la sedación difícil, en pacientes con síndrome de distrés respiratorio agudo (SDRA), estatus asmático y estatus epiléptico superrefractario. Al ofrecer estas ventajas significativas, el uso de sedantes inhalados permite un enfoque personalizado y controlado para optimizar la sedación en la UCI.
The use of sedatives in intensive care units (ICU) is essential for relieving anxiety and stress in mechanically ventilated patients, and it is related to clinical outcomes, duration of mechanical ventilation, and length of stay in the ICU. Inhaled sedatives offer benefits such as faster awakening and extubation, decreased total opioid and neuromuscular blocking agents (NMB) doses, as well as bronchodilator, anticonvulsant, and cardiopulmonary and neurological protective effects. Inhaled sedation is administered using a specific vaporizer. Isoflurane is the recommended agent due to its efficacy and safety profile. Inhaled sedation is recommended for moderate and deep sedation, prolonged sedation, difficult sedation, patients with acute respiratory distress syndrome (ARDS), status asthmaticus, and super-refractory status epilepticus. By offering these significant advantages, the use of inhaled sedatives allows for a personalized and controlled approach to optimize sedation in the ICU.
La sedación desempeña un papel fundamental en el manejo de pacientes críticos ingresados en las unidades de cuidados intensivos (UCI), aliviando la ansiedad, facilitando la adaptación a la ventilación mecánica (VM) y previniendo complicaciones relacionadas con la agitación1. Sin embargo, los sedantes intravenosos (i.v.) utilizados en la UCI, como benzodiacepinas, propofol, ketamina y dexmedetomidina, tienen características farmacológicas impredecibles en el paciente crítico y no están exentos de riesgos.
Las benzodiacepinas, especialmente el midazolam, pueden ocasionar efectos adversos con su uso prolongado, como acumulación, retraso en el despertar, prolongación de la VM, desarrollo de taquifilaxia y síntomas de privación tras su retirada2. Además, constituyen un factor de riesgo para la aparición de delirium3. Recientemente se ha publicado un debate a favor y en contra del uso del midazolam durante la VM en pacientes de la UCI4,5. Asimismo, el uso de soporte extracorpóreo, como las técnicas de reemplazo renal continuo y la oxigenación con membrana extracorpórea (ECMO), afecta la farmacocinética de los sedantes i.v.6,7.
El uso de propofol puede provocar bradicardia, hipotensión e hipertrigliceridemia. Además, a dosis altas o con perfusiones prolongadas puede generar una acidosis metabólica severa asociada a un potencialmente mortal shock cardiogénico conocido como síndrome de infusión del propofol (SIP). Según los autores, una infusión de más de 48horas a una dosis igual o superior a 83μg/kg/min está asociada al desarrollo de SIP. Un análisis retrospectivo realizado por estos mismos autores reveló una prevalencia del SIP del 2,9% y una mortalidad asociada del 36,8%8.
La ketamina produce liberación de catecolaminas y puede resultar en un aumento de la frecuencia cardíaca y de la presión arterial. Además, puede causar una disociación entre el sistema límbico y la vía tálamo-neocortical, lo que conlleva la aparición de disforia, alucinaciones, desorientación, sueños vividos e ilusiones sensoriales y/o perceptivas9.
Por otro lado, la dexmedetomidina, que además puede provocar bradicardia e hipotensión, resulta útil únicamente en la sedación ligera y no es adecuada en sedación moderada o profunda10.
Recientemente, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha aprobado el uso de isoflurano para la sedación moderada o profunda en pacientes adultos hospitalizados en la UCI que necesiten VM.
Desde el Grupo de Trabajo de Sedación, Analgesia y Delirium (GTSAD) de SEMICYUC se ha desarrollado este documento con el objetivo de proporcionar una revisión fundamentada en la evidencia científica disponible, en la cual se resaltan los beneficios, las indicaciones, los efectos adversos, las estrategias de dosificación y de monitorización, así como el manejo de la técnica, ofreciendo una herramienta práctica para la incorporación efectiva de la sedación inhalada en la UCI.
Características de los agentes inhalados¿Cuáles son los agentes inhalados disponibles para la sedación de pacientes adultos ingresados en la UCI?Los sedantes inhalados actualmente disponibles en nuestro medio son el isoflurano y el sevoflurano. Estos agentes actúan deprimiendo las vías de neurotransmisión en distintos niveles. Principalmente, ejercen su acción sedante a nivel del sistema nervioso central pre-sináptico, estimulando receptores inhibitorios GABA y glicina, y a nivel post-sináptico, inhibiendo los receptores excitatorios, como la serotonina (SHT3), la acetilcolina y el glutamato. Además, presentan un efecto analgésico directo a nivel de la médula espinal11.
¿Cuáles son las características principales del isoflurano y del sevoflurano?IsofluranoEl isoflurano muestra su inicio de acción a los 7 minutos, simplificando así el ajuste gradual de la dosis según el nivel deseado de sedación. Aproximadamente el 0,2% se metaboliza a nivel hepático y alrededor del 95% se excreta a través de los pulmones, lo que resulta en una mínima acumulación en el organismo. Su punto de ebullición a 48°C permite su uso a temperatura ambiente, facilitando la administración mediante vaporizadores adaptados a ventiladores convencionales utilizados en la UCI12.
Debido a su perfil de eficacia y de seguridad, y a su aprobación en España, el isoflurano es el agente recomendado para el uso de la sedación inhalada en la UCI13. A diferencia del sevoflurano, no se ha establecido un límite de días para su utilización, aunque se recomienda una reevaluación regular después de las 48horas debido a los datos limitados más allá de este período.
SevofluranoEn ausencia de isoflurano, el sevoflurano se presenta como una alternativa14. Su inicio de acción es de 1-2minutos; aproximadamente el 5% se metaboliza a nivel hepático y su excreción es pulmonar. La administración prolongada de sevoflurano se ha asociado con diabetes insípida nefrogénica e hipernatremia. Este efecto adverso se vincula con el metabolito principal, el hexafluorisopropanolol (HFIP), con liberación de flúor inorgánico y CO215. Por lo tanto, no se recomienda el uso de sevoflurano en la UCI más allá de 5días16.
Indicaciones, contraindicaciones y efectos adversosLos agentes inhalados tienen un perfil farmacocinético favorable para la sedación de pacientes con VM ingresados en la UCI debido a un inicio de acción y finalización rápidos, bajo metabolismo hepático, escasa eliminación renal y acumulación sistémica limitada. Estas características proporcionan una gran precisión en el control de la sedación, con niveles estables la mayor parte del tiempo y una rápida y predecible recuperación17.
¿Cómo afectan los agentes inhalados al tiempo de despertar y la estancia en la UCI?Dos metaanálisis y revisiones sistemáticas de estudios aleatorizados prospectivos demostraron una disminución significativa en los tiempos de despertar y de extubación de los agentes inhalados en comparación con propofol y midazolam18,19. Esta reducción fue especialmente notable en comparación con el midazolam. Sin embargo, no se encontraron diferencias significativas en la estancia en la UCI ni en la estancia hospitalaria. Más recientemente, el estudio de Meiser et al.20, un ensayo clínico aleatorizado, multicéntrico y controlado de no inferioridad de isoflurano frente a propofol durante 48horas en pacientes con VM, demostró tiempos de despertar más cortos y mayores tasas de respiración espontánea, sin encontrar diferencias en el objetivo primario (porcentaje de tiempo en el objetivo de sedación deseado). Posteriormente, Bracht et al.21, en un análisis post hoc con un seguimiento a 30días, encontraron más días libres de UCI en el grupo de isoflurano, con un menor consumo de otros fármacos sedantes.
¿Afectan los agentes inhalados a otros medicamentos analgosedantes y bloqueantes neuromusculares (BNM)?Se ha descrito un menor consumo de fármacos analgosedantes y BNM con el empleo de agentes inhalados debido a sus propiedades analgésicas y su interacción con BNM22. Grasselli et al.23 informaron un menor consumo de opiáceos y BNM sin mayores eventos adversos hemodinámicos. Este efecto «ahorrador de opiáceos» es importante para minimizar las complicaciones derivadas de estos, tales como tolerancia, íleo paralítico, síndrome de privación, polineuropatía del paciente crítico y delirium. Se requiere una monitorización estrecha de los niveles de analgesia y de bloqueo neuromuscular para evitar sobredosificación de fármacos innecesarios y así reducir eventos adversos.
¿Cuáles son los efectos de los agentes inhalados a nivel cardíaco?Los agentes inhalados exhiben un efecto directo de protección cardíaca al facilitar la apertura de canales de potasio ATP-dependientes y aumentar la producción de óxido nítrico durante el pre y post-condicionamiento isquémico. Estas propiedades han llevado a su preferencia en cirugía cardíaca en comparación con anestésicos i.v., como el propofol24,25
¿Cuáles son los efectos de los agentes inhalados a nivel cerebral?Los sedantes inhalados suprimen la actividad convulsiva inhibiendo la excitotoxicidad NMDA y activando los receptores GABA, por lo que se han utilizado como terapia de rescate en los casos de estatus epiléptico refractario y superrefractario (EER/EESR)26. Entre las ventajas descritas para su uso en comparación con otros sedantes i.v. se encuentran su rápida difusión y distribución en el sistema nervioso central, un inicio de acción ultrarrápido y una semivida corta. Estas características permiten una excelente monitorización y titulación del fármaco guiada por EEG a pie de cama, además de la ausencia de interacciones con otros fármacos. Las concentraciones necesarias para el control de las convulsiones son superiores a las dosis requeridas para la sedación profunda, recomendándose concentraciones de isoflurano al final de la espiración (end-tidal) entre el 0,8% y el 2%27. Sin embargo, los informes sobre el control de las convulsiones y los resultados con isoflurano en el SER/EESR son escasos y se precisan más estudios.
Por otro lado, se ha descrito un mecanismo de neuroprotección en enfermedades cerebrovasculares isquémicas similar al pre y post-condicionamiento isquémico cardíaco. Sin embargo, las reducciones en la presión arterial media y en la presión de perfusión cerebral hacen que su uso esté contraindicado en pacientes con hipertensión intracraneal (HIC)28.
¿Cuáles son los efectos de los agentes inhalados a nivel pulmonar?Los sedantes inhalados han sido objeto de amplia investigación a nivel pulmonar, especialmente en el contexto de la pandemia de la COVID-1929. Además de sus efectos broncodilatadores directos, se han descrito propiedades protectoras pulmonares que podrían ser beneficiosas para pacientes con síndrome de distrés respiratorio agudo (SDRA). Estas consisten en la reducción de la liberación de mediadores inflamatorios y el fortalecimiento de las uniones de la membrana alvéolo-capilar, que preservarían la integridad pulmonar, disminuyendo la lesión inducida por el ventilador30. Además, el uso de sevoflurano inhalado podría mejorar la oxigenación y reducir los niveles de marcadores de lesión epitelial y marcadores inflamatorios en pacientes con SDRA, en comparación con midazolam31. Estos agentes inhalados también se han considerado como una opción de rescate en casos de estatus asmático refractario grave32, con múltiples mecanismos beneficiosos propuestos, como la relajación del músculo liso bronquial y la inhibición de la liberación de mediadores inflamatorios30. En resumen, la sedación inhalada podría disminuir la lesión pulmonar asociada al ventilador no solo mediante la sincronización y la limitación de los esfuerzos lesivos para el pulmón, atribuidos a todos los sedantes i.v., sino también a través de un efecto protector pulmonar directo33.
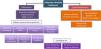
¿Debe reemplazar la sedación inhalada como primera opción a la sedación i.v. en determinado tipo de pacientes?Dada la evidencia científica previamente mencionada sobre los efectos beneficiosos de los agentes inhalados y las recomendaciones de las guías NICE34, desde el GTSAD se sugiere que la sedación inhalada con isoflurano puede ser considerada como primera línea de tratamiento en los siguientes escenarios clínicos, siempre y cuando se cuente con este recurso y con el entrenamiento adecuado (fig. 1).
- •
Sedación moderada-profunda por cualquier causa.
- •
Sedación prolongada para prevenir efectos secundarios debido a la acumulación y taquifilaxia de otros sedantes administrados por vía i.v., especialmente si se requieren dosis elevadas.
- •
Sedación difícil, en la que, a pesar de las dosis máximas de un sedante administrado por vía i.v. o la necesidad de combinar varios sedantes a dosis altas, no se logra mantener el RASS objetivo en el rango de −3 a −5.
- •
Broncoespasmo grave que dificulte la VM.
- •
Disfunción hepática y renal.
- •
Pacientes recuperados de una parada cardiorrespiratoria (PCR) que precisen sedación moderada-profunda35.
- •
Pacientes que requieran valoración neurológica frecuente.
- •
Pacientes con SDRA.
- •
Pacientes con EER/EESR como terapia de rescate y/o alternativa a otros agentes sedantes.
- •
Pacientes mayores con alto riesgo de delirium que precisen sedación profunda prolongada para evitar efectos delirogénicos de otros fármacos sedantes (midazolam y propofol), y de opiáceos por su efecto ahorrador de los mismos36.
El isoflurano está contraindicado en pacientes con hipersensibilidad conocida a agentes anestésicos halogenados volátiles y en pacientes con susceptibilidad genética conocida o sospechada a la hipertermia maligna37. También está contraindicado en la HIC38,28. En pacientes sin HIC pero en riesgo de desarrollarla, se aconseja su uso solo con neuromonitorización. Además, existen otras consideraciones que deben ser tenidas en cuenta, antes de iniciar su uso (tabla 1 del material suplementario).
¿Cuáles son los efectos adversos asociados y cómo se manejan en la práctica clínica?En la figura 2 se detallan los efectos adversos y los problemas potenciales que pueden surgir en la práctica clínica con respecto al uso de isoflurano, así como las posibles soluciones.
Descripción de la técnica¿Cómo se administran los agentes halogenados en la UCI?La vía de administración de los agentes halogenados es la inhalada. Para ello, se deben emplear dispositivos vaporizadores específicos, especialmente diseñados para su uso en la UCI. Se han descrito dos sistemas: el Sedaconda-ACD® (Sedana Medical, Uppsala, Suecia)39 y el sistema MIRUS® (Pall Medical, Dreieich, Alemania)40. El sistema Sedaconda-ACD® es el más ampliamente utilizado y el único aprobado en España.
¿Cómo funciona el dispositivo Sedaconda-ACD®?Configuración proximalEl dispositivo Sedaconda-ACD® funciona como un filtro intercambiador de calor y humedad con propiedades antibacterianas y antivirales cuando se coloca de manera habitual entre la pieza en Y del ventilador y el tubo orotraqueal. Proporciona una humidificación pasiva a una tasa de 31mg/l. Este dispositivo también incluye una varilla vaporizadora y una membrana de carbón activado que actúa como reflector41.
En la salida de gases del ventilador se instala un sistema de adsorción pasiva que incorpora un filtro de carbón activado. Este filtro tiene la función de retener el gas residual y prevenir la contaminación ambiental (fig. 3).
Durante la inspiración, el gas en estado líquido administrado a través de una bomba de jeringa se convierte en vapor y se mezcla con el aire y el oxígeno suministrado por el ventilador. En la fase de espiración el 90% del anestésico volátil se condensa en la superficie de las fibras de carbón activado y queda retenido. Solo el 10% del agente anestésico inhalado atraviesa el filtro y, finalmente, se elimina al exterior a través de la salida espiratoria del ventilador42. (fig. 1 del material suplementario).
En esta configuración, el dispositivo genera un incremento de espacio muerto de 50ml43.
Configuración distalLa configuración distal se puede emplear como alternativa a la proximal en ciertas situaciones. En primer lugar, cuando la reinhalación de CO2 o el espacio muerto de 50ml del dispositivo generen una acidosis respiratoria que no pueda ser corregida mediante ajustes en el ventilador o cambiando el dispositivo cada 12horas. En segundo lugar, esta configuración es de preferencia cuando se ventile al paciente con un volumen tidal inferior a 250ml. En pacientes con ECMO, donde no sea posible ajustar el flujo de gas para compensar la acidosis respiratoria, también se debe considerar la configuración distal23.
En esta configuración, el dispositivo se coloca en la salida de la rama inspiratoria del ventilador, asumiendo exclusivamente la función de vaporizador. Esta configuración evita el aumento del espacio muerto y, por consiguiente, el aumento potencial de la pCO2. Sin embargo, al perder la capacidad de humidificación, es necesario recurrir a la humidificación activa. También implica un aumento significativo del consumo de gas al no haber reinhalación de este. Según el fabricante, esta es la configuración recomendada para el uso de óxido nítrico (ON) (fig. 4).
¿Cómo funciona el dispositivo MIRUS™?El dispositivo MIRUS™ cuenta con una unidad de control y un reservorio específico para el anestésico, conectándose a una interfaz de 100ml a través de un cable multilumen insertado entre la pieza en Y y el tubo orotraqueal. Esta interfaz, equipada con reflector y filtro, incluye cables para la inyección de gas y la medición de presión, flujo y concentración del gas. Además, el filtro funciona como intercambiador de calor y humedad, brindando protección contra bacterias, virus y partículas.
Para mantener un control preciso, el MIRUS™ regula constantemente la presión, el flujo y la concentración del gas; aspira y reintroduce una muestra del gas exhalado, inyectando de manera pulsátil el vapor anestésico al inicio de la inspiración para lograr una rápida dilución y un transporte efectivo. La concentración espiratoria final se ajusta automáticamente según los valores objetivo, y la velocidad de control se adapta a las necesidades de lavado del agente anestésico44.
Consideraciones durante el uso de la sedación inhaladaDurante el inicio, el mantenimiento y la retirada de la sedación inhalada es fundamental considerar ciertos aspectos de los dispositivos y fármacos utilizados. Es importante destacar la necesidad de una monitorización estrecha para evitar cualquier riesgo de sobresedación45.
¿Cuál es la monitorización recomendada durante la administración de sedación inhalada?La monitorización y el ajuste de la profundidad de la sedación debe seguir el protocolo habitual, utilizando escalas validadas, como la Richmond Sedation Agitation Scale (RASS)46. En situaciones de sedación profunda (RASS−4, −5) o con el uso de BNM, se aconseja incorporar la monitorización mediante EEG, empleando un BiSpectral Index (BIS) de 40-6047 o un Patient State Index (PSI) de 25-5048.
Puede ser beneficioso contar con un monitor analizador de gases exhalados. Aunque no sustituye la evaluación de la profundidad de la sedación, permite conocer la concentración del gas exhalado, siendo especialmente útil en situaciones que requieren niveles elevados para lograr efectos broncodilatadores o anticonvulsivantes. Además, facilita la monitorización de la concentración espirada de CO2, lo que ayuda a detectar la aparición de hipercapnia49.
¿Cuáles son los factores a considerar durante el inicio y el mantenimiento de la sedación inhalada?Para optimizar el ajuste de dosis y el mantenimiento de los agentes inhalados se deben tener en cuenta principalmente tres factores:
- 1.
La configuración del dispositivo, ya sea proximal o distal.
- 2.
El volumen corriente del ventilador.
- 3.
La edad del paciente.
Configuración del dispositivo. La dosis administrada depende de la velocidad de la infusión de anestésico líquido que llega al dispositivo para ser vaporizado y que es administrado al paciente en cada inspiración.
En la posición proximal, la velocidad de inicio del isoflurano para obtener sedación moderada-profunda generalmente es de 3ml/h (0,3-0,7%V), mientras que para el sevoflurano es de 5ml/h (0,5-1%V)49. Estas velocidades deben ajustarse cada 5-10 minutos hasta alcanzar el objetivo deseado y pueden utilizarse bolos de 0,2-0,3ml.
En la posición distal, al no reutilizarse el gas, las velocidades de infusión para lograr sedación moderada a profunda son significativamente más altas: entre 5-7ml/h para el isoflurano y de 10-15ml/h para el sevoflurano, y los bolos deben ser de 0,4-0,6ml.
Volumen corriente del ventilador. Cualquier modificación en el volumen corriente (VC) afectará la fracción espirada de gas, lo que, en consecuencia, exigirá ajustar la velocidad de infusión. Un incremento en el VC demandará un aumento en la velocidad de infusión, mientras que una disminución en el VC requerirá reducir la velocidad para mantener un nivel constante de sedación50.
Edad. Las concentraciones mínimas necesarias para alcanzar el objetivo deseado pueden variar principalmente según la edad del paciente, observándose un menor requerimiento de gas en pacientes de mayor edad12.
Situaciones especiales durante el mantenimiento¿Cómo realizar traslados durante la sedación inhalada?Durante traslados a quirófano o pruebas complementarias, existen diferentes estrategias. Se puede emplear el dispositivo con la jeringa si se anticipa que el procedimiento superará los 20minutos. En configuración proximal también es posible utilizar solo el dispositivo, sin la jeringa, considerando que el sedante acumulado en el dispositivo tiene una duración aproximada de 20minutos, complementando con bolos de sedantes i.v. según sea necesario. En configuración distal, esta opción no es viable, ya que el efecto cesa de inmediato al detener la jeringa. Otra opción es prescindir del dispositivo y administrar bolos de sedantes i.v.
¿Cómo realizar nebulizaciones durante la sedación inhalada?En el proceso de nebulización durante la sedación inhalada es crucial considerar la viscosidad de los fármacos y la frecuencia de administración para evitar la obstrucción de la membrana del dispositivo. Se recomienda colocar el nebulizador entre el tubo orotraqueal y el dispositivo, priorizando la nebulización sincronizada. En la configuración distal también se puede situar entre la rama inspiratoria seca y el humidificador activo (figs. 3 y 4). Los nebulizadores ultrasónicos y de malla no afectan las concentraciones del sedante inhalado.
Exposición laboral y seguridad¿Es segura la administración de sedación inhalada en la UCI?Varios estudios confirman la seguridad y la ausencia de una exposición significativa para el personal sanitario durante la sedación inhalada18,51-53. La evaluación del entorno se realiza mediante concentraciones de aire notificadas en partes por millón (ppm), reguladas en España por el Ministerio de Trabajo y Asuntos Sociales. El valor límite ambiental-exposición diaria se establece en 50ppm durante una jornada de 8horas.
¿Cuáles son las medidas recomendadas para minimizar la exposición y garantizar la seguridad del personal de salud?Las recomendaciones que contribuyen a mantener un entorno seguro para el personal de salud incluyen54:
- •
Formación adecuada del personal sanitario para garantizar una manipulación correcta del material y las conexiones.
- •
Sistemas de extracción de gases con filtros de carbón activado conectados a la salida espiratoria del ventilador que se recambien de forma protocolizada.
- •
Minimizar procedimientos que puedan generar picos de ppm.
- •
Sistemas de aspiración cerrados en pacientes que requieran aspiraciones frecuentes.
- •
Boxes con un sistema de ventilación apropiado que asegure un mínimo de 8recambios de aire por hora.
Los sedantes inhalados se pueden administrar de forma segura y eficaz en la UCI. La sedación inhalada presenta ciertas ventajas respecto a la sedación i.v., fundamentalmente tiempos de despertar más cortos que pueden facilitar las valoraciones neurológicas frecuentes e intentos de despertar y respiración espontánea.
El isoflurano, con la evidencia científica actual, puede considerarse como un sedante de primera línea en los pacientes ventilados que requieran una sedación moderada o profunda.
Es importante destacar que la formación adecuada del personal sanitario de la UCI es esencial para optimizar la administración de sedación inhalada y minimizar los riesgos asociados. En consecuencia, la continua investigación y formación en este campo son fundamentales para mejorar la práctica clínica y la atención de los pacientes críticos.
FinanciaciónNinguna.
Contribución de los autoresSofía Contreras ha contribuido a la creación y corrección del manuscrito y aprueba la versión final.
Carola Giménez-Esparza Vich ha contribuido a la creación y corrección del manuscrito y aprueba la versión final.
Jesús Caballero ha contribuido a la creación y corrección del manuscrito y aprueba la versión final.
Conflictos de interesesLos autores declaran colaboraciones docentes con Sedana Medical.
Ninguno.