Resuscitation for patient with sepsis and septic shock
More infoEl shock séptico (SS) es una complicación frecuentemente asociada a la sepsis con una mortalidad elevada. El inicio precoz del tratamiento vasopresor, incluso antes de finalizar la resucitación inicial con fluidos, es un factor determinante del pronóstico. En este sentido, la noradrenalina (NA) continúa siendo el fármaco de primera elección, si bien cada vez existe mayor evidencia del beneficio de la asociación a esta de otros fármacos no adrenérgicos, como vasopresina, en lugar de escalar las dosis de NA. La fisiopatología del SS es multifactorial, y en ocasiones se asocia una situación de disfunción miocárdica que contribuye a la inestabilidad hemodinámica. Es fundamental identificar esta situación ya que empeora el pronóstico y puede beneficiarse del tratamiento combinado con fármacos inotrópicos. Existen nuevos agentes vasoactivos en estudio, más selectivos que los clásicos y que en el futuro podrían ayudar a diseñar tratamientos más individualizados y de precisión en el paciente séptico. En el presente trabajo se resume el conocimiento actual sobre los fármacos vasoactivos y su uso en el manejo del SS de acuerdo con la evidencia científica más reciente.
Septic shock is a high mortality complication frequently associated with sepsis. Early initiation of vasopressor treatment, even before completion of initial fluid resuscitation, is a determining factor in prognosis. In this sense, norepinephrine continues to be the drug of first choice, although there is increasing evidence of benefit combining it with other non-adrenergic drugs, such as vasopressin, instead of escalating norepinephrine doses. The pathophysiology of septic shock is multifactorial, and sometimes is associated with a situation of myocardial dysfunction that contributes to hemodynamic instability. It is essential to identify this situation since it worsens the prognosis and may benefit from combined treatment with inotropic drugs. There are novel vasoactive agents under study, more selective than the classic ones that in a next future could help to design more individualized and precise treatments. In the present work, the current knowledge about vasoactive drugs and their use in the management of septic shock is summarized according to the most recent scientific evidence.
El shock séptico (SS) se define como aquella situación de sepsis en la que las alteraciones circulatorias, celulares y metabólicas subyacentes son lo suficientemente profundas como para aumentar la mortalidad. Incluye la necesidad de tratamiento vasopresor para mantener una presión arterial media (PAM) ≥ 65 mmHg junto con la presencia de niveles de lactato > 2 mmol/L1. Esta situación se asocia a una mortalidad del 30 al 40%. Sin embargo, existen situaciones de SS en las que pese al inicio de terapia vasoactiva a dosis elevadas no se consigue alcanzar PAM ≥ 65 mmHg. A esta situación se la denomina shock séptico refractario (SSR) y aunque no existe una definición universalmente establecida, dosis de NA > 0,5 μg/kg/min o necesidad de terapia de rescate con vasopresina han sido considerados por diversos autores como criterios de SSR y se asocian con cifras de mortalidad que oscilan entre el 50 y el 94%2.
Reseña fisiopatológicaNumerosos mecanismos contribuyen al shock vasodilatador en la sepsis. Destacan el aumento de la expresión inducida por citocinas de la óxido nítrico sintasa inducible. Esta enzima produce óxido nítrico (NO), un potente vasodilatador endógeno, en altas concentraciones. Otros estímulos presentes en el shock, como la hipoxia celular, la acidosis y el propio NO, activan los canales de potasio sensibles al ATP. Estos canales inducen la hiperpolarización de la membrana, lo que evita un aumento del calcio citoplásmico, que conduce a vasodilatación. Otros mecanismos, como la presencia de insuficiencia suprarrenal, niveles plasmáticos inapropiadamente bajos de vasopresina y elevados de adrenomedulina o la oxidación e inactivación de catecolaminas contribuyen a la fisiopatología del SS3,4. En ocasiones se asocia un componente de disfunción miocárdica debido a la inflamación que puede agravar más el cuadro de shock, complicando tanto el pronóstico como el manejo5. Por tanto, incluso en presencia de un cuadro de SS de etiología clara pueden existir múltiples componentes que contribuyen a un colapso circulatorio refractario.
Objetivos de la terapia vasoactivaEl objetivo de la terapia vasoactiva es optimizar la perfusión a los órganos vitales asegurando un suministro adecuado de oxígeno a las células. En la práctica asumimos que la perfusión tisular tiene una relación lineal y directa con la PAM. En este sentido, las últimas guías de la Surviving Sepsis Campaign (SSC)6 recomiendan que los vasopresores se ajusten para mantener una PAM de 65 mmHg en la reanimación temprana del SS. Sin embargo, la PAM objetivo para pacientes con shock sigue siendo un tema de debate. Ya no solo cada individuo, sino cada órgano específico tiene diferente tolerancia a la hipotensión en función de la capacidad de autorregulación del flujo sanguíneo. Dicha capacidad puede estar influida por muchos factores (edad, comorbilidades como la HTA, ateroesclerosis, diabetes, insuficiencia renal, etc.). Dos modestos estudios que analizaron la elevación de la PAM objetivo en SS (85 frente a 65 mmHg) observaron un índice cardiaco (IC) más alto en los primeros, pero sin repercusión en la perfusión global y regional7,8. Un ensayo multicéntrico comparó el efecto de la titulación de vasopresores para PAM de 65-70 frente a 80-85 mmHg en pacientes con SS9. No se observaron diferencias de mortalidad (28 o 90 días) pero el grupo de PAM 80-85 mmHg presentó mayor incidencia de arritmias. Sin embargo, en el subgrupo de pacientes con hipertensión crónica documentada, la PAM objetivo 80-85 mmHg se asoció con una disminución de la necesidad de terapia de reemplazo renal.
Estos hallazgos sugieren que, aunque 65 mmHg puede ser un buen objetivo inicial para la mayoría de los pacientes, será necesario individualizar el tratamiento vasoactivo en función de las características del paciente.
Fármacos vasoactivos: vasopresores e inotroposLos agentes vasoactivos pueden clasificarse en catecolaminérgicos o no catecolaminérgicos. Los primeros comprenden un gran grupo de fármacos simpaticomiméticos, que ejercen sus mecanismos cardiovasculares a través del agonismo alfa-1 (α1), beta-1 (β1), beta-2 (β2) y receptores dopaminérgicos10. La NA, la adrenalina (AD) y la dopamina son catecolaminas endógenas, mientras que fenilefrina (FE) y dobutamina son catecolaminas sintéticas10. Los receptores adrenérgicos incluyen los receptores (α1), (β1) y (β2). El receptor α1 se encuentra en toda la vasculatura periférica y en el corazón, su estimulación conduce a vasoconstricción y a un aumento de la PA y de las resistencias vasculares sistémicas (RVS). Los receptores β1 se encuentran en el corazón y cuando se activan, aumentan la frecuencia cardiaca (FC), la contractilidad y el IC. Los receptores β2 se encuentran también en toda la vasculatura periférica y su estimulación provoca relajación del músculo liso, vasodilatación y disminución de la RVS. Los agentes no catecolaminérgicos incluyen agonistas del receptor de vasopresina, inhibidores de la fosfodiesterasa, agentes sensibilizadores del calcio, agentes inhibidores del NO y angiotensina II (ATII).
Otros receptores incluyen los receptores dopaminérgicos y de vasopresina. Hay cinco receptores de dopamina ubicados en los riñones y el cerebro; D1, D2, D3, D4 y D5. La estimulación de los receptores renales de dopamina conduce a la vasodilatación a nivel renal y mesentérico. Hay tres receptores de vasopresina; V1, V2 y V3. La estimulación del receptor V1, ubicado en el músculo liso vascular, aumenta el calcio intracelular a través de los canales de calcio dependientes de voltaje, lo que produce vasoconstricción sistémica, esplácnica, renal y coronaria. La activación del receptor V2, ubicado en los túbulos renales, produce efectos antidiuréticos. Los receptores V3 se encuentran en la hipófisis anterior y su activación provoca la secreción de ACTH. En la tabla 1 se resumen las características farmacológicas de los principales vasoactivos.
Resumen farmacológico de los principales agentes vasoactivos
| Fármaco | Receptor | Efecto | Dosis | Efectos secundarios |
|---|---|---|---|---|
| Noradrenalina | α1 (>), β1, β2 | Aumenta la contractilidad, la precarga, el GC, la FC, disminuye dependencia de precarga | 0,01-3,3 μg/kg/min (incremento0,1 a 0,3 μg/kg/min cada 5min hasta alcanzar el efecto deseado) | Bradicardia, arritmia cardiaca,isquemia periférica |
| Dopamina | D1 (otros receptores D), α1, β1 | Aumenta la contractilidad, la FC y la PA. Vasoconstricción, a nivel renal y mesentéricoVasodilatación | < 5 μg/kg/min D1; 5-10 μg/kg/minβ1, > 10 μg/kg/min α1 (incremento1-4 μg/kg/min cada 10-30min hasta alcanzar el efecto deseado) | Fibrilación auricular, bradicardia,taquicardia, arritmia ventricular,taquiarritmias |
| Adrenalina | α1 (>) β1, β2 | Aumento del GC, el VS y la PAM. Aumenta las RVS | 0,05-1 μg/kg/min(incremento 0,05-0,2 μg/kg/min cada 10-15 min hasta alcanzar el efecto deseado) | Hiperlactacidemia, hiperglucemia, taquiarritmias, isquemia periférica, disminución del flujo esplácnico |
| Vasopresina | V1 (a y b), V2, V3 | Vasoconstricción, aumenta la sensibilidad a las catecolaminas, disminuye FC, disminuye el VS, disminuye el GC. Retención hidrosalina, aumento de factores procoagulantes, estimula liberación de NO y corticosteroides | 0,01-0,04 UI/min | Bradicardia, arritmia cardiaca, urticaria, cefalea, broncoconstricción, disminución del flujo sanguíneo esplácnico, isquemia y necrosis en dosis altas (> 0,06 UI/min) |
| Terlipresina | V1a, V1b (>), V2 | Vasoconstricción periférica y esplácnica, Disminución gasto cardiaco, incremento consumo de O2 | 1 mg/6-8 h bolus | Arritmias (torsada de puntas), necrosis, isquemia cardiaca, intestinal o cutánea a dosis elevadas |
| Selepresina | V1a | Vasoconstricción periférica | 1,7, 2,5 y 3,5 ng/kg/min* | Fibrilación auricular, bradicardia, hipertensión |
| Fenilefrina | α1 | Aumento de PAM, disminuye FC, vasoconstricción, disminución de GC | 0,5-8 μg/kg/min; incremento de 0,5 a 1 μg/kg/min cada 5 min hasta alcanzarefecto deseado | Arritmias, isquemia periférica, bradicardia, acidosis metabólica, disminución del flujo sanguíneo renal y esplácnico |
| Angiotensina II | AT-I | Vasoconstricción, aumento de ADH,ACTH yaldosterona | 20-200 ng/kg/min; incrementos de hasta 15 ng/kg/min cada 5 min hasta el efecto deseado | Trombosis, taquicardia,trombocitopenia, acidosis, delirium |
| Azul de metileno | Guanilato ciclasa | Inhibición de la vasodilatación, aumento de PAM, disminuye permeabilidad capilar pulmonar | 1-2 mg/kg bolus iv ± infusión. Incrementar gradualmente 0,25, 0,5, 1,2 mg/kg/h | Metahemoglobinemia, vasoconstricción pulmonar, falso descenso de la saturación de O2 en la monitorización pulsioximétrica |
| Dobutamina | β1 >, β2 >, α (débil) | Aumenta contractilidad, GC y transporte de O2. Cronotropo leve. Inodilatador. | 5-20 μg/kg/min | Taquiarritmias, incremento en el consumo miocárdico de oxígeno, tolerancia farmacológica cuando la infusión se prolonga más de 5 días, fiebre, eosinofilia |
| Levosimendan | Sensibilizador del calcio | Aumenta contractilidad, potente vasodilatador. Aumento GC sin incrementar la demanda de O2. Efecto lusitrópico. | 0,05-0,2 μg/kg/min | Cefalea, hipotensión, taquiarritmias a dosis altas, alcalosis metabólica, hipokaliemia. |
GC: gasto cardiaco; FC: frecuencia cardiaca; VS: volumen sistólico; O2: oxígeno; RVS: resistencias vasculares sistémicas; DOP: dopamina; PAM: presión arterial media; Min: minutos; V1: receptor de vasopresina 1; V2: receptor de vasopresina 2; V3: receptor de vasopresina 3; NO: óxido nítrico.
Los tres regímenes de dosis han mostrado similares efectos clínicos y seguridad en los dos únicos ensayos que ha analizado el fármaco34,35.
Inducen vasoconstricción periférica, aumentando las RVS y por consiguiente incrementan la PAM.
NoradrenalinaDebido a sus efectos adrenérgicos sobre los receptores α y su menor efecto sobre el receptor β, parece ser más efectivo para revertir la hipotensión que la dopamina y, al mismo tiempo presenta menor riesgo potencial de taquicardia. Existe una significativa variabilidad farmacocinética entre pacientes en función de factores como la edad, la función renal y hepática.
Se trata de un fármaco con un inicio de acción rápido y una t½ que varía de 2 a 7 minutos. Es metabolizado por la catecol-ometiltransferasa y la monoaminooxidasa en metabolitos inactivos que se excretan en la orina.
En 1993, un pequeño estudio prospectivo, observacional, y unicéntrico analizó por primera vez el efecto de la NA en el SS frente a otros vasopresores11. El grupo tratado con NA alcanzó una mayor tasa de reversión del shock y un mayor incremento en las cifras de transporte de O2. Posteriormente datos similares han sido obtenidos en otros estudios12. El SOAP II, un ensayo aleatorizado y multicéntrico13, con 1.679 pacientes, comparó dopamina frente a NA para el tratamiento del shock. Se observó una incidencia significativamente mayor de arritmias en el grupo de dopamina (24,1 vs. 12,4%; p < 0,001) con similar tasa de mortalidad.
En los últimos años varias revisiones sistemáticas, han demostrado el beneficio de la administración de NA en el SS frente a otros vasopresores, fundamentalmente dopamina, con menor tasa de complicaciones y mortalidad intrahospitalaria o a los 28 días14–17.
Sin embargo, se debe tener en cuenta que el uso de NA a concentraciones elevadas puede regular a la baja la densidad de receptores α1 y β2 disminuyendo la sensibilidad al fármaco y condicionando mayor riesgo de efectos adversos por lo que tal y como se abordará posteriormente sería necesaria la asociación de otras drogas vasoactivas en este escenario.
DopaminaLa dopamina es un precursor de la NA y la AD y tiene efectos farmacológicos variables dependientes de la concentración administrada. Dosis < 5 μg/kg/min producen la activación de los receptores dopaminérgicos causando vasodilatación renal y mesentérica. Dosis de 5 a 10 μg/kg/min, favorecen efectos adrenérgicos β1 resultando en un aumento de la contractilidad cardiaca y de la FC por lo que puede resultar beneficiosa en pacientes con SS y función cardiaca comprometida. Finalmente, con dosis > 10 μg/kg/min, predominan los efectos adrenérgicos (α1), resultando en vasoconstricción arterial y aumento de la PAM.
En el año 2006, el estudio SOAP18 describió una mayor tasa de mortalidad para los pacientes en shock que recibieron dopamina en Unidad de Cuidados Intensivos (UCI) en comparación con otros vasopresores (42,9 vs. 35,7%; p = 0,02) en probable relación a una mayor tasa de eventos adversos (fundamentalmente taquiarritmias). A este siguieron otros muchos estudios como los mencionados en el aparado anterior4,13,15–17, que corroboraron dichos hallazgos, por lo que la dopamina ha pasado a ser considerado un fármaco vasopresor de segunda línea y su uso en el SS ha quedado relegado a casos seleccionados (no disponibilidad de NA o pacientes bradicárdicos)6. Tampoco se ha evidenciado beneficio del uso de dopamina a dosis bajas (< 5 μg/kg/min) a efectos de función renal, necesidad de técnicas de reemplazo renal o mortalidad13.
AdrenalinaLa AD también posee efectos dosis dependientes, con una potente actividad adrenérgica β1 (mayor que NA) y una actividad adrenérgica moderada β2 y α1. Así, a dosis bajas sus efectos vienen dados principalmente por su acción sobre los receptores adrenérgicos β1, lo que favorece un aumento del IC, una disminución de las RVS y efectos variables sobre la PAM. Sin embargo, a dosis más altas, induce un aumento de la PAM, RVS y IC. Puede aumentar además la producción de lactato aeróbico mediante la estimulación de los receptores adrenérgicos β2 del músculo esquelético y la disminución del aclaramiento de lactato hepato-esplácnico. Esto favorece la presencia de acidosis láctica, lo que dificulta el uso de lactato sérico como marcador para guiar la resucitación.
Aunque varios ensayos clínicos aleatorizados (ECAs) muestran que desde un punto de vista clínico la AD es comparable a la NA19, a NA + dobutamina20, e incluso a la NA + vasopresina21, el perfil de efectos secundarios de la AD limita su uso. Las últimas guías de tratamiento de la SSC6 posicionan su uso (con un nivel de recomendación débil y evidencia de baja calidad) como alternativa a la NA + dobutamina en casos de SS con insuficiencia cardiaca asociada e hipoperfusión persistente, como fármaco de tercera línea si pese a infusión de NA + vasopresina no se alcanza la PAM objetivo o bien en situaciones en las que la NA no esté disponible6.
VasopresinaLa arginina-vasopresina (VP) es una hormona vasopresora no catecolaminérgica liberada por la hipófisis posterior en respuesta a la hipotensión y la hipernatremia. Posee una semivida inferior a diez minutos. Estimula una familia de receptores: V1a, V1b, V2, oxitocina (vasodilatador) y receptores purinérgicos (de importancia limitada en sepsis). La VP induce síntesis de NO, lo que paradójicamente puede limitar la vasoconstricción, al tiempo que preserva la perfusión renal y también puede inducir cierto grado de depresión cardiaca. La vasoconstricción inducida por la activación del receptor V1a ocurre a nivel del músculo liso vascular y es independiente de la acción de catecolaminas, lo que explicaría por qué la VP complementa a la NA en situaciones de shock refractario. Por otra parte, en ciertas situaciones de SS se ha observado una deficiencia de VP con relación a un agotamiento de las reservas de la hormona y a una síntesis y liberación inadecuadas a nivel del eje hipotalámico-hipofisario22. En varios ECAs la infusión de dosis bajas de VP (0,01 a 0,04 U/min), aumentó la PAM y disminuyó las necesidades de NA23,24. En el estudio VASST25 778 pacientes con SS y recibiendo al menos 5 μg/min de NA fueron aleatorizados para recibir VP (0,01 a 0,03 U/min) o escalar NA. En general, no se observaron diferencias en la mortalidad a los 28 o 90 días. La tasa de eventos adversos graves también fue similar. Pero en el subgrupo de pacientes con SS menos grave (aquellos con dosis de NA < 15 μg/min), si se observó una mayor supervivencia en el brazo de VP (26,5 vs. 35,7%, p = 0,05). Más recientemente, en el estudio VANISH26 sobre 409 pacientes con SS se comparó el efecto de VP vs. NA ± hidrocortisona. Aunque no hubo diferencias significativas de mortalidad entre ambos grupos (30,9 vs. 27,5%) se observó que el uso de VP redujo el riesgo de necesidad de técnicas de reemplazo renal OR 0,40 [IC 95%, 0,20-0,73]. Ambos estudios demostraron un efecto ahorrador de catecolaminas; por tanto, el uso temprano de VP en combinación con NA puede ayudar a reducir la carga adrenérgica asociada a los agentes vasoactivos tradicionales. En un reciente metanálisis de 4 ECAs27 comparando VP con otros vasopresores, VP redujo el requerimiento de terapia de reemplazo renal (RR 0.86, IC 95% 0.74-0.99).
El fármaco fue aprobado en 2021 por la Agencia Europea del Medicamento para su uso en el shock séptico refractario a catecolaminas en adultos. Las últimas recomendaciones de la SSC6 sugieren añadir VP en lugar de escalar NA por encima de 0,25-0,5 μg/kg/min cuando no se logra alcanzar una PAM ≥ 65 mmHg (recomendación débil, moderada calidad de evidencia).
TerlipresinaLa terlipresina (TP) es un análogo sintético de VP que peptidasas endoteliales transforman en lisina-vasopresina, con una vida media más larga y una mayor selectividad V1. Disponible para su uso en Europa, Australia, Nueva Zelanda e India, pero no así en E.E. U.U. En 2005, Albanèse et al.28 aleatorizaron a un grupo de pacientes con SS sin compromiso miocárdico a recibir NA o un bolo de 1 mg de TP. Aunque ambos fármacos aumentaron la PAM, el grupo de TP presentó menor frecuencia cardiaca, menor IC y disminución del transporte y consumo de oxígeno. Posteriormente el ensayo DOBUPRESS29 demostró que la infusión concomitante de inotrópicos podría contrarrestar estos efectos cardiacos adversos de TP administrando dosis medias de 20 μg/kg/min de dobutamina para revertir la disminución de SvO2, lo que cuestionaba el beneficio de la terapia. Un ECA realizado en 2019 entre 617 pacientes con diagnóstico de SS en 21 UCIs de China30 comparó la administración de NA vs. TP en infusión continua. No hubo diferencias significativas de mortalidad a 28 días, ni en el número de días sin vasopresores. Sin embargo, se observó una mayor tasa de efectos adversos grave (isquemia digital y diarreas) en el grupo de TP (30 vs. 12%; p < 0,001). Un metaanálisis reciente31 evaluó en 9 ECAs el uso de TP y catecolaminas en pacientes adultos con SS. Aunque no se observaron diferencias en la mortalidad global entre grupos, en el subgrupo de pacientes < 60 años la tasa de mortalidad fue menor en el grupo de TP que en el grupo de catecolaminas (RR, 0,66; p = 0,002), en cambio la tasa de isquemia periférica fue mucho mayor en el grupo de TP (OR, 8,65 p = 0,02). Las guías 2021 de la SSC establecen una recomendación débil contra el uso de TP en SS6.
SelepresinaSelepresina (SP) es un agonista V1a puro. En modelos de peritonitis y neumonía se observó que disminuía el aumento de la permeabilidad vascular y favorece la disminución del edema pulmonar mejor que VP al carecer de los efectos hormonales de esta32,33. En 2 ECA fase-2 en pacientes sépticos, SP disminuyó el balance neto de líquidos y algunos marcadores tempranos de lesión orgánica34. Sin embargo, en un reciente ECA pivotal fase 2 B/3 (SEPSIS-ACT) se comparó la administración de SP con placebo en una cohorte de 607 pacientes con diagnóstico de SS y tratamiento con NAD (5 μg/min). No se observaron diferencias entre ambos grupos en el número de días libres de ventilador o de vasopresores ni hubo diferencias relevantes en otras variables clínicas ni en la tasa de eventos adversos, por lo que el estudio fue interrumpido por futilidad35. Actualmente el fármaco no está disponible comercialmente y no se recomienda su uso en el SS.
FenilefrinaLa FE es un agonista α1 puro que se usa habitualmente en situaciones de hipotensión profunda transitoria. Puede causar bradicardia reflejada mediada por barorreceptores e isquemia esplácnica. Parece ser además menos efectiva que la NA en base a un estudio realizado a raíz del desabastecimiento de NA que sufrió E.E. U.U. en 201136. La FE fue el vasopresor más utilizado en aquel periodo y su uso se asoció a una mayor mortalidad que la observada con NA. Un reciente estudio retrospectivo multicéntrico que analizó el efecto de la administración de bolus de FE en pacientes con SS en tratamiento con NA observó mayor estabilidad hemodinámica temprana, pero no sostenida, en el grupo de FE a costa de una mayor tasa de mortalidad intra UCI37. Estos hallazgos van en contra de la utilización del fármaco en el contexto de sepsis6.
Angiotensina IILa ATII es una hormona natural con propiedades endocrinas, autocrinas, efectos paracrinos e intracrinos recientemente aprobada por la FDA para el tratamiento del SS. Tiene efecto vasoconstrictor directo tanto a nivel arterial como venoso. Posee una vida media de alrededor de 30 segundos en la circulación, pero puede permanecer 15-30 minutos en los tejidos. El ATHOS-338 aleatorizó 344 pacientes con shock refractario a catecolaminas (siendo el 90% de pacientes sépticos) a tratamiento con NAD (0,2 μg/kg/min o equivalente), a recibir ATII o placebo. El objetivo principal del estudio, alcanzar un aumento de la PAM basal ≥ 10 mmHg o elevar la PAM por encima de 75 mmHg, se logró en el 69,9% de pacientes de ATII y en el 23,4% del grupo de placebo (p < 0,001) sin diferencias significativas en efectos secundarios graves. Recientemente, en un interesante trabajo por Bellomo et al.39 se observa como los niveles de renina sérica están marcadamente elevados en el shock vasodilatador y puede identificar a pacientes en quienes el tratamiento con ATII puede resultar más beneficioso. Actualmente la ATII no debe considerarse como agente de primera línea, pero habiendo demostrado su seguridad y eficacia fisiológica, puede tener un papel en el futuro como vasopresor coadyuvante.
Azul de metilenoEl azul de metileno es un bloqueador del GMPc, inhibe la guanilato ciclasa y por tanto la relajación del músculo liso mediada por NO. Puede disminuir la fuga vascular pulmonar, aumenta la PAM y disminuye las necesidades de NA en el shock refractario tras circulación extracorpórea y en el SS. La mayoría de los estudios disponibles son observacionales y de escaso tamaño muestral en los que el tratamiento se inició muy tarde en el curso del shock. No existen ensayos clínicos con este fármaco, lo que limita su uso en el SS40.
Fármacos inotrópicosLa disfunción miocárdica inducida por la sepsis se reconoce como un factor importante que contribuye a la inestabilidad hemodinámica y a una peor evolución de los pacientes con SS.
DobutaminaLa dobutamina es usada clínicamente como una mezcla racémica constituida por dos isómeros (+) y (-). La dobutamina se comporta principalmente como un inotropo con relación al incremento de la actividad cardiaca α1, produciendo menos taquicardia que otras drogas adrenérgicas41.
En el tratamiento del SS se recomienda dobutamina para incrementar el gasto cardiaco (GC) y el transporte de O2, con el objetivo final de mejorar la hipoperfusión6. Sin embargo, existe cierto grado de controversia a este respecto. Estudios experimentales han mostrado efectos beneficiosos sobre la hemodinámica sistémica, la perfusión hepática y esplénica42–44. Un estudio mostró que, en el SS, la dobutamina producía un incremento en el transporte de oxígeno junto con mejoría de la acidosis intramucosa e hiperlactatemia45. No obstante, algunos datos sugieren que estos efectos podrían no ser predecibles, particularmente cuando se utiliza la dobutamina a dosis > 10 μg/kg/min, donde la respuesta inotrópica a la infusión de la misma podría estar atenuada, con un efecto cronotrópico conservado a lo que se añade un descenso de las RVS, traduciéndose en incremento de la FC sin aumento del volumen sistólico (VS)46.
Curiosamente los efectos favorables de bajas dosis de dobutamina sobre la microcirculación parecen estar disociados de sus efectos macro-hemodinámicos, este fenómeno ha sido descrito en varios estudios observacionales47,48. Ningún ensayo clínico ha comparado directamente los efectos de la dobutamina frente a placebo, no obstante, esta se ha incorporado a varios protocolos de reanimación cuantitativa como pieza fundamental de dicha estrategia, sin lograr demostrar un beneficio clínico49–52.
Un ECA multicéntrico comparó la combinación de dobutamina + NA frente a AD a en 330 pacientes con SS. No hubo diferencias significativas de mortalidad a 28 días, ni en las necesidades de vasopresores, ni en los efectos adversos entre los grupos53. Un metaanálisis reciente que incluyó 43 ECAs, demostró que la combinación de NA y dobutamina se asoció a una reducción de la mortalidad a día 28 en pacientes con SS y bajo GC54. La evidencia científica actual, aparentemente soporta el empleo de dobutamina en pacientes con SS.
Las últimas guías publicadas de la SSC6 sugieren añadir dobutamina, para aquellos pacientes con disfunción cardiaca e hipoperfusión persistente (recomendación débil, baja calidad de evidencia).
LevosimendánLevosimendán tiene un perfil farmacodinámico que combina efectos inotrópicos y vasodilatadores. En modelos experimentales de sepsis, levosimendán resultó comparable a dobutamina o milrinona en producir una mejoría de la función sistólica, pero mejoró la función diastólica en mayor medida55. El estudio Levosimendan for the Prevention of Acute Organ Dysfunction in Sepsis (LeoPARDS)56, un gran ECA multicéntrico, evaluó el efecto de levosimendán sobre la disfunción orgánica a día 28 en pacientes adultos con SS, pero no pudo mostrar una reducción de dicha disfunción o de la mortalidad cuando se añadió al tratamiento estándar. Además, los pacientes asignados a recibir levosimendán requirieron más NA, tuvieron menor probabilidad de destete exitoso de ventilación mecánica y mayor riesgo de fibrilación auricular. En un análisis de subgrupos de dicho ensayo Antcliffe et al.57 utilizaron los biomarcadores Troponina I, NTproBNP y otros cinco mediadores inflamatorios para identificar a los pacientes con lesión o disfunción miocárdica, respectivamente. Estos autores no observaron ningún beneficio del uso de levosimendán en ninguno de los subgrupos. Un metaanálisis reciente que incluyó 10 estudios y 1.036 pacientes con sepsis y SS58 demostró la ausencia de beneficio del levosimendán sobre la mortalidad (OR 0,89; p = 0,39). No se encontró además ningún beneficio significativo sobre la mortalidad cuando se comparaba el uso de levosimendán con el de dobutamina en pacientes con disfunción cardiaca demostrada. Podemos afirmar que actualmente no existen ventajas de este agente en el tratamiento del paciente con SS.
Elección del fármaco vasoactivoPara el 97% de los participantes en una reciente encuesta entre 839 médicos de 83 países, NA es el fármaco vasopresor de primera elección en el SS59. La SSC en su versión de 2021 recomienda emplear NA como vasopresor de primera línea6.
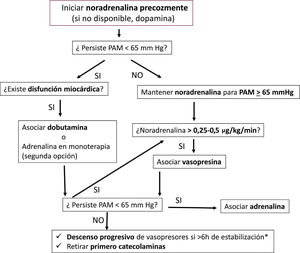
Si por cualquier motivo NA no estuviera disponible, se podría usar dopamina prestando especial atención al riesgo de arritmias. En casos de SSR a NA surge la cuestión de seguir incrementando la dosis de esta o añadir un segundo vasopresor con un mecanismo de acción diferente, lo cual tiene sentido desde el punto de vista fisiopatológico. En esta situación puede haber respuesta a vasopresores no-catecolaminas, como VP, TP o ATII60. Con base en la evidencia disponible la SSC recomienda la adición de VP a dosis bajas (< 0,03 UI/min) cuando la dosis de NA alcanza 0,25-0,5 μg/kg/min. Se podría valorar el uso de AD si no se dispusiese de NA ni de dopamina o como fármaco de tercera línea si con NA + VP no se alcanza la PAM objetivo6 (fig. 1).
Algoritmo de selección de fármacos vasoactivos en el tratamiento del shock séptico
PAM: Presión arterial media.
* Además de alcanzar una PAM objetivo ≥ 65 mmHg podemos considerar otros parámetros como la normalización de las cifras de lactato (y descartar «shock oculto»), la presencia de un adecuado ritmo de diuresis (0,5 mL/kg/h) para considerar que la estabilidad hemodinámica alcanzada es «real» y se traduce en una mejoría clínica del paciente.
Un metaanálisis de 43 ensayos clínicos que evaluó diferentes vasopresores y combinaciones de los mismos en el SS demostró que el uso de NA + dobutamina se asoció con una menor mortalidad a 28 días, especialmente en pacientes con bajo GC54. En la actualidad, el inotropo a emplear en caso de SS con insuficiencia cardiaca es la dobutamina. En esta situación las últimas guías de la SSC posicionan AD como alternativa a NA + dobutamina6 no recomendándose el empleo de levosimendán en base a los resultados de los ensayos clínicos56–58.
Momento de inicio y de retirada de drogas vasoactivasEl inicio precoz de los vasopresores para alcanzar la PAM objetivo en el SS es una medida esencial. Sin embargo, se ha discutido si el inicio de estos debe demorarse hasta que se haya completado la reanimación con fluidos o por el contrario debería iniciarse precozmente. La evidencia actual apunta hacia esta segunda opción, que parece asociarse a un mejor pronóstico.
Un ECA61 y seis estudios retrospectivos62–67 han evaluado el impacto en el pronóstico del inicio precoz de vasopresores (mayoritariamente NA) en pacientes con SS. Los resultados de estos estudios coinciden en el efecto beneficioso (disminución de mortalidad o de fallo orgánico) del inicio precoz del vasopresor aún sin haber completado la reanimación (tabla 2). Un metaanálisis68 que incluyó 929 pacientes, concluyó que el tratamiento temprano con NA en el SS se asoció con una disminución de la mortalidad a corto plazo, mayor precocidad para alcanzar la PAM objetivo y una menor carga de fluidos en las primeras seis horas.
Resumen de los principales estudios que analizan el momento de inicio del tratamiento vasoactivo
| Autor (Ref.) | Diseño del estudio | Núm. pacientes | Definición de uso precoz de vasopresores | Principales resultados | Comentarios |
|---|---|---|---|---|---|
| Bai62 | Retrospectivo | 213(86 en grupo de uso precoz) | Administración de NA en < 2 h | La mortalidad fue del 27,5% si la administración de NA se inició < 1 hora después del inicio del shock séptico; del 30,4% si se inició entre 1 y 2 horas y del 65,2% si se inició ≥ 6 horas.Cada hora de retraso en el inicio de NA durante las primeras 6 horas tras el diagnóstico del shock séptico se asoció con un aumento del 5,3% en la mortalidad | Pacientes quirúrgicos |
| Beck63 | Retrospectivo | 6.514 | Se registró el tiempo en minutos de inicio de NA tras diagnóstico de shock.No definición de uso precoz. | Correlación débil entre el retraso de inicio del vasopresor y la mortalidad hospitalaria (OR ajustado 1,02, IC del 95%: 1,01 a 1,03, p < 0,001) | Estudio multicéntrico |
| Waechter64 | Retrospectivo | 2.849 | Se registró el tiempo en horas de inicio de NA tras diagnóstico de shock.No definición de uso precoz. | La mortalidad más baja cuando NA se inició entre 1-6 horas después del inicio del shock y tras haber recibido al menos un litro de cristaloide comparado con inicio en la primera hora o ≥ 6 horas | Estudio multicéntrico |
| Permpikul61 | Ensayo clínico aleatorizado y doble ciego. Fase II | 310 pacientes: 155 NA precoz; 155 tratamiento estándar. | Se inicia NA al diagnóstico de hipotensión. En grupo de tratamiento estándar se administra placebo. | El control del shock a las 6 horas fue significativamente mayor en el grupo de NA precoz (118/155 [76,1%] frente a 75/155 [48,4%]; p < 0,001).No diferencias en mortalidad a los 28 días | Objetivo primario: Control del shock a las 6 horas del diagnóstico de sepsis más hipotensiónNingún paciente en VM a la aleatorización |
| Colon Hidalgo66 | Retrospectivo | 119 (76 en grupo de uso precoz) | Administración de vasopresor en 6 h | La mortalidad a los 30 días fue superior en los pacientes que recibieron vasopresores después de 6 h (51,1% vs. 25%, p < 0,01) | |
| Ospina-Tascón65 | Retrospectivo | 186 (93 en grupo de uso precoz) | Soporte vasopresor se inicia dentro de la siguiente hora o incluso antes de la primera carga de líquido con intención de reanimación | El empleo precoz se asoció con una reducción significativa en el riesgo de muerte en comparación con uso tardío (HR 0,31, IC 95% 0,17-0,57, p < 0,001).Balance de líquidos significativamente menor a 8 y 24 h con uso precoz | Estudio anidado y ajustado por propensity score |
| Black67 | Retrospectivo | 428 (no especifica número de pacientes con uso precoz de vasopresor) | Administración de vasopresor en 4 h | Mayor riesgo de desarrollo de insuficiencia orgánica si se inicia vasopresor > 4 h (OR = 4,34; IC 95% = 1,47 a 12,79; p = 0,008).No impacto en la mortalidad | Pacientes en área de Urgencias |
NA: noradrenalina; VM: ventilación mecánica; HR: hazard ratio; OR: odds ratio; IC: intervalo de confianza; p = valor p.
El inicio precoz de vasopresores mejora la perfusión tisular y previene la progresión hacia la disfunción orgánica. Además, la administración temprana de la terapia vasopresora en el SS disminuye la cantidad de fluidos administrados durante las primeras 24 horas. Es bien conocido que una reanimación agresiva con fluidos ocasiona un aumento del edema tisular con los consiguientes efectos deletéreos. Además, la NA potencia el efecto hemodinámico de la expansión de volumen como se ha demostrado recientemente en un trabajo con 30 pacientes en SS sometidos a elevación pasiva de las piernas69.
Recientemente un grupo de expertos de una encuesta internacional recomiendan no retrasar el tratamiento vasopresor hasta que se haya completado la reanimación, e iniciar NA precozmente para lograr PAM ≥ 65 mmHg58.
Los vasopresores deben administrarse, siempre que sea posible, a través de un acceso venoso central. Sin embargo, la inserción de este puede retrasar el tratamiento, especialmente si existen dificultades técnicas en la canalización o el paciente presenta una coagulopatía que precise corrección. La SSC sugiere la administración de vasopresores incluso por un acceso venoso periférico para no demorar su inicio hasta la canalización de un acceso central6. Varios trabajos confirman que el inicio de vasopresores por vía periférica es factible, sin aumento de complicaciones y facilita alcanzar más rápidamente el objetivo hemodinámico70,71.
Los vasopresores deben retirarse progresivamente en el menor tiempo posible. Ello se realiza siempre que se mantenga una PAM > 65 mmHg. No obstante, hay que considerar que la sola normalización de la PAM no garantiza la corrección de la hipoperfusión sistémica, debido a las disociaciones existentes entre la macro y microcirculación en el SS. Por ello, es recomendable monitorizar en este proceso parámetros de hipoperfusión como los niveles de lactato. Cuando se emplean conjuntamente NA y vasopresina se recomienda retirar antes la primera para evitar episodios de hipotensión72,73.
ConclusionesEl inicio precoz del tratamiento vasopresor, incluso antes de finalizar la resucitación inicial con fluidos, se ha mostrado como un factor determinante del pronóstico del SS. La NA es el fármaco de primera elección, aunque cada vez existe mayor evidencia del beneficio de la asociación a esta de otros fármacos no adrenérgicos, como vasopresina, en lugar de escalar las dosis de la primera. Es fundamental además identificar la presencia de disfunción miocárdica como causa contribuyente a la inestabilidad hemodinámica, ya que esta situación condiciona un peor pronóstico del SS y puede beneficiarse del tratamiento combinado con fármacos inotrópicos. Existen nuevos agentes vasoactivos en estudio, más selectivos que los clásicos y que en el futuro podrían ayudar a diseñar terapias vasoactivas individualizadas y de precisión en el paciente séptico.
Conflicto de interesesLos autores del manuscrito declaran no tener conflicto de interés alguno con relación al contenido de dicho trabajo.
Nota al suplementoEste artículo forma parte del suplemento «Resucitación del paciente con sepsis y shock séptico», que cuenta con el patrocinio de AOP HEALTH IBERIA.