Resuscitation for patient with sepsis and septic shock
More infoLas alteraciones cardiovasculares relacionadas con la sepsis causan situaciones de hipoperfusión que van a tener un impacto negativo en el pronóstico de estos pacientes. La monitorización hemodinámica pretende servir de guía en la detección y corrección de dicha hipoperfusión y ayuda en la toma de decisiones para la optimización del transporte de oxígeno a los tejidos, principalmente mediante la manipulación del gasto cardíaco.
En la presente revisión, se resumen los diferentes parámetros que comprenden la monitorización hemodinámica, tanto los objetivos de la reanimación como los parámetros fisiológicos o instrumentos de que disponemos para una correcta manipulación del gasto cardíaco.
Cardiovascular disturbances associated with sepsis cause hypoperfusion situations, which will negatively impact these patients’ prognosis. The aim of haemodynamic monitoring is to guide the detection and correction of this hypoperfusion, and assist in decision making in optimising oxygen transport to tissues, primarily by manipulating cardiac output.
This review seeks to summarise the different parameters of haemodynamic monitoring, the objectives of resuscitation, the physiological parameters, and the tools available to us for appropriate cardiac output manipulation.
La sepsis es una entidad clínica definida por el fallo orgánico que amenaza la vida, causado por una respuesta alterada del huésped a una infección. En los casos de sepsis en que se producen profundas alteraciones cardiovasculares que comprometen el metabolismo celular, se habla de shock séptico, que se relaciona con una mayor mortalidad, hasta del 50% en países desarrollados1.
El shock es una situación aguda en la que el sistema cardiovascular es incapaz de mantener un aporte suficiente de oxígeno a los tejidos para cubrir la demanda metabólica. Este desequilibrio entre aporte y consumo de oxígeno provoca una disfunción celular que, de perpetuarse, produce disfunción orgánica, fallo multiorgánico y, finalmente, la muerte del individuo. La definición de shock séptico ha evolucionado en el tiempo y, si antes se asociaba al requerimiento de vasopresores, en la actualidad se ha enfatizado la importancia de las alteraciones metabólicas1,2. Así pues, independientemente del tratamiento específico del shock séptico con antibioticoterapia y control del foco infeccioso, en el tratamiento clínico de estos pacientes es fundamental la restauración precoz del equilibrio entre transporte (DO2) y consumo de oxígeno (VO2), principalmente con intervenciones destinadas a incrementar el transporte general de oxígeno hacia los tejidos mediante la manipulación de la presión arterial y el gasto cardiaco (GC).
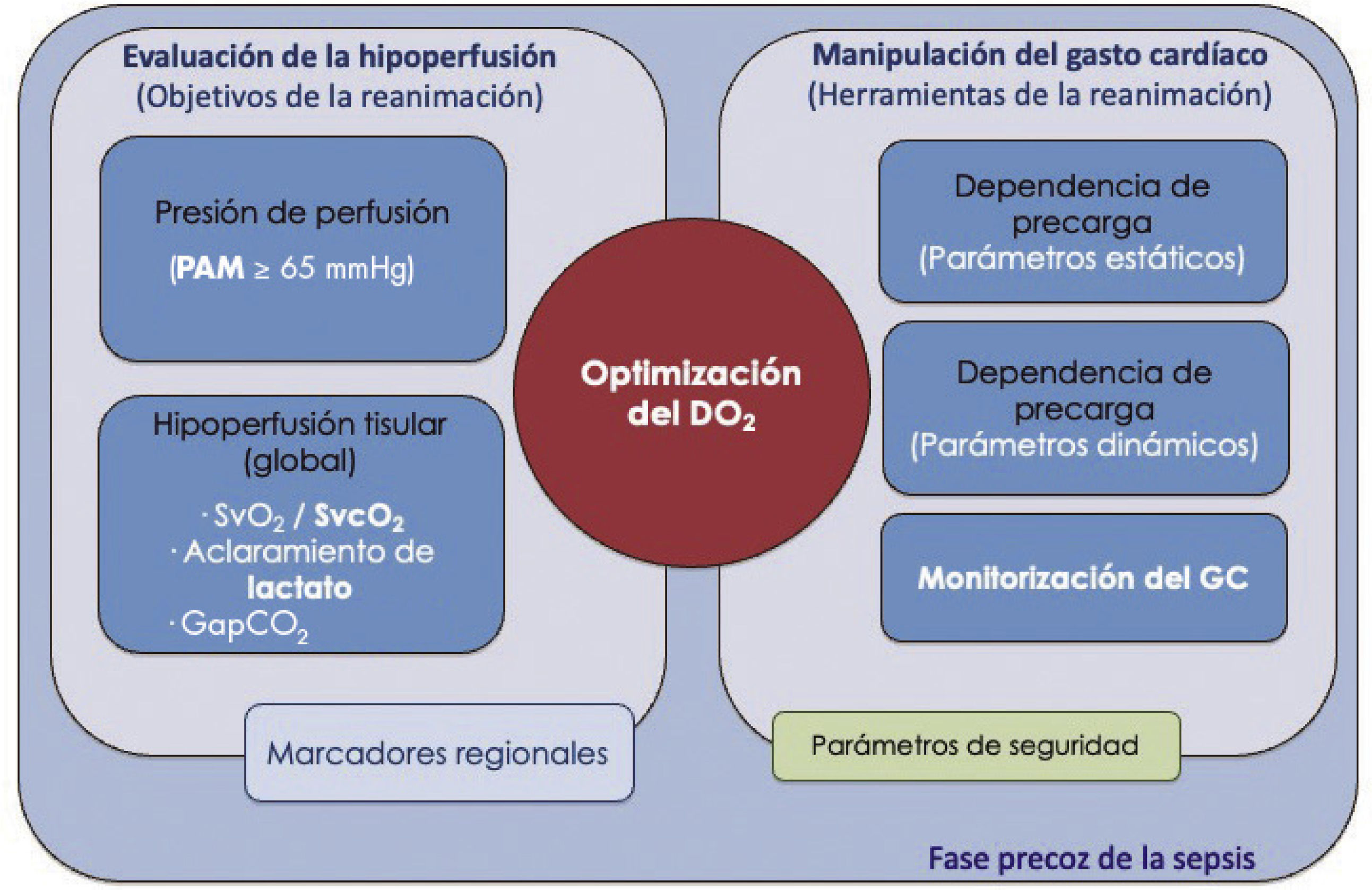
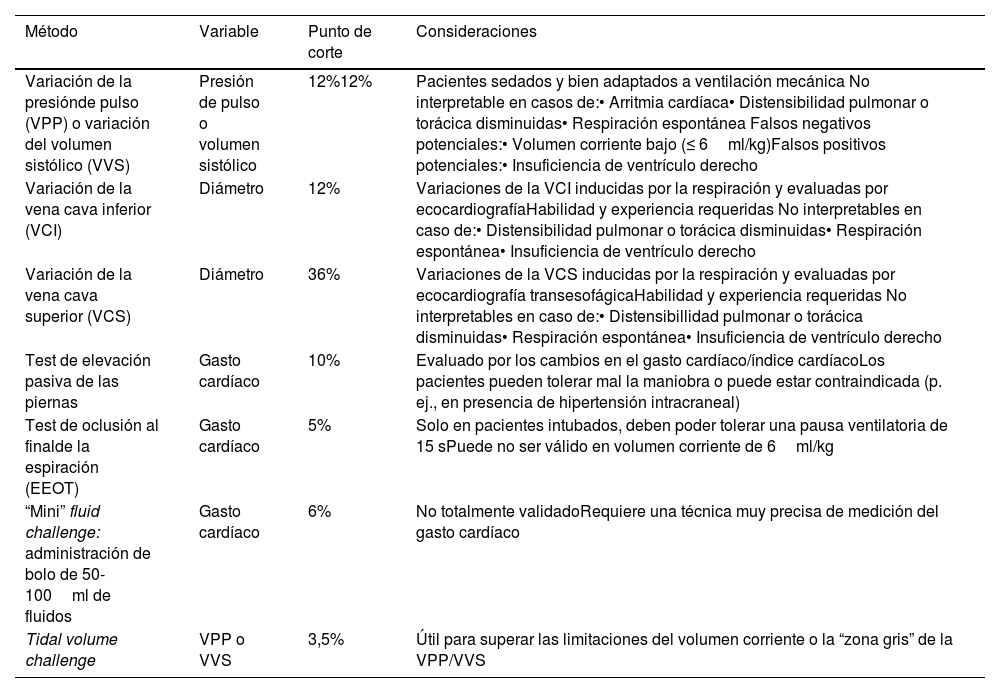
En el tratamiento hemodinámico del shock, hay que tener claros dos aspectos básicos: a) la definición de los objetivos concretos que se persiguen durante la reanimación, y b) el conocimiento en profundidad de los medios que se va a utilizar para conseguir dichos objetivos, con especial atención a los referentes a la manipulación del GC (Fig. 1). Así, la monitorización hemodinámica en la sepsis se refiere a la determinación, medición y/o estimación de diferentes parámetros, tanto objetivos de la reanimación como herramientas para la manipulación del GC, e incluso de diferentes variables informativas del estado de afección del sistema cardiocirculatorio.
Objetivos e instrumentos de la monitorización hemodinámica de la sepsis. De los diferentes parámetros que se va a monitorizar, es fundamental conocer y entender la naturaleza y la utilidad de cada uno de ellos. Así, hay: a) variables que proporcionan información sobre el estado de perfusión de los tejidos y, por tanto, potenciales “objetivos” del proceso de la reanimación, y b) variables instrumentales que proporcionan información sobre el estado de la funcionalidad cardiovascular en que se encuentra el paciente, en una aproximación de Frank-Starling, y son de utilidad en la toma de decisiones para la manipulación del gasto cardiaco. DO2: transporte global de oxígeno; GapCO2: diferencia arteriovenosa central de dióxido de carbono; GC: gasto cardiaco; PAM: presión arterial media; SvcO2: saturación venosa central de oxígeno; SvO2: saturación venosa mixta de oxígeno.
El objetivo final del proceso de resucitación es restablecer la disponibilidad de oxígeno en las células y satisfacer así la demanda metabólica. Las diferentes estrategias de la reani mación guiada por objetivos fisiológicos se basan en:
- •
Restauración de una adecuada presión de perfusión de los tejidos.
- •
Normalización de los marcadores metabólicos que informan del equilibrio VO2/DO2.
En condiciones fisiológicas, la perfusión microcirculatoria está regulada por cambios en el flujo sanguíneo, y no por cambios en la presión arterial. Dichos cambios vendrán dados por la modificación de las resistencias periféricas y el gasto cardíaco principalmente. Sin embargo, en situaciones en las que el flujo sanguíneo no puede compensar la vasodilatación periférica, la presión arterial cae y compromete aún más la perfusión de los tejidos3. Este mecanismo fisiopatológico es especialmente relevante en la sepsis, pues las alteraciones del tono vascular propias de la enfermedad y la pérdida de la capacidad de regular el flujo sanguíneo en la periferia hacen que el tejido sea más sensible a los cambios en la presión de perfusión. Aunque, por definición, la presión de perfusión se da por la diferencia entre las presiones de entrada y salida de un territorio, la presión arterial media (PAM) se considera el parámetro clínico más representativo de la presión de perfusión de los tejidos y es el parámetro utilizado como objetivo en las estrategias de resucitación hemodinámica4. Sin embargo, y como principios generales en la aproximación al tratamiento de la presión arterial, se debe tener en cuenta que la PAM no es un buen reflejo de la perfusión global de los tejidos, a excepción de los territorios cerebral y coronario, y que el objetivo inicial ha de ser la restauración de un gradiente mínimo de presión de perfusión, para la posterior manipulación del GC. Aunque conceptualmente la normalización de la presión arterial y la manipulación del GC son dos actuaciones de carácter secuencial, en la práctica clínica ambas actuaciones suelen superponerse. Así, la resucitación hemodinámica inicial habitualmente consiste en la administración de fluidos, que puede obtener un aumento tanto de la presión de perfusión como del GC. Sin embargo, si el tono vascular está alterado, la elevada distensibilidad del sistema vascular puede resultar en que el volumen administrado sea insuficiente para incrementar la presión intravascular, y así, la presión arterial (PA) puede no aumentar aunque sí lo haga el GC5,6. De esta manera, el uso precoz de vasopresores puede ser necesario si la PA no aumenta pese a la administración inicial de fluidos. En este aspecto, trabajos recientes indican que la administración precoz de noradrenalina en el shock séptico se asocia con un mejor control hemodinámico precoz, sin repercusiones en cuanto a aparición de fallo orgánico7. Sin embargo, uno de los peligros principales es el énfasis desmesurado que se puede dar al valor de PA, hecho que podría contribuir a excesos de prescripción o dosis de vasoconstrictores, lo cual agravaría la hipoperfusión tisular8. Según las recomendaciones de las guías clínicas actuales, basadas fundamentalmente en estudios observacionales, el valor “objetivo” de PAM es 65 mmHg2,9. Algunos trabajos han evaluado la consecución de cifras de PAM mayores, sin detectar un efecto beneficioso en cuanto a supervivencia10. Se ha señalado que, en los pacientes con hipertensión crónica, mantener unos valores de PA más altos podría reducir el riesgo de insuficiencia renal y la necesidad de terapias de reemplazo renal10. Por otra parte, un aumento en la carga catecolaminérgica se ha asociado repetidamente con algunos efectos adversos como arritmias cardiacas e incluso el aumento de la mortalidad11. En general, hay un amplio consenso en la necesidad de individualizar un objetivo tensional en función de las características de cada paciente. Más allá de la aproximación a la PA óptima desde el punto de vista microcirculatorio8, en los últimos años se han propuesto instrumentos derivados del mejor conocimiento de la mecánica del árbol arterial para la ayuda en la dosificación de fármacos vasopresores. Es el ejemplo de la elastancia arterial dinámica (Eadyn), un índice que representa la interacción entre la PA y el volumen sistólico y puede ser de utilidad en la predicción de la respuesta al aporte de volumen12. Sin embargo, la incorporación de parámetros informativos de la carga arterial en las estrategias de resucitación todavía no se ha testado en trabajos prospectivos.
Por lo tanto, la monitorización de la PA debe formar parte de la monitorización hemodinámica básica. La necesidad de una monitorización invasiva (catéter arterial) o no invasiva está determinada por las características de cada individuo y, fundamentalmente, de la continuidad y la precisión requeridas. En general, las mediciones no invasivas pierden precisión con cifras de PA extremas13, y se recomienda utilizar catéteres arteriales en situaciones de hipotensión grave, así como cuando puedan darse cambios rápidos de la PA, como en la infusión de vasopresores.
4Marcadores metabólicosComo ya se ha mencionado, el objetivo final de la resucitación hemodinámica es restablecer la oxigenación tisular. Así pues, una vez conseguidos valores adecuados de presión de perfusión, todo el proceso de reanimación va a guiarse por los marcadores de hipoxia tisular. Estos marcadores pueden ser de naturaleza general o regional.
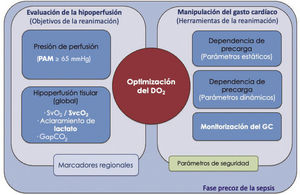
4.1Marcadores generales de hipoxia tisularEn la práctica clínica se dispone fundamentalmente de tres parámetros que ofrecen información sobre la perfusión global de los tejidos: el lactato, las saturaciones venosas de oxígeno —tanto central (SvcO2) como mixta (SvO2)— y las variables derivadas del dióxido de carbono (CO2). En las últimas décadas, las llamadas estrategias de resucitación cuantitativa, entendidas como las que consisten en un protocolo estructurado de intervenciones cardiovasculares que persiguen la consecución de parámetros fisiológicos predeterminados en un tiempo concreto, han utilizado diferentes marcadores de hipoxia tisular como objetivo final del proceso de reanimación hemodinámica. A pesar de que dichas estrategias se han mostrado superiores a la reanimación cualitativa14, la elección del marcador metabólico sigue siendo un debate abierto. La SvcO2 ha sido el objetivo de resucitación más ampliamente recomendado desde que Rivers et al. publicaron su trabajo de Early Goal-Directed Therapy (EGDT) en 200115. Es uno de los parámetros que mejor refleja la adecuación del CO2, puesto que representa la cantidad de oxígeno que permanece en la circulación sistémica después de su paso por los tejidos (Fig. 2). Así, valores de SvO2 inferiores al 60–65% o de SvcO2 inferiores al 70%, en un contexto de enfermedad aguda, son indicadores de un aporte inadecuado de oxígeno a los tejidos2. Sin embargo, la publicación de 3 grandes estudios multicéntricos internacionales en los que la SvcO2 no se asoció con un impacto en la mortalidad16–18 ha generado mucho debate en el valor de este parámetro fisiológico, e incluso ha llegado a desaparecer de las recomendaciones de la Surviving Sepsis Campaign (SSC)9. Los resultados de estos trabajos han generado mucha controversia, puesto que la gran mayoría de los pacientes incluidos en los estudios ya presentaban valores elevados de SvcO2 a la inclusión. Así pues, descartar una variable de gran valor fisiológico como la SvcO2, como consecuencia de una utilización cuando menos dudosa, parece poco razonable.
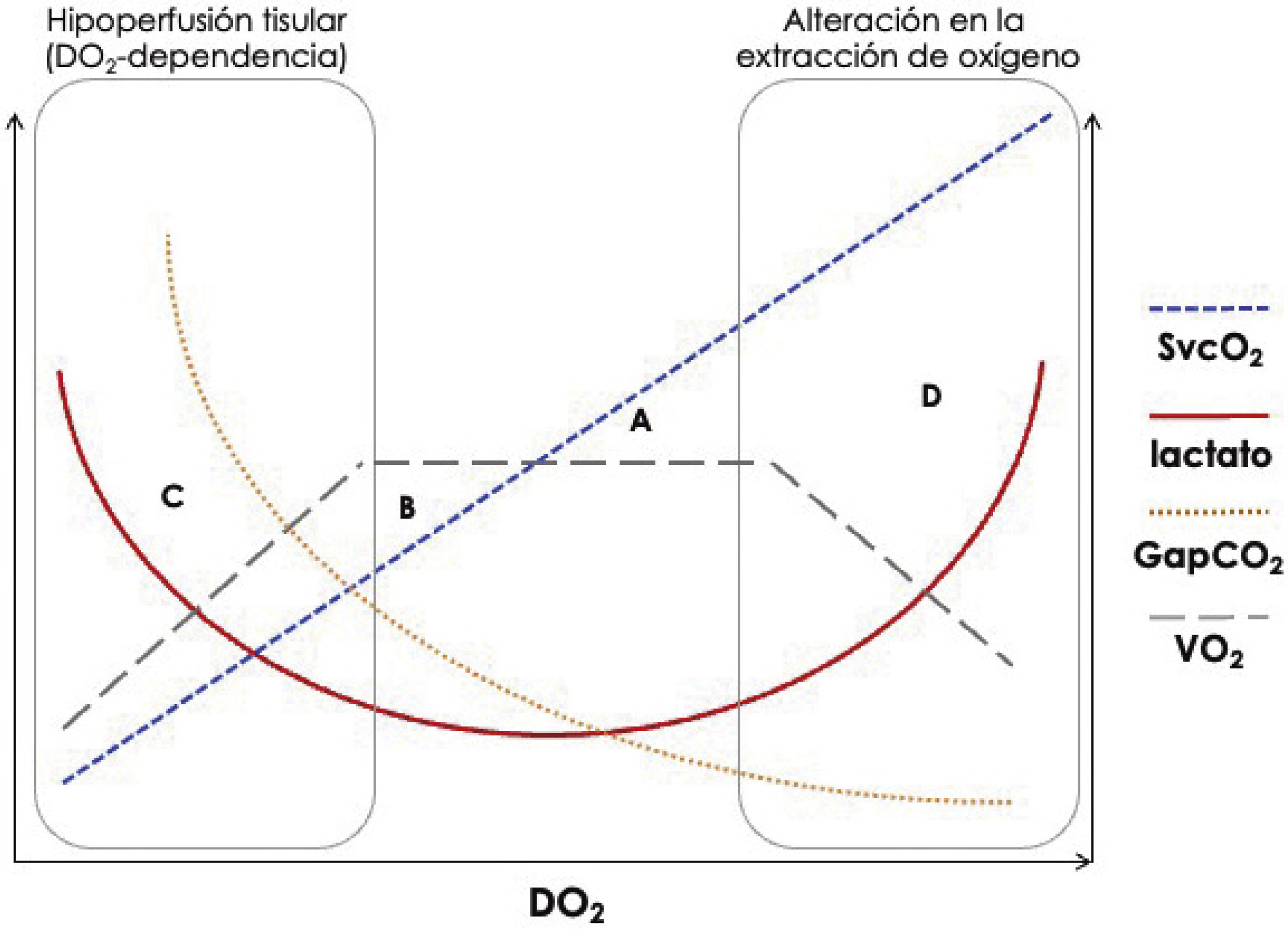
Marcadores metabólicos y VO2/DO2. Se representa la relación entre VO2, DO2 y los principales marcadores generales de perfusión disponibles a pie de cama. Clásicamente, según los valores de SvcO2 y lactato, se definen 4 situaciones principales: a) transporte de oxígeno adecuado para las necesidades metabólicas (lactato y SvcO2 en valores normales); b) déficit de oxígeno (lactato normal, con incremento de la extracción de oxígeno, que produce valores bajos de SvcO2); c) deuda de oxígeno (elevación del lactato con valores bajos de SvcO2), y d) alteración en la extracción de oxígeno (elevación de los valores de lactato y SvcO2)25. Los valores elevados de GapCO2 podrían ser de utilidad en esta última situación al desenmascarar que, a pesar de valores elevados de SvcO2, todavía puede coexistir un flujo sanguíneo bajo que cause el aumento de lactato18. DO2: transporte general de oxígeno; GapCO2: diferencia arteriovenosa central de dióxido de carbono; SvcO2: saturación venosa central de oxígeno; VO2: consumo general de oxígeno.
El aumento del lactato se ha asociado repetidamente con la gravedad de la enfermedad y la supervivencia en los pacientes con shock séptico. La capacidad y la rapidez en la normalización de los valores de lactato se ha relacionado directamente con la supervivencia. Ahora bien, se debe tener presente que la interpretación de la hiperlactacidemia es compleja y no siempre tiene relación con la hipoxia tisular19–21. A pesar de sus limitaciones, en un paciente séptico, la medición del lactato inicial se considera el test fundamental para el cribado de la hipoxia tisular9. En los pacientes con un valor de lactato inicial elevado, y con base en la cinética del lactato, en las fases iniciales de la resucitación se debería medir su valor en plasma cada 1–2h, para así calcular su variación en el tiempo20,21. Entenderemos la variación o aclaramiento de lactato como: [(valor inicial–valor evolutivo)/valor inicial]×100. Aunque la literatura es heterogénea en el valor de aclaramiento de lactato, descensos inferiores al 10% se deben considerar inadecuados y requerirían nuevas intervenciones hemodinámicas para incrementar el DO2.
La combinación del lactato y la SvcO2 ofrece una visión más general del estado de perfusión del tejido (Fig. 2). En una situación donde coinciden un lactato elevado con una SvcO2 baja, hay que sospechar hipoperfusión tisular. Ahora bien, la interpretación de la hiperlactatemia en situaciones de SvcO2 elevada es más compleja, ya que podría corresponder a situaciones de alteración en la utilización de oxígeno—por disfunción mitocondrial, por ejemplo—, aunque no se puede descartar la persistencia de hipoperfusión tisular. En estos casos, los parámetros derivados del CO2 pueden ser de utilidad.
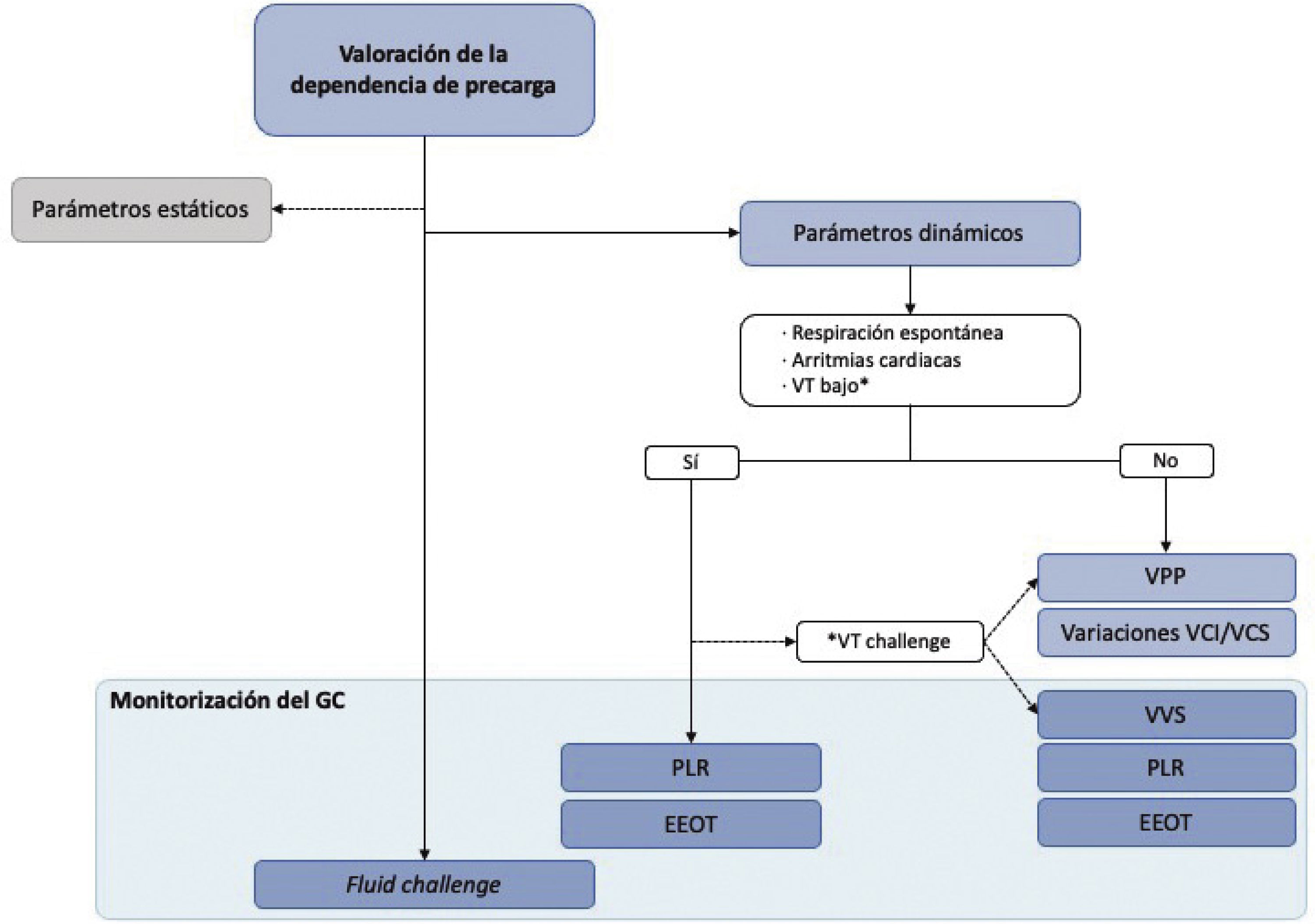
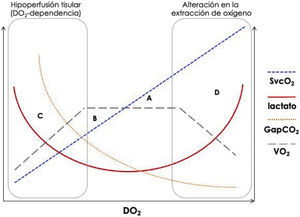
Algoritmo de decisión en la valoración de la administración de volumen. En la predicción de la respuesta a volumen, se recomienda utilizar los parámetros dinámicos, y se desaconseja la toma de decisiones basada en parámetros estáticos. Tanto la variación de la presión de pulso (VPP) como los cambios respiratorios en la vena cava no requieren sistemas de estimación continua del gasto cardiaco. Para el uso de los demás parámetros dinámicos, se requiere un sistema de monitorización continua del gasto cardiaco. Cuando la predicción no es posible, el patrón de referencia es una carga de volumen, o fluid challenge, para lo que también será necesario un sistema de monitorización del gasto cardiaco, continua o no. GC: gasto cardiaco; VPP: variación de la presión de pulso; VT: volumen tidal; VCI: vena cava inferior; VCS: vena cava superior; VVS: variación del volumen sistólico; PLR: test de elevación pasiva de la piernas; EEOT: test de oclusión telespiratoria.
La diferencia arteriovenosa central de CO2 (gap de CO2) está muy relacionada con la perfusión tisular en situaciones de bajo flujo sanguíneo y podría considerarse un indicador indirecto de la idoneidad del GC. Valores de gap de CO2> 6mmHg indican una situación de flujo sanguíneo disminui-do22. Diferentes estudios observacionales han demostrado que, en pacientes sépticos con valores de SvcO2 normales e hiperlactatemia persistente, un gap de CO2>6mmHg identifica a los pacientes con peores resultados pronósticos23,24. Estas observaciones han hecho que algunos documentos de consenso recomienden seguir incrementando el GC cuando haya una aumento tanto del lactato como del gap de CO2 a pesar de valores de SvcO2 normalizados2. No obstante, aún no se dispone de datos sobre el impacto que tiene la incorporación del gap de CO2 en los protocolos de resucitación.
Con la evidencia disponible actualmente, lo más apropia-do parecería ser guiar la toma de decisiones mediante una combinación de los tres parámetros expuestos. De hecho, en el contexto de conocimiento actual, guiar la reanimación mediante un único parámetro debería considerarse incluso inapropiado, por lo que profundizar en la definición de los objetivos del proceso de reanimación sigue siendo una de las prioridades de la medicina intensiva25.
4.2Marcadores regionales de hipoxia tisular y perfusión periféricaTal y como su propio nombre indica, los marcadores regionales de hipoxia tisular brindan información sobre la perfusión o el estado metabólico de una zona concreta, pero no informan de cuál es la situación del organismo en general, si bien es cierto que podrían evidenciar la persistencia de hipoperfusión tisular aunque los parámetros generales ya se hayan normalizado. De hecho, múltiples trabajos han demostrado el valor pronóstico de variables regionales de oxigenación, como la saturación tisular de oxígeno medida mediante espectroscopia de luz cercana al infrarrojo, o variables de perfusión periférica, como la videomicroscopia sublingual, independientemente de otros marcadores generales26. Ahora bien, los datos sobre el impacto de incluir estos marcadores en el árbol de decisión de la resucitación hemodinámica aún son escasos27,28. Uno de los pocos trabajos prospectivos aleatorizados que han analizado el impacto de variables periféricas comparó la reanimación guiada por lactato frente a la reanimación guiada por tiempo de llenado capilar28, o ca- pillary refill time (CRT). En dicho trabajo, el CRT se mostró no inferior al lactato en cuanto a mortalidad y se asoció con la administración de menores cantidades de volumen.
A día de hoy, la incorporación de parámetros regionales a la resucitación sigue estando alejada de la práctica clínica29,30, aunque las guías internacionales recientes ya recomiendan la inclusión del CRT como parámetro complementario para guiar el proceso de reanimación hemodinámica28. Así, dentro de la aproximación multimodal al proceso de resucitación, la utilización del CRT como marcador de baja perfusión tisular sería de interés, principalmente en fases iniciales, aunque probablemente debe complementarse con variables fisiológicas más robustas en la valoración de la hipoxia tisular.
5Medios para la optimización del transporte de oxígenoEn el proceso de restauración del equilibrio entre DO2 y VO2, más allá de las medidas destinadas a minimizar los requerimientos metabólicos del individuo (sedación, control de la fiebre, ventilación mecánica, etc.), la principal herramien-ta de trabajo para la optimización del DO2 es la manipulación del GC. Aunque el DO2 está determinado por la oxigenación arterial, la concentración de hemoglobina y el GC, la gran mayoría de las intervenciones hemodinámicas se dirigen a conseguir el incremento del GC. Los principales instrumentos de monitorización hemodinámica son los que permiten estimar el GC y/o los cambios que se producen en respuesta a una determinada intervención, como la administración de volumen. Es importante recordar que no se busca un valor de GC como objetivo final, en lo que se pueda considerar un valor “normal” de GC, sino que siempre se debe definir si el GC es adecuado o insuficiente en función de si se relaciona con hipoperfusión tisular o no.
6Valoración de la respuesta a volumen: Frank-Starling y la dependencia de precargaLa administración de volumen se considera el primer paso en el proceso de resucitación de los pacientes con shock séptico. El principal objetivo de dicha intervención es aumentar la presión sistémica media (PSM), que va a determinar un aumento en el retorno venoso y la precarga cardiaca y, finalmente, si el paciente se encuentra en el área de precarga-dependencia en la curva de Frank-Star-ling, aumento del GC31,32. Cabe destacar que, a pesar de encontrarse en una zona de precarga-dependencia, si la administración de líquidos no consigue aumentar la PSM, podría no observarse el efecto deseado en el GC. De ahí la recomendación de añadir pronto vasopresores para incrementar el tono venoso de los pacientes en los que no se observa una respuesta a la administración de fluidos32. La predicción/valoración de la respuesta al aporte de volumen es de vital importancia, ya que los beneficios hemodinámicos se observan cuando el paciente aún está en el área de precarga-dependencia; de otro modo, el volumen administrado no tendría impacto en el DO2 y podrían asociarse únicamente con efectos deletéreos para el paciente, como el edema intersticial o el incremento en las presiones de llenado cardiacas, y desencadenar edema pulmonar33. Hay evidencia clara y robusta que relaciona la sobrecarga de volumen con un aumento de la morbilidad y la mortalidad de los pacientes críticos, especialmente en los pacientes sépticos34.
Para evaluar si el paciente se encuentra en la zona de precarga-dependencia, el test de carga de volumen (fluid challenge) se sigue considerando el patrón de referencia35. El fluid challenge consiste en administrar un bolo de 500ml de cristaloides y evaluar su efecto en el GC. Si el incremento en este es>15% respecto al basal, el paciente se encuentra en la zona de precarga-dependencia y se considera que ha respondido a volumen. Las principales limitaciones del fluid challenge son, por una parte, que es necesaria la monitorización del GC y, por otra, que la valoración siempre se hace una vez administrado el volumen, a riesgo de que el paciente no responda. Sabemos que se observa una respuesta satisfactoria en el 50-70% de los pacientes con shock a los que se administra volumen, según las series36,37. Por lo tanto, y a pesar de que el fluid challenge sea la referencia para la valoración de la respuesta a volumen, parece razonable utilizar instrumentos a pie de cama que sirvan para predecir el efecto hemodinámico del volumen antes de administrarlo (tabla 1).
Métodos para la predicción de la respue sta al aporte de volumen
| Método | Variable | Punto de corte | Consideraciones |
|---|---|---|---|
| Variación de la presiónde pulso (VPP) o variación del volumen sistólico (VVS) | Presión de pulso o volumen sistólico | 12%12% | Pacientes sedados y bien adaptados a ventilación mecánica No interpretable en casos de:• Arritmia cardíaca• Distensibilidad pulmonar o torácica disminuidas• Respiración espontánea Falsos negativos potenciales:• Volumen corriente bajo (≤ 6ml/kg)Falsos positivos potenciales:• Insuficiencia de ventrículo derecho |
| Variación de la vena cava inferior (VCI) | Diámetro | 12% | Variaciones de la VCI inducidas por la respiración y evaluadas por ecocardiografíaHabilidad y experiencia requeridas No interpretables en caso de:• Distensibilidad pulmonar o torácica disminuidas• Respiración espontánea• Insuficiencia de ventrículo derecho |
| Variación de la vena cava superior (VCS) | Diámetro | 36% | Variaciones de la VCS inducidas por la respiración y evaluadas por ecocardiografía transesofágicaHabilidad y experiencia requeridas No interpretables en caso de:• Distensibillidad pulmonar o torácica disminuidas• Respiración espontánea• Insuficiencia de ventrículo derecho |
| Test de elevación pasiva de las piernas | Gasto cardíaco | 10% | Evaluado por los cambios en el gasto cardíaco/índice cardíacoLos pacientes pueden tolerar mal la maniobra o puede estar contraindicada (p. ej., en presencia de hipertensión intracraneal) |
| Test de oclusión al finalde la espiración (EEOT) | Gasto cardíaco | 5% | Solo en pacientes intubados, deben poder tolerar una pausa ventilatoria de 15 sPuede no ser válido en volumen corriente de 6ml/kg |
| “Mini” fluid challenge: administración de bolo de 50-100ml de fluidos | Gasto cardíaco | 6% | No totalmente validadoRequiere una técnica muy precisa de medición del gasto cardíaco |
| Tidal volume challenge | VPP o VVS | 3,5% | Útil para superar las limitaciones del volumen corriente o la “zona gris” de la VPP/VVS |
Se han propuesto multitud de parámetros fisiológicos para predecir la respuesta a la administración de volumen. Dichos parámetros podrían dividirse en dos grandes grupos:parámetros estáticos, y b) parámetros dinámicos.
Los parámetros estáticos de respuesta a volumen son medidas estáticas de presiones, volúmenes o áreas cardiovasculares que intentan estimar el valor absoluto de la precarga cardiaca. Este grupo de parámetros incluye el diámetro de la vena cava inferior (dVCI) o el área telediastólica del ventrículo izquierdo (LVEDA) medidos por ecocardiografía, el volumen telediastólico global (GEDV) medido por técnicas de termodilución o la presión venosa central (PVC) obtenida mediante un catéter venoso. La PVC ha sido y es, con diferencia, el valor a pie de cama más empleado para la toma de decisiones sobre la administración de volumen37, aunque la evidencia haya demostrado de forma repetida que, como otros parámetros estáticos, no es un buen predictor de respuesta a volumen, incluso aunque sus valores sean extremos38. En la actualidad, el uso de parámetros estáticos como predictores de respuesta a volumen no está recomendado2.
Los parámetros dinámicos se basan en evaluar la respuesta cardiovascular a un cambio temporal y reversible en la precarga. Tanto la variación de la presión de pulso (VPP) como la variación del volumen sistólico (VVS) son excelentes predictores de la respuesta al volumen en los pacientes en ventilación mecánica39. Ahora bien, estos parámetros tienen limitaciones que se debe conocer para una aplicación óptima. El paciente debe tener un ritmo cardíaco regular, debe estar completamente adaptado a la ventilación mecánica sin realizar esfuerzos inspiratorios y ventilado con un volumen tidal (VT)>8ml/kg de su peso ideal. Esta última limitación deriva de que el VT<8ml/kg podría asociarse con falsos negativos. Una forma de superar esta limitación es realizando una maniobra de incremento transitorio del VT, o tidal volu- me challenge. Dicha maniobra permite mantener la VPP o la VVS como buenos parámetros en la predicción de respuesta a volumen aun para el paciente en ventilación protectora con VT<6ml/kg40,41. También se ha propuesto el test de oclusión al final de la espiración (EEOT) como un predictor fiable de respuesta a volumen, útil también en pacientes con arritmias, pacientes ventilados con respiración espontánea o pacientes con una baja distensibilidad pulmonar42. A pesar de su validez en presencia de respiración espontánea, la realización del EEOT requiere la colaboración del paciente, hecho que puede representar una limitación en determinadas situaciones clínicas, como en pacientes con gran actividad respiratoria43. Por último, se dispone de la maniobra de elevación pasiva de las piernas, o passive leg raising (PLR). Para la realización de dicha maniobra, se debe disponer de un sistema de monitorización del GC, y se considerará positiva cuando la PLR produzca un aumento del GC>10%44. En el caso de la PLR, una alternativa a la monitorización continua del GC es la monitorización del end-tidal de dióxido de carbono (ETCO2).
Así, cambios>5% en el ETCO2 como respuesta a una maniobra de PLR se han asociado con una respuesta favorable a la administración de fluidos45,46. Cabe destacar que la maniobra también es aplicable a los pacientes con arritmias, respiración espontánea y baja distensibilidad pulmonar, aunque se verá limitada en algunos pacientes que no toleren la manio-bra (pacientes con limitaciones de la movilidad, hipertensión intracraneal, etc.). Así, se podría resumir que, para la correcta evaluación de la predicción al aporte de volumen mediante parámetros dinámicos, es necesaria la monitorización continua del GC. Las principales excepciones se hallan principalmente en el uso de la VPP, que se deriva de la señal de un catéter arterial, o las variaciones de la vena cava, medidas mediante ecocardiografía, así como en la utilidad de los cambios en el ETCO2 en la evaluación de la respuesta a la PLR45,46.
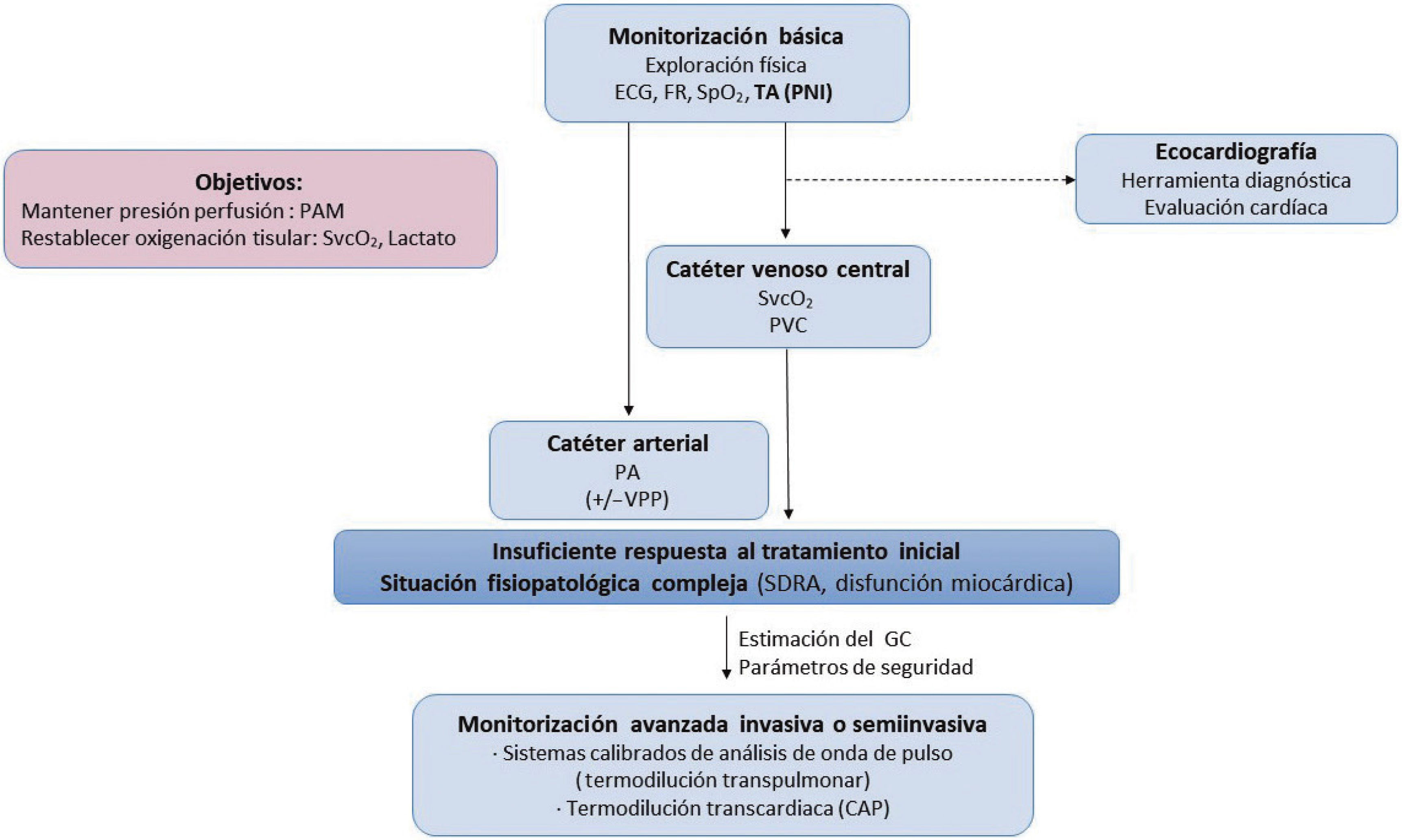
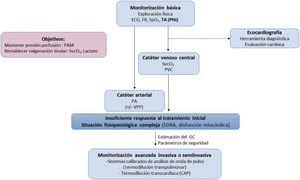
8Monitorización hemodinámica en el shock séptico: una aproximación progresivaLa recomendación para la monitorización del paciente con shock séptico es individualizar en cada caso, empezando con medios lo menos invasivos posible y, en función de si el paciente se deteriora o simplemente no mejora, cambiar a otros más invasivos y que ofrezcan una monitorización hemodinámica continua (Fig. 4)7,47–49.
Algoritmo de monitorización hemodinámica del paciente séptico. CAP: catéter de arteria pulmonar; ECG: electrocardiograma; FR: frecuencia respiratoria; GC: gasto cardíaco; PA: presión arterial; PAM: presión arterial media; PNI: presión arterial no invasiva; SDRA: síndrome de distrés respiratorio agudo; SpO2: saturación de oxígeno por pulsioximetría; SvcO2: saturación venosa central de oxígeno; VPP: variación de la presión de pulso.
La resucitación puede empezar tan solo con la monitorización de parámetros mínimamente invasiva, como la medición de lactato en sangre venosa, y la obtención no invasiva de la PA. La inserción de un catéter venoso central (CVC), ya sea a través de un acceso venoso central como de inserción periférica (PICC), también puede ser de ayuda, ya que, además de facilitar la administración de fármacos vasoactivos y volumen, permite la medición de la SvcO2 y la PVC. Colocar un catéter arterial también estaría recomendado para pacientes que necesiten fármacos vasoactivos, pues se monitoriza la PA de manera continua y, en el caso de estar en ventilación mecánica, se podría disponer de la VPP. En la actualidad, la medición de la SvcO2 a través del CVC puede ser intermitente, mediante la obtención de muestras analizadas con cooximetría, o continua, mediante dispositivos ópticos. A pesar del debate sobre la falta de precisión de los dispositivos de monitorización continua50, en cuanto a impacto clínico ambos sistemas no han mostrado diferencias51,52. La ecocardiografía también se ha propuesto como medio útil a pie de cama, que puede proporcionar información sobre la función cardiaca y su estructura, así como descartar otras posibles causas de shock. Se ha propuesto también como una herramienta fiable para monitorizar el GC. Sin embargo, es muy importante recordar que la ecocardiografía necesita de un grado considerable de formación y experiencia, está sujeta a notable variabilidad intraobservador e interobservadores y no es de carácter continuo53,54. Por lo tanto, hay que tener precaución a la hora de utilizar la ecocardiografía como medio para monitorizar el GC y considerarla más un instrumento diagnóstico, de evaluación cardiaca, y no de monitorización hemodinámica continua.
Para los pacientes con falta de respuesta al tratamiento inicial, como sería un escaso aclaramiento de lactato a pesar de las intervenciones realizadas, o que se encuentren en una situación compleja, como disfunción miocárdica o síndrome de distrés respiratorio agudo (SDRA), se debe considerar un paso más en la invasividad, y utilizar algún dispositivo de monitorización del GC48,55. No existe un consenso sobre el momento en que se requiere un mayor grado de invasividad en los sistemas de estimación del GC, aunque parece razonable que, si tras 2–3h de reanimación activa, la respuesta del paciente no es satisfactoria o presenta parámetros que pueden considerarse de riesgo, como la aparición/sospecha de edema pulmonar, se requiera un mayor grado de monitorización hemodinámica, tanto para un mejor tratamiento del GC como para la medición de parámetros de riesgo. En estos casos, deben incluirse sistemas de análisis de onda de pulso con calibración mediante termodilución transpulmonar o sistemas de estimación del GC mediante termodilución transcardíaca, como el catéter de arteria pulmonar (CAP). En la actualidad, se considera que tanto el análisis de onda de pulso como el CAP son técnicas equivalentes en la estimación del GC. Sin embargo, en caso de disfunción ventricular derecha concomitante o en pacientes con un perfil cardiogénico en el que preocupen las presiones de llenado de las cavidades izquierdas, los expertos recomiendan utilizar el CAP2,49.
Monitorizaciones no invasivas o mínimamente invasivas del GC, como el análisis del contorno del pulso no calibrado, no se recomiendan en pacientes con shock séptico, puesto que su fiabilidad es cuestionable en estados donde hay una grave alteración del tono vascular55.
9Monitorización de parámetros de seguridadDentro de lo que se considera monitorización hemodinámica, no solo se debe incluir los parámetros que proporcionan información sobre variables metabólicas o los instrumentos de evaluación y predicción de los cambios en el GC, sino que se debe incluir variables informativas sobre el grado de estrés o afección del sistema cardiovascular que se podría considerar parámetros “de riesgo” o “de seguridad”. De estos parámetros, cabe destacar la medición de presiones de llenado cardíacas, tanto de las cavidades derechas como las izquierdas. Merece especial mención el valor de la PVC, un parámetro malinterpretado muy a menudo en la práctica clínica. La PVC es un indicador de la precarga del ventrículo derecho, y su valor se ve afectado por el retorno venoso y la función del ventrículo derecho, así como por las presiones torácica, pericárdica y abdominal56. Como ya se ha comentado, a pesar de que su valor es extremadamente limitado en la valoración de la dependencia de precarga, la PVC proporciona información muy valiosa en cuanto al riesgo de congestión extratorácica, y valores elevados se han asociado repetidamente con un peor pronóstico de los pacientes, tanto en la aparición del fallo de órganos como en mortalidad34,57,58. También hay que recordar que los valores de PVC no son un buen reflejo de las presiones de llenado de las cavidades izquierdas, por lo que no se van a asociar necesariamente con riesgo de edema pulmonar. Así, en pacientes con determinado perfil cardiológico o en riesgo de edema pulmonar, es más recomendable la monitorización de la presión capilar de la arteria pulmonar (PCP)48. A pesar de su valor como parámetro de seguridad, no existe un valor de corte de PVC definido que se pueda considerar “seguro”, y la única recomendación posible al respecto es individualizarlo a cada paciente prestando especial atención al riesgo/beneficio de la administración de volumen en situaciones en las que los valores de PVC estén elevados.
Podría establecerse un paralelismo con la estimación del agua extravascular pulmonar (EVLW), ya sea mediante termodilución o bioimpedancia. El EVLW proporciona información sobre la cantidad de líquido acumulado en los pulmones excluyendo la vasculatura pulmonar y el líquido pleural59. De igual forma que sucede con los valores de PVC o con el balance hídrico, valores elevados de EVLW se han asociado repetidamente con mayor mortalidad en el paciente séptico60,61. En la práctica clínica, los valores elevados de EVLW indican edema pulmonar y, pesar a que no proporcionan información sobre la dependencia de precarga, sí indican el riesgo inherente a la administración de volumen, tal y como sucede con valores elevados de PVC. Así, se podría concluir que los parámetros mencionados, aunque no son de ayuda en la valoración de la dependencia de precarga, sí pueden ser de interés en la práctica clínica para determinar el riesgo que se asume al seguir con la administración de volumen y obliga al clínico a una valoración minuciosa de los potenciales riesgos/beneficios. Por supuesto, los principales determinantes de la decisión de administrar fluidos seguirán siendo: a) la existencia de hipoperfusión, y b) la evidencia de que el paciente se encuentra en la zona de dependencia de precarga de la curva de Frank-Starling de funcionalidad cardíaca.
10ConclusionesEl proceso de resucitación del paciente en shock séptico debe individualizarse y basarse en marcadores de hipoxia tisular tanto regionales como generales. La monitorización debe ser gradual, de menos a más invasiva en función del estado del paciente y la respuesta al tratamiento inicial. Comprender las bases fisiológicas e interpretar correctamente los resultados de las variables obtenidas, así como conocer las limitaciones de los medios disponibles, es fundamental para un buen tratamiento del paciente y su correcta evolución.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosA todo el equipo de residentes de Medicina Intensiva del Área de Críticos del Hospital Parc Taulí, por darnos la motivación para seguir profundizando en el mundo del paciente crítico.
Nota al suplementoEste artículo forma parte del suplemento «Resucitación del paciente con sepsis y shock séptico», que cuenta con el patrocinio de AOP HEALTH IBERIA.