INTRODUCCION
Cada vez es más notorio que el tratamiento adecuado del dolor sigue siendo una asignatura pendiente para la mayoría de los profesionales médicos, sin que los intensivistas estemos excluídos. El dolor es muy frecuente en nuestras unidades de medicina intensiva, bien sea causado por factores obvios, como la cirugía, los politraumatismos, o los procesos inflamatorios de todo tipo, o por otros no tan evidentes, como los drenajes, las vías, los catéteres, las aspiraciones endotraqueales, la fisioterapia respiratoria, los cambios posturales, o por el contrario, la inmovilidad prolongada. Sin embargo, si se compara la importancia que este problema tiene subjetivamente para el enfermo, y las consecuencias fisiopatológicas del dolor1 (entre ellas el desencadenamiento de múltiples mecanismos hiperadrenérgicos y hormonales de tipo catabólico, el aumento del consumo de oxígeno, la facilitación de fenómenos tromboembólicos o la inmunosupresión, cortejo que se ha denominado respuestas de estrés) con la escasa presencia de publicaciones sobre analgesia en el ámbito de la medicina intensiva, y con las técnicas de analgesia empleadas en la mayoría de nuestras unidades2, creemos que la afirmación del primer párrafo está plenamente justificada.
Si nos circunscribimos al campo de la analgesia en la pancreatitis aguda, el panorama es similar. La necesidad de la analgesia es reconocida en prácticamente cualquier texto sobre tratamiento de la pancreatitis, pero pocos de ellos emplean más allá de unas pocas líneas; la cantidad de publicaciones que pueden recogerse en búsquedas en bases de datos informatizadas como Medline es muy escasa y en general se trata de textos con cinco o más años de antigüedad. Una búsqueda realizada en enero de 1999 en Medline, bajo la combinación [(analgesia OR pain) AND pancreatitis] (en su título) encontró solamente 149 publicaciones. Cuando se especificó que debían referirse a la situación aguda (acute), quedaron reducidas a 17. Eliminando aquellas dedicadas al diagnóstico del dolor abdominal y a otras situaciones no relevantes para la revisión, quedaron únicamente seis que se referían al tratamiento del dolor en pancreatitis aguda. Excepto dos, de 1990 y 1991, respectivamente, todas ellas eran anteriores. Incluso, en publicaciones recientes dedicadas a la analgesia3, los problemas son los mismos: escasa extensión y vetustez de las referencias.
Por ello nos pareció interesantes revisar, a la luz de los conocimientos actuales sobre fisiología del dolor, las posibilidades terapéuticas de que disponemos para proporcionar analgesia en esta entidad tan frecuente en nuestras unidades.
EL PROCESO NOCICEPTIVO
El dolor es percibido por el individuo como consecuencia de la activación de una serie de terminaciones nerviosas diseminadas por todo el organismo, sensibles a variaciones bioquímicas, térmicas, o mecánicas de su entorno que producen daño tisular. Estas terminaciones se denominan receptores nociceptivos. Los llamados receptores unimodales reaccionan solamente ante algún tipo de estímulos nociceptivos, mientras que los polimodales reaccionan ante varios tipos de estímulos. Las terminaciones nerviosas pertenecen a fibras del tipo Aδ, y sobre todo a fibras C, con mielinización escasa o nula, respectivamente, y velocidades de conducción bajas4.
Los nociceptores de los órganos periféricos están lejos de ser simples interruptores del inicio de la transmisión nociceptiva. Por contra, estas terminales son capaces de liberar una amplia serie de sustancias químicas que, entre otras acciones, producen estimulación adicional del propio receptor, y "reclutan" a receptores silenciosos habitualmente inactivos5 que por ser en general polimodales, producirán sensación dolorosa ante estímulos variados.
Las neuronas bipolares que transmiten las sensaciones dolorosas entran en las astas posteriores de la médula espinal, donde establecen conexión con otras neuronas que transmitirán la información nociceptiva hacia centros superiores. Esta transmisión no es en absoluto pasiva, sino que los estímulos que llegan por las fibras aferentes son sometidos a profundas transformaciones de filtrado, codificación, integración y redireccionado hacia unas u otras de las estructuras superiores. A su vez, determinados centros superiores influirán sobre la progresión de los estímulos nociceptivos, con lo que se conforma un cada vez más rico panorama de posibilidades de influir terapéuticamente, precisamente a través de las astas posteriores medulares, en la percepción final de los estímulos dolorosos.
El asta dorsal de la médula espinal está organizada histológicamente en zonas que fueron descritas por Rexed6, por lo que habitualmente se denominan láminas de Rexed. Las fibras transmisoras del dolor se diseminan a la entrada, y parte de ellas pasan al lado contralateral. Esto puede justificar la condición más difusa del dolor visceral7. La mayor parte de la modulación de los estímulos aferentes parece realizarse a través de las interneuronas de la lámina II, denominada sustancia gelatinosa de Rolando. Particularmente las denominadas células limitantes de Cajal, de carácter excitador, reciben aferencias primarias táctiles y nociceptivas, y de fibras descendentes de núcleos supraespinales, mientras que sus axones cruzan hasta la lámina I, modificando las descargas de las neuronas de esta capa, cuyos axones son el origen de los haces espinotalámicos, y modulando, por tanto, la transmisión de los impulsos nociceptivos8.
La complejidad bioquímica del asta posterior no desmerece de la anatómica, y la llegada de estímulos por las fibras aferentes al asta posterior provoca la liberación de una serie de neurotransmisores estimuladores (sustancia P, neurocinina, colecistocinina, péptido relacionado con el gen de la calcitonina, bombesina, vasopresina y una serie de aminoácidos excitatorios, fundamentalmente L-glutamato y N-metil-D-aspartato), que activan receptores glutaminérgicos del tipo de NMDA9, o depresores, monoaminas y opiodes, de la transmisión a las neuronas.
La mayoría de las vías de transmisión nociceptiva del asta posterior cruzan la comisura anterior y ascienden por la región anterolateral formando los haces espinotalámico, espinorreticular y espinomesencefálico. Algunas vías ipsilaterales pueden actuar como alternativas. Desde centros superiores, fundamentalmente desde la sustancia gris periacueductal y la zona rostral ventromedial del bulbo, se proyectan neuronas descendentes que finalizan fundamentalmente en la sustancia gelatinosa de la lámina II, que también mediante neurotransmisores monoaminérgicos, opioides endógenos y aminoácidos inhibitorios como el GABA y la glicina, pueden disminuir o inhibir la transmisión de los impulsos nociceptivos.
Los mecanismos íntimos de la liberación y acciones de estos numerosos mediadores están lejos de estar bien caracterizados, aunque se sabe que su liberación es dependiente del calcio. Cualquier mecanismo que impida la entrada del calcio a la célula a través de los canales del calcio dependientes de voltaje disminuirá la liberación de los neurotransmisores excitatorios y, por tanto, la transmisión del impulso nociceptivo. Por ello, se han empleado con éxito bloqueadores de los canales del calcio, agonistas opiáceos y agonistas α2-adrenérgicos. Los propios neurotransmisores excitatorios ponen en marcha un mecanismo iniciado por la activación de la fosfolipasa C que finaliza por la activación transcripcional de diversos genes que codifican la producción de péptidos opioides endógenos y taquicininas. Se produce un aumento de la permeabilidad de los canales de potasio, que, al permitir la salida de éste, producen una hiperpolarización de la membrana, con lo que la transmisión de los impulsos nociceptivos posteriores se ve dificultada.
Por tanto, si deseamos producir analgesia, podríamos actuar a escala periférica, en el entorno de las terminaciones libres que constituyen los receptores nociceptivos, impidiendo la síntesis de mediadores procedentes del ácido araquidónico (antiinflamatorios no esteroides [AINE], corticoides, capsaicina, inhibidores de la NO sintetasa, etc.), antagonizar el efecto de otros péptidos como la serotonina o bradicinina, impedir la despolarización de los receptores mediante anestésicos locales, o antagonizar los neuropéptidos excitatorios con antagonistas específicos de la sustancia P o del péptido relacionado con el gen de la calcitonina. Aunque quizá los opiáceos y los antagonistas α2-adrenérgicos tengan también acción en estos territorios periféricos, su efecto se puede utilizar en analgesia mayoritariamente en la integración medular, donde tienen efectos claramente inhibitorios10. Aunque los antagonistas de los aminoácidos excitatorios y los de la colecistocinina podrían utilizarse teóricamente, en general todavía están en el terreno experimental. La manipulación de las sinapsis cerebrales es todavía más compleja y no se dispone por el momento de fármacos específicos.
LA TRANSMISION DEL DOLOR EN LA PANCREATITIS
El páncreas recibe inervación simpática, parasimpática y sensorial. Casi toda la inervación aferente viaja con el sistema simpático, recorriendo el plexo celíaco hasta llegar a las células del asta dorsal de T5 a T12. Casi toda la inervación sensorial del páncreas proviene del sistema esplácnico izquierdo, pero algunas fibras esplácnicas derechas cruzan la línea media para inervarlo. El nervio vago también inerva la víscera, pero la vagotomía no alivia el dolor pancreático, por lo que es dudoso que sus fibras lo medien. En contraste con el sistema nervioso somático, en el visceral no existe distinción precisa entre receptores sensoriales nociceptivos y no nociceptivos. Al parecer, cuanto más intenso, y más receptores recluta el estímulo, más se transforma éste de inocuo a nocivo, por sumación central en la médula. Por ello, la lesión localizada de una víscera abdominal no suele ser nociva, mientras que la estimulación generalizada, como la distensión de un órgano hueco o la inflamación sí causa dolor. El dolor atribuido a inflamación pancreática a menudo se irradia al tórax o a los flancos, y causa espasmos reflejos de la musculatura de la espalda, que aparecen como consecuencia de la convergencia del sistema nervioso somático con aferentes viscerales en el asta medular dorsal. Las respuestas simpáticas descendentes ocasionadas por la percepción dolorosa producen una serie de alteraciones indeseables, como íleo, taquicardia, agitación, hipertensión, aumento del consumo de oxígeno, etc., que pueden ser yuguladas, al menos en parte, con una buena analgesia.
La terapéutica analgésica de la pancreatitis ha descansado hasta hace poco tiempo fundamentalmente en el empleo de analgésicos intravenosos. El modo de administrarlos y la aparición de otras técnicas de igual o mayor eficacia, con menores riesgos, ha cambiado recientemente el panorama, por lo que creemos que deben ser incorporadas progresivamente en el arsenal de nuestras unidades de medicina intensiva.
ANALGÉSICOS DE ACCION PERIFÉRICA
Desde el punto de vista práctico, de todos los posibles fármacos que podrían emplearse por vía intravenosa en los receptores periféricos, para inhibir la transmisión de la sensación dolorosa en la pancreatitis aguda, los únicos empleados en clínica son los AINE.
La fosfolipasa A2 tiene un papel patogénico en la pancreatitis aguda. Su actividad sérica se correlaciona con la gravedad y aumenta al máximo en la forma necrosante. Lógicamente los AINE debieran ser útiles al inhibir la cascada del ácido araquidónico que es estimulada por la fosfolipasa A2; no obstante, sólo parecen útiles en la pancreatitis aguda leve3. El grupo de los fármacos analgésicos, antipiréticos y AINE está formado por un conjunto de compuestos químicamente muy heterogéneos, que tiene en diverso grado estas tres propiedades. Aunque todos ellos tienen un mecanismo de acción común: la inhibición de la ciclooxigenasa, un complejo enzimático que transforma el ácido araquidónico en endoperóxidos cíclicos, a partir de los cuales se sintetizan varios tipos de eicosanoides (prostaglandinas, prostaciclina y tromboxanos), posiblemente ejerzan otras acciones a escala celular que contribuyan a sus acciones. Los diversos grupos químicos son los salicilatos (aspirina, salicilamida), los paraaminofenoles (paracetamol), las pirazolonas (fenilbutazona, metamizol), los derivados del ácido propiónico (ibuprofeno, ketoprofeno), los derivados del ácido acético (indometacina, aceclofenaco, ketorolaco), los del ácido antranílico (ácido flufenámico), los oxicams (piroxicam, tenoxicam) y los del ácido nicotínico (clonixina)11. La acción analgésica es de moderada intensidad. Si bien guarda relación con la dosis, la pendiente de esta relación es pequeña, por lo que el máximo de eficacia de un AINE se consigue a dosis doble o como mucho triple de la habitual, y el efecto máximo alcanzable es muy inferior al que se consigue con los opiáceos ("efecto techo"). Su eficacia analgésica no guarda relación con su eficacia antiinflamatoria, ni hay relación clara entre potencia antioxigenásica y analgésica. Su acción es fundamentalmente periférica, es decir, en las propias terminaciones nerviosas sobre las que actúan los mediadores liberados en el proceso inflamatorio o en la lesión, y posiblemente bloqueando la activación de los neutrófilos. Muchos de ellos son antiagregantes, y algunos son uricosúricos, por competencia renal en el transporte de ácidos. Como grupo pueden lesionar la mucosa gastroduodenal, produciendo erosiones o úlceras con sus complicaciones (hemorragias o perforación). Nuevamente no hay relación estricta entre potencia de inhibición de la ciclooxigenasa y la frecuencia de ulceraciones, aunque aquel factor es fundamental en la aparición de éstas. Producen retención de sodio y agua, y pueden precipitar la insuficiencia renal, en el caso de situaciones de bajo flujo renal, en que el riñón se defiende produciendo una mayor cantidad de prostaglandinas, o empeorar cuadros debidos a retención de líquidos, como hipertensión arterial (HTA) o insuficiencia cardíaca. Su consumo prolongado puede dar lugar a la llamada nefropatía intersticial por analgésicos que termina con necrosis papilar e insuficiencia renal crónica. Con cierta frecuencia protagonizan reacciones alérgicas o seudoalérgicas (de expresión similar, pero en las que no intervienen fenómenos inmunitarios), que no suelen evidenciar reacciones cruzadas con otros AINE. Las reacciones hematológicas en conjunto son infrecuentes, pero dada la profusión con que se utilizan estos productos, hay que tenerlas presentes. La mayor parte de ellas son debidas a fenómenos de naturaleza inmunitaria, como la agranulocitosis, la anemia aplástica, la trombocitopenia o la anemia hemolítica.
De los AINE, posiblemente convenga detenerse en el metamizol, debido a su extendido uso en España. A dosis de 2 g se alcanzan ya los efectos máximos, comparables a dosis bajas de opiáceos (6-8 mg de morfina). Produce menor agresión a la mucosa gástrica que otros AINE y parece tener una ligera acción relajante de la fibra lisa muscular, por lo que es útil, solo o asociado con espasmolíticos, en dolores de tipo cólico. Realmente el metamizol es un profármaco, y son sus productos de hidrólisis 4-metil-aminoantipirina, y 4-aminoantipirina los que tienen actividad antiinflamatoria. La vida media de los metabolitos activos es de unas 3-6 h, y pueden duplicarse con la edad. Sus reacciones adversas más frecuentes son la agranulocitosis y la anemia aplástica, aunque su incidencia real en España parece más baja que en otros países; a dosis elevadas puede producir hipotensión. Puede emplearse 1-2 g/6-8 h por vía intramuscular o intravenosa. No obstante, su acción analgésica no es lo suficientemente potente cuando el dolor es intenso, y debería emplearse en estos casos asociado a opiáceos menores o sedantes, que potencian algo sus acciones.
No creemos que haya sitio para ningún otro AINE en la analgesia de las pancreatitis agudas, aunque podría utilizarse también ketorolaco, que tiene acción más analgésica que antiinflamatoria, con los mismos problemas que el metamizol, es decir, un bajo techo terapéutico (30 mg por vía intramuscular tienen una eficacia comparable a la de 10 mg de morfina, pero ya no aumenta si se incrementa la dosis), y las acciones indeseables de los AINE.
ANALGÉSICOS DE ACCION CENTRAL
Entre éstos pueden utilizarse los opiáceos, los estimulantes α2, y más recientemente una serie de polipéptidos y alcaloides sintetizados a partir de venenos animales o vegetales, muy prometedores, pero que están en su mayoría en fases iniciales de experimentación, por lo que nos referiremos fundamentalmente a los primeros.
Opiáceos
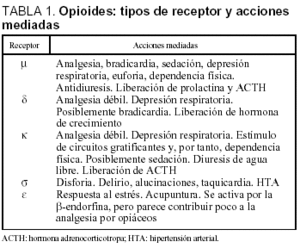
Son fármacos empleados con fines analgésicos desde la más remota antigüedad. Algunos, como la morfina, son de origen natural, y la mayoría de los utilizados en clínica actualmente son sintéticos. Para los farmacólogos, se denominarían opiáceos solamente a aquellos fármacos naturales o sintéticos extraídos estrictamente del opio. La inmensa mayoría son fármacos sintéticos, a los que se denominaría opioides. Su estructura es muy variable: la morfina es un derivado pentacíclico, mientras que otros son hexa, tetra, tri, bicíclicos, algunos son derivados de la 3-3' difenil propilamina, de la aminoetralina, o aun de otras cadenas como la hexahidroazepina o el ciclohexano12. No obstante, todos ellos actúan sobre una serie de estructuras celulares que constituyen los receptores opiáceos. Desde el punto de vista funcional se distinguen varios tipos de éstos, en dependencia de su activación mediante diversos tipos de opioides, o su bloqueo con determinados antagonistas. Aunque su subdivisión varía según los autores, los más aceptados se exponen en la tabla 1.
Desde el punto de vista de su utilización en la clínica, se distinguen los agonistas puros, de acción fundamental sobre los receptores μ, cuyo prototipo podría ser la morfina, los agonistas-antagonistas, que actúan fundamentalmente sobre los receptores κ, y son agonistas μ débiles, o incluso antagonistas de este receptor, cuyo prototipo más conocido podría ser la pentazocina, los agonistas parciales, que actúan sobre receptores μ, pero con una eficacia mucho menor que la de los agonistas, con un representante típico: la buprenorfina, y finalmente los antagonistas, con afinidad por los receptores opiáceos, a los que se ligan, pero no activan, impidiendo por tanto la acción de otros opiáceos sobre el receptor. El fármaco prototípico es la naloxona13.
Los opiáceos más utilizados para el tratamiento analgésico de las pancreatitis agudas son: la morfina, la meperidina, y recientemente el tramadol. Otros, incluso más potentes, se emplean fundamentalmente en anestesiología, como el fentanilo, el alfentanilo y el sufentanilo, por lo que apenas haremos referencias a ellos.
Morfina
Es sin duda alguna el más versátil y el más utilizado para el tratamiento del dolor, tanto agudo como crónico, por numerosas vías de administración. Aunque es absorbido por vía oral, su biodisponibilidad es baja, y muy dependiente del fenómeno de primer paso por el hígado, por lo que varía ampliamente entre individuos. Por vía intravenosa, la única viable en la pancreatitis, se alcanza con rapidez el máximo efecto analgésico, con una duración de 2-3 h. Por ello, cuando se desea que el efecto continúe, suele emplearse la infusión continua. Es muy hidrosoluble, y su volumen de distribución es de 1 a 4,7 l/kg. Se une a proteínas en un 36%. Como todos los opiáceos produce depresión respiratoria. Los inhibidores de la monoaminoxidasa (IMAO), los neurolépticos, los hipnóticos, el alcohol y los relajantes intensifican sus efectos depresores, así como los de otros opiáceos. Favorece la liberación de ADH, por lo que puede reducir la eficacia de los diuréticos. Produce constipación y puede producir retención urinaria.
Petidina o meperidina
Al contrario que la morfina, produce una cierta actividad anticolinérgica, por lo que ha sido preconizado su uso en el cólico biliar. No obstante, tiene mayor cardiotoxicidad y neurotoxicidad, lo que impide incrementar las dosis como puede hacerse con la morfina u otros opiáceos. Aumenta la sensibilidad del aparato laberíntico, por lo que las náuseas y vómitos, y los mareos y vértigos son más comunes que con la morfina. Su actividad es menor, y 60-100 mg corresponden a la de 10 mg de morfina. La duración del efecto es algo menor (2-4 h). Su volumen de distribución es alto, de 200-300 l/kg. Su aclaramiento es de origen hepático. La norpetidina, su metabolito desmetilado, es eliminado muy lentamente y, aunque su actividad analgésica es la mitad que la de la petidina, tiene el doble de actividad convulsionante, por lo que hay que tener precaución con las dosis repetidas. Al eliminarse este metabolito fundamentalmente por el riñón, puede acumularse en caso de insuficiencia renal. Por su acción vagolítica puede dar lugar a taquicardias y arritmias. Al elevar las dosis aparecen signos de excitación y agitación, delirios, alucinaciones y convulsiones. Dado que en general la analgesia en las pancreatitis puede ser necesaria durante varios días, a pesar de su posible efecto favorable en la presión de las vías biliares, creemos que no es aconsejable su uso, sobre todo, cuando existen otras alternativas más favorables.
Buprenorfina
Es un agonista parcial que puede utilizarse por vía sublingual o parenteral. A dosis de 0,4 mg produce una analgesia similar a la de 10 mg de morfina. Por la larga duración de su efecto, debida a una lenta disociación de su receptor, puede administrarse en intervalos mayores (6-8 h) que los de la morfina. La absorción por vía sublingual es bastante lenta, y las máximas concentraciones plasmáticas precisan de unos 200 min para ser alcanzadas, por lo que no creemos que esta vía sea adecuada para la administración en el dolor de la pancreatitis aguda. Por vía parenteral, las concentraciones máximas se alcanzan en pocos minutos. Es un fármaco de estrecho margen terapéutico que además no es antagonizado por la naloxona, por lo que la posibilidad de incrementar las dosis es escasa. No obstante, parece que su acción sobre las vías biliares es menor, como corresponde a su menor acción sobre los receptores μ.
Tramadol
Es un derivado del ciclohexano, disponible en España desde hace pocos años. Su afinidad por prácticamente todos los receptores opiáceos es baja, del orden de 10 veces inferior a la de la codeína, aunque su poder analgésico es sólo de 5-10 veces menor que el de la morfina. Como ésta, la actividad analgésica es central, con un fuerte componente espinal.
Es un opiáceo algo diferente, porque la naloxona antagoniza solamente una parte de sus efectos, lo que sugiere que parte de la analgesia es obtenida por otro mecanismo, posiblemente por un efecto inhibidor de la recaptación de monoaminas como la 5-HT y la noradrenalina que, hemos visto, inhiben la transmisión de los impulsos nerviosos de carácter nociceptivo14. Deprime menos la actividad respiratoria que la morfina, probablemente porque también es menos potente. La estabilidad cardiovascular, con las dosis habituales, es buena. La duración del efecto es parecida a la de la morfina, y es metabolizada en el hígado formando varios productos, uno de los cuales, el ortodesmetiltramadol es activo. Un 80% se elimina vía renal de forma inalterada, por lo que puede acumularse en casos de insuficiencia renal. Produce con cierta facilidad náuseas, vómitos, hipotensión ortostática con taquicardia e irritabilidad. En general creemos que puede utilizarse cuando el dolor sea menos intenso, solo o acompañando a AINE, aunque no le encontramos ventajas evidentes sobre la morfina bien dosificada y posiblemente contribuya al suministro de una analgesia insuficiente.
La polémica de la acción de los opiáceos sobre la presión en vías biliares
En la analgesia de la pancreatitis con opioides existe siempre la polémica a causa de su efecto sobre el tono del esfínter de Oddi, lo que conlleva un aumento de la presión en la vía biliar. Todos los agonistas opiáceos ocasionan este aumento de la presión en vía biliares, en un efecto dependiente de la dosis, de las concentraciones plasmáticas del opiáceo, y mediado al parecer por el receptor μ. Su importancia clínica no se conoce, y los estudios suelen ser muy antiguos15,16, a veces con observaciones anecdóticas, y con un pequeño número de pacientes. En general, parecen coincidir en que las consecuencias clínicas de este aumento de presión en el árbol biliar son escasas, excepto en algunas ocasiones, en que pueden producir un dolor similar al de cólico biliar17-20. De hecho, publicaciones recientes siguen recomendando su utilización21. En inyecciones únicas, el aumento de presión de las vías ha demostrado ser efímero, de unos pocos minutos22, aunque estudios en animales indican que este tiempo puede ser más largo23. Los escasos estudios en humanos, se han efectuado empleando técnicas muy variadas, algunas de ellas con reproductibilidad escasa. La mayor parte emplean manometría intraoperatoria24-28, a través del tubo en T de Kher29-32 o en el curso de una colangiopancreatografía retrógrada endoscópica (CPRE)33-36. Empleando mediciones ecográficas seriadas, no se han podido encontrar cambios significativos en el diámetro de las vías biliares tras la inyección de mórficos37. La mayor parte de los estudios han sido efectuados en enfermos sin problemas pancreáticos, por lo que el significado clínico es incierto. No obstante, las evidencias disponibles, si empleamos los estudios realizados mediante CPRE, que parece por ahora el método más adecuado, y con la salvedad antes citada del escaso número de enfermos incluídos, indican que la morfina y la pentazocina parecen incrementar la presión intraluminal en vías biliares, que la meperidina, al poseer un efecto anticolinérgico, antagonizaría parte de la acción mediada por receptores opiáceos y tiene efectos variables, y que la buprenorfina y el tramadol no causan cambio o éstos son mínimos. Con todo, la buprenorfina tiene un efecto analgésico discreto, y las dosis empleadas de tramadol son bajas (50 mg), por lo que la evidencia para este último fármaco es todavía más débil. Se ha publicado que la hidroximorfina ejercería una acción menor sobre este esfínter3, pero no hemos encontrado estudios que lo avalen; por otra parte, no está comercializada en España (en Europa solamente en Alemania e Irlanda), y en los países en que sí lo está, no parece tener ventajas importantes sobre la morfina.
Forma de administración
Aunque prácticamente todos los opiáceos pueden administrarse vía oral, siendo su absorción y biodisponibilidad por esta vía muy diferente de unos a otros, en la analgesia general de la pancreatitis, la vía de elección es sin duda la intravenosa. Las dosis inicial y el intervalo para repetirla pueden verse en la tabla 2.
Analgesia controlada por el paciente (ACP) frente a administración convencional
Desde hace algunos años, ha comenzado a utilizarse una nueva forma de administración de los analgésicos en clínica. Se trata de la ACP, o analgesia controlada por el paciente, cuyo concepto fue descrito en 1968 por Sechzer, al evaluar la buena respuesta obtenida con pequeños bolos de mórficos intravenosos a demanda del paciente38. La técnica depende de una bomba de infusión especial que permite administrar una dosis inicial determinada, seguida o no por una infusión continua. El propio paciente, en relación con su estado de analgesia, puede ordenar a la bomba, mediante un pulsador, nuevos bolos de una cantidad predeterminada del analgésico. Para evitar sobredosis, la demanda del paciente está sometida a unos intervalos de bloqueo, dentro de los cuales, por mucho que el paciente demande una nueva dosis, la bomba no obedecerá, aunque registrará en su memoria las demandas. La revisión de estas demandas puede permitir a los terapeutas elegir nuevas dosificaciones o nuevos intervalos de bloqueo que correspondan a las necesidades de cada paciente. Estas débiles dosis a intervalos relativamente frecuentes, permiten al enfermo mantener su grado de dolor en la estrecha banda entre una zona inferior, en que persiste cierto dolor, y la superior, en que aparecen la somnolencia y la depresión respiratoria. Los parámetros que hay que conocer, en todos los modelos de bombas son: el analgésico a emplear, la concentración de éste en la jeringa o reservorio de la bomba, la dosis inicial o de carga, si se va a emplear una infusión basal continua, y a qué velocidad, y la dosis incremental o de demanda, que se inyectará cada vez que el paciente lo desee, si el intervalo de bloqueo se lo permite. Este intervalo es una medida de seguridad, y estará de acuerdo con la semivida de eliminación del fármaco. Existen estudios que parecen demostrar que la perfusión continua no reduce especialmente el número de demandas, y la probabilidad de aparición de depresión respiratoria es mayor39. Muchos modelos permiten programar también una dosis máxima en un intervalo de tiempo prefijado (4 o 24 h), a partir de la cual la bomba cesaría de infundir el mórfico. Aunque se han utilizado virtualmente todos los opiáceos, la morfina sigue siendo el fármaco más empleado para la PCA, ya que el alfentanil, remifentanil y fentanil, con su acción tan breve, precisan bolos más frecuentes, o de una infusión de base con sus inconvenientes; otros como la buprenorfina o la nalbufina, por su carácter de agonistas parciales, alcanzan su efecto techo con rapidez, y otros, como la pentazocina o el tramadol, tienen los mismos efectos que la morfina, pero a dosis mayores, y su precio es más elevado.
En el caso de la morfina, una pauta inicial para programar la bomba puede ser de 1 mg/ml, en bolos de 3-4 mg (ml) hasta conseguir un nivel de analgesia aceptable; si se opta por infusión continua, 1 ml/h, en bolo de 1-2 ml, y un tiempo de cierre o bloqueo de 5 min. Como en cualquier administración aguda prolongada de opiáceos, debe tenerse monitorizado al paciente, sobre todo la SaO2, y las frecuencias cardíaca y respiratoria. Los problemas suelen ser muy escasos. La técnica exige explicar al enfermo cuál es el objetivo de la bomba y su manejo, por otra parte sencillísimo para él. En general parece preferible utilizar bolos altos y tiempos de cierre largos, que bolos pequeños y posibilidad de demanda muy frecuente, ya que si el paciente no logra analgesia con cierta rapidez, puede perder la confianza en el sistema. Ello no conlleva mayores peligros, ya que los enfermos reducen la frecuencia de demandas. Las ventajas del sistema son la individualización de las dosis de analgesia, la menor cantidad de analgésico total, una sedación escasa en general, disminución de la ansiedad del paciente, al que se le dota de un instrumento para su propio alivio, y disminuye las complicaciones y el tiempo de enfermería dedicado a la analgesia. Tiene, como inconvenientes, que requiere de un paciente colaborador, y que haya sido instruído por el personal de enfermería de los fines y funcionamiento de la bomba. Por tanto, no es adecuado para pacientes inconscientes o poco colaboradores. El coste es más elevado, al requerir un aparato, y su eficacia depende del buen funcionamiento de éste.
Otros fármacos de acción central
Este apartado incluye a fármacos mucho menos utilizados, y con los que la experiencia en el tratamiento concreto del dolor de la pancreatitis aguda es escasa. Alguno de ellos, como la ketamina, pueden ser útiles en algunas circunstancias concretas; otros como la clonidina, pueden permitir la disminución de las necesidades de opiáceos, y dos nuevas series de analgésicos se encuentran aún en fase experimental, pero tienen perfiles prometedores.
La ketamina es un fármaco del grupo de las arilcicloalquilaminas con acciones analgésicas potentes. Produce además sedación, inmovilidad, amnesia, y un estado de indiferencia hacia el medio, similar al que se consigue con la neuroleptoanalgesia, pero con un único fármaco. Por ello ha sido utilizado fundamentalmente en anestesiología en lo que se ha dado en llamar anestesia disociativa. Su acción analgésica parece ejercerse en los núcleos talámicos y del sistema límbico, y parece tener un ligero efecto opiáceo, pues algunas de sus acciones pueden ser antagonizadas por la naloxona. Tiene una cierta acción simpaticomimética, manteniendo la presión arterial, por aumento de las resistencias periféricas y de la frecuencia cardíaca, por lo que podría emplearse en situaciones de hipotensión o shock. Como derivado que es de la fenciclidina, puede ocasionar cuadros agudos de alucinaciones y delirio, que pueden aparecer poco después de su administración, y reaparecer incluso semanas después, sobre todo en los adultos, en los que son extraordinariamente frecuentes. La aparición de estos cuadros puede minimizarse con el empleo asociado de benzodiacepinas40. Su acción antagonista sobre los receptores del glutamato permite su empleo en inyección epidural, aunque no es muy utilizado por esta vía.
La clonidina es un agonista α2-adrenérgico con acciones hipotensoras y ligeramente sedantes. Su acción analgésica se ejerce en los receptores espinales y supraespinales, disminuyendo la liberación de neurotransmisores excitatorios (sustancia P, péptido relacionado con el gen de la calcitonina) al mismo tiempo que hiperpolariza las membranas de la neurona postsináptica, inhibiendo o dificultando la transmisión de los impulsos nociceptivos. Produce analgesia dependiente de la dosis, tanto si se administra por vía intravenosa como intramuscular, subaracnoidea o epidural, y a dosis de 1-15 μg/kg en bolo es eficaz en todo tipo de dolores de moderada intensidad. Incrementa el efecto analgésico de los opiáceos, sobre todo cuando ambos fármacos se administran por vía epidural o espinal. El efecto se acompaña de cierta sedación y de hipotensión, aunque a dosis bajas combinada con opiáceos estos efectos acompañantes son escasos. La dexmedetomidina es un compuesto de acción similar, que parece algo más selectivo, pero no conocemos que esté comercializado en nuestro país.
El SNX-111 o zinocotide es un bloqueador de los canales de calcio voltaje-sensitivos de tipo N, que intervienen en la modulación de las sensaciones dolorosas. Se trata de un producto de síntesis elaborado a partir de uno de los centenares de compuestos que forman el veneno de algunos caracoles de aguas tropicales, concretamente del género Conus (C. magus, C. geographicus). Está ya en fase 3, es decir, ensayos controlados en humanos, y por ahora tiene una eficacia superior a la de la morfina, sin tolerancia, y es eficaz tanto en dolor agudo, como crónico, como neuropático41-47. Se administra por vía intrarraquídea.
La epibatidina, un compuesto sintético, similar al veneno de algunas ranas tropicales (Epipedobates tricolor) ha demostrado actividad analgésica de corta duración, sin tolerancia ni dependencia, originada a través de la activación de receptores nicotínicos neuronales48-54. La epibatidina como tal es muy tóxica, pero un compuesto similar, el ABT-418, tiene una actividad de 30 a 70 veces superior a la de la morfina, sin causar depresión respiratoria ni transtornos gastrointestinales.
Ambos compuestos son muy prometedores, y teóricamente podrían estar muy indicados en la analgesia de la pancreatitis, por su ausencia de efectos sobre las vías biliares, pero todavía no se dispone de información adecuada.
Analgesia locorregional
Una forma de solventar los problemas indeseables de la administración de opiáceos por vía general es el empleo de éstos o de anestésicos locales mediante su inyección en estructuras que permiten yugular el dolor de origen pancreático con escasa dosificación y, por tanto, también con escasos efectos secundarios. Dos técnicas nos permiten una analgesia eficaz por métodos locorregionales.
Epidural
La inyección en el espacio peridural de las metámeras antes citadas (T5-T12), de analgésicos opiáceos o anestésicos locales, bloquea la transmisión de los impulsos nerviosos ascendentes de carácter nociceptivo, con dosis de opiáceos mucho menores que las que se precisarían para yugular el dolor por vía general. Por otra parte, las escasas dosis necesarias eliminan la preocupación por su efecto en la presión de la vía biliar20.
Creemos que la técnica más aconsejable en la UMI, es la inserción de un catéter epidural por vía lumbar, que es siempre mucho más sencilla que el abordaje torácico. La técnica ha sido descrita en multitud de publicaciones55-57, por lo que no estimamos necesario entrar en ello. El catéter debe ser insertado unos 3 cm en dirección cefálica, con la técnica habitual. Existen kits preparados al efecto, y debe proveerse siempre al catéter de filtro antimicrobiano de 0,22 μ, y efectuar inexcusablemente una dosis de prueba con 3 ml de un anestésico local antes de comenzar la inyección del fármaco elegido, para asegurarse de que la punta del catéter está en espacio epidural. Aunque virtualmente cualquier opiáceo podría ser introducido por esta vía, creemos que el más aconsejable en la pancreatitis sigue siendo la morfina, ya que, por su carácter hidrófilo, tiende a ascender a metámeras más altas, consiguiendo analgesia suficiente con una punción lumbar. En general, dosis bajas, de 4-5 mg suelen producir analgesia eficaz, que comienza aproximadamente a los 45 min, y puede durar alrededor de 8 h o más. El volumen de disolución del opiáceo no parece ser determinante de la analgesia. Otros opiáceos utilizados son el fentanilo y la buprenorfina, y más recientemente el tramadol y el alfentanilo. En general, al ser más liposolubles, son de acción más rápida y tienen menor tendencia a producir depresión respiratoria por migración rostral, pero por la misma razón, precisan que el catéter esté colocado cercano a las metámeras a analgesiar, perdiendo así la ventaja que en este aspecto tiene la morfina. Además de la analgesia, se consigue eliminar el espasmo reflejo, el íleo inducido simpáticamente, y la respuesta neuroendrocina. En su defecto, puede emplearse una dosis inicial de 5-8 ml de bupivacaína al 0,25%, manteniendo después una perfusión continua, regulada según la respuesta. Cuando se espera que sea necesaria la infusión durante varios días, como suele ser el caso, a veces convienen más anestésicos locales de acción más corta y menos liposolubles, como la lidocaína o la mepivacaína al 0,5%, unos 15 a 35 mg/h. El empleo de dosis elevadas de anestésicos locales suele acarrear con cierta frecuencia hipotensión, lo que en la pancreatitis suele ser indeseable. Por ello, creemos que la primera elección debe ser la del mórfico, solo o acompañado de dosis más bajas (al 0,125%) de bupivacaína, a 6-10 ml/h. Las contraindicaciones a la técnica son el shock o hipovolemia, la infección en el lugar de la punción o la sepsis, las alteraciones de la coagulación o el tratamiento anticoagulante. También una enfermedad neurológica preexistente o una deformidad espinal muy grave.
Las complicaciones son bastante escasas: pun-ción dificultosa; punción vascular (aproximadamente un 1% de los casos); punción de la dura (menor del 1%), analgesia incompleta, en cuyo caso quizá haya que emplear otra técnica o revisar las dosis; bloqueo epidural extenso, por sobredosificación absoluta o relativa del analgésico o anestésico local, o bloqueo subaracnoideo masivo, por punción inadvertida de la dura, a menudo por soslayar la prueba inicial con anestésico local. La hipotensión es relativamente frecuente (más con los anestésicos locales que con los opiáceos, aunque no suele ser un problema si se monitoriza al paciente). Puede aparecer bradicardia, si se alcanzan las fibras cardioaceleradoras que nacen entre T1 y T4, o también, si la hipotensión es importante, por reflejo de origen auricular. La retención de orina ocurre a causa del bloqueo de S2-S4 y en la pancreatitis no suele ser relevante, ya que el enfermo suele estar sondado.
Interpleural
La analgesia interpleural se obtiene mediante la introducción de anestésicos locales entre las pleuras parietal y visceral. Fue introducida en 1984 por Kvalheim y Reiestad58,59 para obtener analgesia postoperatoria, pero posteriormente ha sido utilizada con éxito para el tratamiento de síndromes dolorosos agudos y crónicos originados en vísceras del abdomen superior, fundamentalmente en la vesícula y en el páncreas.
La cavidad pleural es virtual. Solamente unos pocos mililitros de líquido pleural sirven para el fácil deslizamiento de ambas hojas pleurales entre sí, aunque existe una secreción continua, de aproximadamente 100 ml/h, que es reabsorbida prácticamente en su totalidad por la pleura visceral.
El material necesario puede obtenerse de algunas casas comerciales en forma de kit, o prepararlo momentos antes de proceder a la técnica.
Técnica60,61: se pinta con antiséptico la piel de la zona del hemitórax izquierdo elegida para la punción. No parece existir diferencias en cuanto a su éxito o a la eficacia de la analgesia obtenida tanto si la punción se efectúa en la línea media axilar, como si se hace en las líneas axilares anterior o posterior. Tampoco hay que efectuarla en un espacio intercostal concreto, aunque suelen preferirse los intermedios, del quinto al noveno, y de ellos, el que sea más cómodo para el paciente concreto y el operador. Se delimita la zona mediante campos estériles, y el operador, que vestirá gorro, mascarilla, bata y guantes estériles, efectuará un habón cutáneo con aguja del 25G con lidocaína al 1-2% en la zona del espacio intercostal elegido. Cambiando luego la aguja por una intramuscular, seguirá infiltrando anestésico por planos, hasta tropezar con el borde superior de la costilla inferior. Retirando entonces ligeramente la agu-ja, e inclinándola ligeramente hacia arriba, penetrará 2-3 mm más, e infiltrará el espacio intercostal.
Tras dejar unos minutos para que comience la acción del anestésico, se efectúa una pequeña incisión en la piel de la zona anestesiada, mediante la hoja de bisturí, para facilitar la introducción de la aguja de Tuohy. Se prepara la jeringa de vidrio con 8-10 ml de suero fisiológico, y se conecta a la llave de tres vías, asegurándose previamente que el catéter pasa fácilmente por el interior de esta llave. Se introduce la aguja de Tuhoy sin su fiador, lentamente, para pasar justo rozando el borde superior de la costilla inferior. Durante este paso, la boca de la llave de tres vías opuesta a la aguja debe estar cerrada, y abierta la boca en ángulo recto conectada a la jeringa. En el momento de entrar en el espacio pleural la presión negativa de éste aspira con rapidez el suero fisiológico, y el émbolo desciende62. Es el momento de cerrar la lleve de tres vías, introducir por el pabellón la punta del catéter, abrir la llave e introducir el catéter en el espacio pleural unos 6-7 cm (los catéteres suelen estar marcados para mantener el control del segmento introducido). Sin mover ya el catéter, se extrae el conjunto aguja de Tuhoy-llave de tres vías-jeringa, y se le inserta al catéter su pabellón. Se añade a éste el filtro antibacteriano, y puede procederse a fijar aquél a la piel con un punto de seda. Se pone un yodóforo en pasta en la incisión, y se tapa la zona con apósitos estériles.
Aunque puede utilizarse prácticamente cualquier anestésico local, hemos obtenido buenos resultados con la bupivacaína al 0,5% con adrenalina. Puede elegirse entre utilizar bolos de 15-20 ml cada 6-8 h, o bien un bolo inicial de esta cantidad, seguido de una perfusión contínua de 5-6 ml/h mediante bomba de infusión.
Se realiza una placa de tórax tras el procedimiento, para detectar la aparición de un posible neumotórax, la complicación, junto con la punción inadvertida de un vaso intercostal, más frecuente.
Los resultados son muy a menudo espectaculares, y el dolor desaparece de forma casi instantánea, con muy buena calidad de analgesia, sobre todo cuando se emplea la infusión continua. Con la infusión intermitente, algunos enfermos precisan acortar algo el intervalo entre dosis sobre lo recomendado anteriormente.
Los problemas son escasos, habiéndose descrito algunos neumotórax de escasa cuantía que rara vez precisan drenaje. Con la técnica descrita, el suero fisiológico que entra desde la jeringa cuando la aguja de Tuohy penetra en el espacio pleural previene en cierto modo la punción de la pleura visceral, al permitir que ésta se aparte. Con todo, debe tenerse a mano material para proceder a un drenaje pleural. La otra complicación, también infrecuente si se sigue una técnica correcta, es la punción del paquete intercostal, con la aparición de hemorragia. Tampoco suele ser importante, pues la aguja de Tuhoy es bastante roma, y más bien suele lesionarse el paquete en la anestesia local.
El mecanismo de acción todavía no está claro, aunque se cree que por difusión se bloquean los aferentes intercostales, y muy probablemente los ganglios de la cadena simpática63, produciendo un bloqueo en cierto modo similar a la infiltración del ganglio celíaco, pero de forma más fácil.
Las contraindicaciones son, por supuesto, la alergia al anestésico local elegido o a otros de su grupo; la fibrosis pleural, porque limita la facilidad de difusión del anestésico; la existencia previa de derrame pleural; la infección en la zona de inserción del catéter, y la ventilación mecánica, que aumenta el riesgo de causar un neumotórax en la introducción del catéter.
Si la infusión se mantiene durante varios días, puede aparecer taquifilaxia, y precisarse dosis más elevadas, o un acortamiento del intervalo entre bolos.
Bloqueos del ganglio celíaco
El bloqueo del plexo celíaco es una opción en aquellos enfermos en que no ha sido eficaz o hay contraindicaciones para emplear la vía extradural o no se considera el bloqueo interpleural. También ha sido empleado en enfermos con pancreatitis aguda de etiología alcohólica, con historia de adicción a opiáceos, en los que la administración de estos fármacos incluso por vía epidural puede ser ineficaz64. El catéter se inserta vía lateral izquierda, dejándolo en posición pre o paraaórtica. Creemos que la técnica es suficientemente compleja como para que sea realizada por un anestesiólogo experto en bloqueos regionales, ya que en raras ocasiones se podrá disponer de un intensivista con la suficiente experiencia como para realizarla sin riesgos para el paciente. Se puede administrar de forma continua bupivacaína al 0,5% a un ritmo de 6 ml/h, o bien a dosis bolo intermitentes de 20 ml que eliminan el dolor de 6 a 12 h.
SEDACION
Mientras que, como se afirmaba en la introducción, la analgesia es un tema que debe experimentar un abundante desarrollo en nuestras unidades de medicina intensiva, antes de poder considerarlo como óptimo, en el capítulo de sedación existe un consenso considerablemente mayor, ya que los fármacos son mejor conocidos, se aplican mayoritariamente escalas de medición de la sedación y existen pocas controversias. En la pancreatitis las necesidades de sedación son muy similares a las de otras entidades nosológicas, y las particularidades son escasas, por lo que dedicaremos a su descripción un espacio considerablemente menor.
En la pancreatitis aguda, es posible precisar sedación fundamentalmente en tres situaciones: a) como coadyuvante en la analgesia; b) como coadyuvante en la ventilación mecánica, y c) en el caso de aparición de síndrome de abstinencia alcohólica.
Aunque la variedad de fármacos disponibles es amplísima, la experiencia ha ido seleccionando éstos. Fármacos de amplio uso hasta hace pocos años, como el diazepam y el pentotal sódico en perfusión, apenas si se emplean en la actualidad por existir otros de perfil más favorable. Realmente sólo dos o tres fármacos son de uso corriente en la mayoría de nuestras unidades, por lo que limitaremos nuestra descripción a ellos.
Propofol
Es el 2,6-diisopropilfenol, un anestésico intravenoso que, como otros anestésicos, a dosis bajas tiene propiedades hipnóticas y sedantes, acción ansiolítica, y cierto grado de amnesia anterógrada65. Su eficacia como sedante es similar a la del midazolam66. A las dosis utilizadas en la UCI no tiene propiedades analgésicas. Parece tener capacidad antioxidante67,68, probablemente por su semejanza estructural con la vitamina E, aunque no está clara la importancia de esta cualidad a las dosis empleadas en clínica. Su acción es muy corta, con una vida media de 1,8 a 8,3 min, debida a la redistribución, seguida de una distribución secundaria de 34-64 min. Su acción es de comienzo rápido, en 1-2 min, y su efecto es breve, de 10 a 15 min, debido a su rápida penetración en el sistema nervioso central y su redistribución consiguiente en los lípidos corporales. Por ello, se recomienda administrarlo solamente en perfusión, comenzando con 0,5 mg/kg/h, titulando su acción mediante incrementos de 0,3-0,5 mg/kg/h que pueden cambiarse cada 5-10 minutos. Lo habitual es alcanzar dosis de mantenimiento de 0,5 a 3 mg/kg/h, aunque no son raras las necesidades de mayores dosis, hasta 8 mg/kg/h, ya dosis consideradas anestésicas.
Es metabolizado fundamentalmente en el hígado. La infusión durante largo tiempo, acaba produciendo acumulación en los tejidos y una prolongación de la vida media de eliminación hasta de 300-700 min. No obstante, el aclaramiento plasmático sigue siendo alto, de 1,4 a 1,8 l/m, por lo que todo el fármaco que entra en el compartimiento vascular es eliminado con rapidez; de ahí el rápido despertar una vez cerrada la infusión. Los ancianos tienen un menor volumen de distribución, y menor aclaramiento, lo que hace necesario dar dosis más bajas. No parece causar problemas en caso de insuficiencias hepática o renal, aunque estos enfermos parecen ser más sensibles a sus efectos69. Es muy lipofílico, por lo que se administra en una emulsión de aceite en fosfolípidos que proporciona 1,1 kcal/ml. En el caso de las pancreatitis, que estos lípidos estén formados fundamentalmente por ácidos grasos de cadena larga puede ser también un inconveniente, puesto que este tipo de ácidos grasos parece estimular la secreción de colecistocinina. Requiere una vía dedicada, porque tiene bastantes incompatibilidades fisicoquímicas y la posibilidad de infección es grande, lo que por otra parte hace aconsejable el cambio de equipos de infusión cada 12 h. Produce hipotensión, bradicardia y dolor cuando se inyecta en vías periféricas. Los aportes nutricionales deben ser reevaluados70. Es preferible su administración por vía central.
Midazolam
Es una benzodiazepina de acción corta. Tras su administración por vía intravenosa sufre un cambio estructural que produce un compuesto lipófilo que penetra con gran facilidad y rapidez en el sistema nervioso central, produciendo sedación en 2,5-3 min, similar a la del diazepam. Debido a redistribución, tiene un descenso rápido de su concentración sanguínea, y por tanto su acción termina con rapidez. Ello conlleva la necesidad de infusión continua para mantener la sedación. Pueden ser necesarios uno o dos bolos previos para conseguir una sedación adecuada antes de comenzar la infusión. En general se requieren infusiones de 2-5 mg/h para mantener una sedación adecuada, pero pueden ser precisas dosis mucho más elevadas71. Como todas las benzodiacepinas, ocasiona amnesia anterógrada. Tiene un metabolito activo, el 1-hidroximetil-midazolam, que tiene una vida media similar al midazolam, por lo que ambos pueden acumularse, sobre todo en el anciano o en pacientes con enfermedad renal, insuficiencia cardíaca congestiva, o con valores bajos de albúmina sérica72-74. Tras detener la infusión, los pacientes pueden permanecer sedados todavía varias horas o días75. Desarrolla tolerancia tras varios días de utilización, y algunos pacientes pueden experimentar reacciones de deprivación horas o días tras detener la infusión. No está claro si conviene disminuir la perfusión lentamente o de forma abrupta. Es posible prevenirlas mediante la administración de una benzodiacepina de acción larga a dosis bajas.
Lorazepam
Es una benzodiazepina de acción intermedia, menos lipofílica que el diacepam, que alcanza un pico en aproximadamente 30 min tras su administración intravenosa. Como todas las benzodiacepinas, ocasiona amnesia anterógrada. Al ser menos lipofílico que el diazepam, se reduce también su volumen de distribución y evita una acumulación. Parece que el despertar es más rápido que en los pacientes a los que se ha administrado midazolam76. Es metabolizado por glucuronoconjugación hepática y no tiene metabolitos activos. Su eliminación no se ve alterada, sin embargo, cuando existen transtornos hepáticos o renales. La dosis habitual en adultos es de 10 mg/h. Puede darse un bolo de 0,05 mg/kg cada 2-4 h al comienzo. Puede administrarse en bolos o en perfusión continua, y su vida media de eliminación es muy parecida en ambos casos. Puede administrarse sin diluir en una jeringa por una vía central. Desgraciadamente no está comercializado en nuestro país en forma intravenosa.
Hemineurina*
Denominada también clometiazol, es la fracción tiazólica de la vitamina B1. Tiene acciones sedantes, hipnóticas y anticonvulsionantes77. Es muy utilizado en Europa para el tratamiento del Delirium tremens y los síndromes de abstinencia alcohólicos, y habitualmente no suele ser considerada para la sedación en otras enfermedades aun cuando su perfil es relativamente favorable. Se utiliza en perfusión (solución comercial de 4 g en 500 ml) comenzando con 25-60 mg/min (3-7,5 ml/min) hasta conseguir una sedación suficiente, pasando después a una dosis de mantenimiento de 4-8 mg/min/ 0,5-1 ml/min).
Es un fármaco de amplio índice terapéutico, que puede producir ligera taquicardia e hipotensión, pero que como todos los sedantes, en la sobredosificación puede producir apnea e insuficiencia respiratoria. Se acumula en la insuficiencia renal crónica y en la insuficiencia hepática. Como la vitamina B1, puede dar lugar a fenómenos anafilácticos en personas alérgicas.
Entre sus ventajas hay que incluir que es ampliamente conocido y utilizado; que produce escasa depresión respiratoria; que tiene un amplio índice terapéutico, y que es barato. Como desventajas, la posible alergia, y el exceso de líquidos que puede representar. Su pH bastante alcalino (excipiente NaOH) aconseja infundirlo por una vía central o una vena de grueso calibre.
En resumen, aunque existe considerable controversia en la bibliografía acerca de las ventajas de uno u otro de estos sedantes78-82, creemos que a favor del midazolam están la amnesia anterógrada, la posibilidad de administrarlo por vía periférica, la menor cantidad de interacciones y la menor posibilidad de infecciones; en contra, la posibilidad de aparición de tolerancia y de abstinencia, un despertar algo más lento y el tener un metabolito activo.
A favor del propofol está el comienzo de la acción y el despertar más rápido; en contra, la administración de alto contenido calórico, la necesidad de una vena central, la mayor cantidad de interacciones, la más frecuente posibilidad de infecciones, la escasa amnesia, la aparición frecuente de hipotensión y taquicardia, y de dolor cuando se administra en vena periférica, y la necesidad de cambio del sistema cada 12 h. En el caso de pancreatitis se podría añadir también la desventaja del vehículo lipídico a base fundamentalmente de ácidos grasos de cadena larga.
A favor del lorazepam está la vida media entre la del midazolam y la del diazepam, el no tener metabolitos activos, la posibilidad de administrarlo tanto en bolos o en infusión, y el coste económico. En contra, que no está comercializado en forma inyectable en el mercado español.