INTRODUCCION
La pancreatitis aguda (PA) es una enfermedad relativamente frecuente que obedece a un proceso de inflamación aguda del páncreas, que puede llegar a afectar no sólo a este órgano sino también a los tejidos peripancreáticos, e incluso llegar a lesionar órganos corporales distantes1. Una de las principales funciones del páncreas es la digestiva, mediante la secreción de potentes enzimas proteolíticas, lipolíticas y amilolíticas, que son necesarias para la digestión de los nutrientes en el intestino2. En condiciones normales, el páncreas evita su autodigestión mediante varios mecanismos fisiológicos. Esta autoprotección puede alterarse en relación con determinadas circunstancias patológicas que son la causa de PA2. En casi un 80% de los casos la PA se relaciona con la presencia de litiasis biliar o alcoholismo, como principales causas1,3. La mayoría de los casos de PA (80-90%) cursan de forma leve (PAL), mientras que una minoría (10-20%) lo hace de forma grave (PAG), y evolucionan con complicaciones locales y sistémicas, que suelen conducir a la muerte2,4,5. Las PAL corresponden a un edema intersticial pancreático PA edematosas, mientras que los casos graves suelen corresponderse con necrosis y/o hemorragias intra y/o peripancreáticas2. Actualmente el tratamiento de las PAG todavía es difícil y controvertido, y aún conlleva una elevada mortalidad. Los casos de PAG deben ser, pues, vigilados y tratados en las unidades de cuidados intensivos (UCI)5.
La PA comienza con la activación intracelular de las enzimas digestivas que da paso a la autodigestión del páncreas6. Esta activación prematura de las enzinmas pancreáticas es el episodio central de la patogenia de la PA1. La destrucción química del parénquima pancreático induce una rápida reacción inflamatoria local en el lugar de la agresión. Este proceso inflamatorio tiende a amplificarse característicamente en la PA, diseminándose y dando lugar a un síndrome de respuesta inflamatoria sistémica (SRIS), que es responsable en gran parte de la morbilidad y la mortalidad de esta enfermedad6. Episodios intracelulares aún desconocidos determinan la lesión inicial de las células acinares páncreas exocrino6, que activa en cadena a las enzimas digestivas, que autodigieren el páncreas y, tras pasar a la circulación, lesionan otros órganos y sistemas, determinando la insuficiencia de uno o varios sistemas orgánicos y no en pocos casos la muerte1. Aunque la PA puede tener distintas etiologías, la respuesta inmunitaria es idéntica, distinguiéndose sólo en su grado de expresión, que condicionará su gravedad; incluso los casos de PAL suelen cursar con algunos signos de un SRIS6.
Las complicaciones de la PA se relacionan con el curso de la respuesta inflamatoria. En los primeros 3 días aparece el SRIS inicial, consecuencia de la amplificación de la reacción inflamatoria local inicial; este SRIS obedece a una rápida cascada de activación inflamatoria que conlleva una activación de mediadores inflamatorios tanto humorales como celulares, tanto de leucocitos como del endotelio7. Este estado de hiperinflamación sistémica6 se resuelve gradualmente en un plazo de 7-10 días o puede dar lugar a una disfunción o hasta insuficiencia multiorgánica (SDMO/FMO), e incluso provocar la muerte7. Este SRIS suele ser aséptico, salvo que se complique con una infección seria, temprana y extrapancreática. El SRIS con el que cursan muchas PA es indistinguible del que se da en las sepsis8. El SDMO/FMO, que aparece tempranamente en la PA, suele ser de naturaleza no infecciosa, mientras el SDMO/FMO más tardío suele ser causado por fenómenos de translocación bacteriana intestinal5,7.
Las fases iniciales de la PA cursan con edema intersticial del páncreas y con necrosis de la grasa peripancreática, y la enfermedad puede progresar rápidamente, y en algunos casos puede aparecer pronto, necrosis de coagulación de las glándulas y del tejido graso circundante, condición conocida como PA necrosante1. La necrosis pancreática y la colonización bacteriana del tejido y el jugo pancreático ocurren en las fases tempranas del curso de la PA9. Esta colonización temprana bacteriana del páncreas puede aparecer incluso en las PAL9. La extensión y la cuantía de la necrosis pancreática determinan, en gran parte, el pronóstico de esta enfermedad, y en este sentido algunos autores definen la PAG como aquella que tiene una extensión de la necrosis pancreática de al menos un 30% de la glándula10,11. El tejido pancreático desvitalizado está predispuesto a la infección, favorecida también por la contaminación bacteriana del páncreas; se considera que el riesgo de infeción se prolonga hasta unas 3 semanas después de la aparición de los síntomas9. La contaminación bacteriana del páncreas necrosado se ha asociado con una mayor mortalidad y con la aparición de graves complicaciones como el SDMO/FMO12. La inflamación del páncreas promueve la translocación de gérmenes gastrointestinales hacia el páncreas y áreas vecinas, y el colon es el origen de la mayoría de estas bacterias emigrantes5. La contaminación y ulterior infección del tejido pancreático necrótico, infección local que se estima que ocurre en un 30% de los pacientes con PAG13, es considerada como una importante causa de sepsis y consiguientes SDMO/FMO, e incluso muerte en la fase tardía de la PA5,14. A pesar de ello, no existe aún ninguna exploración complementaria que permita establecer con certeza el diagnóstico de necrosis pancreática infectada5. Las mejores pruebas diagnósticas hasta ahora se basan en la tinción de Gram y los cultivos microbianos de material obtenido mediante una punción aspirativa del páncreas guiada por ecografía o tomografía axial computarizada (TAC) o bien por laparatomía5,9. Por su lado, la TAC dinámica contrastada permite definir de forma aceptable, la extensión de la necrosis pancreática9. Las infecciones suelen ser causadas, en más de la mitad de los casos, por un solo gérmen5,9,14, y los microorganismos infectantes descritos con más frecuencia suelen ser de una flora de tipo colónico, como las bacterias Escherichia coli, los enterococos, los estafilococos, Pseudomonas sp., Klebsiella sp., Proteus sp., los estreptococos aerobios y anaerobios y otros anaerobios como Bacteroides sp., sin olvidar la creciente incidencia de hongos como Candida sp.5,9,14.
ANTIBIOTERAPIA PROFILÁCTICA EN LA PANCREATITIS AGUDA GRAVE
Dado el mal pronóstico de los pacientes con PA necrosante infectada, se ha planteado la hipótesis de que la utilización de antibióticos de forma profiláctica pudiera reducir la aparición de una infección local con un consiguiente incremento de la supervivencia de los pacientes con PAG5,9,14,15. De todas formas el empleo de antibioterapia profiláctica para prevenir las complicaciones infecciosas de la PA, sigue estando en debate2,3,9,14,16, y es considerada todavía como una terapia novedosa y aún no probada2, aunque a pesar de ello algunos autores la recomiendan en la PAG y en la PA necrosante1,14,16.
Aparte de los experimentos realizados en varios modelos animales, para estudiar la farmacocinética y los efectos terapéuticos de varios antibióticos9,14, no se han publicado muchos estudios clínicos que analicen la eficacia de la profilaxis antibiótica en la PA, y casi ninguno de ellos ha demostrado reducir significativamente la mortalidad de esta enfermedad (tabla 1).
ESTUDIOS CLÍNICOS
Los primeros ensayos clínicos con profilaxis antibiótica en la PA humana, fueron hechos hace más de una década, y fueron incapaces de demostrar un efecto beneficioso sobre la supervivencia17-19. Estos tres primeros estudios aleatorizaron a un pequeño número de pacientes que recibieron ampicilina (23, 48 y 31 pacientes, respectivamente) frente a un placebo (23, 47 y 27 pacientes, respectivamente). En total se aleatorizó a 199 pacientes en los tres ensayos; no se observaron diferencias en su evolución en ninguno de los tres estudios en cuanto a supervivencia ni en cuanto al número de complicaciones infecciosas. Las principales limitaciones de estos estudios fueron dos: la mortalidad observada en el grupo de control fue nula, al igual que también fue muy reducida la incidencia de infecciones, lo que indica que la gravedad de los pacientes no era alta; por otro lado, se halló una limitación relacionada con el antibiótico utilizado, la ampicilina, que no tiene una considerable actividad contra muchas de las bacterias causantes de infección pancreática. Además, este antibiótico penetra poco en el tejido pancreático.
Según se ha demostrado en estudios experimentales y clínicos, es importante el tipo de antibiótico que se utilice para combatir la infección pancreática9,14. La farmacocinética y la biodisponibilidad de los antibióticos varían, y con algunos antibióticos se obtiene una mayor penetración tisular pancreática que con otros que penetran poco en este tejido, con lo que el antibiótico no alcanza una adecuada concentración bactericida. Asimismo, el antibiótico elegido debe tener un amplio espectro de actividad antimicrobiana que cubra la mayoría de gérmenes causantes de infección pancreática, en general bacterias colónicas. Otros factores que hay que considerar al elegir un antibiótico profiláctico son su relación coste-efectividad y el hecho de que tenga poca incidencia de reacciones adversas14. Los antibióticos que alcanzan una mayor penetración tisular pancreática y con una mayor efectividad antibacteriana parecen ser los carbapenems, como el imipenem, las quinolonas, como el ciprofloxacino o el oxofloxacino, el metronidazol, las ureidopenicilinas, como la piperacilina o la mezlocilina, y las cefalosporinas de última generación9,14,16. No obstante, la inflamación pancreática puede alterar la farmacocinética conocida de los antibióticos14.
Casi 20 años después, Pederzoli et al10 reconsideraron el uso preventivo de los antibióticos en la PA. Estos investigadores reclutaron a 74 pacientes con PA en un estudio multicéntrico, controlado y aleatorio. Todos presentaban una PAG, estableciéndose el diagnóstico de necrosis pancreática mediante TAC y de infección pancreática por cultivos de muestras obtenidas por una aspiración percutánea o por cirugía. Los pacientes fueron asignados a un tratamiento intravenoso con imipenem-cilastatina, a dosis de 1,5 g/día (41 pacientes), o bien no se les dio ningún antibiótico (33 pacientes). De los 74 pacientes, 39 presentaban una necrosis de más del 30% del páncreas, pero sólo dos de los pacientes que tenían una necrosis grave, de más del 50% del páncreas, fueron asignados al grupo control. La incidencia de sepsis tanto pancreática como no pancreática, fue menor en el grupo tratado con imipenem que en los no tratados (respectivamente, el 12 y el 15% frente al 30 y el 49%; p <0,01). Sin embargo, los tratados con el antibiótico no tuvieron ni una significativa menor incidencia de SDMO/FMO (el 29% en los tratados frente al 39% en los no tratados) ni una mayor supervivencia (el 7% de muertes en los tratados frente al 12% en los no tratados).
Sainio et al11 ensayaron la utilización de cefuroxima en un estudio controlado, abierto y aleatorio, en pacientes con PA etílica y necrosis pancreática diagnosticada por TAC. Se incluyó a un total de 60 pacientes, administrándosele a 30 pacientes desde el ingreso hospitalario una dosis intravenosa de 4,5 g/día de cefuroxima, comparándolos con un grupo control de otros 30 pacientes a los que se administró antibióticos sólo cuando presentaron signos de infección. No se observaron diferencias significativas en la tasa de infección pancreática de ambos grupos (el 30% en el grupo de tratamiento frente al 40% del grupo control). Sí se apreciaron diferencias entre ambos grupos en cuanto al número de complicaciones infecciosas por paciente, que fue menor en los tratados (uno frente a 1,8; p < 0,01), aunque la diferencia pudo explicarse porque en general había una gran proporción de infecciones de vías urinarias. El tiempo de estancia hospitalaria no se vio afectado por el tratamiento, aunque sí se pudo observar que la profilaxis con cefuroxima redujo la mortalidad (el 3% de muertes frente al 23% del grupo control, p < 0,05).
Delcensiere et al20 estudiaron la utilidad clínica de una antibioterapia combinada que consistía en la administración intravenosa de 6 g/día de ceftazidima, 15 mg/kg/día de amikacina y 1,5 g/día de metronidazol. Este tratamiento se empleó en un ensayo clínico controlado efectuado en 23 pacientes diagnosticados de PAG etílica. El subgrupo tratado con este tipo de antibioterapia sufrió menos infecciones que los pacientes que no recibieron tratamiento antibiótico. Sin embargo, no pudo apreciarse ninguna diferencia significativa en la tasa de mortalidad.
Schwarz et al21 llevaron a cabo un ensayo clínico controlado con 26 pacientes con PA necrosante comprobada con una TAC, en el que estudiaron la administración intravenosa de un tratamiento combinado con 400 mg/día de ofloxacino y 1 g/día de metronidazol. En los 13 pacientes tratados con estos antibióticos se observó una mejoría clínica, documentada por una reducción en la puntuación repetida de la escala APACHE II (días 1, 5 y 10 de su evolución). Por otro lado, esta profilaxis antibiótica no fue capaz de retrasar la aparición de la infección pancreática ni redujo significativamente la mortalidad con respecto al grupo control (ninguna muerte en los 13 tratados frente a dos en los 13 pacientes del control; p > 0,05).
Ho y Frey22 han publicado un estudio retrospectivo en que se revisa una cohorte de 180 pacientes con PAG, donde se valora el impacto que puede tener la profilaxis antibiótica intravenosa en la incidencia de infección pancreática y en la mortalidad de la PAG. En este estudio se revisan tres períodos anuales: un primero (1982-1989) con 50 pacientes a los cuales no se le administró antibióticos; un segundo (1990-1992) con 55 pacientes a los que se les dio antibióticos de forma no protocolizada, y un tercero (1993-1996) con 75 pacientes a los cuales se trató sistemáticamente de forma preventiva durante 4 semanas con 1,5 g/día de imipenem-cilastatina por vía intravenosa. La infección pancreática fue diagnosticada por cultivos de muestras obtenidas mediante punción aspirativa guiada por TAC o bien mediante laparotomía. Sin profilaxis antibiótica (1982-1989) la incidencia de infección pancreática fue del 76%. La profilaxis antibiótica no protocolizada (1990-1992) redujo la tasa de infección al 45% (p < 0,05). El protocolo de imipenem-cilastatina (1993-1996) redujo la proporción de infección hasta el 27% (p < 0,05). Por otra parte, aunque la tasa de mortalidad descendió ligeramente durante los tres períodos (el 16, el 7 y el 5%, respectivamente), no lo hizo de forma significativa (p = 0,11).
La profilaxis antibiótica persigue impregnar con antibióticos el tejido pancreático y prevenir, así, la colonización del páncreas inflamado a partir de la translocación de microbios desde el intestino. Una alternativa terapéutica destinada también a reducir la translocación bacteriana es la descontaminación digestiva selectiva (SDD). Se han publicado varios estudios experimentales que analizan la eficacia de este método para disminuir la translocación bacteriana en distintos modelos animales de PA9,14. El primer y más conocido ensayo clínico con SDD en pacientes con PAG fue realizado por Luiten et al 23; que efectuaron un estudio multicéntrico controlado en el que incluyeron a 102 pacientes diagnosticados de PAG que fueron asignados de forma aleatoria para recibir o un tratamiento convencional (52 pacientes) o (en otros 50 pacientes) medidas de apoyo convencional suplementadas con un régimen de SDD, consistente en la aplicación faríngea de una pasta y de un enema rectal, compuestos de colistina, norfloxacino y amfotericina B, junto con un 1,5 g/día de cefotaxima por vía intravenosa. No observaron diferencias significativas en la mortalidad de los grupos (el 35% en el grupo control frente al 22% del grupo con SDD; p > 0,1, globalmente, y p . 0,05 al ajustarse a la gravedad de la enfermedad). Sí se redujo la tasa de infección pancreática en el grupo tratado con SDD comparado con el control (el 18 y el 38%, respectivamente; p < 0,05).
EVIDENCIA CIENTÍFICA
La gran mayoría de estos estudios clínicos con profilaxis antibiótica en la PAG no demuestran un significativo aumento de la supervivencia de estos pacientes aunque sí parecen reducir la presentación de infecciones. Es manifiesto el carácter heterogéneo de los distintos ensayos clínicos, tanto en cuanto a las características clínicas de los pacientes como en lo referente a los diversos antibióticos usados y la variable duración del tratamiento. Además, todos estos estudios adolecen de un insuficiente poder estadístico ya que el tamaño de las muestras estudiadas no permite responder con certeza a la cuestión de si la antibioterapia profiláctica reduce la mortalidad en la PAG. Si se asume que en un 30% de los pacientes con PAG ésta se complica con una infección de la necrosis pancreática, se necesitaría un tamaño de muestra de 322 pacientes para detectar una disminución del 50% reduciendo el riesgo al 15%, asumiendo un test de dos colas con un nivel de significavión (α) del 5% y un poder estadístico (1-β) del 90%14. Si se reduce al 80% la exigencia de potencia estadística, el tamaño muestral sería de unos 188 pacientes como mínimo9. Todo ello, por supuesto, unido con un adecuado diseño del estudio, que debería ser controlado y aleatorizado, y preferiblemente no abierto, ciego. Estas exigencias metodológicas aumentarían el peso de la evidencia científica respecto a este tema24. El nivel de evidencia científica actualmente establecido, en cuanto a la capacidad de una antibioterapia profiláctica para disminuir la mortalidad en la PAG, no parece hasta ahora suficiente como para recomendar su empleo sistemático. No obstante, algunos expertos y sociedades científicas aconsejan la utilización de antibioterapia profiláctica en la PAG necrosante16,25,26-28, pese a reconocer que persisten dudas acerca de su efecto sobre la supervivencia9,14,16,27,28.
Por otro lado, el objetivo principal de la antibioterapia profiláctica en la PAG es disminuir la mortalidad reduciendo la aparición de infección local, ya que ésta suele provocar un SDMO/FMO que suele determinar el fallecimiento. En este sentido, Tenner et al29 han publicado recientemente un estudio en el que revisaron a 51 pacientes con PA necrosante diagnosticada por TAC. El diagnóstico de la infección pancreática se llevó a cabo mediante una aspiración percutánea guiada por TAC, y sólo en el 51% de los pacientes se complicó con un SDMO/FMO, cursando éstos con una mayor morbimortalidad que los que no sufrieron esta complicación. Además, los pacientes que presentaron infección de la necrosis pancreática no sufrieron una mayor prevalencia de SDMO/FMO que los que tuvieron una necrosis estéril (aproximadamente el 50% de SDMO/FMO en ambos grupos). Estos hallazgos pueden poner en duda la hipótesis de que impidiendo la infección local del páncreas necrosado, se evita con ello la aparición del SDMO/FMO y se previene la muerte.
En un reciente metaanálisis30 se concluye, a partir de la revisión sistemática de sólo tres ensayos clínicos10,11,21 (con las limitaciones antes comentadas), que el empleo de profilaxis antibiótica en la PA necrosante disminuye la aparición de sepsis y reduce la mortalidad, por lo que recomienda la profilaxis con antibióticos en todos los casos30.
INMUNOMODULACIÓN E INMUNOTERAPIA
¿Existen en la actualidad otras alternativas terapéuticas en desarrollo para incrementar la supervivencia de los pacientes con una PAG? Aún no existe evidencia de peso al respecto, pero se intuye algún prometedor beneficio resultante de bastantes estudios experimentales que han intentado modular la respuesta inflamatoria sistémica (RIS) que se da en la PA. Con indepencencia de la etiología responsable de la PA, el resultado final es una producción excesiva de mediadores inflamatorios a escala tanto local como sistémica6, que convierte esta enfermedad de un proceso inflamatorio local en una diseminación inflamatoria sistémica. La gravedad de su evolución se relaciona con la amplitud de la RIS consiguiente, es decir con la incapacidad del organismo de localizar la reacción inflamatoria, permitiendo su diseminación corporal. El SRIS temprano que aparece en los 3-5 días iniciales tras el inicio clínico de la PA parece ser de gran importancia en la evolución de esta enfermedad ya que el mayor determinante de sus muertes, el SDMO/FMO, puede aparecer a partir del quinto día, durante la primera semana de evolución, por lo que parece necesario tratar de regular pronto el SRIS, impidiendo precozmente la aparición de un SDMO/FMO y el consiguiente fallecimiento7.
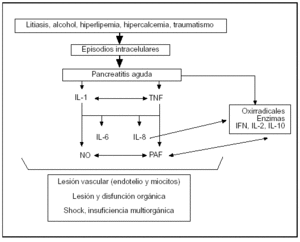
De forma muy parecida a lo que ocurre con las agresiones microbianas en la sepsis, los factores causales de la PA determinan una serie de alteraciones, aún no bien conocidas, dentro de las células acinares, que inducen la producción local y sistémica de una serie de mediadores inflamatorios que diseminan la inflamación. Esta cascada inflamatoria se desarrolla y progresa rápidamente, amplificándose así la respuesta inflamatoria (fig. 1)6. La lesión inicial del páncreas exocrino y sus células acinares determina la liberación de enzimas digestivas sobre todo lipolíticas y proteolíticas, éstas activadas en el interior de este órgano2. Una de estas últimas, la tripsina, parece ser responsable de la activación de muchas otras enzimas y sustancias bioactivas que intervienen en el SRIS y contribuyen a la lesión orgánica a distancia. Enzimas activadas por la tripsina son productos de la calicreína-cinina, de la quimiotripsina, de la elastasa y de la fosfolipasa A. La lipasa, por otro lado, es liberada en su forma activa y es responsable de la necrosis grasa2.
Figura 1. Mediadores inflamatorios en la pancreatitis aguda. IL: interleucina; TNF: factor de necrosis tumoral; NO: óxido nítrico; PAF: factor activador plaquetario; IFN: interferón.
El potente estímulo inflamatorio inicial determina la síntesis y liberación de unos mediadores inflamatorios de primer orden como son las citocinas, el factor de necrosis tumoral (TNF) y la interleucina (IL)1. Estos mediadores iniciales darán lugar a la producción de otros mediadores de segundo orden, de los cuales algunos tendrán tanto un efecto proinflamatorio y lesivo como otros tendrán un efecto antiinflamatorio. Contribuyen a la progresión de la PA mediadores secundarios proinflamatorios, como interleucina (IL) como la IL-6, la IL-8, y la IL-2; los interferones (IFN); el factor activador plaquetario (PAF); sistemas de proteínas plasmáticas como el de contacto cininas, el de la coagulación, el del complemento y el de fibrinólisis; el óxido nítrico (NO), y otros productos leucocitarios, como los radicales libres de oxígeno y la elastasa6,31. El efecto acumulativo de todos y cada uno de estos mediadores determinará la aparición de complicaciones sistémicas, como la lesión vascular diseminada tanto del endotelio como de los miocitos, la lesión hística primero y después la lesión e insuficiencia orgánica única o múltiple (SDMO/FMO) y el shock circulatorio6. Frente a la producción excesiva de mediadores proinflamatorios que ocurre en el SRIS, el organismo intentará en lo posible contrarrestar su efecto produciendo mediadores antiinflamatorios (IL-4, IL-10, IL-13), lo que da lugar al síndrome de respuesta antiinflamatoria compensadora (SRAC)32. Del balance entre el SRIS y el SRAC, depende pues la evolución de la PA.
En la actualidad, se considera la posibilidad de modular la RIS secundaria a la PA antagonizando la actividad de los mediadores proinflamatorios o potenciando el efecto de ciertos mediadores antiinflamatorios6,7. En este sentido, uno de los factores terapéuticos más buscados es el momento apropiado de la intervención inmunomoduladora. Así, el conocimiento del curso evolutivo de la PA pone de manifiesto la existencia de una ventana terapéutica en la que se podría antagonizar efectos de los mediadores inflamatorios con inmunoterapia. La mayoría de los pacientes con una PA reciben atención hospitalaria urgente entre unas 12 y 18 h tras haber aparecido el dolor abdominal. Durante el segundo o tercer día suelen aparecer las disfunciones orgánicas, complicación que diferencia a los pacientes que tendrán una evolución complicada y prolongada, de los que tendrán un curso más leve. La producción de mediadores inflamatorios, como las citocinas, empieza poco después del inicio clínico alcanzando su máximo nivel unas 36-48 h después. Si se trata de evitar la aparición de SDMO/FMO, los primeros 2 o 3 días de la evolución de la PA tras el ingreso hospitalario, constituyen una teórica y potencial ventana de intervención terapéutica6.
Acerca de los mediadores implicados en el SRIS de la PA destacan las siguientes observaciones. El TNF-α tiene una vida media muy corta por lo que esta importante citocina no se ha podido medir bien en la PA7, lo que ha limitado su posible modulación terapéutica. Sí se han podido detectar y medir en la sangre sus receptores solubles (TNFR1 y TNFR2), lo que indica una secreción activa de TNF durante el curso de la PA33. Una importante observación respecto a este mediador primario es que el mismo páncreas lo produce. Se ha demostrado la presencia de los dos receptores para el TNF-α en el páncreas de ratas con y sin PA inducida experimentalmente34. También se demostró en este estudio que las células acinares producen TNF-α y que éste estimula la apoptosis o muerte programada de estas células acinares. Aún no se sabe si los fenómenos de apoptosis observados en el páncreas durante la PA, son nocivos o protectores; lo que sí parece es que una parte de la muerte celular pancreática en la PA que se creía que se debía a una simple necrosis por autodigestión, pueda deberse a una apoptosis mediada por el TNF que produce la glándula inflamada6. En otro experimento35 que provocaba una PA en dos tipos de ratones unos normales y otros manipulados genéticamente (CD14KO) para no poder producir citocinas en respuesta a endotoxina, se observaba no sólo una parecida mortalidad entre los dos grupos sino también una similar producción de citocinas TNF-α e IL-1β, concluyendo que en el curso de la PA la respuesta inflamatoria mediada por citocinas es independiente del efecto de las endotoxinas bacterianas. Un estudio experimental36 realizado en ratones con PA evidenció en el páncreas, una expresión suprarregulada de algunos genes responsables de estrés oxidativo y de los genes de las citocinas TNF-α, IL-1β e IL-6, acompañados de un incremento en la concentración intrapancreática de estas tres citocinas. Cuando, en un experimento paralelo, indujeron un estrés oxidativo pancreático con otro agresor distinto al que provocaba la PA, o bien desencadenaron una respuesta inflamatoria administrando endotoxina bacteriana, no observaron las alteraciones características de la PA. Aunque el antagonismo del TNF no ha conseguido reducir la mortalidad en los pacientes con sepsis grave37, la prevención de su producción, evitando así su liberación, pudiera tener algún valor en el tratamiento de la PAG6. Al igual que el otro mediador mayor, la citocina IL-1 es un responsable temprano de la amplificación y propagación de la cascada inflamatoria, induciendo la producción de muchos mediadores inflamatorios secundarios, iniciando la destrucción hística local y sistémica. De forma parecida al TNF, no se ha conseguido hasta ahora demostrar ninguna utilidad clínica en la sepsis grave, cuando se antagoniza la actividad de la IL-137, aunque también el prevenir la producción de esta citocina tenga alguna eficacia terapéutica6.
La IL-6 es un importante mediador inflamatorio38 que induce en gran parte la respuesta de fase aguda39, que se correlaciona directamente con la gravedad del proceso. La gravedad de la PA viene manifestada por el grado y duración de la elevación de la IL-66 y la medida de sus valores circulantes durante las primeras 24 horas de la evolución de la enfermedad, puede servir como indicador de la gravedad potencial6. La IL-8 es una citocina proinflamatoria de la familia de las quimiocinas CXC, cuyo principal objetivo es activar el neutrófilo40, induciendo su quimiotaxis, degranulándolo y liberando de su interior enzimas y productos con gran poder destructivo. Su concentración sanguínea también se relaciona con la de la IL-6, y ambas con la gravedad de la PA, pero estas citocinas, aunque fiables indicadores de gravedad, no parecen ser más que unos efectos de la acción previa de otros mediadores inflamatorios más proximales (TNF e IL-1)6. La IL-10 es una citocina antiinflamatoria que reduce la secreción de las citocinas proinflamatorias, por lo que se cree que puede atenuar la RIS y la lesión orgánica en la PA6,7. Además, se ha observado que los pacientes con PAG tienen unas reducidas concentraciones circulantes de IL-1041.
El PAF es un mediador inflamatorio distal, muy lesivo, en la PA. A este respecto, se ha demostrado que los valores del PAF están elevados en el suero de enfermos con PA42. Recientemente se han publicado los resultados de un ensayo clínico de fase III43, que descartan un efecto beneficioso derivado de la administración de un antagonista del PAF,
el lexipafant, a pacientes con PA. Este ensayo multicéntrico43, efectuado en 290 pacientes, no consiguió demostrar que la administración de 100 mg diarios de lexipafant, durante una semana e iniciada durante las primeras 72 h tras la aparición de los síntomas, redujera la mortalidad ni la aparición de SDMO/FMO. Un hallazgo de este estudio es la elevada incidencia de SDMO/FMO durante las primeras 72 h del curso de la PA43.
Otra medida de apoyo, que no sólo parece tener un potencial terapéutico sino que también reduce el coste económico44,45, es la nutrición administrada por vía enteral (NE). La nutrición parenteral (NP) parece asociarse con un mayor número de complicaciones o por lo menos carece de efectos beneficiosos46. Un estudio que comparó a dos grupos de pacientes con PA a los que se les administró o NE o NP, encontró que el SRIS se resolvía antes en el grupo de la NE44. Otro ensayo controlado comparando en dos grupos aleatorizados de pacientes con PAG, la NE y la NP, evidenció que el grupo de la NE, aparte de un menor coste, tuvo menos complicaciones y un menor riesgo de complicaciones infecciosas45. En otro ensayo clínico en pacientes con PA, se contrastó también el empleo de la NE y la NP, y se concluyó que la NE moderaba la respuesta de fase aguda, aliviaba la gravedad de la enfermedad y mejoraba su pronóstico47. La NE parece que modula el SRIS en la PAG y puede ser clínicamente beneficiosa48. No obstante, hasta ahora no se dispone de resultados evidentes que hagan optar definitivamente por una determinada vía de administración de la nutrición (NE o NP), ni por unos nutrientes en concreto48. Por ello, en los pacientes con PAG, parece prudente, comenzar lo antes posible la nutrición artificial combinando inicialmente la NP y la NE e instaurando esta última en cuanto se pueda48.
En conclusión, hasta ahora no se ha demostrado claramente que el empleo profiláctico de antibióticos en la PAG reduzca su mortalidad. Aparte del coste económico que su uso generalizado supone, no hay que olvidar que los antibióticos son "armas de doble filo" que pueden tener un efecto ecológico considerable, y repercutir negativamente sobre la flora microbiana, tanto la endógena del paciente como la exógena de su entorno. La aseveración de Powell et al14 de que la frecuente fatalidad de la PA y la escasez de tratamientos racionales para ella justifican por sí solas el empleo de la profilaxis antibiótica, no parece un argumento de suficiente peso que justifique su utilización sistemática. Además, parece que lo más grave en la PAG es la inflamación diseminada desde el principio, en mayor medida que los microbios adquiridos más tarde.