INTRODUCCION: SITUACION ACTUAL DEL PROBLEMA
La pancreatitis aguda grave necrosante (PAG) es definida como la presencia de una o más áreas de parénquima pancreático no viables y representa una forma grave de pancreatitis. El desarrollo de infección de la necrosis pancreática aumenta sustancialmente la mortalidad; por ello la prevención de la infección es fundamental1-7. El objetivo de esta revisión es establecer el papel preventivo de los antibióticos, intentando contestar a preguntas que la medicina intensiva se plantea8-11.
¿Qué es sepsis pancreática?
Definición
Desde la Conferencia de Consenso de Atlanta de 199212, se entiende por sepsis pancreática las complicaciones infecciosas originadas en el páncreas, que aparecen habitualmente a partir de los 14 días12-14.
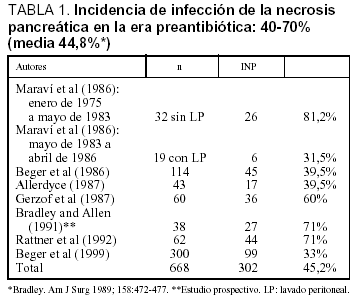
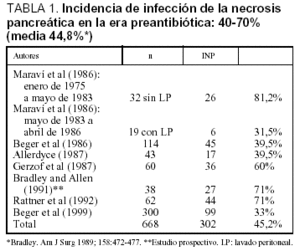
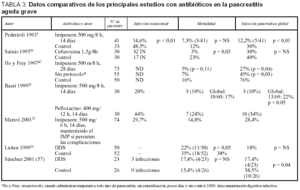
Esta entidad la configuran dos cuadros clínicos bien diferenciados. La infección de la necrosis pancreática (INP) se define como la infección del magma necrótico pancreático y/o peripancreático por microorganismos que pueden afectar al resto de la cavidad abdominal y se caracterizan por no estar encapsulados. Se diagnostica por punción transcutánea y cultivo. La incidencia media en la etapa pre-antibiótica era del 44,8% (tabla 1)15-17. Toda necrosis infectada requiere intervención quirúrgica; y la evolución era frecuentemente fatal y con tratamiento quirúrgico la mortalidad alcanzaba el 15-50%, llegando en algunas series hasta el 80%7,14,15,18. El pronóstico es mucho más grave que la necrosis pancreática estéril, cuya mortalidad es inferior al 10%.
El absceso pancreático (AP) es una colección de material purulento intrabdominal, bien delimitado, rodeado de una pared delgada de tejido de granulación y colágeno. Globalmente aparece hacia la cuarta semana de evolución en el 18% de las PAG, llegando al 56% en las de etiología biliar19. Cirujanos extranjeros han contabilizado el AP en el total de pancreatitis agudas; de allí las cifras del 2,8%17. La mortalidad es del 7,5 y el 20%16. A diferencia de la necrosis pancreática infectada, contiene poco tejido necrótico y es de aparición más tardía. Un pseudoquiste infectado, con pus, se considera un auténtico absceso pancreático.
Etiopatogenia
La contaminación bacteriana de la necrosis pancreática y peripancreática ocurre de forma temprana a los 6 días de evolución, pero se hace evidente clínicamente a partir de la segunda semana12-15,20,21. La forma más grave, la infección de la necrosis se instaura entre los 7 y los 27 días y el absceso, a los 30-82 días del comienzo22.
La vía principal por la que se produce la infección es la translocación transmural de los gérmenes desde la luz intestinal, especialmente del colon23. Sin embargo, el mecanismo patogénico exacto no es bien conocido. Existen cuatro vías posibles de infección mediante las cuales las bacterias pueden llegar y penetrar dentro del páncreas inflamado y del tejido peripancreático:
1. Vía hematógena, principalmente para gérmenes que provienen de focos a distancia.
2. Vía duodenal con infección ascendente a través del conducto principal pancreático;
3. Vía biliar desde la vena porta e hígado siguiendo los conductos biliares;
4. Vía transperitoneal de bacterias translocadas desde el colon (translocación), que es la hipótesis más aceptada después de estudios recientes24, uno de los cuales25 es demostrativo.
El 75% de las bacterias que habitualmente se aíslan en la necrosis pancreática son bacilos gramnegativos de origen intestinal23, seguidos de cocos grampositivos, anaerobios y hongos13-15.
EXPOSICION DEL TEMA
¿Por qué antibióticos en profilaxis?
La invasión bacteriana de la necrosis pancreática (NP) y de las colecciones peripancreáticas es causa frecuente de muerte de la PAG3,14. Por tanto, prevenir la infección es fundamental. Nuestra actitud profiláctica puede llevarse a cabo en distintos niveles:
1. Esterilizando directamente la necrosis pancreática y las colecciones peripancreáticas, mediante aquellos antibióticos con un buen factor de eficacia3.
2. Previniendo la translocación bacteriana desde el intestino, mediante la decontaminación digestiva selectiva (DDS)26-29.
3. Sobre la vía hematógena: actitud profiláctica sobre las infecciones nosocomiales intentando evitar la contaminación secundaria temprana de la glándula pancreática afectada y su posterior infección30.
¿Quiénes se benefician?
De los estudios analizados se deriva que sólo debe recomendarse en las PAG con necrosis pancreática, donde la eficacia es significativa12,14,31-35. En su valoración diagnóstica son útiles: la reacción en cadena de la polimerasa (PCR), elastasa-PMN, la ecografía abdominal y la tomografía axial computarizada (TAC) dinámica temprana.
¿Qué antibiótico?
El antibiótico para prevenir la infección de la necrosis pancreática debe reunir tres condiciones3,36: a) ser activo contra la flora mencionada; b) penetrar el tejido pancreático sano e inflamado, así como las lesiones peripancreáticas, y c) alcanzar concentraciones eficaces en el tejido glandular.
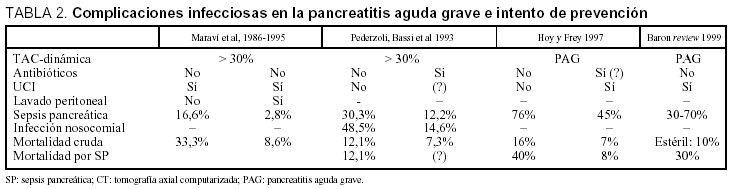
En la tabla 2, se resumen los primeros estudios sin y con antibióticos para reducir estas complicaciones en las pancreatitis: en esta línea, y para responder a la pregunta señalada, es necesario analizar estas tres condiciones:
1. Bacteriología y hallazgos en la PAG. En un metaanálisis7, donde se estudian 1.100 casos de infección pancreática, que corresponden a 45 artículos y durante un período de 20 años, observaron la incidencia de patógenos en el siguiente orden de frecuencia: E. coli, K. pneumoniae, Enterococcus, S. aureus, P. aeruginosa, P. mirabilis, Streptococcus spp., E. aerogenes, E. faecalis y Bacteroides fragilis. Según Banks1 en el 84,3% de los casos, la etiología es monobacteriana y prácticamente la mitad de las infecciones son causadas por Klebsiella o E. coli. Este mismo autor coloca S. aureus en tercer lugar. Recientemente37, como consecuencia de la profilaxis antibiótica, se observa un incremento de la infección por Serratia marcescens y por hongos, como Candida albicans38,39.
2. Penetración de los antibióticos en el interior del páncreas sano y lesionado con necrosis y áreas peripancreáticas. Estudios recientes, como los de Büchler et al3, han demostrado la capacidad de penetración en el interior del tejido pancreático de diferentes antibióticos. Calculan un factor de eficacia (FE) de diferentes antibióticos entre 0 y 1, basándose en: a) el conocimiento del espectro bacteriano de la infección pancreática; b) la concentración tisular del antibiótico, y c)
el porcentaje de microorganismos inhibidos con la concentración mínima inhibitoria del antibiótico.
Un FE de 1 significa una penetración y concentración en el tejido pancreático capaz de eliminar cada una de las bacterias potencialmente infectantes de la necrosis mencionada. En este sentido, se establecen tres grupos de antibióticos:
Sustancias como los aminoglucósidos que no alcanzan una adecuada concentración tisular, y permanecen por debajo de la necesaria concentración mínima inhibitoria (CMI) de muchas de las bacterias encontradas en la infección pancreática (FE: 0,12-0,14);
Antibióticos, como las ureidopenicilinas y cefalosporinas de segunda y tercera generación con suficiente concentración del tejido pancreático para inhibir algunas bacterias pero no todas (FE: 0,71-0,78).
Antibacterianos, como el imipenem y las quinolonas que alcanzan elevados valores en el tejido pancreático y fuerte actividad bactericida contra la mayoría de gérmenes presentes en la infección pancreática (FE: 0,86-0,98).
No se incluye en el análisis el metronidazol, eficaz anaerobicida, ni el tazobactam, un inhibidor de las beta-lactamasas, que alcanzan suficiente concentración en el tejido pancreático (FE: 0,72) para ser efectiva. Por tanto, el metronidazol debe asociarse si el antibiótico elegido no cubre los aerobios. Si existe sospecha o constatación de que la bacteria causante de la infección pancreática es productora de beta-lactamasas se recomienda el tazobactam40.
Eficacia clínica
En un análisis histórico, hasta 1970, no se consideraba la antibioterapia profiláctica y los estudios de entonces no tenían en cuenta la etiopatogenia de la necrosis pancreática y menos de las complicaciones sépticas de esta enfermedad. En las décadas de los setenta-noventa, Ranson introdujo los lavados peritoneales (LP) con ampicilina32,41 sin encontrar grandes diferencias. En 1984 el grupo de Pamplona42 inició el tratamiento de las PAG en UCI e introduce los LP prolongados sin antibióticos, mejorando el pronóstico y disminuyendo la mortalidad, especialmente entre los enfermos menores de 60 años43,44. Estos autores no dispusieron de más oportunidades para seguir desarrollando este método.
Desde los años noventa en adelante, tras conocerse los mecanismos fisiopatológicos infecciosos en la pancreatitis grave, se comienza a reconocer la eficacia del tratamiento temprano en cuidados intensivos y del uso de los antibióticos. Esto se constata al analizar por vez primera la "Sepsis pancreática: infecciones en la pancreatitis aguda grave", durante la VI Reunión Nacional del GTEI-SEMICYUC (Pamplona, 15-16 de junio de 1995).
A partir de aquí, y de acuerdo con los estudios farmacocinéticos, como sólido argumento a falta de estudios clínicos controlados y a doble ciego45, se propone el tratamiento para la profilaxis de la infección en las PAG mediante imipenem o una combinación de una quinolona más metronidazol5,22,23,30,46-52, y los trabajos previos que no tenían en consideración este hecho demostraban la ineficacia de los antibióticos36. En un metaanálisis de estudios con antibióticos que cumplían los requisitos farmacocinéticos mencionados se demuestra que disminuyen la sepsis y la mortalidad al 21 y al 12,3%, respectivamente, comparado con el grupo sin profilaxis53.
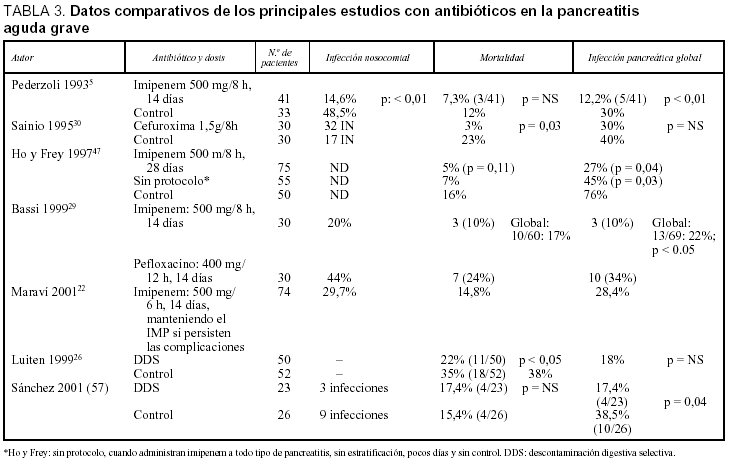
En el primer estudio, controlado y multicéntrico sobre este tema5, se demuestra que la administración profiláctica de imipenem, 500 mg/8 h, i.v. durante 2 semanas, previene la infección, y la disminuye del 30 al 12% (p < 0,01). También se observa que previene la infección en todos los enfermos con una necrosis de la glándula pancreática inferior al 50%. Mientras que en el subgrupo con necrosis superior al 50% de la glándula sólo conseguía reducir la infección del 50 al 37%. Estos resultados no reducían la mortalidad (tabla 3).
En un segundo trabajo (tabla 3), controlado y prospectivo, no doble ciego, la administración de cefuroxima a dosis elevadas de 1,5 g/8 h i.v. redujo las complicaciones y la mortalidad de los enfermos con PAG necrosante30. Los pacientes del grupo control no eran tratados hasta que presentaban signos clínicos de sepsis. La mortalidad del grupo con cefuroxima era más baja (1/30 frente a 7/30 en los controles) y disminuía significativamente la infección pancreática (el 30 frente al 40% del control). Es evidente que este estudio se inicia con una elevada incidencia de infecciones pancreáticas respecto a otras estadísticas. Por otro lado, manejan las complicaciones infecciosas de las PAG controlando las infecciones nosocomiales extrapancreáticas, y por eso emplea un antibiótico del grupo "b" con un FE de sólo 0,71. Se eligió la cefuroxima porque era activo frente a S. aureus, bacteria que junto a E. coli, es la más frecuente en la UCI de ese hospital. Sólo se ha demostrado una disminución de las infecciones urinarias de forma significativa, quedando en entredicho las ventajas aparentes (salvo para esa UCI) y el bajo coste mencionado en el trabajo en cuestión, ya que la antibioterapia alternativa propuesta es múltiple y costosa. Además, no tiene en cuenta que la cefuroxima a dosis altas posee propiedades antioxidantes y que los beneficios pueden ser achacables a este efecto54.
El empleo de una cefalosporina de tercera generación especifica para gramnegativos como la ceftazidima, asociada con amicacina y metronidazol también reduce la infección pancreática46, pero al tratarse de antibióticos de baja liposolubilidad y escaso factor de difusión, sin penetración en el tejido necrótico3,21, actuarían eliminando focos infecciosos extrapancreáticos, de forma parecida a si se emplea cefuroxima a dosis altas30 o cefotaxima23. Schwarz et al observan una mejor evolución clínica de las PAG tratadas con ofloxacino y metronidazol55, confirmando los hallazgos de otros autores3,21. Recientemente, Ho y Frey47, en un análisis retrospectivo de cohortes en 180 pacientes afectados de PAG, refieren que desde 1982 (PAG sin profilaxis antibiótica) hasta 1996 (PAG con imipenem durante 28 días), observaron una disminución de la infección pancreática, desde el 76 al 27% (p = 0,004) y tan sólo una tendencia a mejorar la supervivencia (reducción de la mortalidad del 16 al 5%; p = 0,11); asimismo, confirman que el pronóstico es peor si la infección complica la NP, con una mortalidad de hasta el 40%, mientras que el absceso pancreático, detectado después de la cuarta semana tiene mejor pronóstico, falleciendo solo el 8%. En la misma línea, nuestra experiencia es similar43.
Todos los estudios adolecen de no ser comparativos y doble ciego, muchas veces por razones logísticas y debido al escaso número de pacientes.
De todo lo expuesto es evidente que los antibióticos mejoran el pronóstico de las PAG, y disminuyen de forma evidente la morbilidad, especialmente la sepsis pancreática y en consecuencia la mortalidad, aunque esto último queda todavía por demostrar. En este sentido los antibióticos óptimos son los carbapenémicos, como imipenem-cilastatina (por el momento el único estudiado), y las quinolonas más el metronidazol, con un FE de 0,98. El empleo y su indicación solo se recomiendan en las pancreatitis agudas graves con necrosis glandular demostrada y no en las otras formas de pancreatitis aguda.
¿Cuál es la vía de administración aceptada?
La vía intravenosa es la más estudiada y aceptada. La descontaminación digestiva selectiva (DDS) es el único método que ha demostrado una disminución de la mortalidad en pacientes con PAG.
Se ha demostrado de forma experimental7,50 que la infección en PAG se podía reducir o evitar totalmente25 mediante la DDS56, con estos estudios y conociendo la importancia de la translocación bacteriana intestinal en la fisiopatología de la sepsis pancreática51. Inicialmente se constató, en un estudio no controlado y con pocos pacientes27 un efecto positivo sobre la disminución de episodios sépticos, pero sin influir en la mortalidad. Más adelante, en otro estudio controlado, multicéntrico20, con 102 enfermos con PAG y con esta técnica terapéutica (tabla 3) se reduce la mortalidad del 35 al 22% (18/52 frente a 11/50; p < 0,05), consiguiendo un descenso significativo de la infección pancreática del 38 al 18%, gracias a la disminución de la incidencia de infección "tardía" de la necrosis pancreática por gramnegativos. Sin embargo, los beneficios además se explican porque existía un número menor de laparotomías en el grupo con DDS respecto al control. Por otro lado, junto con los antibióticos orales y en enema rectal, administrados diariamente cada 8 h (polimixina E, norfloxacino y amfotericina), también se suministraba cefotaxima por vía intravenosa, 500 mg/8 h/día, cuyo efecto antibiótico sistémico podía explicar estos resultados más que el de los antibióticos orales de la DDS. Por último, la alimentación enteral a que eran sometidos todos sus pacientes, excepto si existía retención gástrica recurrente, posee una influencia positiva en la prevención de complicaciones sépticas de origen intestinal. La crítica a este estudio es que el estudio comienza con cifras altas de mortalidad y de infecciones con respecto a otros autores. Todos los autores cifran una mortalidad inferior al 15% cuando se utilizan antibióticos (tabla 3).
De forma reciente, el grupo de Alcalá de Henares57 estudia la DDS sin cefotaxima ni antibióticos por vía rectal, es decir sólo utiliza antibióticos por vía oral (gentamicina, polimixina E y amfotericina B), dejando los sistémicos para cuando aparece infección, de tal forma que el imipenem lo administra empíricamente sólo sí se confirma infección pancreática secundaria (¿y las infecciones nosocomiales?). El grupo estudia 49 casos, incluye 23 pacientes en el grupo con DDS y 26 en el grupo control. El primer grupo con DDS tenía un 17,4% de infecciones, mientras que el grupo control un 38,5% (p = 0,04). La mortalidad cruda fue del 16,3% (cuatro en cada grupo: 17,4% en el grupo DDS y 15,4% en el grupo control) y del 13% por FMO (tres en cada grupo: 13 y 11,5%, respectivamente, sin diferencias significativas). Este estudio puede estar solapado con casos de PA leve (hasta un 39%), donde las infecciones prácticamente no aparecen, y nunca necesitan ni están indicados los antibióticos como profilaxis. Por último, cabe plantearse si la mortalidad en el grupo con DDS es mayor que la del grupo control. Por otro lado, no se analiza la mortalidad derivada del FMO de origen infeccioso y de la pancreatitis fulminante, en este caso estéril pero fatal. El estudio está en marcha.
Conviene actuar con precaución con esta política porque se describe una asociación entre DDS y emergencia de cocos grampositivos resistentes, sobre todo Staphylococcus aureus meticilin-resistentes (SAMR). Este tratamiento no se emplea con más entusiasmo debido a esta razón y a los inconvenientes asociados a su uso sistemático en pacientes críticos. A la vista de estos estudios, probablemente tendría sentido hacer un ensayo sobre descontaminación intestinal frente a imipenem en pancreatitis necrosante, pero usando un protocolo de descontaminación intestinal factible para la práctica clínica diaria.
¿Y cuándo?
Hoy día, la profilaxis antibiótica debe iniciarse de acuerdo con estos criterios11,22:
a) cuando se objetive necrosis pancreática: El patrón oro es la TAC dinámica31, y b) en las primeras 72-96 h5, tan pronto como se haga el diagnóstico de PAG necrosante.
Para prevenir el desarrollo de microorganismos emergentes y crear resistencias, los antibióticos deben estar restringidos exclusivamente a la PAG. Debe asumirse por otro lado, la intención de control de la profilaxis, es decir, conocer y tener a disposición los instrumentos de control de las infecciones nosocomiales.
Por último, si el hospital no dispone de la técnica ideal de diagnóstico de la necrosis glandular ni de la infección pancreática, no debe iniciarse este tipo de antibioterapia: el método de elección para el control de esta medida terapéutica es el cultivo o tinción Gram del material aspirado mediante la punción aspiración con aguja fina (PAAF) de la zona pancreática sospechosa de infección clínica, guiada por ecografía58 o TAC31,33,59, repitiendo si hace falta cada 3 días si persisten los signos inflamatorios sistémicos.
Elección del antibiótico ideal, dosis y vía de administración
Está demostrada la eficacia de los antibióticos con un FE elevado (> 0,9), como imipenem/cilastatina, 500 mg i.v./8 h (EF: 0,98) o quinolonas9.
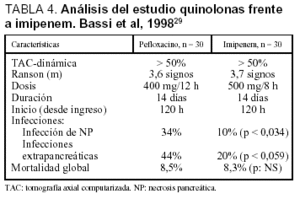
Pero aún quedaba por estudiar qué antibiótico es el ideal, y sobre todo el tiempo de tratamiento necesario para garantizar el objetivo, de acuerdo con las recomendaciones de los expertos12,14,15,44. En este sentido el grupo de Verona29 estudia el imipenem frente al pefloxacino y definen la superioridad del carbapenémico, sin influencia sobre la mortalidad cruda (tabla 4). Probablemente con el ciprofloxacino estas diferencias hubiesen sido menos evidentes. En caso de intolerancia o alergia a los betalactámicos se recomiendan las quinolonas, entre ellas el ciprofloxacino, 400 mg/12 h o el pefloxacino, 400mg/8 h, asociado con el metronidazol: 1.200 mg/24 h.
Aspecto por determinar: ¿cuánto tiempo debería durar la profilaxis y cuándo interrumpirla?
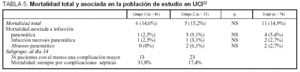
Hasta hace poco, una vez iniciada esta profilaxis antibiótica se mantenía durante 2 o 4 semanas1,5,10,47,49,55,60,61, sin establecer duración exacta. Nuestro grupo ha sido capaz de dilucidar este aspecto22, de tal forma que debe mantenerse al menos durante 14 días y prolongarla si aparece alguna de las complicaciones mayores. En una primera lectura de los resultados no existían diferencias entre el régimen de 14 días con el de más de 14 días; sin embargo, al analizar el subgrupo de los pacientes que al día 14 tenían al menos una complicación mayor, se observó que la mortalidad era mayor entre los pacientes que habían dejado de recibir el antibiótico a los 14 días (tabla 5); por tanto la conclusión fue, que "la profilaxis debe mantenerse mientras persista una complicación mayor y la necrosis pancreática permanezca estéril".
Respecto a la DDS, la pregunta sobre la duración queda por contestar.
Existe un problema añadido
¿Realmente supone una amenaza la infección fúngica y la resistencia al antibiótico, respecto al resto de población de enfermos en intensivos?
Los antibióticos pueden ocasionar efectos indeseables y dar origen a nuevos problemas, como la emergencia de microorganismos resistentes, las infecciones nosocomiales y la aparición de mayor porcentaje de hongos en fases tardías, especialmente Candida spp.22,38,39,62.
Respecto a la emergencia de resistencias queda por comparar con otros grupos de pacientes ingresados en UCI que también reciben antibióticos.
En nuestra experiencia, Candida albicans origi-na el 22% de infección nosocomial22. Aún no se ha definido si es aconsejable el uso preventivo de un antifúngico, algunos autores refieren, en este sentido, que la mortalidad es mucho más elevada en las pancreatitis graves con infección fúngica que con infección bacteriana el 43 frente al 20%, respectivamente63. Sin embargo, estos últimos no aconsejan asociar profilaxis antifúngica, otros sí38,64.
Cuando se utiliza este tipo de tratamiento debe mantenerse la intención de vigilancia continua de estos peligros65,66. En Glasgow devuelven la pregunta, ya que en la práctica diaria se han visto invadidos por infecciones micóticas que han obligado a suspender el antibiótico en la prevención de la sepsis pancreática, utilizándolo sólo en la profilaxis de la CPRE temprana66.
Por estas razones, no debía ser irrazonable repetir estos ensayos con un mejor diseño, debido a que los estudios hasta ahora disponibles adolecen de deficiencias en el diseño, especialmente la falta de un estudio a ciegas10. Es difícil repetir ensayos, pero conviene realizar un nuevo estudio multicéntrico y prospectivo, dirigido a investigar las "infecciones en PAG que ingresan en UCI", y que son tratadas con un protocolo actualizado, con antibióticos por vía intravenosa, por vía oral (DDS) o sin ellos.
¿Se dispone de alternativas distintas a los antibióticos?
En estos momentos existen pocas alternativas a los antibióticos; los siguientes puntos apuntan las posibles y en un futuro próximo pueden clarificar su eficacia:
¿Previene la alimentación enteral yeyunal temprana la infección tardía en la PAG?
¿Se debe tener en cuenta el lavado peritoneal?41,42
La inmunoterapia puede ser útil frente a la "parálisis inmunológica en PAG"18,67-69.
Respecto a la profilaxis de la sepsis pancreática, ¿queda algún papel para la cirugía?70,71.
Conclusión y recomendaciones
¿La profilaxis antibiótica en la pancreatitis aguda necrosante es beneficiosa?
Respuesta:
Disminución de las complicaciones: sí; grado de evidencia: II B.
Descenso de la mortalidad: dudoso; grado de evidencia: II C.
Recomendación: en la actualidad y con la evidencia disponible se considera beneficioso administrar a los pacientes con PAN antibióticos como un carbapenémico, una quinolona o dosis elevadas de cefuroxima.
Es razonable repetir estos ensayos con un mejor diseño, debido a que existen deficiencias en los estudios actuales, especialmente carecemos de un estudio a ciegas.
¿La descontaminación digestiva selectiva mejora la evolución de la pancreatitis aguda necrosante?
Respuesta: sí; grado de evidencia científica: I C.
Recomendación: es probable que la DDS disminuya la incidencia de infecciones respiratorias. Respecto a la disminución de la mortalidad en pacientes con pancreatitis necrosante se demuestra una disminución significativa en uno de los estudios, pero desde valores altos a niveles actualmente inaceptables, del 35 al 22% (p > 0,05)26, y otro estudio en marcha por el momento no demuestra disminución de la mortalidad57. No obstante, este tratamiento no se emplea con más entusiasmo, debido a esta razón y a los inconvenientes asociados con su uso rutinario en pacientes críticos. Probablemente es necesario planificar un estudio comparativo entre DDS (con una modalidad más simple y práctica) e imipenem.
Recomendación general: en la actualidad y desde el Consenso de Santorini (septiembre 1997)65 la profilaxis antibiótica está recomendada en la PAG de acuerdo con los siguientes criterios:
1. Debe ser considerada e iniciada en todos los pacientes con evidencia de necrosis pancreática, cuyo patrón oro diagnóstico es la TAC dinámica.
2. Iniciar el tratamiento antibiótico por vía intravenosa, tan pronto como sea posible.
3. Emplear únicamente antibióticos en monoterapia, que sean capaces de penetrar en el interior del páncreas y del jugo pancreático "sano" y "necrosado", activos contra los microorganismos de origen intestinal: imipenem o, en alérgicos a los betalactámicos, una quinolona más metronidazol.
4. La duración de la profilaxis antibiótica en la pancreatitis necrosante debe ser por lo menos de 14 días y prolongarla si persisten las complicaciones sistémicas.
5. Advertencia de los peligros del amplio uso de la profilaxis antibiótica en la PAG, como la aparición de resistencias bacterianas y la superinfección por hongos, principalmente Candida albicans. Cuando se utiliza este tipo de tratamiento debe intensificarse la vigilancia al respecto.
6. Sin embargo, para determinar exactamente la elección del antibiótico, vía de administración y antifúngico, son necesarios estudios prospectivos, controlados, aleatorios y a ciegas.